2. 山西中医药大学基础医学院, 太原 030024;
3. 中国辐射防护研究院, 太原 030006
2. Basic Medicine School, Shanxi University of Chinese Medicine, Taiyuan 030024;
3. China Institute for Radiation Protection, Taiyuan 030006
砷(As)是一种自然界中广泛存在的类金属, 也是常见的环境污染物.砷主要通过饮水进入人体, 高砷饮用水已经在印度、孟加拉、中国、美国、智利等多个国家被报道.目前, 世界上约有2亿人因慢性饮水型高砷暴露面临健康威胁(Valenzuela et al., 2005).流行病学调查发现, 慢性饮水型砷暴露与多种器官肿瘤、神经系统损伤、肝脏疾病、心血管疾病和糖尿病密切相关(Schuhmacher-Wolz et al., 2009; Lu et al., 2014; Das et al., 2012; Kuo et al., 2015).但有关砷暴露与糖尿病的关系还缺乏深入系统的研究.动物实验研究结果显示, 砷暴露可引起空腹血糖升高、葡萄糖耐量受损(Hill et al., 2009; Izquierdo-Vega et al., 2006), 表明砷暴露扰乱了机体的葡萄糖稳态.
葡萄糖稳态受损主要与葡萄糖利用减少和胰岛素外周靶器官(肝脏、骨骼肌和脂肪)产生胰岛素抵抗有关(Druwe et al., 2010).胰岛素抵抗是指靶器官对胰岛素敏感性降低的状态, 而炎症是导致胰岛素抵抗的重要因素之一.肿瘤坏死因子(TNF-α)是促炎症细胞因子的典型代表, 可通过干扰胰岛素信号转导, 诱发胰岛素抵抗(Shoelson et al., 2006).TNF-α引起胰岛素抵抗主要通过胰岛素受体底物(IRS)丝氨酸磷酸化, 阻碍正常的IRS酪氨酸磷酸化, 使IRS与胰岛素受体结合能力下降, 同时减弱IRS下游的磷脂酰肌醇-3激酶(PI3K)磷酸化, 干扰胰岛素信号经IRS/PI3K通路下传, 引起胰岛素敏感性降低.可见, 在胰岛素信号转导通路中, IRS是TNF-α引起胰岛素抵抗的关键基因.肝脏是胰岛素作用的重要靶器官, 当肝脏胰岛素信号转导发生障碍时, 直接关系到胰岛素抵抗的发生和糖尿病的发病.IRS2主要在肝脏表达, 其酪氨酸磷酸化降低或表达下调可能是导致胰岛素敏感性降低的始动因素(Taniguchi et al., 2005), 表明IRS2介导的胰岛素受体后信号转导障碍可引起胰岛素抵抗.此外, 葡萄糖转运载体(GLUT)是体内负责葡萄糖吸收、转运的重要蛋白质, GLUT2主要表达于肝细胞, GLUT2表达降低可显著下调肝细胞糖代谢功能(Zhou et al., 2006).目前, 关于砷暴露干扰葡萄糖稳态的研究主要集中在脂肪细胞, 有文献报道砷暴露可抑制脂肪细胞胰岛素刺激的葡萄糖摄取, 导致脂肪细胞胰岛素敏感性降低, 进而使葡萄糖稳态受损(Walton et al., 2004; Xue et al., 2011).但砷暴露对肝脏胰岛素敏感性的影响及葡萄糖稳态的调节研究还较少.
鉴于此, 本研究通过饮水砷暴露, 考察砷暴露剂量和时间对小鼠葡萄糖稳态的影响, 并研究肝脏功能和结构损伤情况及肝脏促炎症因子TNF-α、胰岛素受体后信号转导始动基因IRS2和葡萄糖转运蛋白GLUT2的mRNA表达情况, 旨在揭示砷暴露对葡萄糖稳态的影响及相关作用机制.
2 材料和方法(Materials and methods) 2.1 主要试剂亚砷酸钠(NaAsO2)购于Merck公司;葡萄糖(GLU)测定试剂盒购自上海荣盛生物药业有限公司;血清丙氨酸转氨酶(ALT Z-15019)和天冬氨酸转氨酶(AST Z-15018)测定试剂盒购自上海复星长征医学科学有限公司;TransZol Up RNA提取试剂盒和EasyScript First-Strand cDNA Synthesis SuperMix反转录试剂盒购自北京全式金生物技术有限公司.
2.2 实验动物染毒处理和取材清洁级4周龄雄性C57BL/6小鼠, 体重13~17 g, 购自中国食品药品检定研究院.饲养于中国辐射防护研究院动物房内, 自由摄食和饮水, 标准颗粒饲料饲喂.在查阅文献(Paul et al., 2007; Chakraborty et al., 2012)及预实验的基础上, 确定亚砷酸钠的浓度(以As计)为5 mg·L-1和50 mg·L-1.将小鼠随机分为6组, 每组8只, 具体分组情况见表 1.小鼠经饮水途径染毒, 染毒时间为5个月、6个月.每个时间点都设2个染毒剂量和1个对照, 即砷暴露组饮用含5 mg·L-1 As、50 mg·L-1 As的蒸馏水, 对照组饮用蒸馏水.在各自染毒时间结束后, 禁食12 h, 称取小鼠体重, 眼眶取血分离血清用于肝脏功能测定.处死小鼠, 取出肝脏称重, 计算肝脏系数, 随后取部分肝脏用于苏木精和伊红(HE)染色, 其余液氮速冻后-80 ℃保存用于RT-PCR分析.
| 表 1 实验动物分组 Table 1 Grouping of experimental animals |
自染毒之日起, 在整个实验期间的6个时间点(1、2、3、4、5、6个月), 小鼠禁食不禁水12 h, 剪尾釆血, 3000 r·min-1离心10 min, 取上层血清, 按照葡萄糖测定试剂盒的操作过程, 检测各组小鼠每月的空腹血糖.
2.4 腹腔葡萄糖耐量实验(IPGTT)小鼠禁食12 h, 剪尾取血测定葡萄糖浓度作为0 min时的血糖, 之后腹腔注射50%葡萄糖溶液, 剂量为2 g·kg-1, 分别在糖负荷后30、60、120 min剪尾取血, 检测3个时间点的血糖, 绘制葡萄糖耐量曲线, 计算各组糖耐量曲线下面积(AUC), 每月测定一次.
2.5 肝脏功能的测定按照ALT和AST测定试剂盒操作过程, 釆用全自动生化分析仪(Konelab, Prime 30, Finland)检测第5、6个月血清ALT和AST的活性.
2.6 肝脏的组织病理学检查肝组织块用10%中性甲醛固定, 常规脱水透明后, 石蜡包埋, 切片机切片, 厚度为5 μm, 用苏木精和伊红(HE)染色, 光学显微镜观察(Olympus, BX51, Japan).
2.7 RT-PCR分析用Trizol提取小鼠肝脏组织总RNA, 琼脂糖凝胶电泳检测RNA完整性, 同时保证OD260/OD280比值在1.8~2.0之间.以1 μg总RNA为模板, 用反转录试剂盒合成cDNA, MJ Mini Bio-Rad PCR系统进行目标基因和内参β-actin扩增.RT-PCR反应体系为20 μL, 含有0.6~1.0 μL cDNA、2.0 μL 10×Buffer、1.6 μL dNTP (2.5 mmol·L-1)、0.2 μL TransTaqHiFi DNA Polymerase, 以及基因β-actin、GLUT2、IRS2和TNF-α上下游引物各0.5 μL(5 μmol·L-1).引物由上海生工生物工程技术服务有限公司合成, RT-PCR引物序列见表 2.PCR产物用1.5%琼脂糖凝胶电泳检测, 凝胶成像系统摄片.用Bio-Rad Image Lab 5.0图象分析系统, 对目标基因和内参β-actin的电泳条带光密度进行定量分析, 计算目标基因和β-actin条带光密度的比值作为目标基因的相对表达量.
| 表 2 RT-PCR引物序列 Table 2 Primer sequences used for RT-PCR |
采用SPSS 16.0软件对数据进行统计分析.图中结果以均值±标准误(Mean±SE)形式表示, 用Duncan方法比较处理组与对照组间的差异显著性(*p<0.05, **p<0.01)及50 mg·L-1 As组与5 mg·L-1 As组间的差异显著性(#p<0.05, ##p<0.01).
3 结果(Results) 3.1 砷对小鼠体重及肝脏系数的影响由表 3可知, 砷暴露组与同期对照组小鼠比较, 5个月, 50 mg·L-1 As组小鼠体重显著降低;6个月各组小鼠体重未见明显差异.总体而言, 砷暴露组体重均比同期对照组低;砷暴露组与同期对照组小鼠肝脏系数相比, 5个月, 仅50 mg·L-1 As组明显增加;6个月, 5 mg·L-1 As、50 mg·L-1 As组均显著提升, 并呈现剂量依赖性, 表明砷暴露小鼠肝脏系数增加, 提示可能引起肝脏损伤.
| 表 3 砷暴露后小鼠体重、肝脏重量和肝脏系数的变化 Table 3 Effects of arsenic exposure on body weight, liver weight and liver coefficient in mice |
染毒1个月后砷暴露组小鼠空腹血糖较对照组低, 砷暴露2~4个月期间血糖有所波动, 5个月后砷暴露组空腹血糖高于对照组, 但在整个实验期间砷暴露组与对照组小鼠的空腹血糖无显著性差异(表 4).
| 表 4 砷暴露对小鼠空腹血糖的影响 Table 4 Effect of exposure to arsenic on fasting blood glucose in mice |
砷暴露5个月后, 5 mg·L-1 As组在糖负荷60 min时血糖显著高于对照组, 在糖负荷30和120 min时血糖与对照无显著差异;而50 mg·L-1 As组在糖负荷30和60 min时血糖均极显著高于对照组, 120 min时血糖显著高于对照组, 同时, 50 mg·L-1 As组糖耐量曲线下面积(AUC)明显增加.50 mg·L-1 As组在糖负荷不同时间点(30、120 min)的血糖和糖耐量曲线下面积与5 mg·L-1 As组相比显著提升(图 1a和1b).砷暴露6个月后, 5 mg·L-1 As组在糖负荷60 min时血糖仍然显著高于对照组;50 mg·L-1 As组小鼠在糖负荷30、60和120 min时血糖均极显著高于对照组, 同时, 50 mg·L-1 As组糖耐量曲线下面积明显增加.另外, 50 mg·L-1 As组在糖负荷30、60、120 min时的血糖和糖耐量曲线下面积明显高于5 mg·L-1 As组(图 1c和1d).在砷暴露的1~4个月间, 5 mg·L-1 As、50 mg·L-1 As组小鼠葡萄糖耐量与对照组无明显差异(数据未显示).说明砷对小鼠糖耐量的影响具有时间和浓度效应, 提高砷暴露剂量或延长暴露时间能够引起实验动物葡萄糖调节能力的下降.
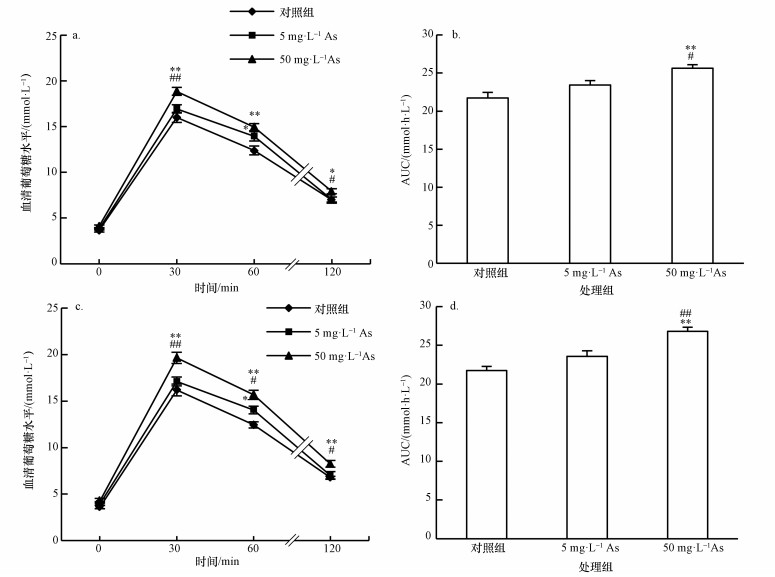 |
| 图 1 砷暴露对小鼠腹腔葡萄糖耐量的影响(a和b:5个月糖耐量;c和d:6个月糖耐量;砷暴露组与对照组比, *p<0.05, **p<0.01;50 mg·L-1 As组与5 mg·L-1 As组比, #p<0.05, ##p<0.01) Fig. 1 Effect of exposure to arsenic on intraperitoneal glucose tolerance test (IPGTT) in mice |
基于砷暴露对小鼠葡萄糖耐量的影响, 本文检测了肝脏功能损伤指标.研究发现, 砷暴露5个月和6个月后, 丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)活性在5 mg·L-1 As组略有上升, 而50 mg·L-1 As组显著升高且暴露6个月后活性高于暴露5个月, 提示小鼠肝脏功能损伤(图 2).该结果表明, As暴露能够引起实验动物肝脏功能异常, 肝功能损伤与高剂量和长时间As暴露有关.
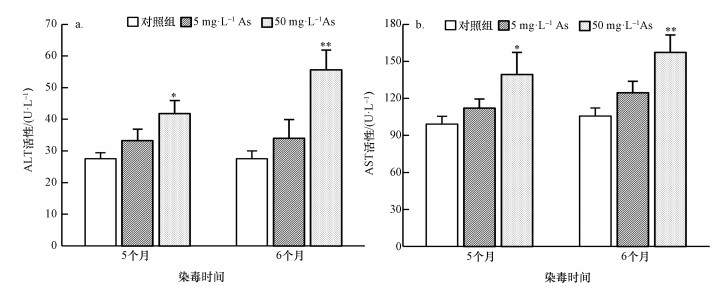 |
| 图 2 砷暴露对小鼠血清丙氨酸转氨酶(a)和天冬氨酸转氨酶(b)活性的影响(与对照组比, *p<0.05, **p<0.01) Fig. 2 Effects of exposure to arsenic on the activities of serum alanine transaminase (a) and aspartate transaminase (b) in mice |
在检测小鼠肝脏功能的同时, 本研究对肝脏结构进行了观察.通过HE染色发现, 砷暴露5、6个月对肝脏形态的影响基本一致(砷暴露5个月的结果未显示).砷暴露6个月, 对照组小鼠肝小叶结构完整、界限清晰, 肝细胞以中央静脉为中心向周围呈放射状排列, 无炎性细胞浸润和坏死现象(图 3a), 然而5、50 mg·L-1 As组小鼠肝细胞索排列紊乱, 肝内可见散在点状坏死灶, 有炎性细胞浸润(图 3b和3c), 表明砷暴露引起肝脏结构损伤, 且随砷暴露浓度增大损伤进一步加重.
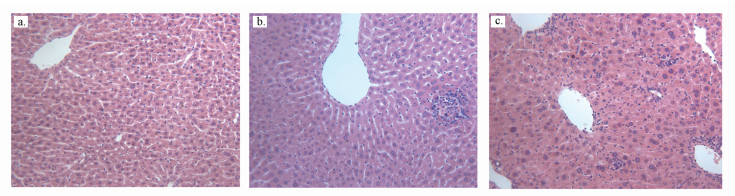 |
| 图 3 砷暴露6个月对小鼠肝脏HE病理切片的影响(a.对照组, b.5 mg·L-1 As组, c.50 mg·L-1 As组;放大200×) Fig. 3 Effects of exposure to arsenic on morphological characteristics of HE stained sections in the liver of mice |
基于HE染色观察到肝脏有炎细胞浸润, 本文检测了肝脏中促炎症因子TNF-α mRNA的表达.砷暴露5、6个月, 5、50 mg·L-1 As组的TNF-α mRNA转录水平均明显高于对照组(图 4), 提示TNF-α可能与肝脏的炎症反应有关, 并且随砷暴露剂量增大炎症反应加重.
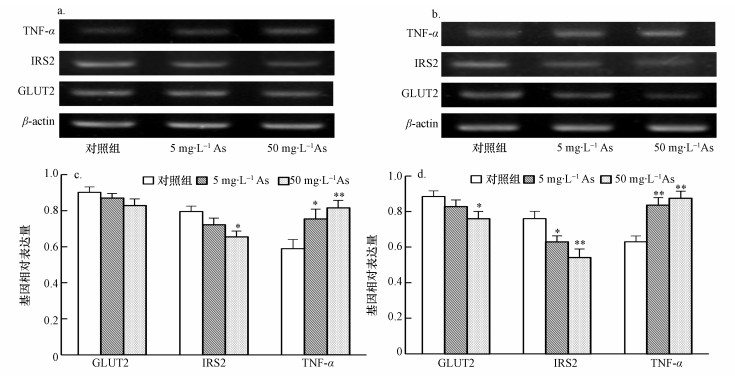 |
| 图 4 砷暴露对小鼠肝脏GLUT2、IRS2和TNF-α mRNA转录水平的影响(a, c.5个月, b, d.6个月;与对照组比, *p<0.05, **p<0.01) Fig. 4 Effects of the exposure to arsenic on mRNA levels of GLUT2, IRS2 and TNF-α in the liver of mice |
为进一步研究砷暴露葡萄糖耐量受损的相关作用机制, 本实验利用RT-PCR对肝脏中胰岛素受体后信号转导始动基因IRS2和葡萄糖转运体GLUT2 mRNA表达进行了检测.结果发现, 砷暴露5个月, IRS2 mRNA表达仅在50 mg·L-1 As组显著下调, GLUT2 mRNA转录水平在砷暴露组均有下降, 但与对照组相比没有显著性差异;砷暴露6个月, IRS2 mRNA水平在5、50 mg·L-1 As组均显著下调, GLUT2 mRNA仅在50 mg·L-1 As组明显低于对照组(图 4), 表明长期砷暴露可引起肝脏胰岛素受体后信号转导障碍和葡萄糖转运异常.
4 讨论(Discussion)糖尿病是以血糖水平升高为特征的代谢性疾病.流行病学调查发现, 饮水型砷暴露与人群2型糖尿病的发生存在不同程度的相关性(Kuo et al., 2015; Feng et al., 2015).动物研究方面, 有文献报道砷暴露可显著升高空腹血糖(Rodríguez et al., 2016; Hill et al., 2009), 也有文献显示砷暴露后血糖降低(Pal et al., 2005).本研究发现, 在5和50 mg·L-1 As暴露的6个月内, 每月空腹血糖与对照组无明显差异, 说明5和50 mg·L-1 As暴露6个月没有对空腹血糖构成影响, 这和Tan等(2011)报道的结果是相似的.上述提到的砷暴露对空腹血糖影响的不一致性可能与砷化物的种类、暴露浓度和暴露时间等不同有关.因此, 本研究的目的是进一步研究砷暴露剂量和时间对葡萄糖稳态的影响及相关作用机制.
空腹血糖只能反映采血时的血糖水平, 然而葡萄糖耐量可反映机体对血糖的调节能力, 所以葡萄糖耐量检测能更准确地反映小鼠血糖的真实情况.临床研究表明, 在糖耐量受损的患者中, 虽然有相当一部分人空腹血糖并无异常, 但餐后血糖调节已经出现问题(Armszrong et al., 2006).本研究显示, 砷暴露5、6个月, 5和50 mg·L-1 As组葡萄糖耐量均受损, 总体而言, 砷暴露时间越长、剂量越大, 表现出糖负荷各时间点(30、60、120 min)的血糖增减幅度也越大, 提示增加砷暴露剂量或延长暴露时间能促进葡萄糖调节能力的下降.与此同时, 小鼠空腹血糖并没有明显升高, 这与临床研究结果是一致的.
肝脏是糖代谢的重要器官, 对维持血清葡萄糖稳态起重要作用.血清ALT和AST是判断肝脏功能是否损伤的主要指标, 考虑到砷暴露5、6个月小鼠葡萄糖耐量明显受损, 本实验检测了血清ALT和AST活性.结果发现, 5 mg·L-1 As组小鼠ALT和AST活性与对照组比没有显著差异;50 mg·L-1 As组小鼠ALT和AST活性以时间依赖性显著提升, 这与Sankar等(2015)研究结果相似, 表明50 mg·L-1 As组小鼠肝脏功能受到损伤.与此同时, HE染色观察到砷暴露小鼠表现出不同程度的肝细胞索排列紊乱, 炎性细胞浸润, 且这种损伤随着砷暴露剂量增大而加重.TNF-α是一种促炎症细胞因子, 参与许多炎症性疾病的病理生理过程(Hu et al., 2007).本研究显示, 砷暴露引起肝脏TNF-α mRNA转录水平显著上调, 这与HE染色观察到的砷暴露组小鼠肝脏炎性细胞浸润是具有一致性的, 提示TNF-α可能与肝脏的炎症反应有关.由于炎症是引起胰岛素敏感性降低, 即胰岛素抵抗的重要因素之一(Li et al., 2010).在本研究中, 考虑到砷暴露5、6个月小鼠肝功能损伤, 尤其是肝脏炎性细胞浸润及促炎症因子TNF-α转录水平提升, 推测砷暴露引起肝脏炎症反应后, 可能会改变胰岛素信号转导通路中某些基因的表达, 使胰岛素信号转导发生障碍, 降低肝脏胰岛素敏感性, 使小鼠葡萄糖调节能力下降而引起糖耐量受损.
因此, 本研究利用RT-PCR检测了肝脏胰岛素信号转导通路和负责葡萄糖摄取的相关基因.在胰岛素信号转导通路中, IRS是TNF-α引起胰岛素抵抗的关键基因.文献报道, 在肝细胞中IRS2是与胰岛素受体信号偶联的重要转导蛋白, 通过该蛋白酪氨酸磷酸化传递胰岛素信号, 调节葡萄糖、脂质和蛋白质代谢及葡萄糖吸收等功能的正常进行以维持血清葡萄糖稳态, IRS2常被称作胰岛素受体后信号转导始动基因.当IRS2表达下降, 胰岛素受体后信号转导发生障碍, 继而干扰糖代谢导致葡萄糖稳态受损(Rother et al., 1998).Goldfine等(2011)报道, IRS2基因敲除的小鼠表现出胰岛素抵抗, 暗示IRS2在胰岛素受体后信号转导中发挥重要作用.本实验显示, 除5 mg·L-1 As暴露5个月小鼠IRS2 mRNA转录水平与对照无统计学差异, 5 mg·L-1 As组在暴露6个月和50 mg·L-1 As组暴露5、6个月, 小鼠IRS2 mRNA表达均显著下调, 该结果与Chakraborty等(2012)的报道相似, 提示IRS2 mRNA转录水平下调可能与胰岛素受体后信号转导障碍、葡萄糖调节能力降低和葡萄糖耐量受损相关.另外, GLUT2是葡萄糖转运载体, 主要负责肝脏葡萄糖转运, 其表达与调控对葡萄糖的吸收、代谢具有重要影响(Guillemain et al., 2000).本研究显示, 只有50 mg·L-1 As组小鼠砷暴露6个月, GLUT2 mRNA转录水平显著降低, 表明长时间砷暴露可引起肝脏葡萄糖转运异常, 提示可能与小鼠葡萄糖耐量受损及高剂量砷组加重葡萄糖耐量受损有关.
5 结论(Conclusions)砷暴露6个月期间, 小鼠每月空腹血糖及1~4个月内葡萄糖耐量与对照组相比没有明显变化.砷暴露5、6个月均引起葡萄糖耐量受损且具有剂量和时间依赖性, 砷暴露还可引起肝脏功能和结构损伤, 产生炎症反应, 同时, 肝脏TNF-α mRNA表达明显上升, IRS2和GLUT2 mRNA转录水平下降.IRS2和GLUT2 mRNA转录水平的下降表明肝脏胰岛素受体后信号转导发生障碍和葡萄糖转运异常, 提示这些变化可能与小鼠糖耐量受损有关.
Armszrong K A, Prins J B, Beller E M, et al. 2006. Should an oral glucose tolerance test be performed routinely in all renal transplant recipients[J]. Clinical Journal of the American Society of Nephrology, 1(1): 100–108.
|
Chakraborty D, Mukherjee A, Sikdar S, et al. 2012. [6]-Gingerol isolated from ginger attenuates sodium arsenite induced oxidative stress and plays a corrective role in improving insulin signaling in mice[J]. Toxicology Letters, 210(1): 34–43.
DOI:10.1016/j.toxlet.2012.01.002
|
Das N, Paul S, Chatterjee D, et al. 2012. Arsenic exposure through drinking water increases the risk of liver and cardiovascular diseases in the population of West Bengal, India[J]. BMC Public Health, 12: 639–639.
DOI:10.1186/1471-2458-12-639
|
Druwe I L, Vaillancourt R R. 2010. Influence of arsenate and arsenite on signal transduction pathways:an update[J]. Archives of Toxicology, 84(8): 585–596.
DOI:10.1007/s00204-010-0554-4
|
Feng W, Cui X, Liu B, et al. 2015. Association of urinary metal profiles with altered glucose levels and diabetes risk:a population-based study in China[J]. PLoS One, 10(4): e0123742.
DOI:10.1371/journal.pone.0123742
|
Goldfine A B, Fonseca V, Shoelson S E. 2011. Therapeutic approaches to target inflammation in type 2 diabetes[J]. Clinical Chemistry, 57(2): 162–167.
DOI:10.1373/clinchem.2010.148833
|
Guillemain G, Loizeau M, Pinçon-Raymond M, et al. 2000. The large intracytoplasmic loop of the glucose transporter GLUT2 is involved in glucose signaling in hepatic cells[J]. Journal of Cell Science, 113(5): 841–847.
|
Hill D S, Wlodarczyk B J, Mitchell L E, et al. 2009. Arsenate-induced maternal glucose intolerance and neural tube defects in a mouse model[J]. Toxicology and Applied Pharmacology, 239(1): 29–36.
|
Hu W, Abe-Dohmae S, Tsujita M, et al. 2007. Biogenesis of HDL by SAA is dependent on ABCA1 in the liver in vivo[J]. Journal of Lipid Research, 49(2): 386–393.
|
Izquierdo-Vega J A, Soto C A, Sanchez-Peña L C, et al. 2006. Diabetogenic effects and pancreatic oxidative damage in rats subchronically exposed to arsenite[J]. Toxicology Letters, 160(2): 135–142.
DOI:10.1016/j.toxlet.2005.06.018
|
Kuo C C, Howard B V, Umans J G, et al. 2015. Arsenic exposure, arsenic metabolism, and incident diabetes in the strong heart study[J]. Diabetes Care, 38(4): 620–627.
|
Li L O, Hu Y F, Wang L, et al. 2010. Early hepatic insulin resistance in mice:a metabolomics analysis[J]. Molecular Endocrinology, 24(3): 657–666.
DOI:10.1210/me.2009-0152
|
Lu T H, Tseng T J, Su C C, et al. 2014. Arsenic induces reactive oxygen species-caused neuronal cell apoptosis through JNK/ERK-mediated mitochondria-dependent and GRP 78/CHOP-regulated pathways[J]. Toxicology Letters, 224(1): 130–140.
|
Pal S, Chatterjee A K. 2005. Prospective protective role of melatonin against arsenic-induced metabolic toxicity in Wistar rats[J]. Toxicology, 208(1): 25–33.
DOI:10.1016/j.tox.2004.11.005
|
Paul D S, Hernández-Zavala A, Walton F S, et al. 2007. Examination of the effects of arsenic on glucose homeostasis in cell culture and animal studies:development of a mouse model for arsenic-induced diabetes[J]. Toxicology and Applied Pharmacology, 222(3): 305–314.
|
Rother K I, Imai Y, Caruso M, et al. 1998. Evidence that IRS2 phosphorylation is required for insulin action in hepatocytes[J]. Journal of Biological Chemistry, 273(28): 17491–17497.
DOI:10.1074/jbc.273.28.17491
|
Sankar P, Gopal Telang A, Kalaivanan R, et al. 2015. Effects of nanoparticle-encapsulated curcumin on arsenic-induced liver toxicity in rats[J]. Environmental Toxicology, 30(6): 628–637.
DOI:10.1002/tox.21940
|
Schuhmacher-Wolz U, Dieter H H, Klein D, et al. 2009. Oral exposure to inorganic arsenic:evaluation of its carcinogenic and non-carcinogenic effects[J]. Critical Reviews in Toxicology, 39(4): 271–298.
DOI:10.1080/10408440802291505
|
Shoelson S E, Lee J, Goldfine A B. 2006. Inflammation and insulin resistance[J]. Journal of Clinical Investigation, 116(7): 1793–1801.
DOI:10.1172/JCI29069
|
Tan M, Schmidt R H, Beier J I, et al. 2011. Chronic subhepatotoxic exposure to arsenic enhances hepatic injury caused by high fat diet in mice[J]. Toxicology and Applied Pharmacology, 257(3): 256–364.
|
Taniguchi C M, Ueki K, Kahn R. 2005. Complementary roles of IRS1and IRS2 in the hepatic regulation of metabolism[J]. Journal of Clinical Investigation, 115(3): 718–727.
DOI:10.1172/JCI23187
|
Valenzuela O L, Borja-Aburto V H, Garcia-Vargas G G, et al. 2005. Urinary trivalent methylated arsenic species in a population chronically exposed to inorganic arsenic[J]. Environmental Health Perspectives, 113(3): 250–254.
|
Walton F S, Harmon A W, Paul D S, et al. 2004. Inhibition of insulin-dependent glucose uptake by trivalent arsenicals:possible mechanism of arsenic-induced diabetes[J]. Toxicology and Applied Pharmacology, 198(3): 424–433.
DOI:10.1016/j.taap.2003.10.026
|
Xue P, Hou Y, Zhang Q, et al. 2011. Prolonged inorganic arsenite exposure suppresses insulin-stimulated AKT S473 phosphorylation and glucose uptake in 3T3-L1 adipocytes:involvement of the adaptive antioxidant response[J]. Biochemical and Biophysical Research Communications, 407(2): 360–365.
DOI:10.1016/j.bbrc.2011.03.024
|
Zhou L, Li Y, Xia T, et al. 2006. Resistin overexpression impaired glucose tolerance in hepatocytes[J]. European Cytokine Network, 17(3): 189–195.
|
 2018, Vol. 38
2018, Vol. 38


