2. 江西农业大学, 江西省鄱阳湖流域农业资源与生态重点实验室, 南昌 330045
2. Key Laboratory of Poyang Lake Basin Agricultural Resource and Ecology of Jiangxi Province, Jiangxi Agricultural University, Nanchang 330045
农业生产过程可能导致大量面源有机污染物排放, 部分有机污染物最终将进入自然水环境, 并在其中发生转化与降解.因此, 以湿地为代表的自然水体在有机污染物的生物地球化学净化过程中扮演着重要角色(许磊等, 2010).经过水体的稀释作用, 自然水环境中的有机污染物浓度通常处于ng·L-1 ~ μg·L-1级的痕量水平, 而能够被微生物作为碳源利用的有机污染物浓度通常在10~100 μg·L-1(Egli, 2010), 暗示着痕量有机污染物可能较难在自然环境中通过微生物降解的方式被针对性地代谢, 尤其是在微生物活性较弱的寒冷冬季(Fenner et al., 2013;Page et al., 2013).
光化学降解作为另一种自然降解过程, 容易在水体表面发生, 可以通过间接光氧化作用将难降解的有机污染物改造成易被生物降解的结构(Lapertot et al., 2006), 是一种与生物降解存在协同或互补关系的自然净化过程.自然水体中的有机污染物含量一般远低于水体中其它基质物质的背景含量, 导致有机污染物分子本身吸收的光子数量稀少, 难以通过直接光解的形式发生降解(Fenner et al., 2013).因此, 自然水环境中痕量有机污染物的光化学净化可能将主要依靠间接光解, 也即与水体光敏物质产生的各种活性氧(Reactive Oxygen Species, ROSs)发生反应而进行(黄建等, 2017).羟基自由基(HO·)是自然水体中较为重要的ROSs之一, 强氧化性(酸性条件下E = 2.8 V)决定HO·可以无选择性地氧化大多数有机分子(杨岳主等, 2013).同时, HO·的形成会受到包括水体化学组成、水深、季节、甚至太阳高度角等多种因素的影响(Vione et al., 2007).因此, 研究特定水体中HO·的浓度与变化特征, 有利于从环境地球化学的角度深入理解该水体的自净能力及承载的生态功能.
抗生素是一类备受瞩目的新兴污染物, 而我国抗生素污染多来自于畜牧等养殖行业的废弃物排放, 且排入环境的抗生素总量中有60%最终会进入水环境(Zhang et al., 2015).作为污染物的重要汇集区域, 目前已发现我国多个湖泊水体出现ng·L-1级的抗生素污染(Ma et al., 2016, Cheng et al., 2017).鄱阳湖作为中国第一大淡水湖, 其流域面积的97%位于农业经济大省—江西省境内, 不可避免地也同样存在抗生素污染问题(Ding et al., 2017).鄱阳湖既是工农业水体污染物的汇集地, 其广阔的湖面也可以作为痕量抗生素类污染物的天然净化场所, 由湖水中形成的HO·可能在区域抗生素污染净化方面承担重要的生态功能.同时, 鄱阳湖水面、水深等水文条件季节变化明显, 丰水期为湖, 枯水期似河, 可能有其特殊的HO·浓度变化特征与抗生素净化能力.
因此, 本文以鄱阳湖为对象, 研究丰水期与枯水期鄱阳湖及周边支流水体中HO·的表观光量子产率, 并对其贡献源及影响HO·形成的关键化学组分与水文因素进行探讨.同时, 通过进一步研究5种典型抗生素在湖水中的光降解, 并结合自然湖水中HO·与抗生素浓度水平, 从环境地球化学角度对鄱阳湖的抗生素自净能力进行初步阐释.
2 材料与方法(Materials and methods) 2.1 实验材料与仪器主要试剂:对苯二甲酸(TPA)、2-羟基对苯二甲酸(hTPA)、对硝基苯甲醚(PNA)购自于阿拉丁试剂(上海)有限公司, 纯度不低于98%;恩诺沙星(ENR)、磺胺嘧啶(SDZ)、磺胺甲基异恶唑(SMX)、红霉素(ERY)、氟苯尼考(FF)抗生素标准品购买自Sigma-Aldrich(St.Louis, MO, USA);色谱纯甲醇与乙腈购自于上海安谱公司.
主要仪器:模拟太阳光氙灯(300 W, 中教金源CEL-HXF300, 加装AM1.5滤光片);Agilent 1260型高效液相色谱仪与荧光检测器(FLD)、紫外检测器(VWD);液相色谱串联三重四级杆质谱HPLC-MS/MS(岛津, 8050);离子色谱仪(皖仪, IC6000);TOC分析仪(Elementar, Liquid TOC Ⅱ); USB 2000+光纤光谱仪(Ocean Optics).
2.2 实验方法 2.2.1 采样点及常规指标分析于2016年8月与12月晴朗天气条件下, 分别在4 d内采集了鄱阳湖地区13个样点的表层水样本(图 1), 其中, 5个样点位于鄱阳湖中(L1~L5), 8个样点位于与鄱阳湖连通的主要河流中(R1~R8), 各样点详情如表 1所示.采集的样本均以0.45 μm滤膜过滤, 之后以离子色谱分析F-、Cl-、NO2-、NO3-与SO4-含量;TOC分析仪测定溶解态有机碳(DOC), 用以表征水体DOM的含量.
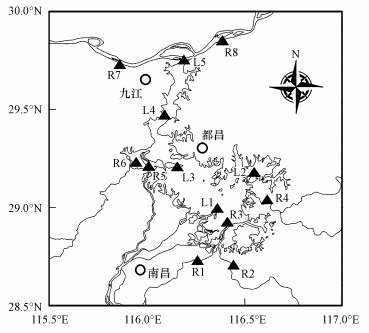 |
| 图 1 鄱阳湖采样点分布示意图 (L1~L5湖泊样本, R1~R8河流样本) Fig. 1 Locations of sampling sites (L1~L5 represent sites in Poyang Lake, and R1~R8 represent sites in rivers around the lake) |
| 表 1 鄱阳湖采样点情况 Table 1 General information of the sampling sites |
取8 mL过滤水样加入TPA(HO·探针)母液, 使TPA在样本中的最终浓度为0.5 mmol·L-1.氙灯照射下, 于0~80 min内每隔一定时间取样, 通过HPLC-FLD分析TPA的羟基加成产物hTPA的形成量(λex = 315 nm, λem = 425 nm).根据动力学曲线0 min的斜率计算HO·的初始形成速率(rHO·, mol·L-1·s-1).
以USB 2000+型光纤光谱仪测定氙灯及太阳光谱(图 2), 同时采用PNA为标准物质对氙灯光强进行测定, 依据公式(1)计算湖水中HO·的表观光量子产率(ΦHO·).根据ΦHO·及与PNA测定的正午太阳光强(图 2插图), 依据公式(2)可计算自然条件下鄱阳湖水体中HO·的稳态浓度([HO·]ss)(Fang et al., 2017).
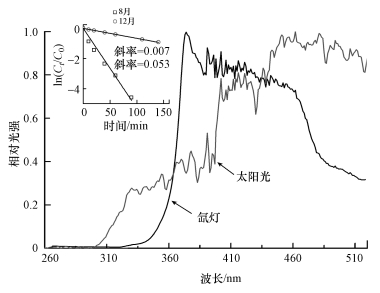 |
| 图 2 氙灯与自然阳光发射光谱的相对能量 (插图为8月与12月中午太阳光照射下PNA光解的一级动力学拟合直线, PNA浓度25 μmol·L-1, Φ夏季=0.0005, Φ冬季=0.00085) Fig. 2 Relative intensity of xenon and sunlight (inset presents the degradation of 25 μmol·L-1 PNA with solar irradiation during noon of sunny day in August and December, Φsummer=0.0005, Φwinter=0.00085) |
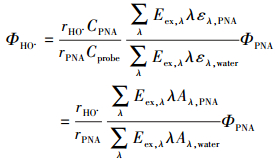
|
(1) |
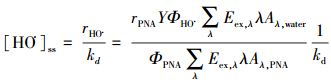
|
(2) |
式中, r为氙灯照射下PNA的降解或HO·的形成速率(mol·L-1·s-1), C表示PNA或TPA探针的初始浓度, Φ表示PNA(Dulin et al., 1982)或HO·的表观光量子产率, ε为摩尔吸光系数, A为单位波长PNA或水样的吸光度, Y为计算实际水体中HO·浓度时的量子产率校准值(Y=0.37, 相同3个水样, 分别在氙灯和太阳光下以相同的方法计算HO·光量子产率, 可得ΦHO·, 太阳光=(0.37±0.11)ΦHO·, 氙灯), Eex, λ表示氙灯或太阳光在特定波长下的入射光能量(W·m-2·s-1), λ表示波长(增量为1 nm, 范围290~400 nm), kd为水体中HO·的自然衰减速率(水中HO·自然衰减的一级速率常数, s-1), 参考HO·与水中物质的绝对双分子反应速率常数或半衰期(Buxton et al., 1988), kd≈105 s-1.
以公式(3)~(5)评估氙灯照射下, 水体3种主要光敏物质(DOM、NO2-与NO3-)对于HO·产量的贡献率η.
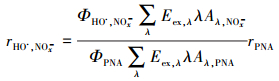
|
(3) |
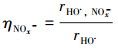
|
(4) |
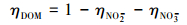
|
(5) |
式中, rHO·, NOx-代表氙灯照射下, 各水样中NO2-与NO3-光敏形成HO·的速率(mol·L-1·s-1).ΦHO·, NOx-表示NO2-与NO3-光敏形成HO·的平均光量子产率, 分别为0.00409与0.00282(Jankowski et al., 1999).
2.2.3 抗生素含量分析与降解速率评估鄱阳湖水(L1~L5)中的5种抗生素采用固相萃取小柱提取(Waters, Oasis HLB), 并以HPLC-MS/MS检测, 提取与检测方法参考本研究之前建立的方法(Liang et al., 2013).基于HO·的稳态浓度, 依据式(6)、(7)估算不同抗生素类药物在鄱阳湖水的半衰期(T1/2, 单位:d, 表示水中抗生素浓度下降1/2所需时间)及单位时间的降解速率(rP, ng·m-3·h-1).
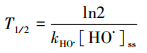
|
(6) |
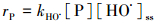
|
(7) |
式中, kHO·为抗生素与HO·的绝对双分子反应速率常数, 可从文献查得; [P]为抗生素在鄱阳湖水中的实测浓度.
配置母液为200 μmol·L-1的抗生素水溶液(红霉素难以溶解, 未做动力学实验检验).取过滤后的L1水样7.96 mL, 分别加入抗生素母液0.04 mL, 形成降解初始浓度为1 μmol·L-1的抗生素光化学反应溶液.由于抗生素与HO·反应的降解半衰期较长, 为缩短实验时间, 通过缩短光照样品与光源的位置使光照得到增强, 同时对相应位置处的辐照强度与HO·稳态浓度分别以PNA与TPA探针进行标定.在氙灯照射下每隔一定时间取样, 以HPLC-VWD测定抗生素的含量, 计算加入甲醇(甲醇在水样中的最终浓度为100 mmol·L-1)与未加入甲醇反应溶液中抗生素的一级降解速率常数k(s-1).通过差减法, 计算HO·作用下4种抗生素光降解的k.
3 结果与讨论(Results and discussion) 3.1 鄱阳湖及其周边河流水体中ΦHO·及不同光敏物质的贡献由图 3可知, 鄱阳湖及其周边河流水体中HO·的表观光量子产率(ΦHO·)范围分别为:丰水期(0.57~10.33)×10-5, 枯水期(0.45~3.52)×10-5, 平均值分别为2.42×10-5、1.36×10-5, 所有13个样点两季间ΦHO·并没有显著差异(p=0.191), 丰水期R1(抚河样点)的ΦHO·则远高于丰水期的平均值.ΦHO·的大小与不同水体光敏物质的构成类型有关, 而水体中对HO·形成有主要贡献的光敏物质为溶解态有机物(DOM)、NO2-与NO3- 3类(赵群, 2014).据此, 本研究进一步对3类光敏物质形成HO·的贡献进行了计算(表 2).结果表明, 鄱阳湖两季所有水样中HO·的形成均由DOM主导(ηDOM>50%), 且丰水期DOM的贡献率均在85.8%以上, 枯水期在58.5%以上.同时, 枯水期水体中的NO2-也表现出较大的贡献, 有5个样点NO2-的贡献率超过10%, NO3-在两季均没有高的贡献(< 6%).DOM是水体中太阳光波段的主要吸收物质, 使得其对HO·的形成具有较大贡献.NO2-更容易吸收氙灯或太阳光中的UVA波段(320~400 nm), 且量子产率比NO3-更高(Jankowski et al., 1999), 因此, 枯水期个别水体NO2-含量的提高也将更有利于在本实验体系下HO·的形成.此外, 13个样点所得到的ΦHO·与提取自天然河流的腐殖酸与富里酸的ΦHO·值((3.01~4.56)×10-5)较为接近, 而远低于NO2-与NO3-的ΦHO·(0.007~0.078)(Zhang et al., 2014).对HO·形成贡献率的计算与ΦHO·量级的比较均说明NO2-与NO3-的贡献很小, 鄱阳湖及其周边水系中对HO·形成的主要光敏物质是DOM.
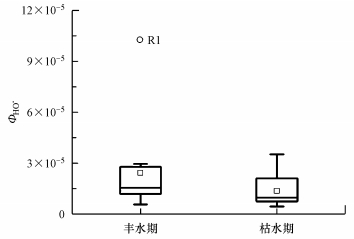 |
| 图 3 丰水期与枯水期鄱阳湖及其周边河流水体的ΦHO·值 Fig. 3 ΦHO· values obtained in aqueous samples of Poyang Lake and the surrounding rivers collected in wet and dry seasons |
| 表 2 NO2-、NO3-与DOM对不同样点HO·形成的贡献 Table 2 Contribution ratios of NO2-, NO3- and DOM to the formation of HO· in water samples |
除显示出共性外, ΦHO·在R1样本中也显示出极大特异性, 可能与抚河所承担的特殊功能有关.与其它河流不同, 抚河是江西省赣抚平原的灌溉水源, 灌区的给排水都由抚河供给.肥沃稻田积累的有机质在丰水期可随降雨或灌溉排水进入抚河, 进而改变抚河DOM的光化学性质.一方面流入的有机质将会提高水体DOM的含量进而促进水体HO·的形成, 如本研究观测到丰水期R1的DOM含量为3.84 mg·L-1, 仅比R3样点略低(3.92 mg·L-1), 而高于其它样点(平均值2.08 mg·L-1);另一方面, 由农业区河流带来的DOM性质与构成也可能与其它来源的DOM显著不同.
3.2 影响湖水化学组成及ΦHO·的潜在因素鄱阳湖河口众多、面积广大, 周边河流的注入及鄱阳湖自身的内源性因素均可能影响湖泊的化学组成, 进而影响到HO·在自然水体的形成与淬灭过程.据此, 本研究首先依据水样的7项物理化学指标(表 3, 包括290~400 nm紫外吸收光谱积分面积(AUV)、DOC、F-、Cl-、NO2-、NO3-、SO42-)及ΦHO·, 对丰水与枯水两季所有样点进行了主成分分析(图 4).
| 表 3 丰水(W)与枯水期(D)13个样点的紫外吸收光谱积分面积(AUV, 290~400 nm)、DOC、F-、Cl-、NO2-、NO3-、SO42-的含量 Table 3 The integrated absorption spectra (AUV, 290~400 nm), levels of DOC, F-, Cl-, NO2-, NO3- and SO42- in 13 water samples collected in wet (W) and dry seasons (D) |
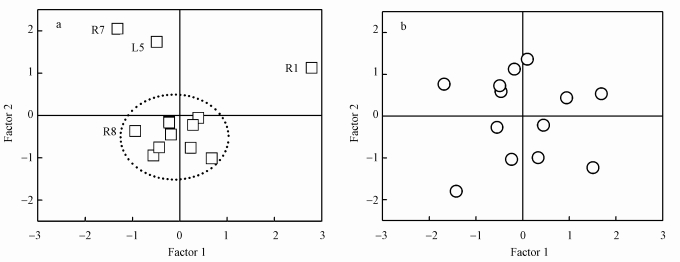 |
| 图 4 基于7项物理化学指标(AUV、DOC、F-、Cl-、NO2-、NO3-、SO42-)与ΦHO·对丰水期(a)与枯水期(b)样点的主成分分析 Fig. 4 Principal component analysis of samples collected in wet (a) and dry (b) seasons based on the levels of seven aqueous physiochemical parameters (AUV, DOC、F-、Cl-、NO2-、NO3-、SO42-) and ΦHO· |
丰水期的多数采样点较为集中(除L5、R1与R7), 说明样点化学组成较为接近, 这可能与丰水期湖泊各水体混合程度增加有关.随鄱阳湖水位抬升, 各水体的连接与交换过程可能变得活跃, 导致鄱阳湖各水体间的化学组成较为接近.采样过程中也发现, 丰水期湖泊水面会扩展, 与部分枯水期属于河道的区域连为一体(如R3、R5与R6), 这种变化可能使得河流水体的化学组成与湖泊主湖区水体接近.进一步对丰水期形成HO·的强影响因素DOC与ΦHO·进行相关性分析发现(图 5a), 除R1可能有其特殊的DOM构成外, 多数样点ΦHO·均随DOC含量的增加而增长.当DOC超过一定含量时(3 mg·L-1), ΦHO·又表现出下降的趋势(R2与R3). DOC与ΦHO·呈现显著的正相关关系(p=0.013)可能也同样说明丰水期不同样点DOM具有相似性, 即只有当各样点DOM结构在光化学性质上相近时, 才比较容易出现DOC含量与ΦHO·的有序相关.而DOC超过一定值, ΦHO·不再增加, 这可能与高含量的DOM主要表现出淬灭HO·的作用有关(刘雪石等, 2017).此外, 因子之间的相关性分析显示, 丰水期DOC与水体其它组成物质(F-、NO2-、NO3-、SO42-)的含量也呈现出显著的正相关关系(p值分别为0.008、0.041、0.060、0.045), 说明随着水中DOC浓度的提高, 其他物质的含量也总体呈上升趋势, 进而加剧水体中HO·的淬灭(Buxton et al., 1988), 这也造成ΦHO·在DOC浓度超过一个较低浓度后, 出现下降的原因.
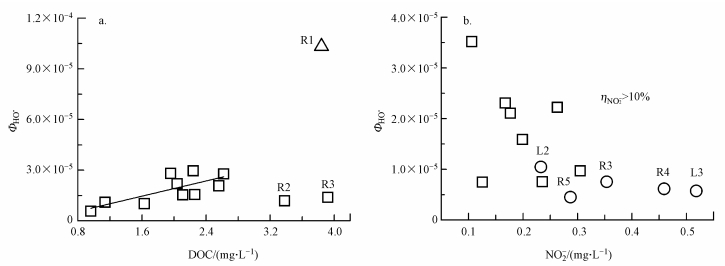 |
| 图 5 丰水期DOC (a)、枯水期NO2- (b)含量与ΦHO·的相关性分析 Fig. 5 Correlations between ΦHO· and levels of DOC and NO2- (a. DOC and wet season; b. NO2- and dry season) |
丰水期L5、R1与R7离散点的存在, 则说明这些区域水体的化学组成可能受到其它因素的强烈影响(图 4a).其中, R1如上文所提, 其形成HO·的特异性可能与该条河流是灌溉水源有关, 具有较高的ΦHO·.L5与R7则位于九江市中心, 附近均具有较大的港口, 城市的排污及港口化石能源的消耗都有可能造成NO3-与SO42-的上升(表 3)(Fan et al.2016).与此对应, Factor 2代表的3个最重要因子即为SO42-、NO3-与Cl-, 因此, L5与R7样点NO3-与SO42-含量的上升也必然会造成两样点Factor 2的坐标值显著高于其它采样点, 但Factor 1坐标值的改变不大.值得注意的是, 虽然R8同属长江样点, 但主成分分析显示, R8与鄱阳湖区域其它样点较为接近, 很可能意味着采样期间鄱阳湖对于长江呈现补水作用, 导致下游水体的物理化学性质与鄱阳湖及其支流较为相似.
枯水期, 鄱阳湖面积从约3000 km2锐减到约1000 km2, 大片水域容易形成碟形湖, 其显著特点是水浅、水流缓慢且可能与主湖区或河流完全隔离(胡振鹏等, 2015).这种现象在所有的湖泊样点(L1~L5)中均被观测到, 其中, L1、L4在丰水期是湖, 枯水期则显露河道, 形成宽度5 ~6 m的河流;L2、L3在丰水期是深度约为6~7 m的湖面, 枯水期时显露出平坦的湖床, 形成大面积深度约为0.1~0.2 m的浅水湖;L5枯水期时水位显著下降, 长江与鄱阳湖接口处的水道收窄.丰水期至枯水期, 鄱阳湖由湖变为河或浅滩均会造成水体流动缓慢, 进而使得水体化学组成容易受水系流经区域局部特异性因素的影响, 导致各样点化学组成差异较大, 主成分分析难以获得统计学上的相似性.水体差异性较大这一点在DOC与ΦHO·的相关性关系方面也有一定体现, 枯水期DOM虽然也是对HO·形成有贡献的首要因子, 但枯水期DOC与ΦHO·的相关性不显著(p =0.153), 造成这种现象的原因可能就是因为枯水期各样点DOM来源不同, 形成HO·的能力差异较大.另一因子NO2-与ΦHO·存在显著相关关系(p=0.012), 且相关性分析表明(图 5b), 随NO2-浓度增加ΦHO·呈下降趋势, 当NO2-浓度达到一定值后(约0.3 mg·L-1)这种下降即不再显著.与丰水期相比, 枯水期水体各化学组成的含量较高(表 3), 可能导致水体中光屏蔽或淬灭作用占据主导(郑晓冬等, 2013).在这种容易抑制HO·形成的体系中, 如果样本中光敏剂含量较低, 其形成HO·的作用则可能完全被这种负面作用掩蔽.只有当NO2-超过一定浓度后对HO·的形成作用才变得显著(η>10%, L2、L3、R3、R4与R5, 表 2), 并由此抵消了其它物质的吸光与淬灭作用, 最终使得ΦHO·值不再下降.
3.3 鄱阳湖水体抗生素降解速率的估算基于常用的4类5种抗生素在鄱阳湖湖水(L1~L5)中的检出浓度(表 4), 可得丰水期5种抗生素的平均浓度分别为0.18、0.34、1.11、25.12、6.00 ng·L-1, 枯水期5种抗生素的平均浓度分别为0.16、0.84、5.05、22.12、27.19 ng·L-1.枯水期抗生素污染的总体水平略高于丰水期, 但差异并不显著(p>0.05).表 3中所列其他水体化学组成受控于丰、枯水期水体的稀释与浓缩作用, 抗生素浓度丰、枯水期的微弱变化也可能受控于相同的水文因素(Chen et al., 2013).此外, 鄱阳湖的丰水期在6—8月, 日照强度与日照时间会远高于枯水期, 湖面面积也是枯水期的数倍, 暗示着丰水期鄱阳湖表层水体的总体光化学净化能力可能会高于枯水期, 使得抗生素光降解速率较快.据此, 本文首先研究了模拟太阳光下抗生素的降解动力学, 结果表明, 加入与未加入甲醇组的抗生素降解均符合一级动力学模型(R2 > 0.97).基于直接光解组与加入甲醇淬灭组的一级降解速率常数k, 以差减法计算可得几种抗生素与HO·反应的k为3.79~12.70 h-1, T1/2为5.5~18.3 h(表 5).
| 表 4 丰水(W)与枯水期(D)鄱阳湖湖水中(L1~L5) 5种抗生素浓度 Table 4 Concentrations of five antibiotics in water samples of Poyang Lake (L1~L5) collected in wet (W) and dry (D) seasons |
| 表 5 丰水(W)与枯水(D)期鄱阳湖湖水中HO·作用下5种抗生素的一级降解速率(k)、绝对双分子反应速率常数(kHO·)、半衰期与单位时间降解速率 Table 5 First order rate constant (k), absolute bimolecular rate constants (kHO·), half-lives and degradation rates of five domestic antibiotics by reactions with HO· during wet (W) and dry (D) seasons in Poyang Lake |
室内模拟过程使用的氙灯辐照强度较高, 经测定反应体系中HO·的稳态浓度为2.02×10-15 mol·L-1, 可能高于自然淡水中HO·的浓度(Zeng et al., 2013).因此, 为更准确地评估抗生素在自然湖水中太阳光照射条件下的降解速率与半衰期, 本研究进一步依据PNA标定的夏、冬两季的太阳光强(图 2), 计算得到丰水与枯水两季湖水中HO·的平均稳态浓度分别为9.51×10-16与4.92×10-17 mol·L-1.在假设日照时长为8 h的情况下, 依据HO·与抗生素的绝对双分子反应速率常数(kHO·, 表 5)(Li et al., 2014;Wols et al., 2014;Ge et al., 2015), 可得丰水期与枯水期5种抗生素在鄱阳湖中的半衰期分别为18.4~111.3 h(2.3~13.9 d, 以日照时长8 h计算)与355.7~2149.7 h(44.5~268.7 d), 单位时间的降解速率分别为4.66~326.72 ng·m-3·h-1与0.21~14.89 ng·m-3·h-1(表 5).而鄱阳湖丰水期的水力停留时间(tR)大致为15 d, 枯水期tR则长达30~40 d(唐昌新等, 2015).丰水期湖水tR显著超过抗生素在HO·作用下的降解半衰期, 表明丰水期鄱阳湖中HO·引发的反应对于抗生素等污染物的消减具有显著的作用.
4 结论(Conclusions)1) 丰、枯水期鄱阳湖及周边河流ΦHO·值在10-5量级, 为DOM主导的HO·形成过程, 其中, 丰水期DOM的贡献均高于85.8%, 枯水期DOM的贡献均高于58.5%, 且枯水期NO2-含量较高, 贡献率为1.7%~40.5%.
2) 丰水期各样点的化学组成较为接近, DOC呈现出先促进后抑制HO·形成的特点.枯水期可能由于水体隔断作用明显, 各样点化学组成无明显共同点, 同时NO2-含量与ΦHO·存在相关关系, 但只有在高浓度下才表现出增强HO·的形成.
3) 鄱阳湖丰水期及枯水期表层水中5种抗生素在HO·作用下的半衰期分别为2.3~13.9 d与44.5~268.7 d, 丰水期半衰期显著低于鄱阳湖的水力停留时间, 表现出较高的光化学净化水平.
Buxton G V, Greenstock C L, Helman W P, et al. 1988. Critical-review of rate constants for reactions of hydrated electrons, hydrogen-atoms and hydroxyl radicals (·OH/·O-) in aqueous-solution[J]. Journal of Physical and Chemical Reference Data, 17(2): 513–886.
DOI:10.1063/1.555805
|
Chen B W, Liang X M, Huang X P, et al. 2013. Differentiating anthropogenic impacts on ARGs in the Pearl River estuary by using suitable gene indicators[J]. Water Research, 47(8): 2811–2820.
DOI:10.1016/j.watres.2013.02.042
|
Cheng D M, Liu X H, Zhao S N, et al. 2017. Influence of the natural colloids on the multi-phase distributions of antibiotics in the surface water from the largest lake in North China[J]. Science of the Total Environment, 578: 649–659.
DOI:10.1016/j.scitotenv.2016.11.012
|
Ding H J, Wu Y X, Zhang W H, et al. 2017. Occurrence, distribution, and risk assessment of antibiotics in the surface water of Poyang Lake, the largest freshwater lake in China[J]. Chemosphere, 184: 137–147.
DOI:10.1016/j.chemosphere.2017.05.148
|
Dulin D, Mill T. 1982. Development and evaluation of sunlight actinometers[J]. Environmental Science & Technology, 16(11): 815–820.
|
Egli T. 2010. How to live at very low substrate concentration[J]. Water Research, 44(17): 4826–4837.
DOI:10.1016/j.watres.2010.07.023
|
Fan Q Z, Zhang Y, Ma W C, et al. 2016. Spatial and seasonal dynamics of ship emissions over the Yangtze River Delta and East China Sea and their potential environmental influence[J]. Environmental Science & Technology, 50(3): 1322–1329.
|
Fang H S, Gao Y P, Wang H H, et al. 2017. Photo-induced oxidative damage to dissolved free amino acids by the photosensitizer polycyclic musk tonalide:Transformation kinetics and mechanisms[J]. Water Research, 115(Supplement C): 339–346.
|
Fenner K, Canonica S, Wackett L P, et al. 2013. Evaluating pesticide degradation in the environment:Blind spots and emerging opportunities[J]. Science, 341(6147): 752–758.
DOI:10.1126/science.1236281
|
Ge L K, Na G S, Zhang S Y, et al. 2015. New insights into the aquatic photochemistry of fluoroquinolone antibiotics:Direct photodegradation, hydroxyl-radical oxidation, and antibacterial activity changes[J]. Science of the Total Environment, 527-528(Supplement C): 12–17.
|
胡振鹏, 张祖芳, 刘以珍, 等. 2015. 碟形湖在鄱阳湖湿地生态系统的作用和意义[J]. 江西水利科技, 2015, 41(5): 317–323.
|
黄建, 田森林, 李英杰. 2017. 药物和个人护理品的水环境光化学转化动力学研究[J]. 环境科学导刊, 2017, 36(增刊): 37–40.
|
Jankowski J J, Kieber D J, Mopper K. 1999. Nitrate and nitrite ultraviolet actinometers[J]. Photochemistry and Photobiology, 70(3): 319–328.
DOI:10.1111/php.1999.70.issue-3
|
Lapertot M, Pulgarín C, Fernández-Ibáñez P, et al. 2006. Enhancing biodegradability of priority substances (pesticides) by solar photo-Fenton[J]. Water Research, 40(5): 1086–1094.
DOI:10.1016/j.watres.2006.01.002
|
Li K, Zhang P, Ge L K, et al. 2014. Concentration-dependent photodegradation kinetics and hydroxyl-radical oxidation of phenicol antibiotics[J]. Chemosphere, 111(Supplement C): 278–282.
|
Liang X M, Chen B W, Nie X P, et al. 2013. The distribution and partitioning of common antibiotics in water and sediment of the Pearl River estuary, south China[J]. Chemosphere, 92(11): 1410–1416.
DOI:10.1016/j.chemosphere.2013.03.044
|
刘雪石, 乔显亮, 刘远. 2017. DOM的光化学活性及其对污染物光解的影响[J]. 环境科学与技术, 2017, 40(1): 85–94.
|
Ma R X, Wang B, Lu S Y, et al. 2016. Characterization of pharmaceutically active compounds in Dongting Lake, China:Occurrence, chiral profiling and environmental risk[J]. Science of the Total Environment, 557-558: 268–275.
DOI:10.1016/j.scitotenv.2016.03.053
|
Page S E, Kling G W, Sander M, et al. 2013. Dark formation of hydroxyl radical in arctic soil and surface waters[J]. Environmental Science & Technology, 47(22): 12860–12867.
|
唐昌新, 熊雄, 邬年华, 等. 2015. 长江倒灌对鄱阳湖水动力特征影响的数值模拟[J]. 湖泊科学, 2015, 27(4): 700–710.
DOI:10.18307/2015.0419 |
Vione D, Minero C, Maurino V, et al. 2007. Seasonal and water column trends of the relative role of nitrate and nitrite as HO· sources in surface waters[J]. Annali Di Chimica, 97(8): 699–711.
DOI:10.1002/(ISSN)1612-8877
|
Wols B A, Harmsen D J H, Beerendonk E F, et al. 2014. Predicting pharmaceutical degradation by UV (LP)/H2O2 processes:A kinetic model[J]. Chemical Engineering Journal, 255(Supplement C): 334–343.
|
许磊, 李华, 陈英旭, 等. 2010. 南太湖地区小型浅水湖泊自净能力季节变化研究[J]. 环境科学, 2010, 31(4): 924–930.
|
杨岳主, 李玉平, 杨道武, 等. 2013. 铁铜催化剂非均相Fenton降解苯酚及机制研究[J]. 环境科学, 2013, 34(7): 2658–2664.
|
Zeng T, Arnold W A. 2013. Pesticide photolysis in Prairie Potholes:Probing photosensitized processes[J]. Environmental Science & Technology, 47(13): 6735–6745.
|
Zhang D N, Yan S W, Song W H. 2014. Photochemically induced formation of reactive oxygen species (ROS) from effluent organic matter[J]. Environmental Science & Technology, 48(21): 12645–12653.
|
Zhang Q Q, Ying G G, Pan C G, et al. 2015. Comprehensive evaluation of antibiotics emission and fate in the river basins of China:Source analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environmental Science & Technology, 49(11): 6772–6782.
|
赵群. 2014. 药物及个人护理品在水中光解的研究进展[J]. 山东理工大学学报(自然科学版), 2014, 28(3): 73–78.
|
郑晓冬, 乔显亮, 肖杰, 等. 2013. 水中溶解性有机质对三氯生光解的影响[J]. 环境科学与技术, 2013, 36(10): 182–185.
|
 2018, Vol. 38
2018, Vol. 38


