为有效预防介水传染病的发生和传播, 饮用水在出厂之前都要使用消毒剂进行消毒.氯、氯胺消毒因消毒效果好、操作简便、在管网中能维持较长时间的余氯等优点而成为饮用水消毒中广泛采用的方法.但氯、氯胺与水源中的有机物会发生反应生成三卤甲烷(trihalomethanes, THMs)、卤乙酸(haloacetic acids, HAAs)、氯代酮(chloroketones, CKs)、卤乙腈(haloacetonitriles, HANs)、卤代硝基甲烷(halonitromethanes, HNMs)等具有致癌性、生殖毒性的消毒副产物(Disinfection by-products, DBPs)(Richardson et al., 2007; Hong et al., 2017).DBPs的形成一般与水源水质(如有机物、溴离子水平等)、消毒条件等密切相关, 而且其形成的关键因子也会随地域水质的不同而有较大差异(Chowdhury et al., 2009; Hong et al., 2016).因此, 针对某一具体的区域, 非常有必要对其水质及DBPs形成情况进行调查, 以便为水务工作者更好地控制DBPs提供有用信息.
钱江源位于钱塘江上游, 水质优良, 但因缺乏控制性骨干工程, 源头优质水资源无法留住.为解决衢江流域防洪及水资源利用问题, 浙江省水利厅于1999年编制的《钱塘江流域综合规划》提出在钱江源区域兴建水库, 但受经济社会发展的限制, 该项目未能实施;2016年, 钱江源水库项目被列入浙江省发改委《2016年浙江省重大项目前期攻坚计划》;2018年, 将着手开始建设设计标准为大(Ⅱ)型的钱江源水库.众所周知, 由河流变成水库, 其水体理化性质(水流速度、温度、浊度、有机物性质水平等)、水体生态环境等会发生一系列变化(盛连喜, 2012).由此可以推测, 钱江源水源水质可能会随着水库的建造而发生改变.钱江源是钱塘江重要的源头水, 而钱塘江又是浙江人民的母亲河, 是浙江众多地区的饮用水源水.因此, 在建造水库前对钱江源水源水的水质及DBPs形成情况进行调查显得尤为重要.但目前除了本课题组对钱江源水源水HNMs的形成进行了报道外(Hong et al., 2015), 未见其它DBPs形成的报道.
鉴于此, 本研究以钱江源水源水为研究对象, 以氯、氯胺为消毒方式, 研究其在不同消毒条件下, THMs、CKs、HANs、di-HAAs、tri-HAAs等5类DBPs形成情况, 并与钱塘江下游九溪水源水、金兰水库水源水的水质、DBPs形成、溴嵌入因子等进行详细的比较分析.以期为水务工作者更好地监测钱江源建库前后的水质变化及其相应DBPs的形成提供重要基础数据.
2 材料与方法(Material and methods) 2.1 水样钱江源水源水采集同本课题组之前发表的文献(Hong et al., 2015).玻璃采样瓶均通过下列方法进行洗涤:先用去污粉洗涤, 然后用自来水冲洗6~7遍后用蒸馏水冲洗2~3遍, 自然晾干后经硫酸酸缸浸泡24 h, 之后捞出再次用蒸馏水冲洗7~8遍, 烘干, 待用.采样时直接取0.1~0.5 m的表层水, 待采样瓶装满后, 用磨口塞盖好, 并用黑色塑料袋包裹后装在自制冰箱里(保温箱内含生物冰袋, 温度维持在4~8 ℃), 当天运回实验室.水样水质指标同之前的研究(Hong et al., 2015), 具体见表 2.
| 表 1 钱江源水源水氯、氯胺消毒实验设计 Table 1 Orthogonal design for chlorination/chloramination of Qianjiang source water |
| 表 2 钱江源与浙江省其它水源水水质及氯化DBPs形成的比较 Table 2 Comparison of water qualities and DBPs formation between Qianjiang source water and other source waters in Zhejiang Province |
NaClO(优级纯)购自Sigma, 氯胺(NH2Cl)则采用现用现配的方式, 先分别配置NaClO和NH4Cl工作液, 并使其Cl2/N的质量比为4:1, 然后在pH为8.3的溶液中先加氯化铵后加次氯酸钠, 混合30 min后使用.临用前均用DPD(N, N-二乙基对苯二胺)法测定有效氯的浓度(APHA, 1998).氯、氯胺消毒实验设计如表 1所示, 变量包括消毒剂量(低、中、高)、pH(6、7、8, 均用2 mmol·L-1的磷酸缓冲液缓冲)、溴离子浓度(本底、本底+100 μg·L-1、本底+300 μg·L-1), 每次在基准(表 1中处理组2)的基础上, 只变换一个条件进行实验, 所有处理组的消毒时间均为24 h, 温度保持20 ℃, 每个处理均为2个平行.消毒完毕立即进行DBPs分析.
2.3 DBPs分析THMs、HANs、CKs的分析采用甲基叔丁基醚(MTBE)液液萃取-GC/ECD检测的方法进行, 具体参考USEPA551.1(USEPA, 1990);HAAs的测定则采用MTBE液液萃取-酸化甲醇衍生化-GC/ECD分析的方法进行, 具体参考USEPA552.3(USEPA, 2003).方法检测限同本课题组之前的研究(张西等, 2015; 宋倩云等, 2017), 具体如下(μg·L-1):三氯甲烷(TCM)0.468、一溴二氯甲烷(BDCM)0.084、二溴一氯甲烷(DBCM)0.062、三溴甲烷(TBM)0.049、三氯乙腈(TCAN)0.053、二氯乙腈(DCAN)0.053、溴氯乙腈(DCAN)0.062、二溴乙腈(DCAN)0.093、二氯丙酮(DCP)0.039、三氯丙酮(TCP)0.046、一氯乙酸(CAA)0.192、一溴乙酸(BAA)0.054、二氯乙酸(DCAA)0.128、三氯乙酸0.066、溴氯乙酸(BCAA)0.046、二溴乙酸(DBAA)0.049、一溴二氯乙酸(BDCAA)0.077、二溴一氯乙酸(DBCAA)0.098、三溴乙酸(TBAA)0.113.
2.4 溴取代因子的计算溴取代因子被广泛用于评价溴嵌入DBPs程度的研究.一般来说有两种表达方式, 一种称为溴嵌入因子(Bromine incorporation factor, BIF), 具体定义为溴嵌入某类DBPs的物质的量浓度([DBP-Br])与该类DBPs物质的量浓度([DBP])的比值, 以THMs为例, 其计算方法如式(1)~(2)所示(Chang et al., 2001; Sun et al., 2009; Hua et al., 2012).一卤代DBPs的BIF在0~1之间, 二卤代DBPs的BIF在0~2之间, 而三卤代DBPs的BIF在0~3之间.由于不同类别DBPs的BIF取值范围不一致, 不能用于比较各类DBPs间的溴取代能力.
另一种称为溴取代因子(Bromine substitution factor, BSF), 具体定义为某类DBPs中溴的物质的量浓度与该类DBPs所有卤族元素的总物质的量浓度的比值, 以THMs为例, 其计算方法如式(3)~(4)所示.一般来说无论是哪类DBPs, BSF的取值范围均在0~1(或0~100%)之间, 可用于比较各类DBPs间溴取代能力的大小, 因此, BSF比BIF具有更好的应用潜力(Hua et al., 2012; Hong et al., 2017).本研究采用BSF进行溴取代能力的评价.
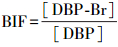
|
(1) |
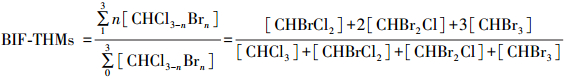
|
(2) |
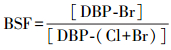
|
(3) |
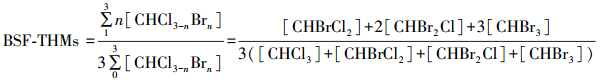
|
(4) |
尽管BIF与BSF计算过程和取值范围有所差异, 但它们之间可以互相转换:BIF=BSF(一卤代DBP);BSF=BIF/2(二卤代DBP);BSF=BIF/3(三卤代DBP).
3 结果与讨论(Results and discussion) 3.1 钱江源水源水氯、氯胺消毒后DBPs形成总体情况氯胺消毒下DBPs的产量普遍比氯消毒要低3~7倍(THMs、DHAAs、CKs)甚至低一个数量级(HANs、THAAs)(图 1~3), 说明对于钱江源水源水, 氯胺消毒可以显著降低THMs、HAAs、HANs和CKs的形成, 这与文献报道类似(Goslan et al., 2009; Fang et al., 2010; Hong et al., 2013ab).但不管是氯消毒还是氯胺消毒, 受控DBPs(如THMs、DCAA、TCAA)均在我国饮用水标准范围内(THMs标准:TCM < 60 μg·L-1, BDCM < 60 μg·L-1, DBCM < 100 μg·L-1, TBM < 100 μg·L-1, 且TCM、BDCM、DBCM和TBM的实际浓度与各自限值的比值之和小于1;HAA标准:DCAA < 50 μg·L-1, TCAA < 100 μg·L-1)(中华人民共和国卫生部, 2006).
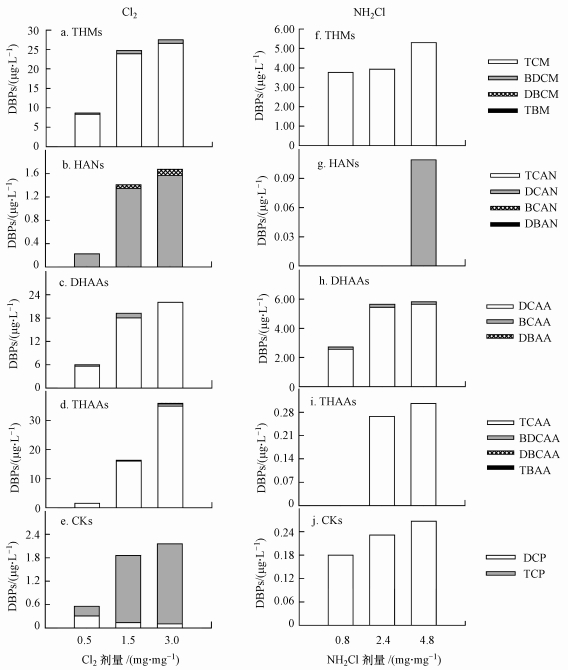 |
| 图 1 氯、氯胺剂量对DBPs形成的影响 Fig. 1 Effect of chlorine/chloramine dose on the formation of DBPs |
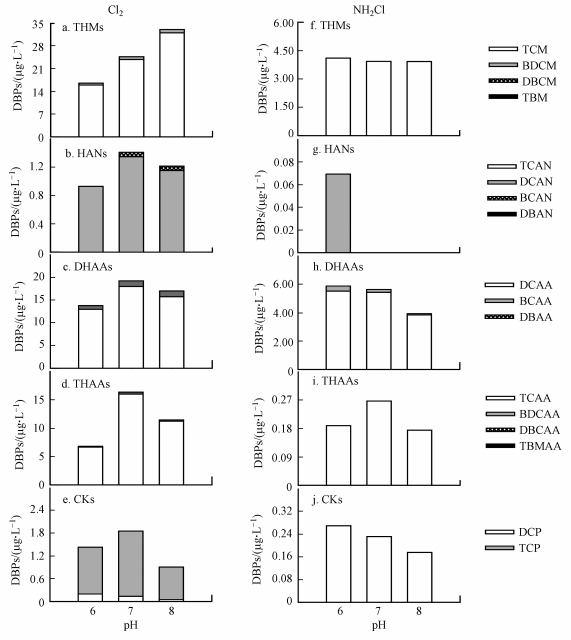 |
| 图 2 氯、氯胺消毒下pH对DBPs形成的影响 Fig. 2 Effect of pH on the formation of DBPs in chlorination and chloramination |
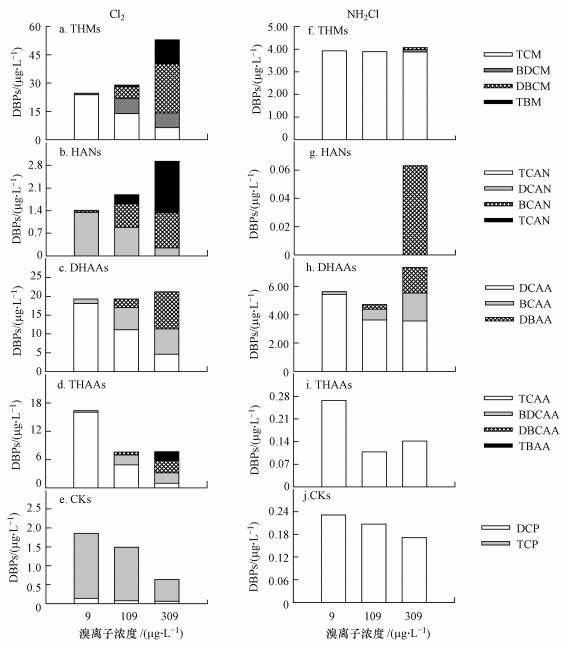 |
| 图 3 氯、氯胺消毒下溴离子对DBPs形成的影响 Fig. 3 Effect of bromide on the formation of DBPs in chlorination and chloramination |
除了溴离子加入组(图 3), 钱江源水源水氯、氯胺消毒后, 均以氯代DBPs为主(图 1~2), 这主要与钱江源水源水溴离子浓度低有关.HANs的形成则以DCAN为主, 而TCAN均在检测限以下, 这主要是因为DCAN比TCAN稳定, 在pH>5.5的环境下TCAN很快发生碱催化降解(Bougeard et al., 2010).此外, 氯消毒下, CKs的形成以TCP为主, 而氯胺消毒下以DCP为主, 这与先前的研究基本一致(Bougeard et al., 2010; Hong et al., 2013a).DCP和TCP是中间消毒副产物, DCP很容易被氯进一步氧化而形成TCP, TCP则会进一步水解形成TCM, 但DCP在氯胺环境下却较稳定, 很难被氯胺进一步氧化形成TCP, 因此, 氯胺消毒下DCP产量较高, 而TCP则基本检测不到, 这也是氯胺消毒下TCM浓度较低的原因之一(Yang et al., 2007).
此外, 由表 2可知, 与下游钱塘江九溪水源水相比, 钱江源水源水有机物(如DOC、UVA、DON、叶绿素)和无机污染物(如氨氮、亚硝氮、溴离子等)水平相对较低, 氯消毒下形成的DBPs水平(包括卤代硝基甲烷HNMs)也较低.即使与同省水质较好的金兰水库相比, 其DOC特别是DON、叶绿素、亚硝氮也处于很低的水平.但由于钱江源水源水的有机物以陆生来源为主(叶绿素浓度很低, 说明藻来源有机物很少, 且钱江源水体周围分布着茂密的森林), 具有较高的UVA254值, 因此, 与金兰水库相比, 氯消毒中含碳DBPs(如THMs、DHAAs、THAAs、CKs)的形成较高.但考虑到SUVA>2 L·mg-1·m-1的有机物很容易通过传统的混凝沉淀工艺去除(USEPA, 1998), 因此, 综合来看, 钱江源水源水形成DBPs的风险还是比较低的.
纵观表 2数据还可看出, THMs、DHAAs、THAAs、CKs的形成量与UVA254分布一致, 均为钱塘江>钱江源>金兰水库, 提示对于这3个水源水来说, 芳香有机物是其重要前驱物;对于HANs, 其形成与DON、亚硝氮的分布一致, 均为钱塘江>金兰水库>钱江源, 提示氯消毒中HANs的形成可能与DON和亚硝氮有密切联系;HNMs的形成则既不与DOC、UVA254、DON、叶绿素同步, 也不与无机离子的分布一致, 说明其前驱物比较复杂, 不能用单个水质指标进行描述.
3.2 不同消毒剂量下钱江源水源水DBPs的形成氯消毒下, DBPs的形成量均随着氯剂量的增加而增加(图 1a~e), 其中, THMs、DHAAs、THAAs的结果在预期范围内, 因为随着氯剂量的增加, 越来越多的中间产物会进一步氯化而转化为稳定的终产物如THMs、DHAAs、THAAs(Xie, 2004; Hong et al., 2013b).但对于HANs、CKs, 它们是不太稳定的中间产物.Xie(2004)研究发现, 氯剂量的增加会加速HANs、CKs的降解;Fang等(2010)研究则表明, 在DOC=5 mg·L-1时, 投氯量从3.42 mg·L-1增加到10.26 mg·L-1期间, DCAN的形成逐渐上升, 但之后DCAN产量随着氯剂量的继续增加而迅速下降.上述文献报道结合本研究结果说明, 氯剂量对HANs和CKs形成的影响取决于它们形成与降解速度的对比, 在氯剂量达到一定程度前, HANs和CKs的形成速度往往高于降解速度, 表现出增加的趋势.
氯胺消毒下, DBPs产量随着氯胺剂量的增加均呈上升趋势(图 1f~j).这基本也在预期内, 因为THMs、DHAAs、THAAs均为稳定的终产物(Xie, 2004; Hong et al., 2013b);而HANs、CKs在氯胺中的稳定性很高(Yang et al., 2007), 随着氯胺剂量的增加, 越来越多的上游产物会转化为HANs、CKs.
3.3 不同pH下钱江源水源水DBPs的形成氯消毒下随着pH的增加, THMs的产量呈显著增加而CKs的产量则呈显著减少的趋势(图 2a、2e).这可能是因为在碱性条件下, 很多不稳定的中间产物(如TCP)会加速水解生成THMs(Xie, 2004).而对于DHAAs和THAAs, 其在pH=7、8条件下的产量均要高于pH=6条件下(图 2c、2d).这与Liang等(2003)报道的不太一致, 该文献发现DHAA在pH=6和8时的产量基本持平, 而THAA则是在pH=6下的产量多于pH=8时;但本研究结果与Fang等(2010)及Hong等(2013b)的报道相似, 即pH=7、8环境下DCAA、TCAA的产量要高于pH=6时.上述结果表明, 氯消毒下HAAs的形成随着pH的变化存在不确定性, 其原因可能与不同水体有机物与氯反应形成HAAs的限速步骤不同有关.根据Reckhow等(1985)提出的模型, 在氯化消毒中, 有机物首先要经过氧化反应而形成DHAAs和THAAs的前驱物β -二酮(RCO—CH2—COR), 之后经过氯的取代反应, 进而水解形成二氯乙酰丙酮(CHCl2—COR), 若R基团为—OH, 则直接形成DCAA, 若R基团为易氧化基团(如芳香类物质等), 则进一步氧化形成TCAA.在这个过程中, 既有氧化反应, 又有水解反应.在酸性条件下, 氯(pKa=7.5)主要以HClO的形式存在, 它具有很强的氧化性;而在碱性条件下, 氯以ClO-为主, 氧化性较弱, 但水解反应容易进行.因此, 若某水体形成HAAs的限速步骤是水解反应, 则可能在碱性条件下形成的多;如果其限速步骤为氧化反应, 则在酸性条件下形成的多;如果水解反应和氧化反应均是限速步骤, 则可能在中性条件下形成的多.氯消毒下, HANs的形成也呈现出中、碱性条件大于酸性条件的情况(图 2b), 这与文献报道的pH=6下HANs的形成多于pH=7和8的情况不太一致(Yang et al., 2007; Fang et al., 2010), 具体原因有待进一步研究.
氯胺消毒下, THMs、HANs、DHAAs、CKs在pH=6时的产量要高于pH=7和8时的产量, 而对于THAAs, 则pH=6、7下的产量要高于pH=8时的产量(图 2f~j), 此结果与文献报道基本一致.其原因可能有两方面:①氯胺在中、酸性条件下比碱性条件下释放出更多的游离氯, 如此更有利于DBPs的形成;②一些不稳定的DBPs如HANs、CKs在碱性条件下容易水解导致产量不高(Xie, 2004; Yang et al., 2007).
3.4 溴离子对钱江源水源水DBPs形成的影响氯、氯胺消毒下, 随着溴离子浓度的增加, THMs、HANs、DHAAs的总产量呈增加趋势, 但THAAs却呈减少趋势(图 3).这与通常认为的DBPs形成一般会随着溴离子浓度的增加而增大不太一致(Chowdhury et al., 2009; Hong et al., 2017).其中的原因可能与本研究消毒剂量投加不高及每一类DBPs形成的特点有关.溴离子的加入会消耗氯形成次溴酸, 从而造成次氯酸相对减少, 即消毒系统的氯氧化能力减弱, 但溴取代能力增强.如此, 某些溴取代反应在其形成中发挥重要作用的DBPs(如DHANs、THMs、DHAAs等, 其BSF值较高, 见表 3及文献(Obolensky et al., 2005; Hua et al., 2012)), 随着溴离子浓度的增加, 其产量基本呈增加趋势.但在THAAs形成中, 氯的氧化作用非常重要(Reckhow et al., 1985), 而溴的取代作用相对较弱(其BSF值在所有DBPs中最低, 见表 3及文献(Obolensky et al., 2005; Hua et al., 2012)), 因此, 在氯/氯胺剂量较低的情况下, 随着溴离子浓度的增加, 其形成却不一定增加.但假如投氯量足够多, 消毒系统由于溴离子的增加而减少的有效氯可以忽略的情况下, THAAs产量一般会随着溴离子浓度的增加而递增.此外, 由于本研究只测了CKs, 没有测含溴卤代酮, 其产量随溴离子的增加而降低的情况也在预料之中(图 3e, j).
| 表 3 氯、氯胺消毒方式下不同DBPs的BSF值 Table 3 BSFs of different DBPs classes during chlorination and chloramination |
从图 3还可看出, 随着溴离子浓度的增加, Br-THMs、Br-HANs、Br-DHAAs、Br-THAAs的产量逐渐增加, 而相应氯代DBPs的产量则逐渐减少, 溴取代因子(BSF)呈逐步上升的趋势(表 3).但总的来说, 氯胺消毒形成的溴代DBPs的绝对含量和相对含量都比氯消毒少, 特别是THMs、THAAs(图 3), 说明对钱江源水源水来说, 氯胺消毒不仅可以减少DBPs的形成, 还可以较好地控制溴代DBPs的生成.
为了更好地说明钱江源水源水形成溴代DBPs方面的特征, 本文将溴离子含量表示成Br-/DOC, 并把文献中钱塘江下游九溪水源水、金兰水库水源水氯化消毒后各类DBPs的BSFs一起纳入进行了比较(图 4).结果显示, 3个水源水5类DBPs的BSFs值均随着Br/DOC值的增加而增加, 但相比来说, 在相同Br-/DOC情况下, 钱江源水源水溴嵌入因子最小, 金兰水库其次, 而钱塘江下游九溪水源水形成DBPs的溴嵌入因子最大.此结果与相应SUVA值相反(图 4), 即SUVA大的水源水其DBPs的溴嵌入因子小, 而SUVA小的水源水其DBPs的溴嵌入因子大.这可能是由于不同SUVA值的有机物亲疏水特性不同, 低SUVA的有机物亲水性较大, 溴离子容易嵌入(Liang et al., 2003; Wang et al., 2014).由于之前文献有关溴离子对DBPs形成的影响研究绝大部分集中在溴离子本身对DBPs的影响(Obolensky et al., 2005; Hua et al., 2012), 却很少涉及有机物性质对DBPs溴嵌入因子的影响(Hong et al., 2017), 而且本研究涉及DBPs种类较多, 所以本文是目前最早系统描述DBPs溴嵌入因子与有机物性质之间关系的研究之一.这对于水务部门选择何种类型水源水可以较大程度地降低溴代DBPs的健康风险提供了重要参考.
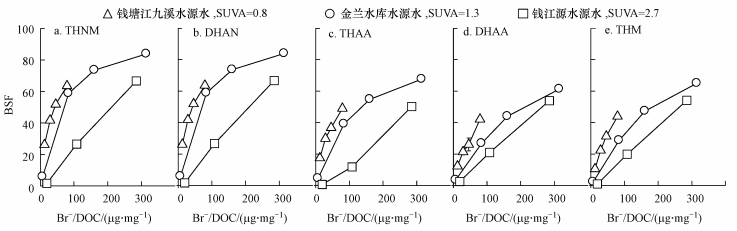 |
| 图 4 不同SUVA的水源水氯消毒后DBPs的BSF比较分析 (3个水源水消毒条件相同, 均为Cl2/DOC=1.5 mg·mg-1, pH=7, T=20 ℃; t=24 h;钱塘江九溪水源水的BSF值源于文献(Hong et al., 2017); 金兰水库的BSF值根据文献(Hong et al., 2013; Wang et al., 2014)中的数据计算得到) Fig. 4 Comparative analysis of BSFs for DBPs formation during chlorination of source water with different |
从表 3和图 4还可看出, 不同DBPs, 其溴取代能力存在较大差异.三卤硝基甲烷的BSF值(BSFTHNM)最大, 其次是BSFHANs, 而THMs、DHAAs、THAAs的BSF值随着SUVA的大小略有差异:对钱江源水源水来(高SUVA)说, BSFTHM≈BSFDHAA> BSFTHAA, 而对钱塘江和金兰水库来说, BSFTHAA>BSFTHM≈BSFDHAA, 此结果进一步证实了本课题组之前的推测, 即不同SUVA水体, 对THNMs、DHANs的溴嵌入能力影响不大, 但对DHAAs、THMs、THAAs的溴嵌入能力有一定影响(Hong et al., 2017).
3.5 影响DBPs形成的关键因子分析为了更好地确定钱江源水源水在氯、氯胺消毒中形成DBPs的关键因子, 本文对pH、消毒剂量、溴离子进行了极差分析, 结果如表 4所示.一般来说, 某因子的极差值越大, 说明某因子越重要, 反之亦然.用这种方法可以得出, 氯消毒下, 溴离子是THMs、HANs形成的关键因子, 氯剂量是DHAAs、THAAs、CKs形成的关键因子;氯胺消毒下, 氯剂量是所有DBPs形成的关键因子.考虑到钱江源水源水本身溴离子浓度很低, 因此, 对钱江源水源水来说, 在确保消毒质量的情况下, 控制氯、氯胺剂量是控制DBPs形成的有效策略.而且还值得注意的是, 氯胺消毒下DBPs的极差值普遍比氯消毒下低很多, 说明氯胺消毒中消毒剂量的变化不太会引起DBPs形成量大幅度的波动.
| 表 4 DBPs形成影响因子的极差分析 Table 4 Range analysis for DBPs formation in chlorination and chloramination |
1) 氯消毒下DBPs的产量比氯胺消毒高出3~7倍甚至1个数量级, 但不管是哪种消毒方式, THMs、DCAA、TCAA的形成量均在我国饮用水标准范围内.
2) 氯消毒下, 大部分DBPs(除了CKs)均在中碱性条件下形成的多, 氯胺消毒则是在中、酸性条件下DBPs形成的多.消毒剂量对5类DBPs的形成有明显的促进作用;溴离子对THMs、DHANs、DHAAs的形成有明显的促进作用.但目前来说, 控制氯/氯胺剂量是控制钱江源水源水DBPs形成的有效策略.
3) 钱江源水源水的水质比钱塘江下游九溪水源水好很多, DBPs形成量较低, DBPs的溴嵌入能力较低, 某些指标(如有机碳、有机氮、HANs形成量等)甚至比同省水质较好的金兰水库还要好.
APHA. 1998. Standard methods for the examination of water and wastewater (20th ed)[S]. Washington, DC, USA: American Public Health Association
|
Bougeard C M, Goslan E H, Jefferson B, et al. 2010. Comparison of the disinfection by-product formation potential of treated waters exposed to chlorine and monochloramine[J]. Water Research, 44(3): 729–740.
DOI:10.1016/j.watres.2009.10.008
|
Chang E E, Lin Y P, Chiang P C. 2001. Effects of bromide on the formation of THMs and HAAs[J]. Chemosphere, 43(8): 1029–1034.
DOI:10.1016/S0045-6535(00)00210-1
|
Chowdhury S, Champagne P, McLellan P J. 2009. Models for predicting disinfection byproduct (DBP) formation in drinking waters:a chronological review[J]. The Science of the Total Environment, 407(14): 4189–4206.
DOI:10.1016/j.scitotenv.2009.04.006
|
Fang J Y, Yang X, Ma J, et al. 2010. Characterization of algal organic matter and formation of DBPs from chlor(am)ination[J]. Water Research, 44(20): 5897–5906.
DOI:10.1016/j.watres.2010.07.009
|
Goslan E H, Krasner S W, Bower M, et al. 2009. A comparison of disinfection by-products found in chlorinated and chloraminated drinking waters in Scotland[J]. Water Research, 43(18): 4698–4706.
DOI:10.1016/j.watres.2009.07.029
|
Hong H, Huang F, Lin H, et al. 2013a. Factors affecting formation of haloacetonitriles and haloketones during chlorination/monochloramination of Jinlan Reservoir water[J]. Water Science & Technology:Water Supply, 13(4): 1123–1129.
|
Hong H, Qian L, Xiong Y, et al. 2015. Use of multiple regression models to evaluate the formation of halonitromethane via chlorination/chloramination of water from Tai Lake and the Qiantang River, China[J]. Chemosphere, 119: 540–546.
DOI:10.1016/j.chemosphere.2014.06.084
|
Hong H, Song Q, Mazumder A, et al. 2016. Using regression models to evaluate the formation of trihalomethanes and haloacetonitriles via chlorination of source water with low SUVA values in the Yangtze River Delta region, China[J]. Environmental Geochemistry & Health, 38: 1303–1312.
|
Hong H, Xiong Y, Ruan M, et al. 2013b. Factors affecting THMs, HAAs and HNMs formation of Jin Lan Reservoir water exposed to chlorine and monochloramine[J]. Science of the Total Environment, 444: 196–204.
DOI:10.1016/j.scitotenv.2012.11.086
|
Hong H, Yan X, Song X, et al. 2017. Bromine incorporation into five DBP classes upon chlorination of water with extremely low SUVA values[J]. Science of the Total Environment, 590: 720–728.
|
Hua G H, Reckhow D A. 2012. Evaluation of bromine substitution factors of DBPs during chlorination and chloramination[J]. Water Research, 46(13): 4208–4216.
DOI:10.1016/j.watres.2012.05.031
|
Liang L, Singer P C. 2003. Factors influencing the formation and relative distribution of haloacetic acids and trihalomethanes in drinking water[J]. Environmental Science & Technology, 37(13): 2920–2928.
|
Obolensky A, Singer P C. 2005. Halogen substitution patterns among disinfection byproducts in the information collection rule database[J]. Environmental Science & Technology, 39(8): 2719–2730.
|
Reckhow D A, Singer P C. 1985. Mechanisms of Organic Halide Formation During Fulvic Acid Chlorination and Implications with Respect to Preozonation//Jolley R L(eds). Water Chlorination: Chemistry, Environmental Impact and Health Effects(vol 5)[M]. Boca Raton, FL: Lewis. 1229-1257
|
Richardson S D, Plewa M J, Wagner E D, et al. 2007. Occurrence, genotoxicity, and carcinogenicity of regulated and emerging disinfection by-products in drinking water:a review and roadmap for research[J]. Mutation Research, 636(1/3): 178–242.
|
盛连喜. 2012. 环境生态学导论[M]. 北京: 高等教育出版社.
|
宋倩云, 宁萍, 孙洪杰, 等. 2017. 长三角部分水源水氯化消毒后卤乙酸形成的多元回归模型研究[J]. 环境科学学报, 2017, 37(6): 2048–2054.
|
Sun Y X, Wu Q Y, Hu H Y, et al. 2009. Effect of bromide on the formation of disinfection by-products during wastewater chlorination[J]. Water Research, 43(9): 2391–2398.
DOI:10.1016/j.watres.2009.02.033
|
USEPA. 1990. Method 551. 1: Determination of chlorination disinfection byproducts and chlorinated solvents in drinking water by liquid-liquid extraction and gas chromatography with electron-capture detection[S]. Washington D C: Enviromental Protection Agency
|
USEPA 2003. EPA 815-B-03-002. Revision 1. 0. Method 552. 3: Determination of haloacetic acids and dalapon in drinking water by liquid-liquid microextraction, derivatization, and Gas chromatography with electron capture detection[S]. Washington D C: Enviromental Protection Agency
|
USEPA 1998. National primary drinking water regulations: disinfectants and disinfection byproducts[S]. Washington D C: Enviromental Protection Agency
|
Wang F Y, Ruan M Y, Lin H J, et al. 2014. Effects of ozone pretreatment on the formation of disinfection by-products and its associated bromine substitution factors upon chlorination/chloramination of Tai Lake water[J]. Science of the Total Environment, 475: 23–28.
DOI:10.1016/j.scitotenv.2013.12.094
|
Xie Y F. 2004. Disinfection Byproducts in Drinking Water: Formation, Analysis and Control[M]. Washington, D. C. : Lewis Publishers
|
Yang X, Shang C, Westerhoff P. 2007. Factors affecting formation of haloacetonitriles, haloketones, chloropicrin and cyanogen halides during chloramination[J]. Water Research, 41(6): 1193–1200.
DOI:10.1016/j.watres.2006.12.004
|
张西, 宋倩云, 周小玲, 等. 2015. 太湖、钱塘江取水口底泥及周边土壤有机物形成消毒副产物的特征研究[J]. 环境科学学报, 2015, 35(10): 3225–3233.
|
中华人民共和国卫生部, 2006. 中华人民共和国生活饮用水卫生标准(GB5749-2006)[S]. 北京: 中国国家标准化管理委员会
|
 2018, Vol. 38
2018, Vol. 38


