《巴黎气候协定》签署意味着污水处理碳中和运行时代的来临(郝晓地等, 2014a;2014b).采用化石燃料发电处理污水产生的二氧化碳(CO2)及污水处理过程产生的甲烷(CH4)与氮氧化物(NxO)引起的CO2排放当量约占全球温室气体排放量的2%~5%(El-Fadel et al., 2001;Kampschreur et al., 2009).如果污水处理实现碳中和运行, 或者说运行能量完全自给, 便可避免使用外部化石燃料发电(Hao et al., 2015).污水处理碳中和运行能量来源显然应先关注污水处理过程中产生的剩余污泥, 因为污泥厌氧消化往往是传统污水处理过程中必要环节.
然而, 剩余污泥中细菌细胞结构、木质纤维素及腐殖质等成分在很大程度上制约了污泥厌氧消化能源转化(CH4)效率, 中温厌氧消化获得的污泥能源转化率一般低于30%~45%(Weemaes et al., 2000), 这就大大制约了污泥厌氧消化的大规模工程应用.其中, 污泥中所含腐殖质成分较为特别, 它不仅自身难以生物降解, 而且在厌氧消化过程中还会影响到其它有机物降解或转化.因此, 有必要对腐殖质影响污泥厌氧消化的过程和机理进行必要研究(Fernandes et al., 2014).
腐殖质是剩余污泥有机物中的重要组分, 约占有机成分的6%~20%(以VSS计)(Thurman et al., 1985;Imai et al., 2002;Akio et al., 2002;郝晓地等, 2013;金鹏康等, 2015).腐殖质是芳香族醌类聚合有机物, 由胡敏酸(腐殖酸:主要成分)、富里酸和胡敏素组成.腐殖质含有大量羧基(—COOH)、酚羟基(酚—OH), 醇羟基(醇—OH)、甲氧基(—OCH3)和羰基(C=O)等多种含氧官能团;这些官能团具有离子交换性、弱酸性、吸附性、络合性、氧化还原性等特性(Schnitzer et al., 1974).腐殖质的这些特性决定了它们会对污泥厌氧消化过程产生影响和干扰.已有研究表明, 污泥中腐殖质含量虽少, 但会明显抑制蛋白质、脂质、纤维素等复杂有机物的水解(Fernandes et al., 2014;任冰倩, 2015).此外, 腐殖质或醌类物质还会影响污泥厌氧消化系统产甲烷细菌生理代谢, 进而影响污泥厌氧消化产甲烷过程(Cervantes et al., 2000).但腐殖质结构中的醌类基团可以作为电子受体、电子中间体参与厌氧消化过程微生物与有机底物间的电子传递, 促进酸化过程(Scott et al., 1998;Dos et al., 2004).因此, 有必要研究腐殖质对厌氧消化过程的影响, 这对整体提高污泥有机物能源转化效率具有现实意义.
鉴于此, 本研究通过培养污泥、序批实验, 定量探究污泥中不同腐殖酸含量对厌氧消化过程的影响, 定量检测厌氧消化系统生物气产量、CH4含量、溶解性多糖、溶解性蛋白质、pH和挥发性脂肪酸(VFAs)等含量指标, 系统分析腐殖酸对污泥厌氧消化过程的影响.
2 材料与方法(Materials and methods) 2.1 实验材料市政污泥已含腐殖质, 实验需探究不同腐殖酸含量对厌氧消化过程影响, 因此使用市政污泥无法实现不同腐殖酸含量变化要求, 而且污泥中存在的金属离子可能会屏蔽腐殖质的影响, 所以实验中采用人工配水、序批(SBR)培养方法培养几乎不含腐殖质和金属离子的剩余污泥.表 1为人工配水主要成分和微量元素成分.
| 表 1 人工配水主要成分和微量元素成分 Table 1 Composition of main compounds and trace elements in synthetic wastewater |
SBR污泥培养反应器体积40 L, HRT=3 d, SRT=12 d;反应器运行周期设定为:进水(0.5 h)→好氧曝气(20 h)→沉淀(2 h)→出水(0.5 h)→静置(1 h).反应器安装有可调转速的搅拌装置和加热装置;搅拌电机转速240 r·min-1, 加热温度至25 ℃.排泥在出水阶段后, 反应器每天排出的剩余污泥经重力浓缩和人工筛滤后, 置于4 ℃冰箱保存, 供厌氧消化实验使用.
以上述获得几乎不含腐殖质和金属离子的剩余污泥作为底物培养实验用接种污泥.发酵罐(德国BIOSTAT© B plus Twin)总体积6 L, 有效体积4 L;自带搅拌电机转速设置为250 r·min-1, 温度设置至35 ℃, pH调节在6.8~7.2.
为排除培养剩余污泥中残留溶解性COD(SCOD)对接种后厌氧消化序批实验结果形成干扰, 实验前先将浓缩后剩余污泥曝气24 h, 以去除残留SCOD.表 2列出了曝气后剩余污泥和接种污泥特性参数.
| 表 2 培养剩余污泥与接种污泥特征 Table 2 Characteristics of cultured excess activated sludge and seed sludge |
实验前采用红外光谱比较市售腐殖酸与实际北京某污水处理厂腐殖酸红外光谱特征(市售腐殖酸替代依据详见结果与分析3.1节).序批式厌氧消化实验使用400 mL血清瓶, 分别向瓶内加入表 2所示接种污泥和剩余污泥, 接种比1:3(以VSS计), 调节pH至7.0;分别向各瓶组(3个平行样)中投加不同含量(以VSS计)实验用市售腐殖酸:0(R0)、5%(R1)、10%(R2)、15%(R3)和20%(R4).实验前, 向血清瓶内持续通入N2达5 min, 以保证严格厌氧环境;所有血清瓶全部置于摇床(T=(35±0.5) ℃, RPM=160 r·min-1)中培养.
2.3 项目分析与方法实验检测指标测定方法见表 3(Chaplin et al., 1994;Frølund et al., 1995;Swift et al., 1996;APHA, 1998).
| 表 3 检测指标测定方法 Table 3 Measurement methods of test items |
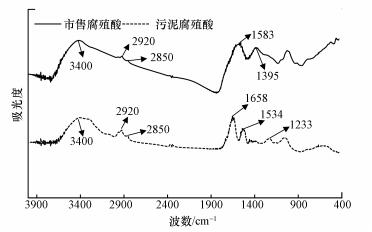
因需研究腐殖酸对污泥厌氧消化的影响, 实验中使用了市售腐殖酸.然而, 实验前需要确定市售腐殖酸是否与实际市政剩余污泥中所含腐殖酸性质相同, 以决定是否可以使用替代实际污泥腐殖酸.图 1显示了市售腐殖酸与实际污泥腐殖酸红外光谱测定结果.结果显示, 两种腐殖酸红外光谱特征吸收峰在4000~1250 cm-1波数带基本相似;在4000~1700 cm-1波数带, 两种腐殖酸红外光谱特征吸收峰几乎完全一致;仅在1700~1250 cm-1波数带, 两种腐殖酸红外光谱特征吸收峰存在一些差异.
 |
| 图 1 市售腐殖酸与污泥腐殖酸红外光谱 Fig. 1 Infrared spectra of humic acids from both chemicals and municipal excess sludge |
表 4列出了腐殖酸红外光谱吸收峰及其归属.据表 4分析可知, 两种腐殖酸在3500~3100 cm-1波数带吸收峰都很强且较宽, 主要为缔合—OH伸缩振动吸收所致, 主要为酚羟基和醇羟基结构存在特征吸收峰带;2920 cm-1和2850 cm-1处出现的肩峰分别代表脂肪族烷烃结构中—CH2反对称伸缩振动和—CH2对称伸缩振动, 吸收峰主要是烷烃结构存在的特征吸收峰带.红外光谱分析表明, 两种腐殖酸均存在酚羟基和醇羟基, 并含有烷烃结构.然而, 市售腐殖酸在1583 cm-1和1395 cm-1处出现了特征吸收峰, 这两处分别是羧酸根(—COO-)反对称收缩和酚羰基(C—O)、酚羧根(—COO-)、酚羟基(—OH)振动;污泥腐殖酸在1658 cm-1和1534 cm-1处出现了特征吸收峰, 这两处分别是高度共轭羰基(C=O)和芳环羰基(C=O)、仲酰胺酰胺Ⅱ面内弯曲振动.因1250 cm-1以下波数带易受到腐殖酸复杂结构和杂质影响, 缺少进一步分析价值, 故不作分析(Mcdonnell et al., 2001).
| 表 4 腐殖酸红外光谱吸收峰及其归属 Table 4 Absorption peaks and assignments of HA in FITR |
综上, 红外光谱物质鉴定软件定量分析市售腐殖酸与污泥腐殖酸谱图相似程度显示, 在4000~1250 cm-1波数带两者相似度高达87.3%.这表明可以用市售腐殖酸近似替代市政污泥腐殖酸进行实验目的.
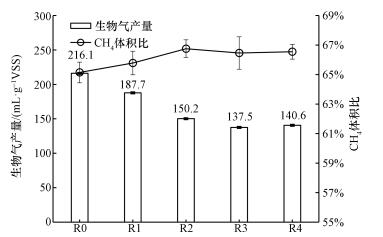
3.2 腐殖酸含量对厌氧消化产气性能影响图 2显示了不同腐殖酸投加量对培养污泥厌氧消化生物气产量以及所含CH4体积比的影响.相对于未投加腐殖酸的R0组最高生物气产量(216.1 mL·g-1 VSS), 投加15%腐殖酸R3组生物气产量最低, 仅为137.5 mL·g-1 VSS, 为R0组的63.7%.结果表明, 腐殖酸确实会抑制污泥厌氧消化产气量, 且随着腐殖酸含量增加, 抑制作用越为明显.然而, 当腐殖酸含量高于15%后, 腐殖酸对厌氧消化抑制作用则不会继续扩大.图 2生物气中CH4体积比显示, R0、R1、R2、R3和R4实验组分别为65.1%、65.8%、66.8%、66.5%和66.5%;这表明, 腐殖酸虽然抑制生物气产量, 但并未对CH4体积比产生明显影响(p>0.05).因此, 腐殖酸应该抑制的是总厌氧消化过程, 而非CH4产生过程.
 |
| 图 2 腐殖酸含量对污泥厌氧消化生物气产量及CH4体积比的影响 Fig. 2 Dosing effects of humic acid on biogas and CH4 composition during anaerobic digestion |
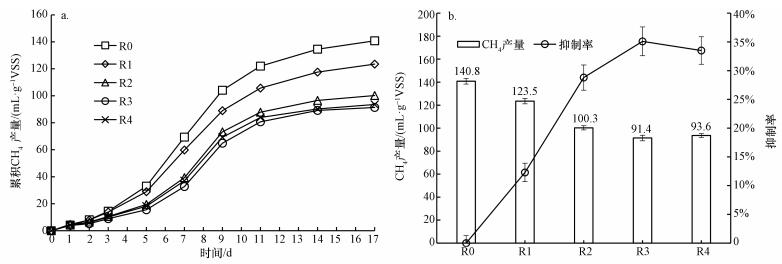
为了进一步说明腐殖酸抑制厌氧消化过程以及CH4产量, 图 3显示了1个实验周期内的累积CH4产量(a)及腐殖酸对CH4产量的抑制率(b);实验结束时, 各实验组中CH4累积产量(93.6~140.8 mL·g-1 VSS)范围与相关研究(83~270 mL·g-1 VSS)较为吻合(Bolzonella et al., 2012;Duan et al., 2012;Zhang et al., 2017);腐殖酸投加组R1、R2、R3和R4较未投加腐殖酸对照组(R0)CH4累积产量分别减少12.3%、28.8%、35.1%和33.5%.在实验开始的前2 d(D0~D2), 因污泥处于水解阶段, CH4产量很低且几乎各实验组间无差别;第2 d后(D2), 厌氧消化开始进入产CH4阶段, 累积CH4产量开始发生明显分级现象, 腐殖酸含量越高累积CH4产量则越低, 直至达15%腐殖酸含量后不再降低.
 |
| 图 3 腐殖酸含量对厌氧消化CH4累积量(a)和抑制率(b)的影响 Fig. 3 Dosing effects of humic acid on the accumulated CH4 yield (a) and inhibition ratio (b) during anaerobic digestion |
腐殖酸抑制产生物气/CH4过程原因可以归结为:①腐殖酸含量高则使污泥基质黏度变大, 导致微生物利用营养物质出现延迟;②腐殖酸还原菌与产CH4古菌(Archaea)在营养竞争中处于优势(Cervantes et al., 2002);③腐殖酸作为电子受体, 可改变产CH4路径电子流向, 抑制嗜乙酸产CH4路径, 抑制乙酰辅酶A向5-甲基-四氢甲烷蝶呤转化过程, 致乙酸产CH4路径被阻断(Fischer et al., 1990;Ferry et al., 2010;Liu et al., 2015);④当腐殖酸超过一定含量时, 腐殖酸呼吸作用也会抑制产CH4细菌活性(Dos et al., 2004;马晨等, 2011).
3.3 腐殖酸含量对溶解性多糖和蛋白质影响厌氧水解是可溶性高分子有机物(蛋白质、多糖、脂质等)在细菌胞外水解酶的水解作用下转化成小分子有机物质(氨基酸、葡萄糖、脂肪酸等)的过程, 水解产物因此可通过细胞膜被细菌利用.水解过程因为较为缓慢, 所以, 成为厌氧消化过程的限速步骤(Eliosov et al., 1995).
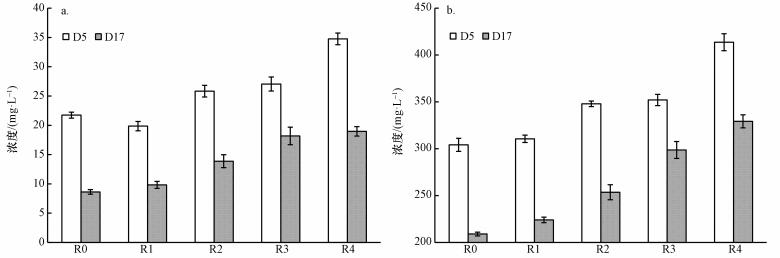
图 4分别显示了实验第5与第17 d残留溶解性多糖与蛋白质含量.无论是在实验初期的第5 d还是在实验结束的第17 d, 分离上清液中残留溶解性多糖与蛋白质含量均随腐殖酸含量呈增加趋势说明腐殖酸对溶解性多糖与蛋白质水解均产生了抑制作用.因腐殖酸会与水解酶结合, 这就会导致对水解酶的抑制, 以至于出现多糖、蛋白质残留.厌氧消化结束时(D17), R4实验组(20%腐殖酸含量)残留溶解性多糖、蛋白质浓度分别是对照组(R0)的2.2倍和1.6倍, 揭示出高腐殖酸含量对水解的严重抑制.
 |
| 图 4 实验第5 d与第17 d残留溶解性多糖含量(a)与蛋白质含量(b) Fig. 4 Residual concentrations of soluble polysaccharide (a) and protein (b) on Day 5 and Day 17 |
pH是指示厌氧消化影响因素的重要指标, 对厌氧消化系统菌群生理代谢及生长繁殖等均有明显影响(张自杰, 2000);pH与系统内挥发性有机酸(VFAs)含量有关.图 5显示了系统内腐殖酸含量对厌氧消化过程pH的影响(a)及不同时间段内VFAs积累量(b).各实验组pH值均在7.09~7.54间变化, 且变化趋势几近一致, 表明各实验组均处于稳定运行状态.实验前5 d(D1~D5), pH呈明显下降趋势(图 5a), 主要是因产酸代谢速率较产CH4代谢速率要快, 导致VFAs积累(图 5b).第5 d(D5)后, 各实验组pH逐渐开始升高, 表明系统中产CH4细菌代谢速率较产酸代谢速率变快, 所累积VFAs已开始被消耗而转化为CH4, 与图 3记录的CH4产生量迅速升高相一致;与此同时, 在有机物分解产CH4过程也会产生CO2、HCO3-和NH4+, 致厌氧消化系统碱度升高(付胜涛等, 2006).
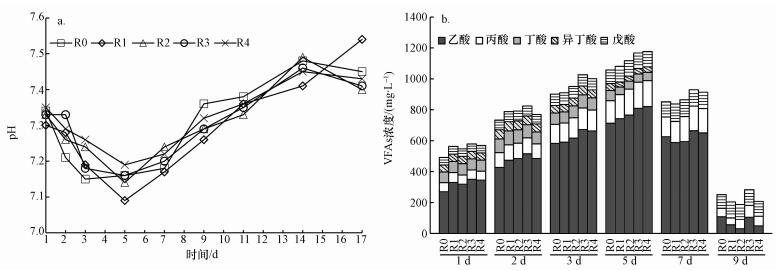 |
| 图 5 腐殖酸含量对厌氧消化pH(a)与VFAs (b)影响 Fig. 5 Dosing effects of humic acid on pH (a) and VFAs (b) during anaerobic digestion |
图 5b显示的各种VFAs含量在第5 d时达到极值, 且各实验组随腐殖酸含量增加, VFAs有微弱增加趋势(R0=1057、R1=1081、R2=1117、R3=1166、R4=1176 mg·L-1).这表明腐殖酸对厌氧酸化过程具有一定促进作用, R1、R2、R3和R4组VFAs产生量较对照组(R0)分别提高2.3%、5.7%、10.3%和11.3%(R4组较R3组增加并不明显).酸化过程其实是有机化合物既作为电子受体、也作为电子供体的生物降解过程.显然, 腐殖酸可作为电子受体而促进酸化过程, 增加VFAs产量, 但当腐殖酸含量超过15%时(R3组), 腐殖酸充当电子受体的容量已满足厌氧消化过程电子转移的需要, 过度增加含量对充当电子受体已不再奏效.
实验结果表明, 腐殖酸存在于厌氧消化系统可以促进VFAs生成.图 6显示了氨基酸、葡萄糖酸化过程(任南琪等, 1995).在厌氧条件下, 氨基酸和葡萄糖分别可通过脱氧和糖酵解途径产生丙酮酸, 然后丙酮酸通过降解生成VFAs, 并伴随脱氢、递氢和受氢过程.脱氢物质为供氢体(电子供体), 经脱氢作用而氧化;受氢物质为受氢体(电子受体), 经受氢作用而被还原.例如, 葡萄糖向丙酮酸转化路径、丙酮酸向乙酸、丙酸、丁酸、乳酸和乙醇的转化路径中均伴随着烟酰胺腺嘌呤二核苷酸氧化态(NAD+)、烟酰胺腺嘌呤二核苷酸还原态(NADH)相互之间的转化;式(1)和(2)显示了NAD+和NADH的电子转移过程.
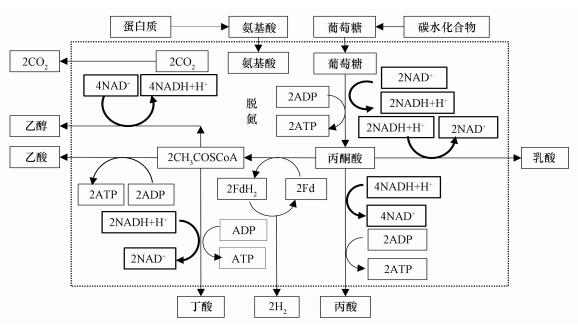 |
| 图 6 腐殖酸强化氨基酸、葡萄糖酸化路径 Fig. 6 Enhanced acidification routes of amino acid and glucose by humic acid |
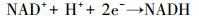
|
(1) |
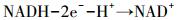
|
(2) |
酸化过程VFAs含量随腐殖酸含量增加而有所增加, 主要源于腐殖酸可以作为良好的电子传递中间体(Scott et al., 1998;Lovley et al., 1999).进言之, 酸化细菌细胞内释放的电子, 直接与膜蛋白或细胞表面附属物接触, 将电子传递至吸附于细胞表面的腐殖酸(沈萍等, 2007;唐家桓等, 2014);或者酸化细菌在细胞内氧化有机物释放出电子, 产生的电子通过电子传递链传递至细胞外电子受体.腐殖酸作为外源介体加入到厌氧消化系统中, 它可作为细胞外电子受体接受来自酸化细菌的电子, 以氧化态形式接受来自微生物体内的电子, 介导电子传递, 提高细胞外电子传递效率(Mehta et al., 2005).图 7显示了醌、半醌、氢醌之间的电子传递特性(Uchimiya et al., 2009).因腐殖酸所含醌基可作为VFAs形成的电子受体, 所以, 醌基含量越多其接受电子容量越高, 形成VFAs也就越多(Scott et al., 1998).
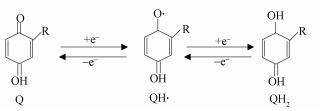 |
| 图 7 醌、半醌、氢醌间电子传递特性 Fig. 7 Electron transfer characteristics of quinone, p-semiquinone radical and hydroquinone |
图 8分别显示了腐殖酸含量对污泥厌氧酸化中乙酸和丙酸的影响.实验中, 酸化过程产生的VFAs虽有5种(乙酸、丙酸、正丁酸、异丁酸和正戊酸;异戊酸在整个厌氧消化过程未检测出), 但主要成分为乙酸和丙酸.图 8显示, 实验进行到第5 d(D5)时, 乙酸和丙酸含量约占VFAs总量的83%;乙酸含量随着腐殖酸含量升高而明显升高, 各实验组乙酸含量较对照组(R0)分别提高4.1%、7.5%、13.5%和15.2%(图 8a);丙酸含量较对照组(R0)也分别提高7.4%、13.8%、14.3%和12.5%(图 8b).有研究表明, 污泥厌氧消化系统VFAs组分中丙酸是最难降解的, 厌氧消化过程中30%的电子传递与丙酸降解过程有关, 而腐殖酸可促进丙酸转化成乙酸(Sahm et al., 1984).实验第5 d(D5)时, R4组丙酸含量略低于R3组, 原因就是腐殖酸作为电子中间体强化了丙酸氧化产生乙酸.
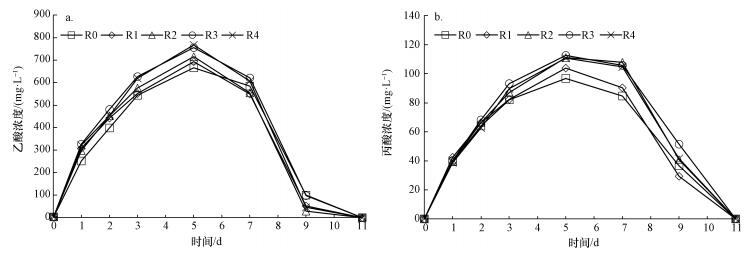 |
| 图 8 腐殖酸含量对厌氧酸化中乙酸(a)和丙酸(b)的影响 Fig. 8 Dosing effects of humic acid on acetic acid (a) and propionic acid (b) during acidification |
第5 d(D 5)后, 乙酸、丙酸含量开始迅速降低, 产CH4细菌活性明显增强, 而此时丁酸、戊酸含量相对较低;至第7 d(D7)和11 d(D11)时, 丁酸和戊酸含量已分别降至0, 原因是戊酸转化为乙酸所需吉布斯自由能(△G=+69.8 kJ·mol-1)高于丁酸转化为乙酸所需吉布斯自由能(△G=+48.1 kJ·mol-1)(胡纪萃, 2003).至第11 d(D11)时, 各实验组已检测不到任何VFAs含量, 已全部经乙酸转化为CH4.
4 结论(Conclusions)1) 腐殖酸可以抑制有机物厌氧水解过程.厌氧消化系统上清液中残留的溶解性多糖、蛋白质随腐殖酸含量增加而增加.厌氧消化实验结束时, 投加20%腐殖酸组残留的溶解性多糖、蛋白质含量分别是未投加腐殖酸对照组的2.2和1.6倍.
2) 腐殖酸作为外源电子受体, 可以一定程度促进厌氧酸化过程, 加速氨基酸和葡萄糖氧化还原, 提高酸化效率.随着腐殖酸含量增加, VFAs、乙酸和丙酸产生量有所升高;至实验第5 d时, 各实验组VFAs浓度达到极值;其中, 投加20%腐殖酸实验组VFAs浓度最高, 较对照组提高了11.3%.
3) 腐殖酸会抑制厌氧消化产CH4过程, 且随腐殖酸含量增加, CH4产量逐渐降低.投加15%腐殖酸组CH4产量降低最多, 较对照组降低了35%.
Akio I, Takehiko F, Kazuo M, et al. 2002. Characterization of dissolved organic matter in effluents from wastewater treatment plants[J]. Water Research, 36(4): 859–870.
DOI:10.1016/S0043-1354(01)00283-4
|
American Public Health Association, American Water Works Association, Water Pollution Control Federation, et al. 2012. Standard methods for the examination of water and wastewater[M]. Washington, D C: United Book Press.
|
Bolzonella D, Cavinato C, Fatone F, et al. 2012. High rate mesophilic, thermophilic, and temperature phased anaerobic digestion of waste activated sludge:a pilot scale study[J]. Waste Management, 32(6): 1196–1201.
DOI:10.1016/j.wasman.2012.01.006
|
Cervantes F J, de Bok F A, Duong-Dac T, et al. 2002. Reduction of humic substances by halorespiring, sulphate-reducing and methanogenic microorganisms[J]. Environmental Microbiology, 4(1): 51–57.
DOI:10.1046/j.1462-2920.2002.00258.x
|
Cervantes F J, van der Velde S, Lettinga G, et al. 2000. Competition between methanogenesis and quinone respiration for ecologically important substrates in anaerobic consortia[J]. Fems Microbiology Ecology, 34(2): 161–171.
DOI:10.1111/fem.2000.34.issue-2
|
Chaplin M F, Kennedy J F. 1994. Carbohydrate analysis:a practical approach[M]. Oxford: Oxford University Press.
|
Dos Santos A B, Cervantes F J, van Lier J B. 2004. Azo dye reduction by thermophilic anaerobic granular sludge, and the impact of the redox mediator anthraquinone-2, 6-disulfonate (AQDS) on the reductive biochemical transformation[J]. Applied Microbiology and Biotechnology, 64(1): 62–69.
DOI:10.1007/s00253-003-1428-y
|
Duan N, Dong B, Wu B, et al. 2012. High-solid anaerobic digestion of sewage sludge under mesophilic conditions:feasibility study[J]. Bioresource Technology, 104(104): 150–156.
|
El-Fadel M, Massoud M. 2001. Methane emissions from wastewater management[J]. Environmental Pollution, 114(2): 177–185.
DOI:10.1016/S0269-7491(00)00222-0
|
Eliosov B, Argaman Y. 1995. Hydrolysis of particulate organics in activated sludge systems[J]. Water Research, 29(1): 155–163.
DOI:10.1016/0043-1354(94)E0109-J
|
Fernandes T V, Lier J B V, Zeeman G. 2014. Humic acid-like and fulvic acid-like inhibition on the hydrolysis of cellulose and tributyrin[J]. Bioenergy Research, 8(2): 821–831.
|
Ferry J G. 2010. The chemical biology of methanogenesis[J]. Planetary and Space Science, 58(14): 1775–1783.
|
Fischer R, Thauer R K. 1990. Ferredoxin-dependent methane formation from acetate in cell extracts of Methanosarcina barkeri (strain MS)[J]. Febs Letters, 269(2): 368–372.
DOI:10.1016/0014-5793(90)81195-T
|
Frølund B, Griebe T, Nielsen P H. 1995. Enzymatic activity in the activated-sludge floc matrix[J]. Applied Microbiology and Biotechnology, 43(4): 755–761.
DOI:10.1007/BF00164784
|
付胜涛, 严晓菊, 付英. 2006. 剩余活性污泥和厨余垃圾的混合中温厌氧消化[J]. 环境科学, 2006, 27(7): 1459–1463.
|
郝晓地, 曹兴坤, 王吉敏, 等. 2013. 剩余污泥中木质纤维素稳定并转化能源可行性分析[J]. 环境科学学报, 2013, 33(5): 1215–1223.
|
Hao X D, Liu R B, Huang X. 2015. Evaluation of the potential for operating carbon neutral WWTPs in China[J]. Water Research, 87: 424–431.
DOI:10.1016/j.watres.2015.05.050
|
郝晓地, 魏静, 曹亚莉. 2014a. 美国碳中和运行成功案例——Sheboygan污水处理厂[J]. 中国给水排水, 2014a(24): 1–6.
|
郝晓地, 张璇蕾, 刘然彬, 等. 2014b. 剩余污泥转化能源的瓶颈与突破技术[J]. 中国给水排水, 2014b(18): 1–7.
|
胡纪萃. 2003. 废水厌氧生物处理理论与技术[M]. 北京: 中国建筑工业出版社.
|
Imai A, Fukushima T, Matsushige K, et al. 2002. Characterization of dissolved organic matter in effluents from wastewater treatment plants[J]. Water Research, 36(4): 859–870.
DOI:10.1016/S0043-1354(01)00283-4
|
金鹏康, 石彦丽, 任武昂. 2015. 城市污水处理过程中溶解性有机物转化特性[J]. 环境工程学报, 2015(1): 1–6.
DOI:10.12030/j.cjee.20150101 |
Kampschreur M J, Temmink H, Kleerebezem R, et al. 2009. Nitrous oxide emission during wastewater treatment[J]. Water Research, 43(17): 4093–4103.
DOI:10.1016/j.watres.2009.03.001
|
Liu K, Chen Y, Xiao N, et al. 2015. Effect of humic acids with different characteristics on fermentative short-chain fatty acids production from waste activated sludge[J]. Environmental Science and Technology, 49(8): 4929.
DOI:10.1021/acs.est.5b00200
|
马晨, 周顺桂, 庄莉, 等. 2011. 微生物胞外呼吸电子传递机制研究进展[J]. 生态学报, 2011, 31(7): 2008–2018.
|
Mcdonnell R, Holden N M, Ward S M, et al. 2001. Characteristics of humic substances in heathland and forested peat soils of the Wicklow Mountains[J]. Biology and Environment Proceedings of the Royal Irish Academy, 101.
|
Mehta T, Coppi M V, Childers S E, et al. 2005. Outer membrane c-type cytochromes required for Fe(Ⅲ) and Mn(Ⅳ) oxide reduction in Geobacter sulfurreducens[J]. Applied and Environmental Microbiology, 71(12): 8634–8641.
DOI:10.1128/AEM.71.12.8634-8641.2005
|
任冰倩. 2015. 腐殖酸抑制厌氧消化过程实验研究[D]. 北京: 北京建筑大学. 1-46
http://cdmd.cnki.com.cn/Article/CDMD-10016-1015351116.htm |
任南琪, 王宝贞, 马放. 1995. 有机废水产酸发酵的生理生态学分析[J]. 中国沼气, 1995(1): 1–6.
|
Sahm H. 1984. Anaerobic wastewater treatment[M]. Berlin Heidelberg: Springer.
|
Schnitzer M, Khan S U. 1974. Humic substances in the environment[J]. Journal of Environmental Quality, 3(2): 186.
|
Scott D T, McKnight D M, Blunt-Harris E L, et al. 1998. Quinone moieties act as electron acceptors in the reduction of humic substances by humics-reducing microorganisms[J]. Environmental Science and Technology, 32(19): 2984–2989.
DOI:10.1021/es980272q
|
沈萍, 陈向东. 2007. 微生物学实验(第四版)[M]. 北京: 高等教育出版.
|
Swift R S, Sparks D L, Page A L, et al. 1996. Organic matter characterization[J]. Methods of soil analysis. Part 3 Soil Science Society of American Society of Agnomy:Madison, Wisconsin: 1011–1069.
|
唐家桓, 刘毅, 周顺桂, 等. 2014. 电活性生物膜:形成、表征及应用[J]. 应用与环境生物学报, 2014, 20(6): 1096–1103.
|
Thurman E M. 1985. Aquatic humic substances[M]. Netherlands: Springer.
|
Uchimiya M, Stone A T. 2009. Reversible redox chemistry of quinones:impact on biogeochemical cycles[J]. Chemosphere, 77(4): 451.
DOI:10.1016/j.chemosphere.2009.07.025
|
Weemaes M, Grootaerd H, Simoens F, et al. 2000. Anaerobic digestion of ozonized biosolids[J]. Water Research, 34(99): 2330–2336.
|
Zhang J, Yao C, Zheng P, et al. 2017. Synergistic effects of anaerobic digestion from sewage sludge with lime mud[J]. International Journal of Hydrogen Energy, 42(16): 12022–12031.
DOI:10.1016/j.ijhydene.2017.02.098
|
张自杰. 2000. 排水工程(第四版)[M]. 北京: 中国建筑工业出版社.
|
 2018, Vol. 38
2018, Vol. 38


