环境中铅主要来源于酸蓄电池、铅矿冶炼、石油加工等行业, 进入水体的铅不能降解, 在生物体内长期累积, 危害人体健康, 甚至低浓度的铅都会对人体及水体中的水生生态系统造成巨大的危害, 0.01 mg·L-1为我国饮用水中铅的最大允许残留量, 故含铅废水的治理深受关注.
活性炭(Adebisi et al., 2017; Asuquo et al., 2017; Legrouri et al., 2017; 李坤权等, 2014; 谢超然等, 2016)、硅藻土(Irani et al., 2011; 朱健等, 2012)、膨润土(Alexander et al., 2017)等对水中的Pb(Ⅱ)均具有一定的吸附能力, 但大部分吸附剂都存在固液分离困难、难再生、易造成二次污染等问题, 因此开发易固液分离的吸附剂净化含铅废水值得探索.
近年来, 研究表明, 将磁性纳米颗粒(magnetic nanoparticles, 简写为MNPs)或磁性纳米复合材料(magnetic nanocomposites, 简写为MNCs)作为吸附剂, 可用于水中多种污染物的去除(Bée et al., 2011; 鲍晓磊等, 2013; Fan et al., 2012; Feitoza et al., 2014; Hashemian et al., 2015; Hokkanen et al., 2015; Hughes et al., 2017; Jia et al., 2015; Jiang et al., 2015; Kyzas et al., 2013; Lata et al., 2016; Li et al., 2013; Lin et al., 2013; Liu et al., 2013; Parham et al., 2012; Peng et al., 2006; Shan et al., 2013; Shan et al., 2015; 张晓蕾等, 2013), MNCs因其易固液分离、高效以及可回收等特点为水污染控制技术开辟了新的方向和思路.
具有尖晶石结构的锰锌铁氧体Mn1-xZnxFe2O4 MNPs具有高饱和磁通密度, 高磁导率, 低损耗及较好的机械强度, 当x为0.4时, Mn0.6Zn0.4Fe2O4饱和磁化强度最大(Gawas et al., 2010), 利用Mn1-xZnxFe2O4 MNPs所制备的磁性吸附剂在水处理领域具有极大应用潜力.以Mn1-xZnxFe2O4 MNPs作为磁性吸附剂, 因MNPs易团聚, 减小了比表面积, 吸附效果较差; 另外, 还存在MNPs组分流失的情况, 对其磁性能也带来影响, 为解决上述问题, 以Mn1-xZnxFe2O4 MNPs为磁核制备核壳结构磁性纳米复合物(magnetic nanocomposites, 简写为MNCs)吸附剂降低MNPs的团聚程度, 增大比表面积; 且能保护磁核, 提高磁核的耐候性.
实验室前期制备得到Mn0.6Zn0.4Fe2O4 MNPs(简写为Fe-MNPs)(郝旗等, 2017); 以Fe-MNPs作为磁核, 制备得到核壳结构磁性Mn0.6Zn0.4Fe2O4@SiO2(简写为MZF@SiO2) (姜德彬等, 2015), 本研究对MZF@SiO2的晶型、形貌及磁性能等进行了表征, 以水中重金属Pb(Ⅱ)为目标污染物, 研究了其对水中Pb(Ⅱ)的吸附规律, 推测了吸附机理, 为进一步的应用研究提供基础理论数据.
2 材料与方法(Materials and methods) 2.1 试剂与仪器试剂:正硅酸乙酯(TEOS, SiO2质量分数28%)、柠檬酸、硝酸铅等, 所用药品均为分析纯(成都科龙化工试剂厂, 中国).锰锌铁氧体Mn0.6Zn0.4Fe2O4(Fe-MNPs)自制.
仪器:赛曼GGX-6火焰原子吸收分光光度计(北京科创海光仪器有限公司, 中国); SSA-4220型孔隙比表面分析仪(北京彼奥德电子技术有限公司, 中国); Nicolet IS50型傅立叶红外光谱仪(Thermo Scientific公司, 美国); DX-2700 X射线衍射仪(辽宁丹东方圆仪器厂, 中国); JEM-2100F场发射透射电子显微镜(JEOL, 日本); BHV-525型振动样品磁强计(Riken Denshi, 日本); Escalab 250Xi型X射线光电子能谱仪(Thermo Fisher Scientific公司, 美国); 纳米激光粒度及zeta电位分析仪ZEN3600(马尔文公司, 英国).
2.2 MZF@SiO2的制备取0.05 mol·L-1柠檬酸溶液150 mL于250 mL三口烧瓶中, 加入Fe-MNPs 0.5 g, 将Fe-MNPs在柠檬酸溶液中搅拌分散180 min后, 用氨水调节溶液pH值至5.50左右, 搅拌分散180 min后, 逐滴加入TEOS, 水浴加热搅拌360 min.待溶液冷却后, 将固体物质进行磁分离, 并用去离子水反复洗涤固体物质至洗涤液pH约为7.00, 将收集得到的固体物质在333 K真空干燥300 min, 即得MZF@SiO2.
2.3 Pb(Ⅱ)的吸附将0.5 g MZF@SiO2加入50 mL一定初始浓度的Pb(Ⅱ)溶液中, 转速200 r·min-1, 于一定温度下, 在恒温振荡器中进行吸附, 一定时间后取出锥形瓶, 磁分离后, 利用火焰原子吸收分光光度法测定溶液中Pb(Ⅱ)的浓度, 铅的吸附量计算如下:
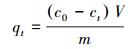
|
(1) |
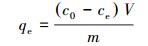
|
(2) |
式中, qt和qe分别为不同时刻t (min)和吸附达平衡时, MZF@SiO2对Pb(Ⅱ)的吸附量(mg·g-1); ct和ce分别为不同时刻t (min)和吸附达平衡时吸附后水相中Pb(Ⅱ)浓度(mg·L-1); c0为初始Pb(Ⅱ)浓度(mg·L-1).V为初始Pb(Ⅱ)溶液的体积(mL); m为吸附剂MZF@SiO2的质量(g).
2.4 MZF@SiO2的再生将0.5 g MZF@SiO2加入50 mg·L-1的Pb(Ⅱ)溶液50 mL中, 在200 r·min-1, 303 K条件下, 吸附60 min后, 进行磁分离, 移去上层液体, MZF@SiO2留于锥形瓶中, 然后加入0.1 mg·L-1硝酸溶液10 mL, 在303 K, 200 r·min-1的条件下进行MZF@SiO2的再生.再生60 min后, 通过磁分离, 移去上层液体, MZF@SiO2留于锥形瓶中, 用去离子水在303 K, 200 r·min-1条件下对MZF@SiO2洗涤3次, 每次20 min, 再生后的MZF@SiO2重复吸附步骤并计算其对Pb(Ⅱ)的吸附量(mg·g-1), 如此循环5次.
3 结果与讨论(Result and discussions) 3.1 MZF@SiO2的表征图 1a为MZF@SiO2和Fe-MNPs的XRD图谱.样品在29.7° (220), 35.1°(311), 42.6°(400), 52.9°(422), 56.3°(511)和61.8°(440)分别出现特征衍射峰, 各衍射峰位置和相对强度与Mn0.6Zn0.4Fe2O4标准图谱(JCPDS74-2401)一致, 说明磁核Fe-MNPs在包覆前后均为具有尖晶石结构的锰锌铁氧体Mn0.6Zn0.4Fe2O4.图 1b为MZF@SiO2和Fe-MNPs的XPS宽谱图, 在641.8、1022.1、711.6、532.8 eV处峰分别对应的是Mn、Zn、Fe及O元素, 而MZF@SiO2在103.5 eV处峰对应的是Si元素, 表明MZF@SiO2表面存在硅元素.
 |
| 图 1 MZF@SiO2和Fe-MNPs的XRD和XPS图谱 Fig. 1 XRD and XPS spectra of MZF@SiO2 and Fe-MNPs |
MZF@SiO2为球形颗粒(图 2a), 具有核壳结构(图中深色部分为磁核Fe-MNPs, 浅色部分为包覆层SiO2), SiO2包覆层形成了狭缝状的孔道结构.在图 2b中可以观察到无定型的SiO2包覆层, Fe-MNPs被完全包覆.因此所制备磁性吸附剂MZF@SiO2具有无定形的SiO2包覆层和磁性内核的核壳结构.
 |
| 图 2 MZF@SiO2的TEM照片 Fig. 2 TEM image of MZF@SiO2 |
MZF@SiO2比表面积为241.5 m2·g-1(表 1), 较大的比表面积能为目标污染物提供更多的吸附活性位点; MZF@SiO2的孔容为0.3566 cm3·g-1, 与Fe-MNPs相比有所增加, 这是由于SiO2包覆层形成了狭缝状孔道结构.Fe-MNPs和MZF@SiO2的磁滞回线(图 3)表明MZF@SiO2的饱和磁化强度(Ms)、剩磁(Mr)和矫玩力(Hc)均比包覆前有所降低, 这是由于包覆层SiO2呈磁惰性所致.
| 表 1 Fe-MNPs和MZF@SiO2的BET分析结果 Table 1 The results of BET analysis on Fe-MNPs and MZF@SiO2 |
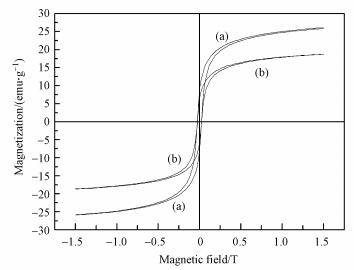 |
| 图 3 Fe-MNPs(a)和MZF@SiO2(b)的磁滞回线 Fig. 3 Magnetic hysteresis curves of Fe-MNPs(a) and MZF@SiO2(b) at room temperature |
吸附动力学研究主要是用来描述吸附剂吸附速率的快慢, 采用准一级动力学(Pseudo-first-order model)(式(3))和准二级动力学(Pseudo-second-order model)(式(4))模型(邓述波等, 2012)非线性拟合分析了MZF@SiO2对Pb(Ⅱ)的吸附动力学(表 2).
| 表 2 MZF@SiO2对Pb(Ⅱ)的吸附动力学模型拟合参数(318 K) Table 2 Kinetic model fitting parameters of Pb(Ⅱ) adsorption onto MZF@SiO2 (318 K) |
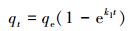
|
(3) |
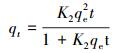
|
(4) |
式中, qt为t (min)时刻吸附量(mg·g-1); qe为平衡吸附量(mg·g-1); k1为准一级吸附速率常数(min-1); k2为准二级吸附速率常数(mg·g-1·min-1).
拟合结果表明, 准二级动力学模型的R2(R2>0.99)比准一级动力学模型的R2大, 且由准二级动力学模型计算得出的平衡吸附量qe, cal更加接近实验值qe, exp, 故准二级动力学模型更适合用来描述MZF@SiO2对Pb(Ⅱ)的吸附过程.这是由于准二级动力学模型包含外部液膜扩散、表面吸附和颗粒内扩散等吸附过程(姚超等, 2010), 能更真实全面地反映Pb(Ⅱ)在MZF@SiO2上的吸附机制.拟合所得吸附速率常数k2随着溶液初始浓度的增加而下降, 这表明MZF@SiO2对Pb(Ⅱ)的吸附是以化学吸附为速率控制步骤(姚超等, 2010).
3.3 吸附等温线及热力学吸附等温线可以评价吸附剂的吸附能力, 有助于了解吸附过程中吸附剂和被吸附物质之间的相互作用.Langmuir(式(5))和Freundlich(式(6))两种吸附等温方程分别描述了均匀表面单层吸附和非均匀表面非均匀吸附(邓述波等, 2012; 高淑玲等, 2014), 而Dubinin-Radushkevich(D-R)模型(式(7))有助于更加深入地了解和理解吸附机理, 进而确定吸附类型(Ma et al., 2012), 不同温度下的吸附平衡数据采用非线性拟合, 拟合结果如表 3所示.
| 表 3 MZF@SiO2吸附Pb(Ⅱ)的吸附等温方程及热力学参数 Table 3 Isotherm and thermodynamic parameters of Pb(Ⅱ) adsorption onto MZF@SiO2 |
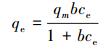
|
(5) |
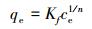
|
(6) |
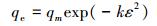
|
(7) |
式中, qe和qm分别为平衡吸附量(mg·g-1)和最大吸附量(mg·g-1); b为吸附常数(L·mg-1); ce为吸附平衡时铅离子的浓度(mg·L-1); Kf为吸附系数; n为Freundlich常数; k为吸附能常数(mol2·kJ-2); ε为吸附势(kJ·mol-1), ε=RT(1+1/ce); E为吸附自由能(kJ·mol-1), E=(2k)-0.5; R为通用气体常数(J·mol-1·K-1); T为温度(K).
在相同条件下, Freundlich方程的R2均大于Langmuir模型的R2, 因此Freundlich模型能更好地描述Pb(Ⅱ)在MZF@SiO2上的吸附行为, 这表明MZF@SiO2是以非均匀孔隙或表面为主要吸附位, 对Pb(Ⅱ)的吸附并非均匀的单层吸附.由Freundlich常数n计算得到1/n的值介于0.1到0.5之间, 表明MZF@SiO2对Pb(Ⅱ)的吸附容易进行(Ma et al., 2012; Qiang et al., 2013).
当吸附自由能E介于1~8 kJ·mol-1之间, 为物理吸附; 介于8~16 kJ·mol-1之间, 吸附过程以离子交换为主; 介于20~40 kJ·mol-1之间, 为化学吸附(Ma et al., 2012).由D-R模型得到该吸附过程的吸附自由能E介于8~40 kJ·mol-1之间, 表明该吸附过程存在离子交换和化学吸附, 这也与准二级动力学拟合结果相吻合.
MZF@SiO2吸附Pb(Ⅱ)时, 吸附过程的吉布斯自由能变化和焓变可通过式(8)(李坤权等, 2010)和式(9)(Garcia-Delgado et al., 1992)计算得到, 而吸附过程的熵变通过式(10)计算.

|
(8) |
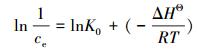
|
(9) |
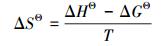
|
(10) |
式中, ΔGΘ为吸附过程中的吉布斯自由能变量(kJ·mol-1); ΔHΘ为吸附过程等量吸附焓变(kJ·mol-1); ΔSΘ为吸附过程熵变(J·mol-1·K-1); R为通用气体常数(8.314 J·mol-1·K-1); T为热力学温度(K); Kd为吸附平衡常数, 以lnqe/ce对ce作图, 外延至qe=0, 得到lnKd(李坤权等, 2010); K0为Van′t Hoff方程常数, qe、ce分别为平衡吸附量和平衡时水相中Pb(Ⅱ)的浓度.
由表 3可知, ΔHΘ>0说明该吸附过程为吸热过程, 温度升高有助于该吸附过程进行.ΔSΘ>0, 说明该吸附过程增加了固液界面的混乱度(Qiang et al., 2013).ΔGΘ<0, 表明MZF@SiO2吸附Pb(Ⅱ)是自发进行的过程, 通常ΔG在-20~0 kJ·mol-1为物理吸附过程, 当ΔG在-400 ~-80 kJ·mol-1为化学吸附过程(Ma et al., 2012), 该吸附过程的ΔGΘ介于-20~-80 kJ·mol-1之间, 可以推测该吸附过程既存在物理吸附, 也存在化学吸附, 结合准二级动力学拟合结果可以推测, 化学吸附为速率控制步骤.
负载Pb(Ⅱ)的MZF@SiO2可使用0.01 mol·L-1硝酸再生, 5次吸附-再生循环后, 平衡吸附量为28.4 mg·g-1, 为新鲜材料的57.7%, MZF@SiO2的回收率为71.2%.
在吸附-再生循环过程中, 在外加磁场(0.2 T)的作用下, 吸附了Pb(Ⅱ)的MZF@SiO2能在3 min之内实现固液分离, 易于固液分离; 经再生后的MZF@SiO2再次使用时, 只需轻微振荡即可再次均匀分散.
与部分已报道吸附Pb(Ⅱ)的磁性吸附剂相比(表 4), MZF@SiO2能在较短的时间内达到吸附平衡, 具有较大的平衡吸附量, 故MZF@SiO2具有一定的应用前景.
| 表 4 各种磁性吸附剂对Pb(Ⅱ)的平衡吸附量 Table 4 Equilibrium adsorption capacity for the adsorption of Pb(Ⅱ) onto various magnetic adsorbents |
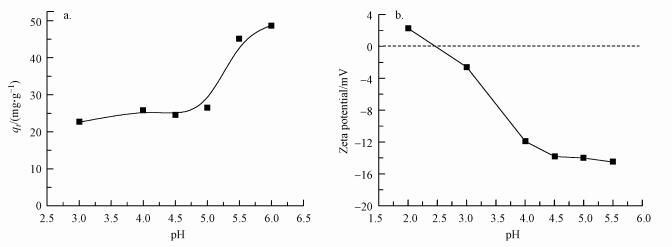
pH除了会影响吸附剂表面电荷和质子化程度外, 还会影响吸附质Pb(Ⅱ)在溶液中的存在状态, 当含Pb(Ⅱ)溶液浓度为50 mg·L-1时, pH大于6.00时会形成Pb(OH)2沉淀, 影响真实吸附效果的判断, 因此在此仅讨论水相初始pH值为3.00~5.50时对Pb(Ⅱ)吸附的影响.由图 4a可知, 随着水相初始pH升高, MZF@SiO2对Pb(Ⅱ)的吸附量逐渐增大, 当pH大于5.0时, 吸附量增加较快.由图 4b MZF@SiO2的Zeta电位分析可知MZF@SiO2的等电点pI约2.45.
 |
| 图 4 不同初始pH对MZF@SiO2吸附Pb(Ⅱ)的影响 Fig. 4 Effect of pH on the adsorption of Pb(Ⅱ) onto MZF@SiO2 |
当溶液初始pH值为3.00~5.50时, 因利用TEOS水解制备得到的MZF@SiO2表面具有丰富的羟基(姜德彬等, 2016), Pb(Ⅱ)可能因阳离子交换而被吸附于MZF@SiO2表面;另一方面, MZF@SiO2表面因硅羟基解离而带负电, 而此pH范围内Pb(Ⅱ)在水相中主要以阳离子形式存在, 故溶液中的H3O+与Pb(Ⅱ)存在竞争吸附.随着溶液初始pH的逐渐升高, 水相中H3O+浓度逐渐降低, 使得MZF@SiO2表面质子化程度降低, 而Pb2+依靠静电作用占据了MZF@SiO2表面的活性位点, 故吸附量随着pH升高而逐渐增加, 因此静电作用和阳离子交换均有可能为该吸附过程的作用力.
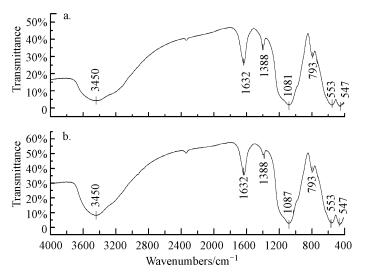
图 5为吸附Pb(Ⅱ)前后MZF@SiO2的红外谱图.由图 5b可见, MZF@SiO2吸附Pb(Ⅱ)后的红外谱图与图 5a相比无新的特征峰出现, 但图 5b中Si-O-Si的反对称伸缩振动吸收峰由1081 cm-1蓝移至1087 cm-1, 这可能是由于Si-O-Si能与具有空轨道的Pb(Ⅱ)配位结合, 使得Si-O-Si伸缩振动需要的能量增加而导致的.图 5中3450 cm-1和1388 cm-1分别归属于MZF@SiO2表面羟基的伸缩振动和弯曲振动特征峰; 1632 cm-1归属于MZF@SiO2表面的水羟基; 793 cm-1归属于Si-O-Si的对称伸缩振动, 457cm-1处归属于Si-O的弯曲振动; 553 cm-1处归属于锰锌铁氧体的Fe-O特征吸收峰.
 |
| 图 5 MZF@SiO2吸附Pb(Ⅱ)前后的红外谱图 Fig. 5 FTIR spectra of MZF@SiO2 before (a) and after adsorption (b) |
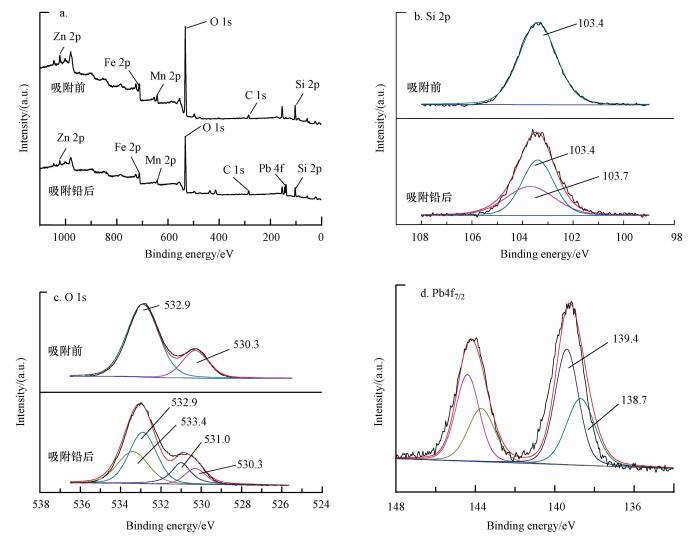
图 6为吸附Pb(Ⅱ)前后MZF@SiO2的XPS能谱图.图 6a中, 吸附铅后的MZF@SiO2的宽谱中, 结合能139.4 eV的位置为Pb4f7/2的特征峰, 表明Pb(Ⅱ)的确被MZF@SiO2所吸附.
 |
| 图 6 MZF@SiO2吸附Pb(Ⅱ)前后的XPS谱图 Fig. 6 XPS spectra of MZF@SiO2 samples before and after the adsorption of Pb(Ⅱ) |
图 6b是吸附铅前后的MZF@SiO2中Si 2p的XPS能谱图.吸附前, MZF@SiO2的Si 2p能谱只能被103.4 eV处的峰拟合.吸附铅后, MZF@SiO2的Si 2p能谱可被结合能分别为103.4 eV和103.7 eV两个峰拟合, 硅具有孤对电子, 可与铅形成配位键, 导致硅的电子云密度减小, 故Si 2p能谱出现结合能为103.7 eV的新峰, 这表明硅能与Pb(Ⅱ)配位; 而吸附铅后Si 2p能谱中103.4 eV处的峰也因吸附作用而有所减少.
图 6c是吸附铅前后的MZF@SiO2中O 1s的XPS能谱图.吸附前, MZF@SiO2的O 1s能谱能被分配到532.9 eV和530.3 eV两个峰, 分别对应于Si-OH中的氧和铁氧体中的氧.吸附铅后, 由于吸附作用原结合能为532.9 eV和530.3 eV的峰均减小, 并且出现了两个具有较高结合能的峰533.4 eV(Si-OH中的氧)和531.0 eV(铁氧体中的氧), 这是由于氧具有孤对电子, 可与铅形成配位键, 因此出现了两个更高结合能的峰, 这表明MZF@SiO2硅羟基中的氧和磁核铁氧体中的氧均能与Pb(Ⅱ)配位.
在图 6d中, Pb 4f7/2的XPS光谱能被结合能分别为139.4 eV和138.7 eV两个峰拟合, 其中139.4 eV处的峰可能分配到Pb(NO3)2中的Pb2+(Pb2+储备液由Pb(NO3)2配制)(Deng et al., 2003).结合能为138.7 eV的峰可能代表Si-O-Pb, 或O-Si-Pb, 或M-O-Pb(M代表磁核铁氧体中的Mn、Zn、Fe)键, 这与Si 2p和O 1s的能谱相吻合, 也与图 5的红外光谱分析结果相一致.
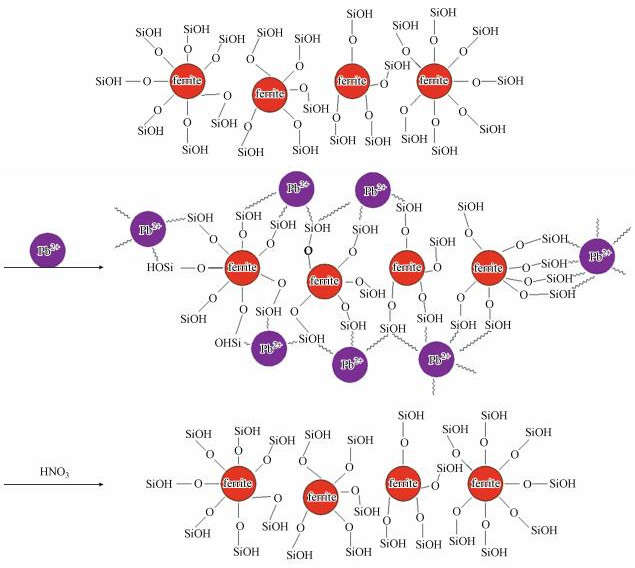
综上, MZF@SiO2对Pb(Ⅱ)的吸附既有物理吸附, 也有化学吸附; 吸附作用力有静电作用、阳离子交换和配位作用, 配位作用包括Pb(Ⅱ)与O(Si-OH中的氧和铁氧体中的氧)和Si的络合, MZF@SiO2对Pb(Ⅱ)的吸附机理示意图如图 7所示.
 |
| 图 7 MZF@SiO2吸附Pb(Ⅱ)的机理示意图 Fig. 7 Schematic mechanism of Pb(Ⅱ) adsorption on MZF@SiO2 |
1) MZF@SiO2能够有效吸附去除水中的Pb(Ⅱ), 负载Pb(Ⅱ)的MZF@SiO2可用0.01 mol·L-1HNO3进行再生, MZF@SiO2对Pb(Ⅱ)的吸附动力学过程可用准二级动力学模型用来描述; MZF@SiO2对Pb(Ⅱ)的吸附等温行为符合Freundlich模型.
2) 吸附吉布斯自由能变化ΔGΘ<0, 吸附焓变ΔHΘ>0, 吸附熵变ΔSΘ>0, 该吸附过程为吸热和熵增的自发过程.该吸附过程既有物理吸附又有化学吸附, 吸附作用力有静电作用、阳离子交换和配位作用.
Adebisi G A, Chowdhury Z Z, Alaba P A. 2017. Equilibrium, kinetic, and thermodynamic studies of lead ion and zinc ion adsorption from aqueous solution onto activated carbon prepared from palm oil mill effluent[J]. Journal of Cleaner Production, 148: 958–968.
DOI:10.1016/j.jclepro.2017.02.047
|
Alexander J A, Ahmad Zaini M A, Surajudeen A, et al. 2017. Insight into kinetics and thermodynamics properties of multicomponent lead (Ⅱ), cadmium (Ⅱ) and manganese (Ⅱ) adsorption onto Dijah-Monkin bentonite clay[J]. Particulate Science and Technology: 1–9.
|
Asuquo E, Martin A, Nzerem P, et al. 2017. Adsorption of Cd (Ⅱ) and Pb (Ⅱ) ions from aqueous solutions using mesoporous activated carbon adsorbent:Equilibrium, kinetics and characterisation studies[J]. Journal of Environmental Chemical Engineering, 5(1): 679–698.
DOI:10.1016/j.jece.2016.12.043
|
Bée A, Talbot D, Abramson S, et al. 2011. Magnetic alginate beads for Pb (Ⅱ) ions removal from wastewater[J]. Journal of Colloid and Interface Science, 362(2): 486–492.
DOI:10.1016/j.jcis.2011.06.036
|
鲍晓磊, 强志民, 贲伟伟, 等. 2013. 磁性纳米复合材料CoFeM48对水中磺胺类抗生素的吸附去除研究[J]. 环境科学学报, 2013, 33(2): 401–407.
|
Deng S, Bai R, Chen J P. 2003. Aminated polyacrylonitrile fibers for lead and copper removal[J]. Langmuir, 19(12): 5058–5064.
DOI:10.1021/la034061x
|
邓述波, 余刚. 2012. 环境吸附材料及应用原理, 第1版[M]. 北京: 科学出版社.
|
Fan L L, Luo C N, Sun M, et al. 2012. Preparation of novel magnetic chitosan/graphene oxide composite as effective adsorbents toward methylene blue[J]. Bioresource Technology, 114: 703–706.
DOI:10.1016/j.biortech.2012.02.067
|
Feitoza N C, Goncalves T D, Mesquita J J, et al. 2014. Fabrication of glycine-functionalized maghemite nanoparticles for magnetic removal of copper from wastewater[J]. Journal of Hazardous Materials, 264: 153–160.
DOI:10.1016/j.jhazmat.2013.11.022
|
Garcia-Delgado R A, Cotoruelo-Minguez L M, Rodriguez J J. 1992. Equilibrium study of single-solute adsorption of anionic surfactants with polymeric XAD resins[J]. Separation Science and Technology, 27(7): 975–987.
DOI:10.1080/01496399208019736
|
Gawas U, Mojumdar S, Verenkar V. 2010. Synthesis, characterization, infrared studies, and thermal analysis of Mn0.6Zn0.4Fe2(C4H2O4)3·6N2H4 and its decomposition product Mn0.6Zn0.4Fe2O4[J]. Journal of Thermal Analysis and Calorimetry, 100(3): 867–871.
DOI:10.1007/s10973-010-0720-1
|
高淑玲, 杨翠玲, 罗鑫圣, 等. 2014. 坡缕石黏土污泥对水相中亚甲基蓝吸附研究[J]. 中国环境科学, 2014, 34(1): 78–84.
|
Hashemian S. 2015. MnFe2O4/bentonite nanocomposite as a novel magnetic material for adsorption of acid red 138[J]. African Journal of Biotechnology, 9(50): 8667–8671.
|
Hokkanen S, Repo E, Lou S, et al. 2015. Removal of arsenic (V) by magnetic nanoparticle activated microfibrillated cellulose[J]. Chemical Engineering Journal, 260: 886–894.
DOI:10.1016/j.cej.2014.08.093
|
Hughes D L, Afsar A, Harwood L M, et al. 2017. Adsorption of Pb and Zn from binary metal solutions and in the presence of dissolved organic carbon by DTPA-functionalised, silica-coated magnetic nanoparticles[J]. Chemosphere, 183: 519–527.
DOI:10.1016/j.chemosphere.2017.05.146
|
郝旗, 余静, 袁率, 等. 2017. 废无汞碱性电池极性材料制备锰锌铁氧体磁性纳米颗粒[J]. 化工环保, 2017, 37(3): 340–345.
|
Irani M, Amjadi M, Mousavian M A. 2011. Comparative study of lead sorption onto natural perlite, dolomite and diatomite[J]. Chemical Engineering Journal, 178: 317–323.
DOI:10.1016/j.cej.2011.10.011
|
Jiang T, Liang Y D, He Y J, et al. 2015. Activated carbon/NiFe2O4 magnetic composite:A magnetic adsorbent for the adsorption of methyl orange[J]. Journal of Environmental Chemical Engineering, 3(3): 1740–1751.
DOI:10.1016/j.jece.2015.06.020
|
Jia Z, Qin Q, Liu J, et al. 2015. The synthesis of hierarchical ZnFe2O4 architecture and their application for Cr (Ⅵ) adsorption removal from aqueous solution[J]. Superlattices and Microstructures, 82: 174–187.
DOI:10.1016/j.spmi.2015.01.028
|
姜德彬, 余静, 程庆峰, 等. 2015. 锰锌铁氧体/SiO2复合磁性材料的制备和表征[J]. 化工环保, 2015, 35(5): 536–541.
|
姜德彬, 余静, 叶芝祥, 等. 2016. 磁性纳米复合物对水中亚甲基蓝的吸附及其机理研究[J]. 中国环境科学, 2016, 36(6): 1763–1772.
|
Kyzas G Z, Deliyanni E A. 2013. Mercury (Ⅱ) removal with modified magnetic chitosan adsorbents[J]. Molecules, 18(6): 6193–6214.
DOI:10.3390/molecules18066193
|
Lata S, Samadder S R. 2016. Removal of arsenic from water using nano adsorbents and challenges:a review[J]. Journal of Environmental Management, 166: 387–406.
DOI:10.1016/j.jenvman.2015.10.039
|
Legrouri K, Khouya E, Hannache H, et al. 2017. Activated carbon from molasses efficiency for Cr (Ⅵ), Pb (Ⅱ) and Cu (Ⅱ) adsorption:a mechanistic study[J]. Chem Int, 3: 301–310.
|
Li LL, Fan L L, Sun M, et al. 2013. Adsorbent for chromium removal based on graphene oxide functionalized with magnetic cyclodextrin-chitosan[J]. Colloids and Surfaces B:Biointerfaces, 107: 76–83.
DOI:10.1016/j.colsurfb.2013.01.074
|
Lin Y F, Chen H W, Chen Y C, et al. 2013. Application of magnetite modified with polyacrylamide to adsorb phosphate in aqueous solution[J]. Journal of the Taiwan Institute of Chemical Engineers, 44(1): 45–51.
DOI:10.1016/j.jtice.2012.09.005
|
Liu Y, Chen M, Yongmei H. 2013. Study on the adsorption of Cu (Ⅱ) by EDTA functionalized Fe3O4 magnetic nano-particles[J]. Chemical Engineering Journal, 218: 46–54.
DOI:10.1016/j.cej.2012.12.027
|
李坤权, 杨美蓉, 王燕锦, 等. 2014. 新型胺化介孔炭的制备及其对Pb (Ⅱ)的吸附[J]. 中国环境科学, 2014, 34(8): 1985–1992.
|
李坤权, 郑正, 蒋剑春, 等. 2010. 铅在棉秆基活性炭上的吸附动力学与热力学[J]. 环境科学, 2010, 31(5): 1402–1408.
|
Ma J, Yu F, Zhou L, et al. 2012. Enhanced adsorptive removal of methyl orange and methylene blue from aqueous solution by alkali-activated multiwalled carbon nanotubes[J]. ACS Applied Materials & Interfaces, 4(11): 5749–5760.
|
Ma Y X, Kou Y L, Xing D, et al. 2017. Synthesis of magnetic graphene oxide grafted polymaleicamide dendrimer nanohybrids for adsorption of Pb (Ⅱ) in aqueous solution[J]. Journal of Hazardous Materials, 340: 407–416.
DOI:10.1016/j.jhazmat.2017.07.026
|
Nassar N N. 2010. Rapid removal and recovery of Pb (Ⅱ) from wastewater by magnetic nanoadsorbents[J]. Journal of Hazardous Materials, 184(1): 538–546.
|
Parham H, Zargar B, Shiralipour R. 2012. Fast and efficient removal of mercury from water samples using magnetic iron oxide nanoparticles modified with 2-mercaptobenzothiazole[J]. Journal of Hazardous Materials, 205: 94–100.
|
Peng X J, Luan Z K, Zhang H M. 2006. Montmorillonite-Cu(Ⅱ)/Fe(Ⅲ) oxides magnetic material as adsorbent for removal of humic acid and its thermal regeneration[J]. Chemosphere, 63(2): 300–306.
DOI:10.1016/j.chemosphere.2005.07.019
|
Qiang Z, Bao X, Ben W. 2013. MCM-48 modified magnetic mesoporous nanocomposite as an attractive adsorbent for the removal of sulfamethazine from water[J]. Water Research, 47(12): 4107–4114.
DOI:10.1016/j.watres.2012.10.039
|
Ren Y, Li N, Feng J, et al. 2012. Adsorption of Pb (Ⅱ) and Cu (Ⅱ) from aqueous solution on magnetic porous ferrospinel MnFe2O4[J]. Journal of Colloid and Interface Science, 367(1): 415–421.
DOI:10.1016/j.jcis.2011.10.022
|
Shan C, Ma Z Y, Tong M P. 2015. Efficient removal of free and nitrilotriacetic acid complexed Cd (Ⅱ) from water by poly (1-vinylimidazole)-grafted Fe3O4@SiO2 magnetic nanoparticles[J]. Journal of Hazardous Materials, 299: 479–485.
DOI:10.1016/j.jhazmat.2015.07.024
|
Shan C, Tong M P. 2013. Efficient removal of trace arsenite through oxidation and adsorption by magnetic nanoparticles modified with Fe-Mn binary oxide[J]. Water Research, 47(10): 3411–3421.
DOI:10.1016/j.watres.2013.03.035
|
谢超然, 王兆炜, 朱俊民, 等. 2016. 核桃青皮生物炭对重金属铅, 铜的吸附特性研究[J]. 环境科学学报, 2016, 36(4): 1190–1198.
|
姚超, 刘敏, 李为民, 等. 2010. 凹凸棒石/氧化锌纳米复合材料对亚甲基蓝的吸附性能[J]. 环境科学学报, 2010, 30(6): 1211–1219.
|
Zhu Y, Hu J, Wang J. 2012. Competitive adsorption of Pb (Ⅱ), Cu (Ⅱ) and Zn (Ⅱ) onto xanthate-modified magnetic chitosan[J]. Journal of Hazardous Materials, 221: 155–161.
|
朱健, 王韬远, 王平, 等. 2012. 硅藻土基多孔吸附填料的制备及其对Pb2+的吸附[J]. 中国环境科学, 2012, 32(12): 2205–2212.
DOI:10.3969/j.issn.1000-6923.2012.12.014 |
张晓蕾, 陈静, 韩京龙, 等. 2013. 壳-核结构Fe3O4/MnO2磁性吸附剂的制备、表征及铅吸附去除研究[J]. 环境科学学报, 2013, 33(10): 2730–2736.
|
 2018, Vol. 38
2018, Vol. 38


