铬及其化合物被广泛应用于电镀、采矿作业、皮革鞣革、颜料制造等生产活动中(汤克勇, 1997), 这些工业活动所排放的含铬废水往往含有大量的六价Cr(Ⅵ)和三价铬Cr(Ⅲ), 在食物链中积累会导致严重的健康问题(徐衍忠等, 2002), 对我国水环境安全具有不可估量的潜在影响(李爱琴等, 2006).含铬废水具有三致毒性、难生物处理等特点, 在处理含铬废水的各种常规处理方法中, 吸附法因其高效、经济、低能耗等特点被广泛研究应用, 相较于离子交换、电渗析、化学沉淀等方法的苛刻条件, 吸附工艺的应用具有较大的灵活性和可再生性(Volesky, 2007).近年来应用于含铬废水处理中的吸附剂多为碳基吸附剂, 相较于各种无机吸附剂, 更多的活性位点和更大的比表面积使得碳基吸附剂的处理效果更为高效, 对吸附剂后续的改性过程也更为便利(Fu and Wang, 2011).在众多碳基吸附剂中, 壳聚糖作为一种新型绿色生物材料被广泛开发, 它具有良好的生物相容性和可降解性, 作为理想的生物吸附剂材料有巨大的潜力(Yong et al., 2013;张玉红等, 2012), 但其在酸性条件下易流失、机械强度低等缺点限制了壳聚糖材料在吸附工艺中的直接应用(Liu et al., 2013).因此将壳聚糖通过特殊方法改性, 改善其吸附性能、稳定性和机械强度, 以期达到便于分离、回收和再生的目的已成目前的研究热点.
本研究中, 通过共沉淀法制备磁性壳聚糖颗粒以提高壳聚糖的机械强度和耐酸性, 并利用间苯二胺对制备的磁性壳聚糖颗粒进行改性, 形成具有大量有机官能团的有机核壳结构, 制成了可再生的高效有机碳基吸附剂.以序批实验法探讨了其对Cr(Ⅵ)的吸附特性, 并通过各类分析表征方法证明了其对Cr(Ⅵ)的去除具有氧化还原和吸附反应的双重特性, 对此种吸附剂在日后含铬废水的消毒和处理提供了理论基础和实践依据.
2 材料与方法(Materials and methods) 2.1 实验材料壳聚糖(脱乙酰度>90%)购于Sigma-Aldrich公司;间苯二胺(mPD)和过硫酸钠购于阿拉丁化学试剂有限公司;铬酸钾(K2CrO4)、乙酸溶液、乙酸乙酯、三氯化铁、硫酸亚铁及纳米四氧化三铁等材料均为分析纯, 购于国药集团化学试剂有限公司.所有的含铬溶液均由铬酸钾进行配置.所用盛取含铬溶液的容器均为塑料制品, 购于无锡德凡仪器有限公司.
2.2 实验方法在研究过程中发现, 由于纳米尺度材料往往具有凝聚效应(赵永纲等, 2009;周利民等, 2006), 一开始采用的纳米尺度磁性壳聚糖的覆膜效果及后续的去除效果和回收率都不尽如人意.经过各方面权衡之后, 采用了本文使用的改进后的制备方法, 可以制备出与常见的纳米尺度磁性吸附剂相比尺度更大, 却仍具有较好的比表面积以及极佳的磁分离能力的高效吸附剂.
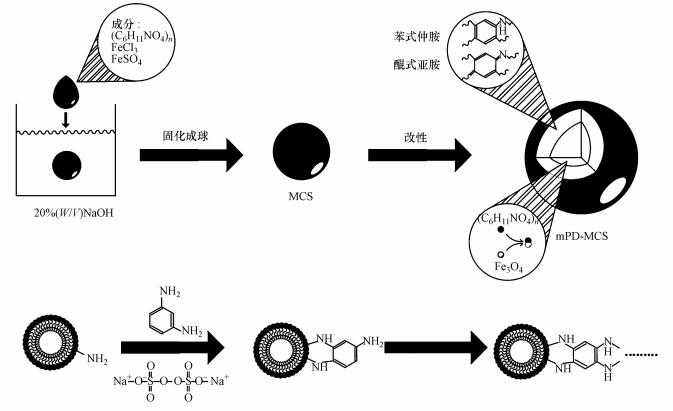 |
| 图 1 磁性壳聚糖的制备和改性 Fig. 1 Scheme of fabrication and modification |
具体步骤如下, 10 g壳聚糖在160 r·min-1和50 ℃条件下溶于400 mL 2%的乙酸溶液中, 后将7.5 g FeSO4和14.5 g FeCl3以1:2的物质的量比溶于上述壳聚糖乙酸溶液中, 混合溶液搅拌2 h使其混合均匀, 并放置0.5 h.静置后的溶液用滴定管缓缓滴入到500 mL体积分数为20%的NaOH溶液中(含10 mL乙酸乙酯, 便于成球)之后将混合液缓慢搅拌3 h, 使壳聚糖凝胶小球固化.将剩余的NaOH倒掉, 形成的微球用去离子水反复洗涤, 直到洗液呈中性为止.收集固化成型后的壳聚糖凝胶球, 在80 ℃条件下干燥12 h后贮存于干燥器中, 即为磁性壳聚糖颗粒(MCS).
将干燥后的0.5 g磁性壳聚糖颗粒在超声下, 放于500 mL水溶液中均匀扩散, 后放入冰水浴中快速搅拌.依次在搅拌条件下将相同物质的量的mPD和Na2S2O8加入壳聚糖扩散相中, 其中MCS:mPD: Na2S2O8的质量比为0.5:1.5:3.3.在0 ℃下搅拌5 h后, 收集黑色沉淀物, 经磁分离筛选磁性颗粒, 后依次使用去离子水和乙醇进行清洗3次, 烘干后置于干燥器中贮藏.
2.3 表征方法使用傅里叶红外光谱(FTIR, Nicolet 6700 spectrometer, USA)对吸附前后吸附剂表面官能团的变化进行分析.表面形态分析由扫描电镜(SEM, JSM-IT300, Japan)进行探究.同时使用了X射线衍射仪(XRD, D8 Advance diffractometer, Germany)和比表面积分析仪(BET, TriStar-Ⅱ 3020, USA)辅助分析吸附剂的物化性质.吸附剂的表面元素变化则由X射线光电子能谱仪(XPS, ESCALAB 250Xi spectrometer, USA)进行研究.
2.4 吸附序批实验取修饰后的mPD改性磁性壳聚糖颗粒进行pH序批吸附试验, pH变化范围为2~10, 将0.05 g mPD改性磁性壳聚糖颗粒样品颗粒加入到50 mL 200 mg·L-1的含铬溶液中, 置于100 mL塑料锥形瓶中.后将混合液放入恒温摇床中(25±1) ℃在160 r·min-1下吸附24 h.之后将溶液用0.22 μm的滤膜注射器过滤, 测定溶液中Cr(Ⅵ)的浓度.动力学批次实验步骤为, 投加0.05 g mPD改性磁性壳聚糖颗粒样品颗粒于100 mL塑料锥形瓶中, 加入50 mL Cr(Ⅵ)溶液.调节溶液的pH至3左右, 反应温度为(25±1) ℃, 设置取样点为10 min、20 min、30 min、1 h、2 h、3 h、4 h、6 h、8 h、12 h和24 h.等温线测定步骤为, 设定初始铬浓度范围为200~1000 mg·L-1, 梯度为100 mg·L-1.将0.05 g mPD改性磁性壳聚糖颗粒加入到50 mL 200~1000 mg·L-1的铬溶液中.后将混合液放入恒温摇床中(25±1) ℃在160 r·min-1下吸附24 h.pH控制为3.滤液中Cr(Ⅵ)的浓度是利用紫外可见分光光度计(UV-754, 中国上海)测量Cr(Ⅵ)与1, 5-二苯基卡巴肼的络合物在540 nm处的最大吸收波长来确定的(GB /T7467—1987)(祝琳琳, 2012).所有实验的pH是通过加入少量的浓硝酸或氢氧化钠溶液来进行调整的.在不同竞争离子对Cr吸附效果的影响试验中, 分别使用KNO3、Ca(NO3)2和Mg(NO3)2配制一定浓度的贮备液.在Cr贮备液中分别加入适量的不同离子贮备液, 并用去离子水按所需浓度将贮备液稀释.
为了评估吸附剂的实用性和稳定性, 同时进行了吸附-解吸实验.取吸附Cr(Ⅵ)达到饱和的修饰的mPD改性磁性壳聚糖颗粒0.05 g, 用1 mol·L-1的盐酸处理1 h.之后将脱附后的样品颗粒用去离子水冲洗干净, 烘干后再次装入50 mL 200 mg·L-1的铬溶液中, 置于100 mL塑料锥形瓶中.后将混合液放入恒温摇床中(25±1) ℃在160 r·min-1下摇动24 h.以上这个过程重复6遍.
3 结果和讨论(Results and discussion) 3.1 制备和改性如图 2所示, 通过XRD分析吸附剂的晶体结构, 可明显发现改性前后的磁性壳聚糖表现出和四氧化三铁类似的特征峰, 即18.3°、30.1°、35.5°、43.1°、53.4°、57.0°和62.6°等处分别对应于四氧化三铁为(111)、(220)、(311)、(400)、(422)、(511)和(440)的晶面指数的特征峰(Wang et al., 2013).说明磁性壳聚糖中四氧化三铁的结晶度较好, 复合材料具备有四氧化三铁的磁性等特殊性质, 且改性过程也并未对四氧化三铁的结晶结构产生较大影响, 所得到的吸附剂均为磁性颗粒.
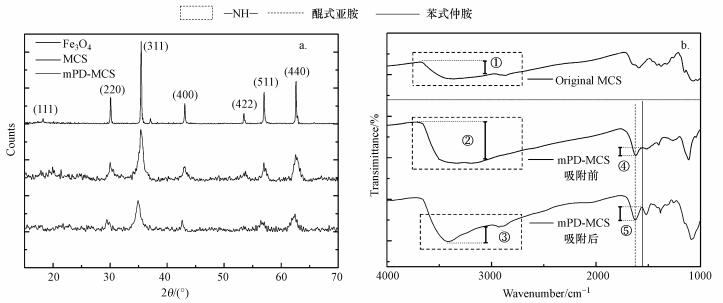 |
| 图 2 改性前后吸附剂的XRD(a)和FTIR(b)图像 Fig. 2 XRD(a) and FTIR (b)of original adsorbent and modified adsorbent |
通过FTIR观察磁性壳聚糖颗粒改性前后表面的官能团变化.图 2b为原始磁性壳聚糖颗粒和mPD改性磁性壳聚糖颗粒及吸附后mPD改性磁性壳聚糖颗粒的傅里叶红外光谱图.从图中可以看到4个明显的吸收峰, 分别为3000~3500、1700、1580和1260 cm-1.处于3000~3500 cm-1之间的宽峰属于—NH—的伸缩振动区, 1700、1580和1260 cm-1处分别为醌型亚胺、苯式仲胺和C—N键的伸缩振动吸收峰(Zhang et al., 2011;Zhang et al., 2013).
比较原始磁性壳聚糖颗粒和改性后磁性壳聚糖颗粒的FTIR图谱, 明显可以发现, —NH—的伸缩振动区的峰值在改性后得到了大幅增强(比较①和②), 由此可以得出, 改性后磁性壳聚糖颗粒表面接枝了大量氨基功能基团, 改性成功.另比较1700和1580 cm-1处, 即醌型亚胺、苯式仲胺的振动吸收峰, 可以发现未改性之前, 磁性壳聚糖颗粒表面此处的峰值并不明显, 而改性后醌型亚胺、苯式仲胺得到了一定程度的增加, 进一步说明mPD改性磁性壳聚糖颗粒成功, 并且以聚合物形式接枝在磁性壳聚糖颗粒表面, 丰富了磁性壳聚糖颗粒表面的功能基团.
如图 3所示, 通过SEM对改性前后磁性壳聚糖进行表面形态学分析, 图 3a中原始磁性壳聚糖表面存在由壳聚糖成分组成的无定型的絮状有机层, 且排列稀疏无法覆盖整个球体, 其黑色阴影部分即四氧化三铁组分仍占据表面较大空间.通过比较改性后的SEM图像(图 3b), 可明显发现改性后颗粒表面附着了一层形态更为紧凑的聚合物, 呈颗粒堆叠状, 进一步说明通过聚合反应, 间苯二胺及其聚合物成功附着在颗粒表面, 形成具有一定厚度的有机壳结构(Yu et al., 2013a).
 |
| 图 3 改性前后磁性壳聚糖的SEM图像 (a.原始, b.改性后, 倍率均为×2000) Fig. 3 SEM of original adsorbent and modified adsorbent |
如表 1所示, 由BET分析可知, 改性后的磁性壳聚糖的比表面积和平均孔径相较于原始颗粒有了较大的提高, 这说明了改性过程不但接枝了大量有机官能团, 且产生的有机壳结构显著改善了颗粒的表面形态结构, 有助于颗粒与污染物的充分接触, 改善其去除效果.
| 表 1 改性前后磁性壳聚糖的比表面积和平均孔径 Table 1 BET surface and average pore volume of original adsorbent and modified adsorbent |
将经mPD改性后的磁性壳聚糖颗粒应用于吸附试验, 并以原始磁性壳聚糖作为对照.如图 4所示, 在pH小于4时, mPD改性磁性壳聚糖的去除量在Cr(Ⅵ)的初始浓度为200 mg·L-1和100 mg·L-1时分别稳定在145 mg·g-1和85 mg·g-1左右, 当pH=4时, 可以发现去除量发生了小幅的波动, 这归因于重金属形态随着pH的变化而发生改变(赵堃等, 2006), 六价铬形态在此pH附近由Cr2O72-转化为CrO42-, 当pH持续上升至碱性环境后, 可发现去除量急剧降低至16 mg·g-1左右.分析原因是, 处于低pH环境时, 接枝在磁性壳聚糖颗粒表面壳结构上的大量含氮官能团由于质子化作用而带有正电荷, 此时由于电性力的作用有利于与Cr2O72-发生吸附作用, 随着pH的增大, 大量质子化基团逐渐去质子化, 由带有负电荷的游离OH-裹挟, 此时CrO42-不易与活性位点接触, 故去除效果大幅降低(Hamed et al., 2016;Wang et al., 2015).相似的趋势也出现在原始磁性壳聚糖颗粒的曲线上, 而其去除量相较于改性后小, 这是由于未改性颗粒表面的含氮活性官能团较少, 比表面积也较小所导致的.吸附反应后, 溶液的pH有小幅的升高, 这说明吸附过程中含氮官能团与溶液中游离的H+产生作用, 这进一步说明质子化过程的存在.由此可知, 低pH环境下导致的含氮基团质子化过程有助于mPD改性磁性壳聚糖对于Cr(Ⅵ)的去除, 由于Cr(Ⅵ)的重金属形态和含氮基团质子化过程受pH制约, pH对于mPD改性磁性壳聚糖颗粒对Cr(Ⅵ)的去除有较大的影响, pH < 4时去除效果最佳.
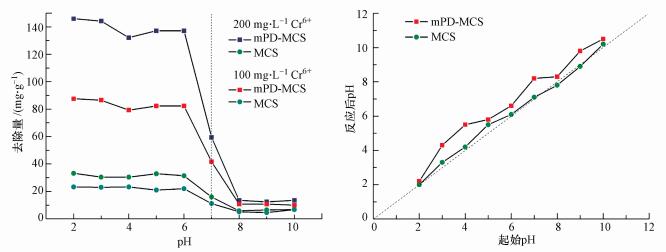 |
| 图 4 去除量随pH变化的改变及反应后pH的变化 Fig. 4 The adsorption of Cr(Ⅵ) under different pH and the change of pH after adsorption |
为了对吸附过程进行动力学研究, 采用拟二级动力学模型对吸附过程进行拟合.拟二级动力学模型适用于存在饱和位点的反应, 表达了多重吸附机理的复合效应, 被广泛应用于重金属吸附领域(Lecca, 2013).拟二级动力学模型描述如式(1)所示:
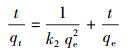
|
(1) |
式中, t为反应时间(min), qt为吸附过程中的t时刻的吸附量(mg·g-1), K2为拟二级动力学常数.
由图 5可知, 由于颗粒表面存在大量吸附位点, 反应初期原始磁性壳聚糖和改性后磁性壳聚糖的曲线斜率较大, 后期由于吸附位点的逐渐饱和, 斜率逐渐趋于平缓, 直至吸附达到平衡.另外从qt-t图中也可发现, mPD改性磁性壳聚糖颗粒的达到吸附平衡所需时间明显较原始磁性壳聚糖颗粒更长, 这归因于其相较于未改性颗粒更强的吸附能力, 另由于改性颗粒所具有大量的活性位点和官能团, 吸附过程延续了较长时间, 这归因于颗粒核壳结构的阻隔和吸附质向深层次的扩散.
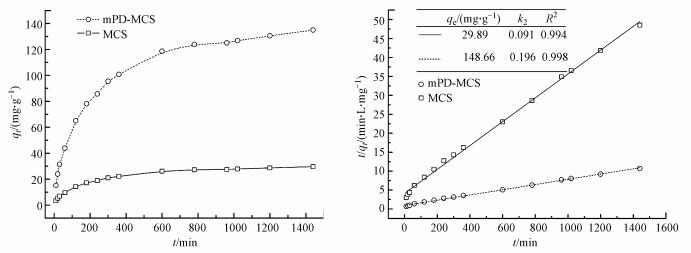 |
| 图 5 伪二级动力学模型拟合 Fig. 5 Pseudo second-order fitting of original MCS and mPD-MCS |
拟合结果如图中数据所示, 可看出改性前后的磁性壳聚糖颗粒的平衡吸附量分别为29.89 mg·g-1和148.66 mg·g-1, 且拟二级动力学模型的拟合可决系数R2都大于0.99, 拟合程度较为良好.
3.4 等温线拟合由吸附等温线来描述吸附剂与吸附质之间的相互作用, 模型的拟合具有可以进一步了解吸附剂与吸附质的作用力关系, 对界面上分子的存在形态进行一定的推测等作用.选取Langmuir(2)、Freundlich(3)和Redlich-Peterson(4) 3种模型对Cr(Ⅵ)吸附过程进行拟合(王建龙, 2010), 其相关公式如下所示.
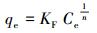
|
(2) |

|
(3) |
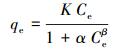
|
(4) |
式中, Ce为溶液中检出的吸附质平衡浓度(mg·L-1), qe为吸附剂的平衡吸附量(mg·g-1), qm为吸附剂的饱和吸附量(mg·g-1), KF、KL和K分别为Langmuir、Freundlich和Redlich-Peterson模型中与吸附容量有关的平衡常数.
Langmuir模型假定吸附剂表面均匀, 吸附质之间没有相互作用, 即吸附只发生在吸附剂的外表面的吸附过程, 由Langmuir模型可得出吸附剂的最大吸附量;Freundlich模型既可以应用于单层吸附, 也可以应用于不均匀表面的吸附情况;Redlich-Peterson模型是Langmuir模型和Freundlich模型的综合, 表明吸附过程是一个复合过程.各项拟合数据如图 5所示, 可知mPD改性磁性壳聚糖颗粒的吸附过程更符合Redlich-Peterson的描述, 说明其对Cr(Ⅵ)的去除过程不仅仅包含范德华力、静电引力、氢键、配位结合等吸附作用, 还包括了氧化还原过程(Foo and Hameed, 2010), 即mPD改性磁性壳聚糖颗粒对Cr(Ⅵ)的去除包含了氧化还原和吸附的双重作用.
而由Langmuir模型的qm可知, mPD改性磁性壳聚糖颗粒对Cr(Ⅵ)的最大去除量可达212.21 mg·g-1, 与已经报道的很多磁性颗粒对Cr(Ⅵ)的去除效果相比较, mPD改性磁性壳聚糖颗粒具有高效持久的吸附性能, 体现出其具有良好的研究前景和使用价值.
3.5 吸附机理分析由图 2b中比较吸附前与吸附后mPD改性磁性壳聚糖颗粒的FTIR图谱, 可以发现—NH—的伸缩振动区的峰值在吸附后有了明显的下降(比较②和③), 说明mPD改性磁性壳聚糖颗粒与六价铬发生作用时氨基有了明显的消耗, 在二者反应时扮演了很重要的角色.通过观察1700和1580 cm-1处, 即醌型亚胺、苯式仲胺的振动吸收峰, 发现④和⑤处的高度差距有了一定程度的变化, 反应后醌型亚胺有了一定程度的增加而苯式仲胺的量相对地有了降低, 可以得出结论, Cr(Ⅵ)在与mPD改性磁性壳聚糖颗粒表面的含氮基团发生吸附作用的同时会与其发生氧化还原作用, 吸附反应的进行伴随着氧化还原反应.
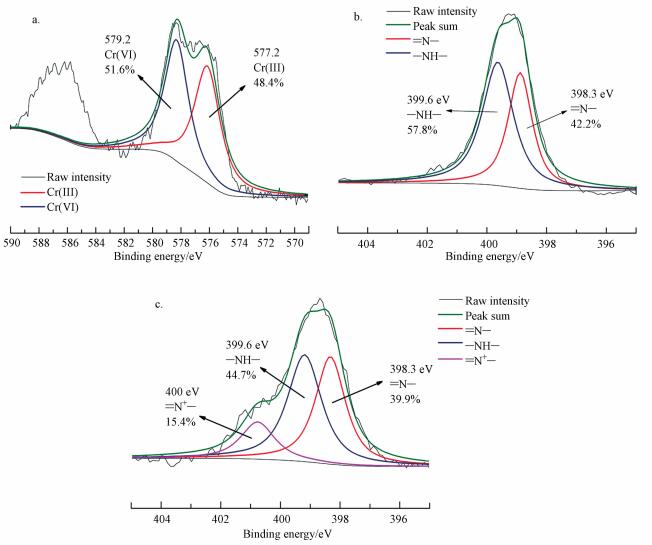
图 1b为吸附前和吸附后的mPD改性磁性壳聚糖颗粒的X射线光电子能谱图, 图 6a表明了吸附后mPD改性磁性壳聚糖颗粒样品表面Cr元素的组成形态, Cr(Ⅵ)和Cr(Ⅲ)的XPS典型吸收峰结合能分别为579.2 eV和577.2 eV(Yu et al., 2013a), 经过拟合后可发现, 在mPD改性磁性壳聚糖颗粒表面的Cr(Ⅵ)和Cr(Ⅲ)物质的量比分别为51.6%和48.4%.Cr(Ⅵ)、Cr(Ⅲ)的存在是由于mPD改性磁性壳聚糖颗粒表面的含氮基团对Cr的吸附作用, Cr(Ⅲ)的出现进一步说明了mPD改性磁性壳聚糖颗粒表面的含氮官能团对Cr(Ⅵ)具有一定的还原作用.
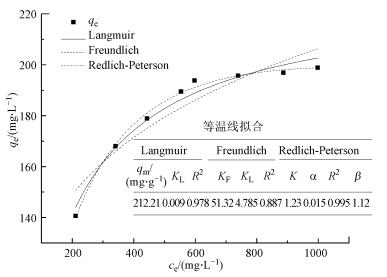 |
| 图 6 mPD改性磁性壳聚糖的吸附等温线拟合 Fig. 6 Isotherm modeling fitting of mPD-MCS |
| 表 2 相关磁性吸附剂对Cr(Ⅵ)的去除能力 Table 2 List of Cr(Ⅵ) Removal Performance of Magnetic Materials |
图 6b和6c表明了吸附前后含氮官能团的变化, —NH—和=N—的XPS典型吸收峰结合能分别为399.6 eV和398.3 eV(Bayramoğlu and YakupArica, 2008), 其中—NH—和=N—分别属于苯式仲胺和醌型亚胺的组成部分.比较吸附前后官能团的变化, 可明显发现—NH—和=N—的摩尔比由57.8%和42.2%降至44.7%和39.9%, 且在400.1 eV和401.2 eV处出现了新的峰, 经分析后其分别属于=N+—和—NH3+, 即质子化后的含氮基团.=N+—和—NH3+是由于酸性条件下质子与含氮基团的结合而产生的, 这部分解释了—NH—和=N—的减少, 而=N+—和=N—的摩尔比的总量明显大于吸附反应之前, 这证实了Cr(Ⅵ)和—NH—发生氧化还原反应生成了=N+—和=N—.而=N+—和—NH3+的产生, 显然有助于其与Cr(Ⅵ)在酸性条件下的形态, 即Cr2O72-或HCr2O7-, 由于电性作用力而接触乃至发生吸附反应.可得出结论, mPD改性磁性壳聚糖颗粒对Cr(Ⅵ)具有还原和吸附的双重作用, 且两种作用相辅相成.
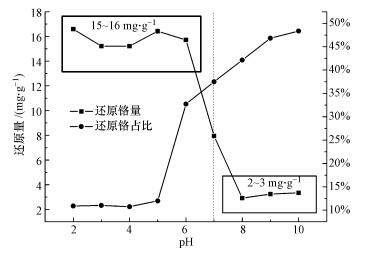
3.6 pH变化对氧化还原过程的影响图 7显示了不同pH条件下上清液中检出Cr(Ⅲ)的量.结果表明, pH范围由2到6即酸性条件下变化时, 上清液中检出的被还原的游离的Cr(Ⅲ)几乎不变.随着pH值的增加, 到了碱性至中性环境下, Cr(Ⅵ)的还原量急剧下降, 当pH在8~10左右时, 仅仅只有2~3 mg·g-1的还原能力.因此可以得出结论, 酸性条件不仅影响了mPD改性磁性壳聚糖颗粒对Cr(Ⅵ)的吸附, 也对mPD改性磁性壳聚糖颗粒对Cr(Ⅵ)的还原作用产生了一定作用.不同pH值下, Cr(Ⅵ)和各类含氮基团的不同存在形式会显著影响其在颗粒表面的结合和氧化还原反应.在酸性条件下, mPD改性磁性壳聚糖颗粒表面质子化的含氮基团具有正电荷属性, 此时Cr(Ⅵ)的主要存在形式为Cr2O72-或HCr2O7-, -NH3+等基团与铬酸根阴离子之间的正负电荷的相互作用, 提高了其接触的几率, 间接对还原效果进行了强化.而在碱性条件下, 氨基不再具备有正电荷属性, 甚至会去质子化具有负电荷属性, 而此时Cr(Ⅵ)会以CrO42-形式存在, 去质子化的氨基与CrO42-之间的静电排斥力会阻碍两者的接触, 从而降低了还原效果.而一些原始状态的含氮基团始终会对Cr(Ⅵ)具有还原作用, 所以mPD改性磁性壳聚糖颗粒始终具有一定的还原能力.由图中可以看出, 还原去除的Cr(Ⅵ)随着pH的升高而升高, 可以得出结论, pH升高对mPD改性磁性壳聚糖颗粒吸附能力的影响大于对其还原能力的影响.
 |
| 图 7 对吸附前后mPD改性磁性壳聚糖颗粒的XPS分析 Fig. 7 XPS spectra of mPD-MCS before and after adsorption |
 |
| 图 8 溶液中检出的Cr(Ⅲ)和还原铬占总去除量的百分比 Fig. 8 Amount and ratio of Cr(Ⅲ) in solution |
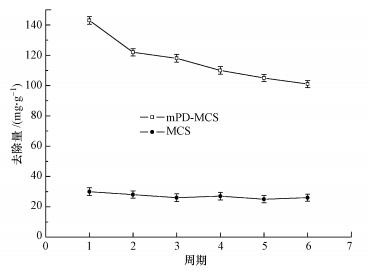
研究中采用1 mol·L-1的盐酸溶液作为解吸剂, 利用液相环境中高浓度的游离H+可将吸附于吸附剂表面的重金属置换出来, 从而完成吸附剂的再生过程(Wang et al., 2015).吸附-解吸实验过程重复6次, 以原始磁性壳聚糖颗粒作为参考.结果显示, mPD改性磁性壳聚糖的去除量始终保持在100 mg·g-1以上, 具有良好的再生能力.
 |
| 图 9 吸附-解吸实验 Fig. 9 Desorption and regeneration |
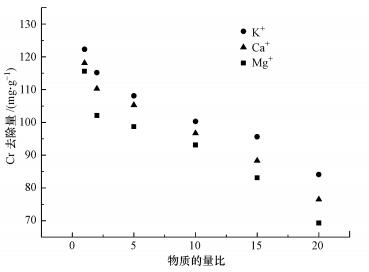
研究中以100 mg·L-1的Cr(Ⅵ)溶液作为基准, 在pH为3条件下分别加入一定比例的离子进行竞争吸附试验.结果显示二价碱金属离子Ca2+和Mg2+对mPD改性磁性壳聚糖吸附Cr(Ⅵ)的影响明显大于K+, 这是由于Ca2+和Mg2+具有更强的水合作用, 在吸附剂表层会形成阻碍吸附反应的水合层, 阻碍Cr(Ⅵ)与吸附位点的接触.由于K+、Ca2+和Mg2+的加入, 改变了吸附剂表面的电荷分布, 对吸附产生了一定的削弱, 但当竞争离子与Cr(Ⅵ)的物质的量比达到20时, 吸附剂仍表现出了60%的吸附性能, 上述结果表明, mPD改性磁性壳聚糖对Cr(Ⅵ)具有良好的选择性.
 |
| 图 10 竞争吸附实验 Fig. 10 Competitive adsorption experiments |
1) 使用改进后的方法制备了具有良好颗粒形态的磁性壳聚糖颗粒并使用mPD对其进行改性, 改性过程中由于mPD和其聚合物在颗粒表面的接枝和聚合, 形成了一层含有大量含氮官能团的有机壳结构, 并且有效改善了原始磁性壳聚糖颗粒的比表面积和吸附位点数量.
2) 在吸附实验中, 酸性条件下mPD改性磁性壳聚糖颗粒表现出持续高效的吸附性能, 其对Cr(Ⅵ)的去除由相辅相成的氧化还原反应和吸附过程混合推动, 最大吸附量可达可观的212.21 mg·g-1, 比很多新型磁性吸附剂更为有效.
3) 通过对mPD改性磁性壳聚糖颗粒去除Cr(Ⅵ)的机理进行分析可知, 质子化的含氮官能团在酸性条件下对Cr(Ⅵ)同时具有还原和吸附行为, 且还原和吸附起协同作用.
4) 经过1 mol·L-1的盐酸解吸再生6个周期后, 仍具有100 mg·g-1以上的吸附量, 说明其耐用和容易再生的优良特性.此外, 竞争吸附试验证明了mPD改性磁性壳聚糖颗粒具有较为良好的选择吸附性.
Bayramoğlu G, Yakup Arica M. 2008. Adsorption of Cr(Ⅵ) onto PEI immobilized acrylate-based magnetic beads:Isotherms, kinetics and thermodynamics study[J]. Chemical Engineering Journal, 139(1): 20–28.
DOI:10.1016/j.cej.2007.07.068
|
Chen G, Qiao C, Wang Y, et al. 2014. Synthesis of magnetic gelatin and its adsorption property for Cr(Ⅵ)[J]. Industrial & Engineering Chemistry Research, 53(40): 15576–15581.
|
Foo K Y, Hameed B H. 2010. Insights into the modeling of adsorption isotherm systems[J]. Chemical Engineering Journal, 156(1): 2–10.
DOI:10.1016/j.cej.2009.09.013
|
Fu F, Wang Q. 2011. Removal of heavy metal ions from wastewaters:a review[J]. Journal of Environmental Management, 92(3): 407–418.
DOI:10.1016/j.jenvman.2010.11.011
|
Hamed I, Ozogul F, Regenstein J M. 2016. Industrial applications of crustacean by-products (chitin, chitosan, and chitooligo-saccharides):A review[J]. Trends In Food Science & Technology, 48: 40–50.
|
Lecca P. 2013. Stochastic chemical kinetics:A review of the modelling and simulation approaches[J]. Biophysical Reviews, 5: 323–345.
DOI:10.1007/s12551-013-0122-2
|
Li Z, Li H, Liu T, et al. 2008. A novel technology for biosorption and recovery hexavalent chromium in wastewater by bio-functional magnetic beads[J]. Bioresour Technology, 99(14): 6271–6279.
DOI:10.1016/j.biortech.2007.12.002
|
李爱琴, 唐宏建, 王阳峰. 2006. 环境中铬污染的生态效应及其防治[J]. 中国环境管理干部学院学报, 2006, 16(1): 74–77.
|
Liu B, Wang D, Yu G, et al. 2013. Adsorption of heavy metal ions, dyes and proteins by chitosan composites and derivatives - A review[J]. Journal of Ocean University of China, 12(3): 500–508.
DOI:10.1007/s11802-013-2113-0
|
汤克勇. 1997. 铬的污染源及其危害[J]. 皮革科学与工程, 1997(1): 33–37.
|
Volesky B. 2007. Biosorption and me[J]. Water Research, 41(18): 4017–4029.
DOI:10.1016/j.watres.2007.05.062
|
Wang T, Zhang L, Wang H, et al. 2013. Controllable synthesis of hierarchical porous Fe3O4 particles mediated by poly(diallyldimethyl-ammonium chloride) and their application in arsenic removal[J]. ACS Appl Mater Interfaces, 5(23): 12449–12459.
DOI:10.1021/am403533v
|
Wang T, Zhang L Y, Li C F, et al. 2015. Synthesis of Core-Shell Magnetic Fe3O4@poly(m-Phenylenediamine) Particles for Chromium Reduction and Adsorption[J]. Environmental Science and Technology, 49(9): 5654–5662.
DOI:10.1021/es5061275
|
王建龙, 陈灿. 2010. 生物吸附法去除重金属离子的研究进展[J]. 环境科学学报, 2010, 30(4): 673–701.
|
徐衍忠, 秦绪娜, 刘祥红, 等. 2002. 铬污染及其生态效应[J]. 环境科学与技术, 2002, 25(s1): 8–9.
|
Yong S K, Bolan N S, Lombi E, et al. 2013. Sulfur-Containing Chitin and Chitosan Derivatives as Trace Metal Adsorbents:A Review[J]. Critical Reviews in Environmental Science and Technology, 43(16): 1741–1794.
DOI:10.1080/10643389.2012.671734
|
Yu W, Zhang L, Wang H, et al. 2013a. Adsorption of Cr(Ⅵ) using synthetic poly(m-phenylenediamine)[J]. Journal of Hazardous Materials, 260(18): 789–795.
|
Yu Z, Zhang X, Huang Y. 2013b. Magnetic chitosan-iron(Ⅲ) hydrogel as a fast and reusable adsorbent for chromium(Ⅵ) removal[J]. Industrial & Engineering Chemistry Research, 52(34): 11956–11966.
|
Zhang L, Chai L, Liu J, et al. 2011. pH manipulation:a facile method for lowering oxidation state and keeping good yield of poly(m-phenylenediamine) and its powerful Ag+ adsorption ability[J]. Langmuir, 27(22): 13729–13738.
DOI:10.1021/la203162y
|
Zhang L, Wang T, Wang H, et al. 2013. Graphene@poly(m-phenylenediamine) hydrogel fabricated by a facile post-synthesis assembly strategy[J]. Chemical Communications, 49(85): 9974–9976.
DOI:10.1039/c3cc45261a
|
张玉红, 张爱丽, 周集体, 等. 2012. Cu(Ⅱ)印迹壳聚糖交联膜的表征及其吸附热力学特性[J]. 环境科学, 2012, 33(7): 2403–2409.
|
赵堃, 柴立元, 王云燕, 等. 2006. 水环境中铬的存在形态及迁移转化规律[J]. 工业安全与环保, 2006, 32(8): 1–3.
|
赵永纲, 沈昊宇, 李勍, 等. 2009. 氨基功能化纳米Fe3O4磁性高分子吸附剂对废水中Cr(Ⅵ)的吸附研究[J]. 化学学报, 2009, 67(13): 1509–1514.
DOI:10.3321/j.issn:0567-7351.2009.13.018 |
周利民, 王一平, 刘峙嵘, 等. 2006. 羧甲基化壳聚糖-Fe3O4纳米粒子的制备及对Zn2+的吸附行为[J]. 物理化学学报, 2006, 22(11): 1342–1346.
|
祝琳琳. 2012. 分光光度法快速测定水质中六价铬含量[J]. 科技创新导报, 2012(31): 135–136.
DOI:10.3969/j.issn.1674-098X.2012.31.098 |
 2018, Vol. 38
2018, Vol. 38


