2. 四川大学水力学与山区河流开发保护国家重点实验室, 成都 610065
2. State Key Laboratory of Hydraulics and Mountain River Engineering, Sichuan University, Chengdu 610065
20世纪初, 塑料被发明并在50年代开始大量生产且逐年递增(Jambeck et al., 2015).排入水体进入大海的塑料会不断的分解成为塑料碎片, 微塑料颗粒甚至会到纳米级别(Mattsson et al., 2014), 而其具有稳定的化学性质, 可在海洋环境中存在数百年甚至数千年(Cozar et al., 2014).微塑料的分布广泛, 全球海洋中的微塑料颗粒数达到15~51万亿个, 总量在(9.3~23.6)×104 t(Van et al., 2015).在2014年, 海洋微塑料颗粒被首次列为一项重要的全球性污染问题, 并成为近年来全球范围一个新的研究热点(周倩等, 2015).微塑料颗粒在海洋中的分布并不均匀, 在大西洋上观察到微塑料颗粒的浓度仅为0.5 MP·L-1, 但在瑞典的沿海水域上发现的微塑料颗粒浓度却达到了1000 MP·L-1(Enders et al., 2015).此外, 在南北极等少有人居住的区域也发现了微塑料的存在, 且2014年在北极发现的微塑料颗粒的浓度是2005年的2.4倍(Amélineau et al., 2016;简敏菲等, 2017), 同时, 微塑料也在内陆的湖泊中被发现, 包括西藏、潘阳湖等(Zhang et al., 2016).微塑料粒径小, 易与海洋生物发生相互作用(刘强等, 2017).有研究表明, 鲈鱼的仔鱼暴露在含有高浓度微塑料的水体中, 其孵化率、行为能力、生长率、死亡率和嗅觉均会受到影响(Ooan and Peter, 2016), 斑马鱼暴露在含有微塑料颗粒的水体后, 其鳃组织也发生了病变(Chen et al., 2011).微塑料颗粒会随着水流经过鱼鳃, 有研究表明当寄生虫感染鱼鳃会导致鱼鳃上体液免疫和细胞免疫的基因表达产生变化(Christoffersen et al., 2016), 但对于微塑料这种非寄生生物的物质是否会对鱼鳃产生影响暂没有相关的研究.本文将虹鳟暴露在含有不同粒径大小的微塑料颗粒的水体中, 研究其鱼鳃免疫基因的表达是否会发生变化.选取的微塑料颗粒没有微生物附着且形状为球形, 以避免不规则的形状会导致鱼鳃出现物理损伤.国内外缺少微塑料颗粒对鱼类的影响研究, 因此本文的实验结果可以为该领域未来研究积累科学数据.
2 材料与方法(Materials and methods) 2.1 实验鱼实验的虹鳟在丹麦博恩霍尔姆岛上孵化并一直在无菌环境下成长, 实验前将其转移到丹麦哥本哈根大学动物实验室在无菌环境下暂养大概一个月后, 随机选取体格相似的虹鳟(长度(14.4±0.3) cm, 体重(10.76±0.09) g)进行实验.暂养的水箱体积约为600 L, 全天24 h充氧, 每天投食1次并吸污换水1次, 实验期间水温维持在7.5 ℃.
2.2 微塑料颗粒实验中采用的0.2、1、20、40和90 μm的微塑料颗粒采购自德国的microParticles GmbH公司, 为聚苯乙烯.不同直径微塑料颗粒在实验中的浓度为2×105 MP·L-1.在配置含有微塑料颗粒的水体时, 需要采用吐温20对微塑料颗粒进行预处理, 吐温20是一种表面活性剂, 又称为聚氧乙烯失水山梨醇单月桂酸酯.在本实验中, 吐温20用来分离微塑料颗粒, 以防止微塑料颗粒的聚集.将微塑料颗粒放置在0.1%的吐温20中1 min, 然后用离心机离心, 移除上清液, 最后将微塑料混合到水中产生2×105 MP·L-1的微塑料颗粒水体.随机取5次0.1 mL液体, 用显微镜观察微塑料颗粒的数量以确认微塑料颗粒水体的浓度.
2.3 实验方法进行实验的水箱为5 L, 水箱外用黑色塑料袋包裹以防止外界刺激对虹鳟造成影响.对于每种粒径大小的微塑料颗粒, 设置2个平行组, 每组6条虹鳟, 其中1条取鱼鳃观察微塑料的附着情况, 剩下5条检测其免疫基因的表达.实验鱼暴露2 h后取出并放入500 mg·L-1的MS222中使鱼死亡, 然后称量实验鱼的体重体长.
解剖虹鳟以观察微塑料在鱼鳃中的附着情况.打开鳃盖, 将鱼鳃(从内到外以及左右总共8片鱼鳃)取出并分别放在载玻片上, 在光学显微镜下观察, 由于0.2 μm和1 μm的微塑料颗粒难以在光学显微镜和电子显微镜下观察, 因此实验中只观察了20、40和90 μm的微塑料颗粒.
将取到的虹鳟鱼鳃放入RNAlater, 保持新鲜组织样品中的RNA免受降解, 然后将组织样品放入4 ℃的冰箱内24 h后再放入-20 ℃的冰柜中保存.样品取出解冻后进行RNA的提纯, DNA的移除, 将RNA反转录成cDNA, 最后采用AriaMx荧光定量PCR仪进行多聚酶链反应扩增, 过程为95 ℃变性15 min, 94 ℃ 30 s和60 ℃ 30 s循环40次, 其中内参基因为ELF-1α.最终免疫基因的表达量用2-ΔΔCt的方法进行分析(Livak and Schmittgen, 2001), 测试的基因及其引物如表 1所示.
| 表 1 qPCR引物和探针 Table 1 Primers and probes applied for qPCR |
在虹鳟鳃上附着的微塑料颗粒分布采用非参数Kruskall-Wallis检测, 不同工况下的差异采用one way ANOVA检验.而对于免疫基因的表达, 采用t检验对实验组和对照组的结果进行差异性分析, 只有存在显著性差异才可以认为该基因的表达有变化.对于所有差异性分析, 显著性水平为p<0.05.
3 结果与分析(Results and analysis) 3.1 鱼鳃上的附着经过2 h的暴露, 在20、40和90 μm粒径下均发现微塑料颗粒附着在鳃上, 如图 1所示.
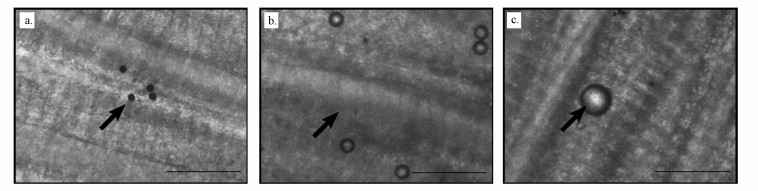 |
| 图 1 附着在鳃上的微塑料颗粒(a. 20 μm, b. 40 μm, c. 90 μm) Fig. 1 Location of microplastic particles in rainbow trout gills (a. 20 μm, b. 40 μm, c. 90 μm) |
观察并计算从内到外每片鱼鳃上的分布如图 2所示, 对于90、40和20 μm微塑料颗粒, 从表层鳃片到最内部的分布为20:21:13:18, 145:146:228:158和125:145:201:174.可以看到微塑料颗粒已经进入最里面的鳃片上, 且各鳃片上的分布较为均匀, 并没有显著性差异.通过计算两条鱼上微塑料的附着总颗粒数, 发现不同粒径的微塑料颗粒在虹鳟鱼的附着情况不同, 其中90 μm粒径的微塑料颗粒附着程度较少, 但经过2 h的暴露还是有72颗微塑料颗粒附着在虹鳟的鳃上;40 μm粒径的微塑料附着程度最高, 共发现1354颗;而对于20 μm粒径的微塑料颗粒, 共有645颗附着在虹鳟的鱼鳃上.
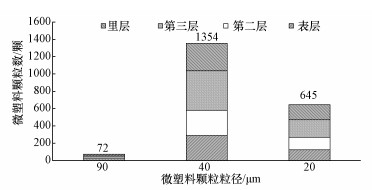 |
| 图 2 不同粒径微塑料颗粒在鳃上的附着情况 Fig. 2 Number and location of microplastic trapped in gill |
不同基因在虹鳟体内的表达有所不同, 计算2-Ct得到每种基因在虹鳟体内的含量并以表达量最小的IL-6为基准, 得到不同基因的表达量对比如图 3所示.其中表达量最高的SAA是表达量最低的IL-6的599倍.其中60条实验鱼均有表达了IgM、IL-1b和TNF-α;59条实验鱼表达了S100A1;58条实验鱼表达了SAA和IL-8;57条鱼表达了IFN-γ;53条实验鱼表达了IgT;仅有14条实验鱼表达了IL-6.
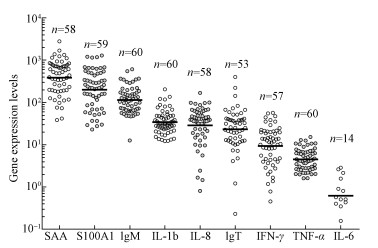 |
| 图 3 不同基因的表达程度(横线是每种基因的平均表达程度, n代表能够测出基因表达的样品量) Fig. 3 Relative immune gene expression (Horicontal bars indicate geometric means, n presents the number of sample expressed the gene) |
由图 4可知,实验组和对照组中IFN-γ、IL-1β、S100A1和SAA的基因表达具有显著性差异, 而实验组和对照组的IgM、IL-8、IgT、TNF-α和IL-6均没有显著性差异.IFN-γ基因在各实验组均表现为基因上调, 且粒径为0.2 μm和40 μm实验组的结果与对照组的结果有显著性差异.IL-1β和S100A1在各实验组均表现为下调, 对于IL-1β, 粒径为1 μm实验组与对照组具有显著性差异, 而对于S100A1, 粒径为40 μm实验组的结果与对照组有显著性差异.SAA的实验组表现为基因下调, 在1、40和90 μm实验组均有显著性差异, 特别对于40 μm和90 μm粒径实验组其差异性的显著水平为1%.
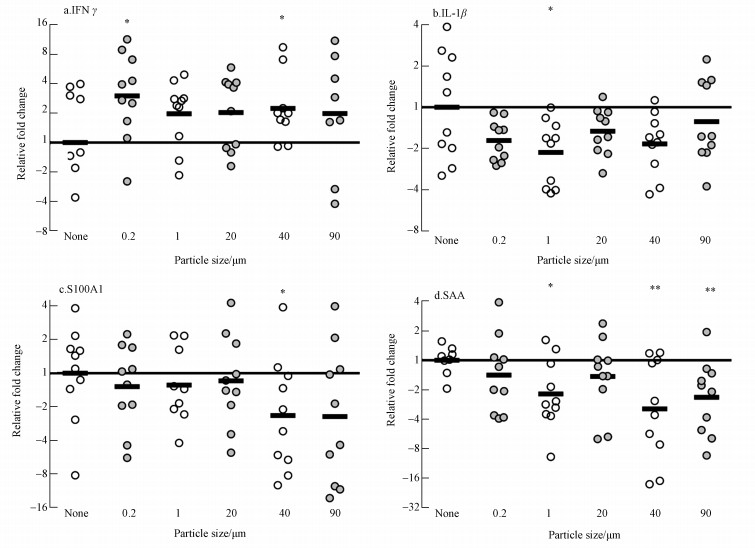 |
| 图 4 IFNγ、IL-1β、S100A1和SAA在不同粒径下的基因表达(*表示差异性显著, 显著性水平为5%, **表示差异性显著性水平为1%) Fig. 4 Expression of IFNγ, IL-1β, S100A1 and SAA under different diameters |
当虹鳟暴露在含有微塑料颗粒的水体中2 h后, 可以发现不同粒径的球形微塑料颗粒会附着在其鳃上, 且从内到外不同鳃片上均有分布, 但对于粒径较小的微塑料颗粒(20 μm和40 μm), 其附着量比粒径较大的微塑料颗粒(90 μm)的多.因此可以推测鳃片的规格及鳃片与鳃片之间的距离对附着的微塑料颗粒的粒径大小有影响.对于本文中的实验, 较小的微塑料颗粒容易随着呼吸水流流走不易附着在鳃上, 而较大的微塑料颗粒由于粒径较大, 不易进入鳃片因而附着的颗粒数较少.粒径40 μm的微塑料颗粒由于其大小对实验鱼而言适中, 因此更容易附着在虹鳟的鳃上.有研究分析3种鲱形目的鱼对微塑料颗粒的附着作用, 也发现鳃耙之间的距离会对微塑料颗粒的附着程度有影响(Collard et al., 2017), 即不同大小的鱼对不同粒径微塑料颗粒的附着作用各不相同.在海洋中, 存在的微塑料颗粒并不会是规则的圆球形, 可能会有尖锐的棱角, 同时微塑料颗粒的表面可能会有污染物或者微生物的附着, 因此海洋中的微塑料颗粒对鱼类的影响会更严重(Servizi and Martens, 1991).
虽然我们没法观测到1 μm和0.2 μm的微塑料颗粒在虹鳟鳃上的分布, 但基因检测的结果表明, 1 μm和0.2 μm的微塑料颗粒还是影响了虹鳟鳃的免疫基因的表达.实验中我们检测了当虹鳟暴露在含有不同粒径的微塑料颗粒的水体中, 其鳃上与免疫相关基因的变化, 结果表明了与炎症反应相关的基因IL-1β和S100A1均出现了轻微下调, 而SAA在大部分的实验组均出现了明显的下调趋势.值得注意的是IFN-γ在各粒径实验组均出现了上调趋势, 且在最小的微塑料颗粒0.2 μm的实验组以及附着有最多微塑料颗粒的40 μm实验组出现了明显的上调.IFN-γ是一种促炎因子, 同时该细胞因子主要是促进淋巴细胞参与细胞内病原体如病毒和肿瘤控制的免疫反应(Zou et al., 2005), 但是对于水体中的微塑料颗粒是否会激活虹鳟对病毒或肿瘤的反应, 还需要更多的研究证明.IFN-γ的上调可以说明当微塑料颗粒附着在鳃上时会引起炎症反应.同时值得注意的是, 在实验中发现暴露在微塑料颗粒中, 对病菌产生免疫反应的基因出现了下调.在炎症反应中, 促炎性细胞因子IL-1β的作用主要是诱导嗜中性粒细胞刺激S100A1的生成, 这是一种钙结合蛋白, 会让白细胞浸润.但是在本实验中鳃细胞中的IL-1β和S100A1反而下调, 这说明当微塑料颗粒附着在虹鳟鳃上时, 可能会导致虹鳟鳃的免疫细胞减少.同样的, SAA会在机体感染病毒和细菌或发生免疫反应时发生急性反应(Jensen and Whitehead, 1998;Kania et al., 2014), 它的功能是结合入侵的病菌然后保护机体对抗疾病.本实验中当虹鳟暴露在含有微塑料颗粒的水体中, SAA出现了下调, 可能是由于微塑料颗粒影响了鳃的抗病菌能力.以在体外培养的虹鳟巨噬细胞为模型, 研究显示在内毒素的作用下细胞产生了急性炎症反应, 包括IL-1β、TNF-α和IL-6上调(Teles et al., 2011), 且细胞暴露在颗粒物中, IL-1β起了显著的作用.但在我们的实验中, 这些较大的惰性微塑料颗粒物并不诱发这种反应, 反而在某些情况下, 这些光滑的和球形的微塑料颗粒的非侵略性可能会降低基因的表达.
在海洋中, 存在着不同大小及不同形状的微塑料颗粒, 同时可能会有污染物, 原生或多细胞的微生物、细菌等附着其上(Buchmann, 1988), 这会导致鱼鳃出现物理损伤以及附着的微生物的表面分子可能会刺激鱼鳃细胞(Alvarez-Pellitero, 2008).针对自然界不同形状、化学组成以及大小的微塑料颗粒对鱼类的影响研究难以同时实现, 本文通过研究不同大小的球形微塑料颗粒对虹鳟的免疫基因表达的影响, 表明微塑料颗粒会导致鱼类出现免疫反应且其程度与微塑料的大小有关, 具体的影响机制还需要更多的研究, 本文的研究结果可以为未来相关研究提供科学数据.
Alvarez-Pellitero P. 2008. Fish immunity and parasite infections:from innate immunity toimmunoprophylactic prospects[J]. Veterinary Immunology & Immunopathology, 126: 171–198.
|
Amélineau F, Bonnet D, Heitz O, et al. 2016. Microplastic pollution in the Greenland Sea:Background levels and selective contamination of planktivorous diving seabirds[J]. Environmental Pollution, 219: 1131–1139.
DOI:10.1016/j.envpol.2016.09.017
|
Buchmann K. 1988. Epidemiology of pseudodactylogyrosis in an intensive eel culturesystem[J]. Disease of Aquatic Organisms, 5: 81–85.
DOI:10.3354/dao005081
|
Chen J, Dong X, Xin Y, et al. 2011. Effects of titanium dioxide nano-particles on growth and some histological parameters of zebrafish (Danio rerio) after a long-term exposure[J]. Aquatic Toxicology, 101: 493–499.
DOI:10.1016/j.aquatox.2010.12.004
|
Christoffersen T B, Kania P W, Jørgensen L G, et al. 2016. Zebrafish Danio rerio as a model to study the immune response against infection with Ichthyophthirius multifiliis[J]. Journal of Fish Diseasese, 40(6): 847–852.
|
Collard F, Gilbert B, Eppe G, et al. 2017. Morphology of the filtration apparatus of three planktivorous fishes and relation with ingested anthropogenic particles[J]. Marine Pollution Bulletin, 116: 182–191.
DOI:10.1016/j.marpolbul.2016.12.067
|
Cozar A, Echevarria F, Gonzlezgordillo J I, et al. 2014. Plastic debris in the open ocean[C]. Procedings of the National Academy Sciences of the United States of America, 111(28): 10239-10244
|
Enders K, Lenz R, Stedmon C A, et al. 2015. Abundance, size and polymer composition of marine microplastics ≥ 10 μm in the Atlantic Ocean and their modelled vertical distribution[J]. Marine Pollution Bulletin, 100: 70–81.
DOI:10.1016/j.marpolbul.2015.09.027
|
Jambeck J R, Geyer R, Wilcox C, Siegler T R, et al. 2015. Plastic waste inputs from land into the ocean[J]. Science, 347(6223): 768–771.
DOI:10.1126/science.1260352
|
Jensen L E, WhiteheadA S. 1998. Regulation of serum amyloid a protein expression during the acute-phase response[J]. Biochemical Journal, 334: 489–503.
DOI:10.1042/bj3340489
|
刘强, 徐旭丹, 黄伟, 等. 2017. 海洋微塑料污染的生态效应研究进展[J]. 生态学报, 2017, 37(22): 7397–7409.
|
Kania P W, Chettri J K, Buchmann K. 2014. Characterization of serum amyloid A (SAA) in rainbow trout using a new monoclonal antibody[J]. Fish & Shellfish Immunology, 40(2): 648–658.
|
Livak K J, Schmittgen T D. 2001. Analysis of relative gene expression data using real- time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 25: 402–408.
DOI:10.1006/meth.2001.1262
|
Mattsson K, Ekvall M T, Hansson L A, et al. 2014. Altered behavior, physiology, and metabolism in fish exposed to polystyrene nanoparticles[J]. Environmental Science & Technology, 49: 553–561.
|
Oona M L, Peter E. 2016. Environmentally relevant concentrations of microplastic particles influence larval fish ecology[J]. Science, 353(6290): 1213–1216.
|
Servizi J A, Martens D W. 1991. Effect of temperature, season, and fish size on acute lethality of suspended sediments to coho salmon (Oncorhynchuskisutch)[J]. Canadian Journal of Fisheries & Aquatic Sciences, 48: 493–497.
|
Teles M, Mackenzie S, Boltana S, et al. 2011. Gene expression and TNF-alpha secretion profile in rainbow trout macrophages following exposure to copper and bacterial lipopolysaccharide[J]. Fish & Shellfish Immunology, 30: 340–346.
|
Van S E, Chris W, Laurent L, et al. 2015. A global inventory of small floating plastic debris[J]. Environmental Research Letters, 10: 124–126.
|
简敏菲, 周隆胤, 余厚平, 等. 2017. 鄱阳湖-饶河入湖段湿地底泥中微塑料的分离及其表面形貌特征[J]. 环境科学学报, 2017, 38(2): 579–586.
|
Zhang K, Su J, Xiong X, et al. 2016. Microplastic pollution of lakeshore sediments from remote lakes in Tibet plateau, China[J]. Environmental Pollution, 219: 450–455.
DOI:10.1016/j.envpol.2016.05.048
|
周倩, 章海波, 李远, 等. 2015. 海岸环境中微塑料污染及其生态效应研究进展[J]. 科学通报, 2015, 60: 3210–3220.
|
Zou J, Carrington A, Collet B, et al. 2005. Identification and bioactivities of interferin gamma in rainbow trout Oncorhynchus mykiss:the first Th1 type cytokine characterized functionally in fish[J]. Journal of Immunology, 175(4): 2484–2494.
DOI:10.4049/jimmunol.175.4.2484
|
 2018, Vol. 38
2018, Vol. 38


