甲烷(CH4)是仅次于CO2的第2种重要的温室气体.如何减排温室气体CH4成为了全球关注的焦点.同时, 生物脱氮是当前废水处理领域的研究热点.污水处理厂中通常通过硝化和反硝化实现生物脱氮, 而目前城镇污水普遍存在C/N比低的问题, 导致在反硝化过程中往往需要大量的外加碳源.而在污水处理厂的厌氧处理过程中会产生大量的甲烷, 如能将这部分甲烷作为碳源进行利用, 既减少了甲烷的排放, 又节省了能源的消耗.反硝化型甲烷厌氧氧化反应(Denitrifying Anaerobic Methane Oxidation, DAMO)正是可以利用甲烷作为碳源完成反硝化脱氮的过程.DAMO过程是以甲烷为电子供体和唯一碳源, 以硝酸盐或亚硝酸盐为电子受体的一种氧化还原反应.2006年, 该过程在实验室中得以证实(Raghoebarsing et al., 2006).在自然界中, 溶解于水中的甲烷主要靠甲烷氧化菌等通过生物作用得以消耗;现已发现在淡水系统、湿地系统、近海海洋生态系统中(Deutzmann et al., 2011;Luesken et al., 2011;Kojima et al., 2012;Wang et al., 2012;Han et al., 2013;Shen et al., 2013;Shen et al., 2014)均有存在可以耦合甲烷厌氧氧化作用(Anaerobic Oxidation of Methane, AOM)和反硝化作用(Denitrification)的DAMO(Denitrifying Anaerobic Methane Oxidation, 反硝化型甲烷厌氧氧化)微生物.根据系统发育分析, 研究者检测到的DAMO细菌隶属于NC10门细菌;DAMO古菌则属于甲烷厌氧氧化古菌ANME-2(Raghoebarsing et al., 2006).2017年, Wang等(2017)提出了侧流式、主流式两种DAMO反应应用于污水处理厂的设想.
目前污水处理厂进水多为低碳高氮性质, 多种化工、制药废水及垃圾渗滤液等, 都含有较高浓度的氨氮, 而高浓度的氨氮会对活性污泥中的微生物起抑制作用(郑雄柳等, 2014), 并会影响系统微生物菌群结构.目前已有研究报道高浓度氨氮对活性污泥系统中硝化细菌、厌氧氨氧化细菌等微生物具有抑制作用(Zhou et al., 2011), 但对DAMO微生物的影响及机理鲜见报道.如欲将DAMO工艺应用于废水生物脱氮, 探明氨氮对该过程的影响显得尤为重要.因此, 本文利用已经成功富集的以DAMO细菌为优势菌种的系统(以下简称DAMO细菌系统)(楼菊青等, 2016)为研究对象, 通过短期和长期试验, 从宏观和微观两个层面, 研究氨氮对DAMO过程脱氮性能、微生物菌群结构的影响, 综合考察DAMO细菌对氨氮的应激性、耐受性, 并探索其抑制机理.为促进对DAMO微生物脱氮机理的研究和完善DAMO理论的发展添砖加瓦, 为该工艺向实际工程应用推进一步.
2 试验材料与方法(Materials and methods) 2.1 材料 2.1.1 试验系统本文的试验系统是基于之前已成功富集的以DAMO细菌为优势菌种的混培物(楼菊青等, 2016).所得混培物是以淡水河道(西溪河)底泥、淡水湖泊(西湖)底泥及水稻农田土壤的混合物为接种污泥, 甲烷和亚硝酸盐为唯一碳氮源.至本试验止, 系统已稳定运行1392 d.
2.1.2 试验装置试验装置为特制的直径为7.5 cm、高度为17 cm的500 mL厌氧反应器.
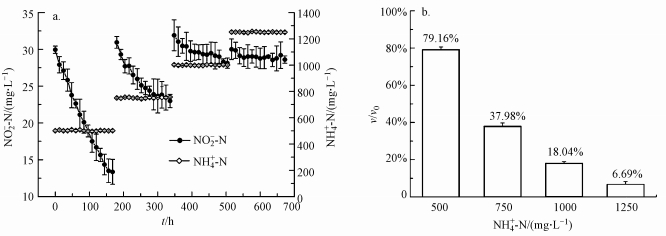
2.2 试验方法 2.2.1 短期试验方法① 不同浓度氨氮对DAMO细菌的影响:通过批式实验研究氨氮对以DAMO细菌为优势菌种系统(以下简称DAMO细菌系统)的短期影响, 设3个平行试验组和一个对照组, 试验时长7 d, 氨氮浓度梯度分别为50、250、500、750、1000、1250、1500 mg·L-1.每12 h取3 mL水样, 利用0.22 μm微孔滤膜过滤后进行三氮(氨氮NH4+-N、硝态氮NO3--N、亚硝态氮NO2--N)的测定.在最高氨氮梯度浓度试验后, 取泥水混合液10 mL进行扫描电镜分析实验.②不同pH体系下氨氮的影响:根据上述短期试验结果进行批式试验, 选取750 mg·L-1氨氮作为试验浓度.用0.1 mol·L-1 HCl或0.1 mol·L-1 NaOH分别将pH调节为6.5、6.8、7.0、7.5、7.8 5个浓度并利用pH计实时监控反应器内的pH值, 使其保持在相应的范围内, 每组试验持续7 d.取样与测定同①.当T = 27 ℃时, 不同pH体系对应的FA浓度可由公式(1)计算得到.
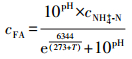
|
(1) |
式中, cFA为FA的浓度(mg·L-1);cNH4+为氨氮的浓度(mg·L-1);T为温度(℃)
2.2.3 长期试验方法氨氮对DAMO细菌的长期影响试验以短期试验结果为依据, 将长期试验分为连续的4个阶段, 每个阶段7 d, 这4个阶段的氨氮浓度按照短期试验浓度依次递增(李媛, 2014), 浓度分别为500、750、1000、1250 mg·L-1, 在28 d后取样进行高分子通量测序.
2.3 分析方法 2.3.1 常规指标测定NO3--N、NO2--N、NH4+-N测定方法参考《水和废水监测分析方法》第四版(魏复盛, 2002).
2.3.2 微生物微观形态结构分析利用扫描电镜对微生物微观形态进行特性分析.在每个阶段的短期试验过程中, 取10 mL样品, 在4000 r·min-1条件下离心5 min, 取上清液, 样品处理后用扫描电子显微镜SEM(SU8010, Hitachi)进行微生物微观形态的特性分析.
2.3.3 微生物群落结构分析提取长期试验前后污泥样品中的基因组DNA, 储于-20 ℃以下, 并利用高通量测序分析.利用上海申能博彩生物科技有限公司生产的3S柱离心式DNA抽提试剂盒进行样品DNA的提取;利用特定PCR引物进行序列扩增, 全部样本按照正式试验条件均进行3次重复实验;参照电泳初步定量结果, 将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)进行检测定量, 之后按照每个样本的测序量要求, 进行相应比例的混合;通过构建Miseq文库、Miseq测速对16S RNA序列进行测序;区分样本后, 采用RDP classifier贝叶斯算法对97%相似水平的OUT代表序列进行分类学分析, 与Silva数据库比对, 并在门、纲、属3个水平统计每个样品的群落组成.
3 结果与讨论(Results and discussion) 3.1 氨氮对DAMO细菌的短期影响 3.1.1 氨氮对以DAMO细菌脱氮性能的影响不同浓度梯度(50~950 mg·L-1)的氨氮对DAMO细菌的脱氮性能影响见图 1.其中图 1a表示不同浓度氨氮作用下, 系统内亚硝酸氮的消耗曲线, 图 1b表示不同浓度下亚硝酸氮的消耗速率与对照组的比值, 以v表示试验组亚硝酸氮的消耗速率, v0表示对照组亚硝酸氮的消耗速率.其中误差范围由标准偏差表示.
 |
| 图 1 不同浓度NH4+-N对DAMO细菌脱氮性能的影响 (a.NO2--N消耗曲线, 以N计;b.试验组与对照组的比值) Fig. 1 NO2--N consumption and nitrogen removal performance in DAMO bacteria System with different NH4+-N concentration (a. NO2--N consumption curve; b.The ratio of nitrogen removal performance between experimental and control) |
当控制pH实验条件为7.0时, 通过公式(1)计算可知FA = 4.879 mg ·L-1, 由图 1可见, 在一定范围内, DAMO细菌脱氮性能随着氨氮浓度的增加而降低.由图 1a可知, 在空白对照组中, 其亚硝酸盐初始浓度为30.19 mg·L-1, 7 d平均消耗速率为2.92 mg·L-1·d-1.在50、250 mg ·L-1氨氮作用下, 系统的亚硝酸氮的消耗速率分别为2.94 mg ·L-1·d-1和2.96 mg·L-1·d-1.相比于对照组, 消耗速率略有上升, 但经过单因素方差分析后可知, 其p值为0.65, 大于0.05, 说明3组数据无显著性差异, 从而表明在50、250 mg·L-1氨氮作用下, 系统的脱氮性能并未出现抑制或促进现象(故该两组数据未在图 1a中表示).而当氨氮浓度增加至500 mg·L-1时, 7 d平均亚硝酸盐消耗速率下降为2.42 mg·L-1·d-1, 其消耗速率为对照组的82.71%.当氨氮浓度为750 mg·L-1时, 7 d平均消耗速率与对照组相比, 下降了43.15%.当在1000 mg·L-1氨氮抑制条件下, 经7 d的消耗后, 消耗速率下降了56.20%.在1250 mg·L-1氨氮抑制条件下, 亚硝酸盐7 d平均消耗速率仅为对照组的27.27%.Dapena-Mora等的研究认为针对厌氧氨氧化细菌, 氨氮的IC50为770 mg·L-1, 与本试验结果相近(Dapena-Mora A, 2007), 可见, DAMO细菌对高氨氮废水表现出较强的抗冲击负荷的能力.这有利于DAMO细菌系统在含高氨氮废水处理厂中的应用.
3.1.2 不同pH条件下氨氮对以DAMO细菌为优势菌种系统的影响根据3.1.1节的短期试验结果, 选取750 mg·L-1的氨氮浓度进行试验.当T=27 ℃, 不同pH体系下, 对应的FA的浓度可由公式(1)计算得到, 计算结果见表 1.
| 表 1 不同pH值时FA的浓度 Table 1 FA concentration under different pH |
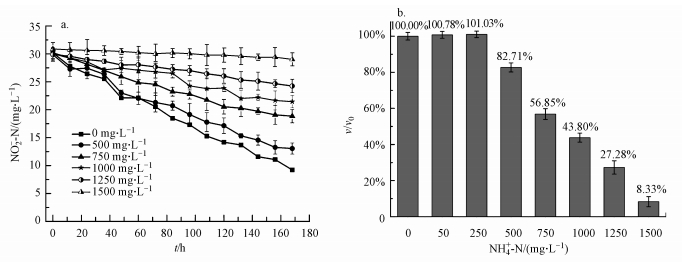
图 2为不同pH时, DAMO细菌系统受氨氮影响时的脱氮性能.以pH = 7.0为对照组, 各pH条件下脱氮速率与该条件下脱氮速率比值为纵坐标, 得图 2b, 由图 2可知, 在碱性条件下(pH = 7.0、7.5、8.0), 同样为750 mg·L-1的氨氮, 随着pH升高, FA升高, 脱氮速率下降, 当pH=8.0时, 其FA浓度为46.09 mg·L-1, 此时脱氮速率不到对照组的1/2, 且对pH=7.0、7.5、8.0条件下所得3组数据进行单因素方差分析, 其p值为9.93×10-5, 远小于0.01, 说明这3组数据之间有极显著差异;而在酸性条件下(pH = 6.5、6.8、7.0), 虽然FA值随着pH值的升高而升高, 但通过单因素方差分析发现脱氮速率与FA值并无显著性差异.这说明在碱性条件下, 氨氮对系统的抑制效果与FA值有关, FA是限制性抑制因子, 该结果与氨氮对其他微生物抑制的大多数研究结果相吻合(Anthonisen, 1976);在酸性条件下, 抑制效果与FA的浓度无关, 认为离子化氨氮应是真正的抑制因子.该结果与之前部分研究相吻合, 当溶液呈酸性(pH < 7.0)时, 厌氧氨氧化菌、甲烷菌、反硝化菌等微生物活性受到抑制;甲烷菌(Lay, 1997)等的活性取决于离子化氨氮NH4+的浓度, 而不是质子化氨氮FA的浓度.
 |
| 图 2 不同pH下NH4+-N对DAMO细菌系统内NO2-消耗情况及脱氮性能的影响 (a.不同pH条件下NO2--N消耗曲线;b.不同pH条件下NH4+-N对系统脱氮性能的影响) Fig. 2 NO2- consumption and nitrogen removal performance in DAMO bacteria system with different pH (a. NO2- consumption curve; b. nitrogen removal performance in DAMO bacteria system with different pH) |
在1500 mg·L-1的氨氮抑制试验7 d后, 取污泥混合液10 mL离心后, 利用扫描电镜分别观察抑制前后的污泥结构与微生物微观形态特性, 结果见图 3.由图 3可知, 氨氮抑制试验之前, 在SEM下的絮状污泥微观结构清晰可见, 细菌形状多样, 以菌胶团的形式聚合在一起, 其中占主导地位的是球状菌和短杆状菌, 丝状菌数量较少.菌的表面较为光滑, 附着有少量胞外聚合物(Extracellular Polymeric Substances, EPS).
 |
| 图 3 氨氮抑制前后DAMO细菌系统扫描电镜照片 (a.氨氮抑制前, b.氨氮抑制后) Fig. 3 SEM images of DAMO System before and after ammonium inhibition (a. before ammonium inhibition, b. after ammonium inhibition) |
经高浓度氨氮短期抑制后的污泥与抑制之前相比, 结构变得松散, 丝状菌大量繁殖, 球状菌和短杆状菌则大量减少, 污泥出现了明显的膨胀现象.而污泥中的微生物出现了明显的皱缩现象, 另外微生物表面还包裹着一层粘性物质.由于聚合物覆盖在微生物的表面, 在环境与微生物胞膜之间形成一个缓冲层, 这种缓冲层有助于保护细胞体免受有毒物质损害, 从生物反馈机制上理解:在环境条件改变的情况下, 微生物分泌大量EPS的行为可以归结为生物应激性的一种表现, 从而能够最大程度地避免微生物细胞体受危害.所以, 微生物表面包裹着的这层粘性物质应为细菌所分泌的EPS(郑雄柳, 2014), 用以抵抗外界的不利因素.
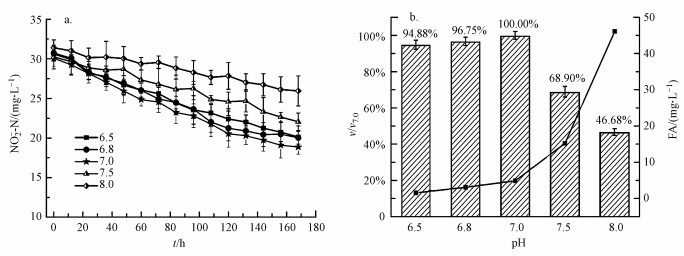
3.2 氨氮对DAMO细菌的长期影响 3.2.1 氨氮对以DAMO细菌脱氮性能的影响氨氮对DAMO细菌系统长期抑制后对系统脱氮性能影响结果见图 4.
 |
| 图 4 DAMO细菌系统内NO2--N消耗曲线及长期抑制对脱氮性能的影响 (a.系统NO2--N消耗曲线;b.长期抑制对系统脱氮性能的影响) Fig. 4 NO2--N consumption and nitrogen removal performance in DAMO bacteria System under long term inhibition (a. NO2--N consumption curve; b. nitrogen removal performance in DAMO bacteria System) |
控制第一阶段(1~7 d)氨氮浓度维持在500 mg·L-1左右, 亚硝酸盐初始实测浓度为29.95 mg·L-1, 7 d内平均消耗速率为2.37 mg·L-1·d-1, 与空白对照组相比其消耗速率下降了20.80%(图 4b), 出现明显抑制效应, 此时抑制效果与短期试验基本没有差别.控制第二阶段(8~14 d)氨氮的浓度为750 mg·L-1左右, 亚硝酸盐初始实测浓度为30.95 mg·L-1, 7 d平均消耗速率为1.14 mg·L-1·d-1, 与对照组相比其消耗速率下降62.02%, 而同样为750 mg·L-1的短期试验中, 其消耗速率只下降了43.15%.第三阶段(15~21 d)氨氮的浓度控制在1000 mg·L-1左右, 该阶段亚硝酸盐初始浓度为31.91 mg·L-1, 7 d平均消耗速率为0.54 mg·L-1·d-1, 其消耗速率仅仅达到了对照组的18.04%(图 4b), 而短期试验该浓度下的NO2--N消耗速率却还有对照组的43.80%, 可见, 与短期抑制相比, 在长期抑制条件下, 氨氮的毒性具有累积效应.
当氨氮的浓度上升到1250 mg·L-1时(22~28 d), 7 d内其亚硝酸氮的消耗速率仅为对照组的6.69%, 且经过单因素方差分析后发现, 与氨氮浓度为1000 mg·L-1条件下所得数据并无显著性差异, 从而表明当控制氨氮浓度为1000 mg·L-1时, DAMO细菌系统的脱氮性能已基本被抑制.在长期抑制试验的pH条件下(7.0), 氨氮浓度为500、750、1000 mg·L-1时, 其相对应的FA分别为3.253、4.879、6.505 mg·L-1, 其FA浓度依次升高, 而根据3.1.2节试验结果可知, 在pH = 7.0~7.5条件下, 氨氮对系统的抑制效果与FA值相关, FA增加, 抑制效果增强.
3.2.2 氨氮对DAMO系统菌群结构的影响本试验利用第二代高通量测序技术Miseq高通量测序揭示氨氮抑制前后微生物群落多样性的变化, 结果详见表 2.其中, Coverage表示样本文库的覆盖率, 其数值越高, 则样本中序列被测出的概率就越高, 该指数反应测序结果是否代表了微生物的真实情况.在本试验中, 所有Coverage指数均为99.85%, 故此次测序结果真实可靠.由表 2可知, 在经过4周高浓度氨氮抑制之后, OTUs的数值出现了明显的下降, DAMO细菌系统初始的OTUs为288.00, 但抑制后仅为227.00, 此外, 表征群落丰度的指标Chao1值和Ace值也分别从320.00、328.98下降到255.27和255.64, 说明在抑制过程中系统内物种数不断减少.而表征群落多样性的指标, Shannon指数从3.11下降到2.26;Simpson指数从0.09上升到0.11, 说明抑制过程中系统内群落多样性在不断减少.综上可知, 氨氮对以DAMO细菌为优势菌种的微生物系统有明显的抑制作用, 长期抑制后, 微生物系统的物种丰度以及多样性明显下降.
| 表 2 氨氮抑制前后DAMO细菌系统群落多样性 Table 2 The variations of community diversity in DAMO Bacteria System before and after ammonium inhibition |
基于第二代高通量测序技术Miseq高通量测序, 对16S RNA序列进行测序.氨氮抑制前后DAMO细菌系统的微观群落结构组成见图 5.
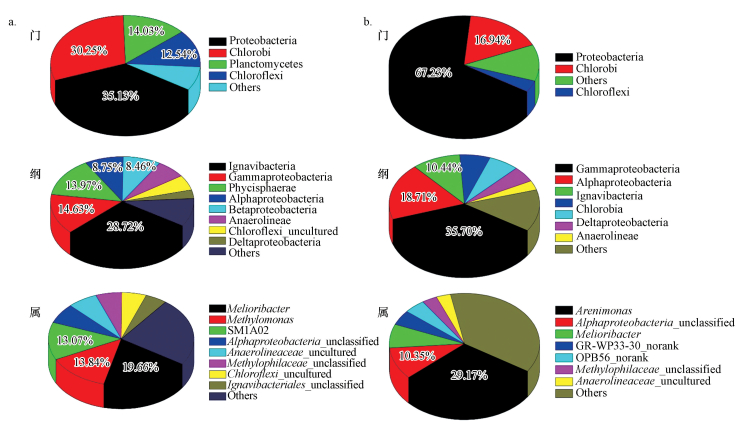 |
| 图 5 氨氮抑制前后DAMO细菌系统微观群落结构 (a.氨氮抑制前;b.氨氮抑制后) Fig. 5 Community structure of DAMO bacteria System before and after ammonium inhibition (a. before ammonium inhibition; b. after ammonium inhibition) |
从图 5可见, 氨氮对系统微生物群落结构有较大影响.
从门的层次上, 氨氮抑制实验前后均检测到28类已知门类的细菌, 其中氨氮抑制实验前占优势地位的是变形菌门(Proteobacteria, 35.13%)、绿菌门(Chlorobi, 30.25%)、浮霉菌门(Planctomycetes, 14.03%)和绿弯菌门(Chloroflexi, 12.54%).这几类细菌都是厌氧脱氮生物反应器中常见的细菌(Guo, 2015; Shu, 2015).而在氨氮抑制实验以后, 占据优势地位的门类细菌种类不变, 但其比例已较抑制前发生较大改变, 变形菌门(Proteobacteria)从35.13%上升到67.23%, 绿菌门(Chlorobi)的比例从抑制前的30.25%下降到抑制后的16.94%, 而绿弯菌门(Chloroflexi)从12.54%下降到3.84%, 浮霉菌门(Planctomycetes)的比例从14.03%下降到1.08%.变形菌门在高浓度氨氮氮条件下比例升高, 说明高浓度氨氮对其有一定的促进作用;而对于绿菌门门、绿弯菌门及浮霉菌门, 抑制作用则十分显著.
在纲的层次上进一步分析发现, 氨氮抑制实验前, 变形菌门中Alphaproteobacteria、Betaproteobacteria、Deltaproteobacteria、Gammaproteobacteria均被检测到, 其比例分比为:8.75%, 8.46%, 3.09%, 14.63%.但占比最大的是隶属于绿菌门的Ignavibacteria(28.72%).系统中的优势菌群为属于绿菌门的Melioribacter, 属于变形菌门的Methylomonas(甲基单胞菌属), 及属于浮霉菌门的SM1A02, 其比例分别为19.66%, 13.84%和13.07%.其次是属于浮霉菌门的Phycisphaerae占比13.97%, 以及属于绿弯菌门的Anaerolineae(厌氧蝇菌纲)占6.68%.绿弯菌门所属细菌多为厌氧细菌.Melioribacter所属的Ignavibacteria是绿菌门中唯一一类化能自养菌, 兼性厌氧(Podosokorskaya, 2013), 它与浮霉菌门的SM1A02都曾在厌氧氨氧化或其他具有反硝化功能的微生物系统中被检测到(Chu, 2015).而在氨氮抑制实验以后, 深入分析发现, 隶属于绿菌门的Ignavibacteria其比例由抑制前的28.72%下降到10.44%, 这也是绿菌门比例下降的主要原因, 另外属于绿菌门(Chlorobi)的绿硫细菌(Chlorobia)的比例从1.53%上升到6.51%.属于绿弯菌门的Anaerolineae(厌氧蝇菌纲)也在氨氮的作用下由之前的6.68%下降到3.09%.属于浮霉菌门的Phycisphaerae抑制前占比13.97%, 抑制后下降到0.99%.由此表明, 氨氮对Ignavibacteria、Anaerolineae以及Phycisphaerae有明显的抑制作用.而在变形菌门中, 除Betaproteobacteria的比例从8.46%下降到6.58%外, Alphaproteobacteria, Deltaproteobacteria, Gammaproteobacteria其比例分别从8.75%, 3.09%, 14.63%上升至18.71%, 5.20%, 35.70%, 这直接导致了在门的水平上, 变形菌门比例的显著上升, 说明氨氮对变形菌门的促进作用主要集中在Alphaproteobacteria、Deltaproteobacteria以及Gammaproteobacteria.
通过对属水平上群落结构的分析可发现, 优势菌种在高浓度氨氮作用下发生了改变, 原本的优势菌是属于绿菌门的Melioribacter, 但其比例从抑制前的19.66%下降到7.58%, 说明该类菌对高氨氮的耐受性较差;属于变形菌门的Methylomonas(甲基单胞菌属), 其比例从13.84%下降到0.01%, 这种甲烷氧化细菌比例的下降, 应是系统脱氮性能下降的原因之一, Methylomonas(甲基单胞菌属)在甲烷浓度较低的环境中具有一定的竞争力(Zeng, 2016), Kim等在该菌属的细菌中检测到了编码甲烷单加氧酶(MMO)的基因而甲烷单加氧酶是甲烷氧化过程的第一步也是关键一步的催化剂(Kim, 2016), 同时在荷兰的Lieshout污水处理厂底泥的DAMO分子检测结果可知在系统发育树中(Luesken, 2011)、实验室内富集成功的DAMO微生物的Illumina序列分析结果中(Siniscalchi, 2017)等均有发现该菌属的存在;属于浮霉菌门的SM1A02, 其比例从13.07%下降到0.26%;同时出现了新的优势菌种, 与Methylomonas(甲基单胞菌属)同属于变形菌门Gammaproteobacteria的Arenimonas其比例由0.01%上升到29.17%, 说明该类细菌在受长期高浓度氨氮影响的DAMO细菌系统中具有一定优势, 亦对高浓度氨氮有较强的耐受能力.该类细菌多为杆状菌, 革兰氏阴性菌, 无芽孢, 无鞭毛, 不可移动, 但对于其在脱氮微生物系统中的作用尚不明朗.另外由于自然界中含有大量的不可培养或难以培养的微生物, 导致众多菌群的生物学分类是未知的, 因而在序列信息比对过程中, 数据库中鉴定到属水平的菌种只是自然界的一部分, 大量的有效序列目前还无法找到合适的配对信息, 同时表明, 系统中囊括了未知菌属, 需要进一步深入探究.
综上可知, 在氨氮长期抑制作用下, DAMO细菌系统中物种丰度, 多样性以及群落结构发生较大改变, 而Methylomonas(甲基单胞菌属)的减少应是系统脱氮性能下降的主要原因.
4 结论(Conclusions)1) 高浓度氨氮会影响DAMO微生物的生长和性能.在短期抑制条件下, 氨氮对DAMO细菌的安全浓度为250 mg·L-1;当氨氮浓度增至500 mg·L-1时, DAMO细菌的脱氮效率受到明显抑制, 随着浓度、时间的增加, 氨氮对其的抑制效果增强;当氨氮浓度增加到1500 mg·L-1时, 系统基本丧失脱氮性能.
2) 抑制前后的污泥结构与微生物微观形态特性经过扫描电镜分析发现, 高浓度氨氮短期抑制后, 污泥结构均变得松散, 丝状菌大量繁殖, 球状菌和短杆状菌则大量减少, 污泥出现明显的膨胀现象, 同时微生物分泌大量EPS, 以抵抗外界的不利环境.
3) 在不同pH体系下, 起到真正抑制作用的抑制因子不同, 在碱性条件下, FA为主要抑制因子;在酸性条件下, 离子化的氨氮为主要的抑制因子.
4) 在相同氨氮抑制浓度下, 与短期试验相比较, 长期抑制条件下DAMO细菌脱氮速率更低.氨氮浓度增加到1250 mg·L-1时, 脱氮性能就被完全抑制.
5) 高通量测序技术分析结果显示, 经长期的氨氮抑制后, DAMO系统内的物种多样性和丰度都大大降低, 菌群结构发生较大改变, 变形菌门比例明显上升, 绿菌门、绿弯菌门及浮霉菌门比例下降.尤其是Methylomonas(甲基单胞菌属)数量的减少, 导致了系统脱氮效率降低.
Anthonisen A C, Loehr R C, Prakasam T B, et al. 1976. Inhibition of nitrification by ammonia and nitrous acid[J]. Journal (Water Pollution Control Federation), 48(5): 835–852.
|
Chu Z R, Wang K, Li X K, et al. 2015. Microbial characterization of aggregates within a one-stage nitritation-anammox system using high-throughput amplicon sequencing[J]. Chemical Engineering Journal, 262: 41–48.
DOI:10.1016/j.cej.2014.09.067
|
Dapena-Mora A, Fernández I, Campos J L, et al. 2007. Evaluation of activity and inhibition effects on Anammox process by batch tests based on the nitrogen gas production[J]. Enzyme and Microbial Technology, 40(4): 859–865.
DOI:10.1016/j.enzmictec.2006.06.018
|
Deutzmann J S, Schink B. 2011. Anaerobic oxidation of methane in sediments of an oligotrophic freshwater lake(Lake Constance)[J]. Applied and Environmental Microbiology, 77(13): 4429–4436.
DOI:10.1128/AEM.00340-11
|
Guo J, Peng Y, Ni B J, et al. 2015. Dissecting microbial community structure and methane-producing pathways of a full-scale anaerobic reactor digesting activated sludge from wastewater treatment by metagenomic sequencing[J]. Microbial Cell Factories, 14(1): 33.
DOI:10.1186/s12934-015-0218-4
|
Han P, Gu J D. 2013. A newly designed degenerate PCR primer based on pmoA gene for detection of nitrite-dependent anaerobic methane-oxidizing bacteria from different ecological niches[J]. Applied Microbiology and Biotechnology, 97(23): 10155–10162.
DOI:10.1007/s00253-013-5260-8
|
Kim D S, Jung N S, Park Y S. 2008. Characteristics of nitrogen and phosphorus removal in SBR and SBBR with different ammonium loading rates[J]. Korean Journal of Chemical Engineering, 25(4): 793–800.
DOI:10.1007/s11814-008-0130-2
|
Kojima H, Tsutsumi M, Ishikawa K, et al. 2012. Distribution of putative denitrifying methane oxidizing bacteria in sediment of a fresh water lake, Lake Biwa[J]. Systematic and Applied Microbiology, 35(4): 233–238.
DOI:10.1016/j.syapm.2012.03.005
|
Lay J J, Li Y Y, Noike T, et al. 1997. Analysis of environmental factors affecting methane production from high-solids organic waste[J]. Water Science and Technology, 36(6/7): 493–500.
|
李媛. 2014. 厌氧氨氧化工艺启动和运行特性及其受抑制机理研究[D]. 无锡: 江南大学
|
楼菊青, 王析镭, 杨东叶, 等. 2016. 不同接种物对富集反硝化型甲烷厌氧氧化微生物的影响[J]. 环境科学学报, 2016, 36(11): 1–9.
|
Luesken F A, van Alen T A, van der Biezen E, et al. 2011. Diversity and enrichment of nitrite-dependent anaerobic methane oxidizing bacteria from wastewater sludge[J]. Applied Microbiology and Biotechnology, 92(4): 845–854.
DOI:10.1007/s00253-011-3361-9
|
Siniscalchi L A B, Leite L R, Oliveira G, et al. 2017. Illumina sequencing-based analysis of a microbial community enriched under anaerobic methane oxidation condition coupled to denitrification revealed coexistence of aerobic and anaerobic methanotrophs[J]. Environmental Science and Pollution Research, 24(20): 16751–16764.
DOI:10.1007/s11356-017-9197-9
|
Podosokorskaya O A, Kadnikov V V, Gavrilov S N, et al. 2013. Characterization of Melioribacter roseus gen. nov., sp. nov., a novel facultatively anaerobic thermophilic cellulolytic bacterium from the class Ignavibacteria, and a proposal of a novel bacterial phylum Ignavibacteriae[J]. Environmental Microbiology, 15(6): 1759–1771.
DOI:10.1111/emi.2013.15.issue-6
|
Raghoebarsing A A, Pol A, van de Pas-Schoonen K T, et al. 2006. A microbial consortium couples anaerobic methane oxidation to denitrification[J]. Nature, 440(7086): 918–921.
DOI:10.1038/nature04617
|
Shen L D, Liu S, Zhu Q, et al. 2013. Distribution and diversity of nitrite-dependent anaerobic methane-oxidising bacteria in the sediments of the Qiantang River[J]. Microbial Ecology, 67(2): 341–349.
|
Shen L D, Zhu Q, Liu S, et al. 2014. Molecular evidence for nitrite-dependent anaerobic methane-oxidising bacteria in the Jiaojiang Estuary of the East Sea (China)[J]. Applied Microbiology and Biotechnology, 98(11): 5029–5038.
DOI:10.1007/s00253-014-5556-3
|
Shu D, He Y, Yue H, et al. 2015. Microbial structures and community functions of anaerobic sludge in six full-scale wastewater treatment plants as revealed by 454-high-throughput pyrosequencing[J]. Bioresource Technology, 186: 163–172.
DOI:10.1016/j.biortech.2015.03.072
|
Wang Y L, Wang D B, Yang Q, et al. 2017. Wastewater opportunities for denitrifying anaerobic methane oxidation[J]. Trends in Biotechnology, 11: 9.
|
Wang Y, Zhu G, Harhangi H R, et al. 2012. Co-occurrence and distribution of nitrite-dependent an-aerobic ammonium and methane oxidizing bacteria in a paddy soil[J]. FEMS Microbiology Letters, 336(2): 79–88.
DOI:10.1111/fml.2012.336.issue-2
|
魏复盛. 2002. 水和废水监测分析方法(第4版)[M]. 北京: 中国环境科学出版社.
|
Zeng X, Hosono T, Ohta H, et al. 2016. Comparison of microbial communities inside and outside of a denitrification hotspot in confined groundwater[J]. International Biodeterioration & Biodegradation, 114: 104–109.
|
郑雄柳. 2014. 亚硝酸盐和氨氮对颗粒化EBPR系统影响机制研究[D]. 杭州: 浙江工商大学
http://cdmd.cnki.com.cn/Article/CDMD-10353-1014224620.htm |
Zhou Y, Oehmen A, Lim M, et al. 2011. The role of nitrite and free nitrous acid (FNA) in wastewater treatment plants[J]. Water Research, 45(15): 4672–4682.
DOI:10.1016/j.watres.2011.06.025
|
 2018, Vol. 38
2018, Vol. 38


