2. 工业聚集区污染控制与生态修复教育部重点实验室, 广州 510006;
3. 广东省环境风险防控与应急处置工程技术研究中心, 广州 510006;
4. 广东省环境纳米材料工程技术研究中心, 广州 510006
2. The Key Lab of Pollution Control and Ecosystem Restoration in Industry Clusters, Ministry of Education, South China University of Technology, Guangzhou 510006;
3. Guangdong Provincial Engineering and Technology Research Center for Environmental Risk Prevention and Emergency Disposal, South China University of Technology, Guangzhou 510006;
4. Guangdong Engineering and Technology Research Center for Environmental Nanomaterials, Guangzhou 510006
随着人类社会发展进程的加快, 核能作为一种高效的清洁能源被广泛应用, 藉此来缓解日益严重的能源危机.据估计, 我国核电对天然铀的需求量在2020年将达到3180~6540 t(刘晨等, 2017).于此同时, 核能的应用也给自然环境造成了不可忽视的放射性污染, 其主要来源包括核材料开采和加工过程中产生的废水及尾矿、核废物及核泄漏等.历史上有11次比较大的核泄漏事故, 其造成的危害不亚于核武器, 影响比较大的有1986年苏联的切尔诺贝利核电站爆炸事件(胡遵素, 1994)和2011年日本福岛的核泄漏事故(张琼等, 2012; 盛黎等, 2013).由于铀具有高溶解性、长半衰期、高毒性等特点, 进入自然环境中的铀会对自然环境产生化学毒性和放射性毒害, 致使生物体细胞活性降低甚至诱导癌变(Zou et al., 2017).
由于核泄漏事件时有发生, 所以亟需开发一种高效的材料用于去除环境中的高浓度铀.近些年来, 专家学者对从自然环境中去除铀做了大量的研究工作, 常见的铀处理工艺有化学沉淀法(Zhang et al., 2017)、离子交换法(Amphlett et al., 2018)、絮凝法(高旭等, 2017)、溶液萃取法(Chen et al., 2018), 以及新型的膜处理法(Zakrzewska-Trznadel, 2013)、生物处理法(Merroun et al., 2011)等, 然而这些方法由于工艺和经济条件的限制, 制约了其大规模应用.吸附法因具有环境友好、吸附剂廉价易得、操作简单等优点而被广泛使用, 而吸附材料是吸附法的研究重点.目前研究比较多的铀吸附材料主要有石墨烯(Wang et al., 2017)、粘土矿物(陈阳等, 2015; Zhu et al., 2017)、零价铁(Nekhunguni et al., 2017)、高分子聚合物(王哲等, 2015; Pan et al., 2017)、碳材料及其改性材料.
LDH(层状双氢氧化物)作为一种阴离子粘土矿物材料, 具有制备简单、廉价、无毒害、吸附量大等特点, 已被广泛应用于阴离子重金属(Wang et al., 2014)、含氧阴离子(Yu et al., 2011)、卤素元素及其含氧化合物(Lv et al., 2009; Yang et al., 2012)的吸附.但目前对于重金属阳离子在LDH上的吸附行为研究较少, 而天然铀在水体中多以UO22+的形式存在.研究表明, LDH吸附阳离子的机理主要有3种:①表面沉淀;②与含氧官能团(—OH)形成表面络合;③与层间插入的阴离子螯合(Yue et al., 2017).Linghu等(2017)制备了LDH/GO, 发现其对UO22+的吸附主要是因为GO上的含氧官能团在起作用;Zou等(2017)制备了g-C3N4@Ni-Mg-Al-LDH, 发现在其对UO22+吸附过程中受离子强度的影响很大, 由此推断其吸附的主要机理是表面络合和离子交换;Xie等(2017)制备了Fe-Al LDH, 发现其对UO22+的吸附包括吸附-还原两个过程, 先是UO22+被吸附在材料上, 然后是Fe(Ⅱ)将U(Ⅵ)还原成U(Ⅳ), 自身被氧化成Fe(Ⅲ).基于此, 本文通过制备Mg/Al比(物质的量比)分别为2:1和4:1的Mg/Al LDH, 将其用于对水中UO22+的吸附研究, 探讨吸附剂投加量、pH、吸附时间、初始浓度对吸附的影响, 并结合热力学、动力学模型及材料表征来研究UO22+在Mg/Al LDH上的吸附机理.
2 实验部分(Experiment) 2.1 实验试剂硝酸镁(Mg(NO3)2·6H2O)、硝酸铝(Al(NO3)3·9H2O)、氢氧化钠(NaOH)、硝酸钠(NaNO3)、硝酸(HNO3)、盐酸(HCl)均为分析纯, 购于广州化学试剂厂;硝酸铀酰(UO2(NO3)2)、一氯乙酸(C2H2ClO2)、2, 4-二硝基酚(C6H4N2O4)、偶氮胂Ⅲ;去离子水为实验室自制.
2.2 材料制备用共沉淀的方法制备不同Mg/Al比的Mg/Al LDH.按Mg/Al比(分别为2:1、4:1)准确称取一定质量的Mg(NO3)2·6H2O、Al(NO3)3·9H2O, 溶于一定体积的去离子水中, 使得混合盐溶液中总金属阳离子(Mg2++ Al3+)浓度为0.1 mol·L-1, 将装有盐溶液的三口烧瓶置于磁力搅拌器上常温搅拌, 缓慢滴加1.0 mol·L-1的NaOH溶液, 使体系的终点pH值为10.0, 滴定完成后再搅拌1 h.所得悬浊液于60 ℃下老化18 h, 用去离子水于4000 r·min-1下离心洗涤多次至上清液pH为中性.所得固体60 ℃干燥24 h, 研磨过200目筛备用, 所得样品分别记为Mg/Al-2 LDH、Mg/Al-4 LDH.
2.3 材料表征扫描电镜分析(SEM)采用德国蔡司公司的Merlin型超高分辨场发射扫描电子显微镜.X射线衍射分析(XRD)采用德国Bruker公司的D8 ADVANCE X-射线衍射仪(Cu靶, Kα为射线源, Lynx Exe阵列探测器, 波长为0.15418 nm), 扫描范围2θ=2°~70°, 扫描步长0.02°, 扫描速度17.7 s·步-1, 工作电压为40 kV, 电流为40 mA, 工作温度为室温.傅里叶变换红外光谱(FT-IR)采用Perkin Elmer公司的1725X红外光谱仪, 扫面区间为4000~400 cm-1, 仪器分辨率为4 cm-1, 扫描次数为64次, 测试温度25 ℃, 采用溴化钾压片法进行制样.BET分析采用美国Micromeritics公司ASAP 2020比表面积与孔径测定仪对材料的比表面积进分析, 测试条件为:以N2为载气, 在80 ℃下脱气12 h, 用N2吸附法测定吸附剂的比表面积, t-plot方法测定外表面积和微孔体积, BJH方法计算平均微孔直径.X射线光电子能谱(XPS)分析采用英国Krato公司的AXIS Ultra DLD型号光谱仪, 实验条件为:单色Al Kα X射线源(hv=1486.6 eV), 功率为75 W;以C1s= 284.6 eV为内标测定各元素的结合能.
2.4 铀离子的测定因UO22+可与显色剂偶氮胂Ⅲ迅速反应生成蓝色络合物, 可采用紫外分光光度法在652 nm下准确测定溶液中铀离子浓度(杜浪等, 2015).经实验测得, 铀离子浓度与吸光度成正比例关系, 满足方程y=0.2177x+0.0186, R2=0.9994>0.999.
2.5 吸附实验以UO22+为目标污染物, 称取一定质量的硝酸铀酰用去离子水溶于1 L的容量瓶中, 使铀浓度为100 mg·L-1.分别称取Mg/Al-2 LDH、Mg/Al-4 LDH各0.04 g于50 mL离心管中, 加入20 mL的目标污染物溶液, 用一定浓度的HNO3和NaOH调节溶液的pH为6.0, 在振荡器上于30 ℃条件下反应4 h, 待反应完成后, 用离心机对溶液进行离心, 取上清液过膜, 用紫外分光光度计于652 nm下测定其吸光度值, 计算溶液中剩余铀离子浓度.
另外, 在相同的条件下分别测定不同的吸附剂投加量(0.1、0.2、0.3、0.4、0.5、0.6、0.8、1.0 g·L-1)、初始pH(3、4、5、6、7、8、9、10)、反应时间(5、10、15、20、25、30、40、50、60、120、180、240 min)、初始浓度(50、100、150、200、250、300、350 mg·L-1)下溶液中剩余铀离子浓度.通过以下公式来计算去除率R和吸附量qe(mg·g-1):
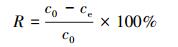
|
(1) |
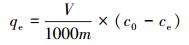
|
(2) |
式中, V为污染物溶液的体积(mL), m为投加吸附剂质量(g), c0、ce分别表示吸附前后污染物浓度(mg·L-1).
3 结果与讨论(Results and discussion) 3.1 材料的表征 3.1.1 吸附前SEM分析图 1分别为Mg/Al-2 LDH和Mg/Al-4 LDH吸附前的SEM图.对于Mg/Al-2 LDH的SEM图, 可以看出它是像花瓣一样团簇在一起的片状结构;而对于Mg/Al-4 LDH的SEM图, 其片状结构则是堆叠在一起, 因此, 相对于Mg/Al-4 LDH, Mg/Al-2 LDH可能有更大的比表面积, 吸附性能更强.将这两种材料进行热解分析, 发现其Mg/Al物质的量比分别为2.239、3.878, 这与预计的2:1、4:1相差不大, 误差可能是在制备过程中产生了部分损失.
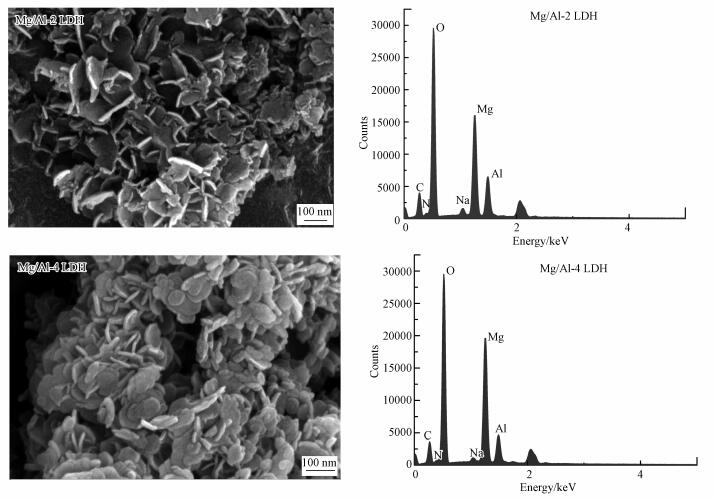 |
| 图 1 吸附前Mg/Al-2 LDH和Mg/Al-4 LDH的SEM和EDS图 Fig. 1 SEM micrograph and EDS plot of Mg/Al-2 LDH and Mg/Al-4 LDH before adsorption |
表 1所示为Mg/Al-2 LDH和Mg/Al-4 LDH的比表面积和孔结构分析结果.从表中可以看出, Mg/Al-2 LDH的比表面积为112.28 m2·g-1, 要明显高于Mg/Al-4 LDH的比表面积78.996 mg·g-1.这可能是因为Mg/Al-2 LDH的花瓣形结构使其有更多的空间空隙, 使大量的活性位点暴露出来, 由此可以初步断定Mg/Al-2 LDH的吸附性要高于Mg/Al-4 LDH的吸附性.
| 表 1 不同Mg/Al比Mg/Al LDH的孔结构及比表面积 Table 1 Structural information of Mg/Al LDH with different Mg/Al molar ratio |
图 2为改变吸附剂Mg/Al-2 LDH、Mg/Al-4 LDH投加量对吸附UO22+的影响.由图可知, Mg/Al-2 LDH对UO22+的吸附量大于Mg/Al-4 LDH, 这是由于Mg/Al-2 LDH的比表面积要大于Mg/Al-4 LDH的比表面积, 可以提供更多的吸附位点, 有利于对UO22+的吸附.随着吸附剂投加量的增大, Mg/Al-2 LDH、Mg/Al-4 LDH对UO22+的吸附量逐渐降低, 当吸附剂投加量达到0.6 g·L-1时, 对UO22+的吸附量急剧下降.这是因为在溶液中UO22+浓度一定时, 增大吸附剂投加量, 单位质量的吸附剂对应的吸附量就越少, 当达到吸附平衡时, Mg/Al LDH对UO22+的去除率不变, 因此, 再增加吸附剂的投加量会使得吸附量显著下降.
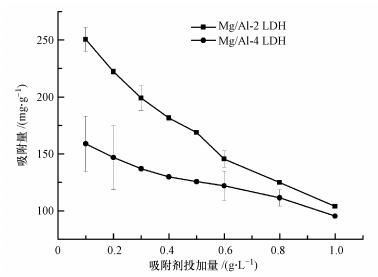 |
| 图 2 吸附剂投加量对吸附的影响 Fig. 2 Effect of adsorbent dosages on adsorption capacities |
由图 3a可知, pH的改变可以显著影响吸附剂对UO22+的吸附去除, 因此, 选择吸附剂投加量为0.2 g·L-1.当pH小于6时, Mg/Al LDH对UO22+的吸附量随着pH的增大而逐渐增大, 这是因为在低pH值时, 溶液中存在大量的H+, 它与UO22+产生竞争吸附, 降低了可供UO22+结合的吸附位点, 因而吸附量较小(Xie et al., 2017);随着pH值的增大, 吸附剂上的吸附位点去质子化, 增强了UO22+与吸附剂之间的电荷吸附作用, 因而吸附量增加.当pH值大于6时, UO22+更易与水溶液中OH-结合, 形成(UO2) 2(OH)22+、(UO2)3(OH)25+等水合离子, 从而使得对UO22+吸附率降低(Yin et al., 2017).
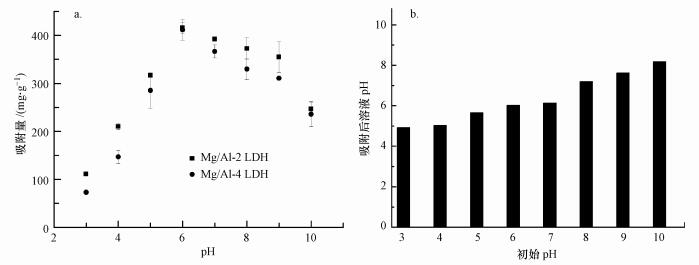 |
| 图 3 pH对吸附的影响(a)及吸附前后溶液pH的变化(b) Fig. 3 Effect of pH on adsorption capacities(a) and the change of pH before and after adsorption(b) |
图 3b所示为吸附前后溶液pH的变化, 调节溶液初始pH为3~10, 发现吸附完成后, 溶液的pH向着中性范围调节变化.这是因为在酸性范围时, 溶液中H+与UO22+竞争吸附活性位点被吸附, 使得H+浓度降低, pH增大;此外, 在酸性条件下, Mg/Al LDH会发生一定程度的溶解, 释放出OH-, 与溶液中H+反应, 也可以使溶液的pH值增大.当在碱性范围时, UO22+会与溶液中的OH-发生反应, 形成水合物, 从而使OH-浓度减小, pH值降低.由图 4可知, 当pH=6.0时, 反应前后的pH几乎不发生变化, 由此也可以说明pH=6.0为吸附反应的最佳pH.
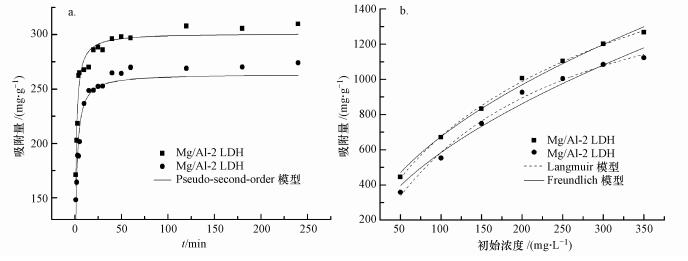 |
| 图 4 Mg/Al-2 LDH、Mg/Al-4 LDH对UO22+的Pseudo-second-order动力学模型(a)及吸附等温模型(b) Fig. 4 Pseudo-second-order kinetic(a) and adsorption isotherms(b) of UO22+ adsorption by Mg/Al-2 LDH, Mg/Al-4 LDH |
图 4a为Mg/Al-2 LDH和Mg/Al-4 LDH在pH=6.0的情况下对UO22+的吸附量随时间变化的动力学拟合曲线.由图可知, 两种材料的吸附量随时间的延长而增加, Mg/Al-2 LDH对UO22+的吸附效果优于Mg/Al-4 LDH.吸附在较短时间内就达到平衡, 在反应达到平衡后, 随时间的延长, UO22+的去除率没有明显增加, 整个吸附过程大致可以分为两个阶段:第一个阶段为快速反应阶段, 大概30 min可以完成, 这是因为刚开始阶段, 向溶液中投入Mg/Al LDH可以提供大量的活性位点, 有利于吸附的快速进行;第二阶段为慢速反应阶段, 随着时间的推移, 溶液中的UO22+被吸附剂吸附, 吸附剂上可供的活性位点减少至饱和状态, 使吸附速率降低直至吸附达到平衡.Mg/Al LDH对UO22+的吸附大概在60 min时达到平衡, 达到平衡时Mg/Al-2 LDH、Mg/Al-4 LDH对UO22+平衡吸附量分别是301.28、263.85 mg·g-1.
吸附动力学模型可用于吸附机制的探索和吸附速率的控制, 利用Pseudo-first-order模型(式(4))和Pseudo-second-order模型(式(3))对实验数据进行拟合.
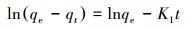
|
(3) |
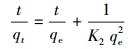
|
(4) |
式中, qt和qe分别代表吸附t时刻和平衡时的吸附量(mg·g-1), K1(min-1)和K2(g·mg-1·min-1)分别表示Pseudo-first-order和Pseudo-second-order的吸附速率常数.
Mg/Al LDH吸附UO22+的动力学拟合参数如表 2所示, 由表中数据可知, Mg/Al-2 LDH、Mg/Al-4 LDH吸附UO22+的Pseudo-first-order模型的R2在0.8左右;相反, Pseudo-second-order模型的拟合效果较好, R2均可达到0.99, 同时, 经拟合后的平衡吸附量与实际的吸附量更为接近.这说明Mg/Al LDH对UO22+的吸附主要是化学吸附.Mg/Al-2 LDH拟合后得到的K值比Mg/Al-4 LDH的大, 表明Mg/Al-2 LDH吸附速率比Mg/Al-4 LDH快, 更容易达到平衡.
| 表 2 Pseudo-first-order、Pseudo-second-order模型拟合参数 Table 2 Parameters of the Pseudo-first-order, Pseudo-second-order rate equations |
分别配制初始铀浓度为50~350 mg·L-1的溶液, 在温度为30 ℃、pH=6.0的条件下吸附4 h, 以吸附平衡浓度为横坐标, 以平衡吸附量为纵坐标, 采用Langmuir、Freundlich等温吸附模型进行吸附等温线拟合, 拟合方程如公式(5)和公式(6)所示.
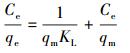
|
(5) |

|
(6) |
式中, qe为平衡吸附量(mg·g-1), Ce为吸附质浓度(mg·L-1), qm为吸附剂的最大吸附量(mg·g-1), KL、KF和n为吸附常数.
吸附等温线拟合结果如图 4b所示.由图可知, 随着UO22+初始浓度的增加, Mg/Al LDH的平衡吸附量也随之增加.这是因为溶液中UO22+的浓度增加时, 单位体积溶液中UO22+数量变多, 吸附剂Mg/Al LDH表面的吸附位点捕集到UO22+的几率变大, 而内部原本难以接触到的吸附位点在吸附质浓度梯度作用的推动下也可以吸附一定数量的UO22+, 故UO22+的吸附量会随着初始浓度的增加而增加.而当吸附剂的吸附位点被占据达到饱和后, 吸附量很难再有很大的提高.
吸附等温的拟合参数如表 3所示.由表可知, Langmuir模型的可决系数要比Freundlich模型的大, 表明Langmuir模型的拟合效果更好, 这说明Mg/Al-2 LDH和Mg/Al-4 LDH对UO22+的吸附为单层吸附.经拟合后, Mg/Al-2 LDH和Mg/Al-4 LDH对UO22+的最大吸附量分别可高达2087.1、1706.6 mg·g-1, 说明Mg/Al LDH是一种对UO22+吸附效果优良的材料.将Mg/Al LDH吸附UO22+的最大吸附容量与其他材料进行对比, 结果如表 4所示, 由表可见, Mg/Al LDH对UO22+具有高效吸附的能力.
| 表 3 吸附等温拟合参数 Table 3 Adsorption isotherm parameters |
| 表 4 Mg/Al LDH与其他吸附剂对UO22+的最大吸附容量对比 Table 4 Comparison of the maximal adsorption capacity of UO22+with other adsorbents |
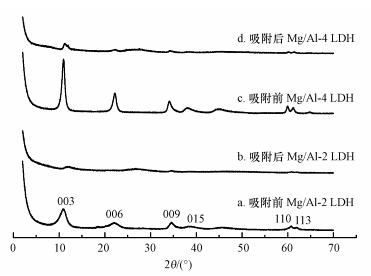
图 5所示为Mg/Al-2 LDH和Mg/Al-4 LDH吸附UO22+前后的X射线衍射光谱图.其中, 曲线a和c分别为吸附前Mg/Al-2 LDH和Mg/Al-4 LDH的XRD图, 从图中可知, 曲线a和c均出现衍射强度较大的003、006、009、015、110、113晶面序列特征衍射峰, 说明生成的固体具有LDH结构.图中尖锐的003、006、009衍射峰说明制备的LDH材料晶体结构良好(张钱等, 2011).图中曲线b和d分别为吸附后的Mg/Al LDH的XRD图谱.由图可知, 当Mg/Al LDH吸附后, LDH的特征峰几乎消失, 只有003处有微弱的特征峰, 说明当材料吸附UO22+后, Mg/Al LDH的晶体结构变差, 产生一些非晶体结构物质.
 |
| 图 5 吸附前后Mg/Al-2 LDH和Mg/Al-4 LDH的XRD衍射图谱 Fig. 5 X-ray diffraction of Mg/Al-2 LDH and Mg/Al-4 LDH before and after adsorption |
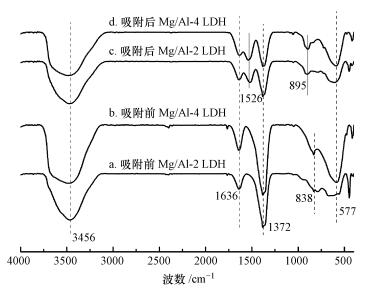
图 6所示为Mg/Al-2 LDH和Mg/Al-4 LDH吸附UO22+前后的红外光谱图.曲线a和b分别为Mg/Al-2 LDH和Mg/Al-4 LDH吸附前的红外曲线, 3465 cm-1处的吸收峰代表Mg/Al LDH层间吸附水O—H或O—H官能团的伸缩振动峰(Qin et al., 2017);1636 cm-1处的吸收峰代表层间水分子的弯曲振动(Mohd Sidek et al., 2017);834 cm-1和1380 cm-1处的吸收峰代表Mg/Al LDH层间CO32-的振动峰(Yin et al., 2017);800~500 cm-1处的吸收峰代表金属氧键的振动峰, 一般为Mg/Al—O、O—Mg/Al—O、Mg/Al—O—Mg/Al(Linghu et al., 2017).对比3种材料发现, Mg/Al物质的量比越大, 其吸收峰的强度越大.曲线c和d分别为Mg/Al-2 LDH和Mg/Al-4 LDH吸附UO22+后的红外曲线, 从图中可以看出, 吸附UO22+后, 其红外曲线发生了明显的变化, 895 cm-1处的振动峰为O=U=O的振动峰(Xie, 2017);吸附后, 3465 cm-1处代表层间水O—H和OH官能团的伸缩振动峰出现右移, 范围扩大;1372 cm-1处NO3-振动峰强度减弱, 出现左移, 在1526 cm-1处出现新的振动峰, 代表CO32-的特征峰(Xie et al., 2017), 而且834 cm-1处的特征峰消失.由此可以说明, UO22+被吸附到LDH材料上, 并且层间OH、CO32-官能团参与了吸附反应.
 |
| 图 6 吸附前后Mg/Al-2 LDH和Mg/Al-4 LDH的傅里叶红外光谱 Fig. 6 FTIR spectroscopy of Mg/Al-2 LDH and Mg/Al-4 LDH before and after adsorption |
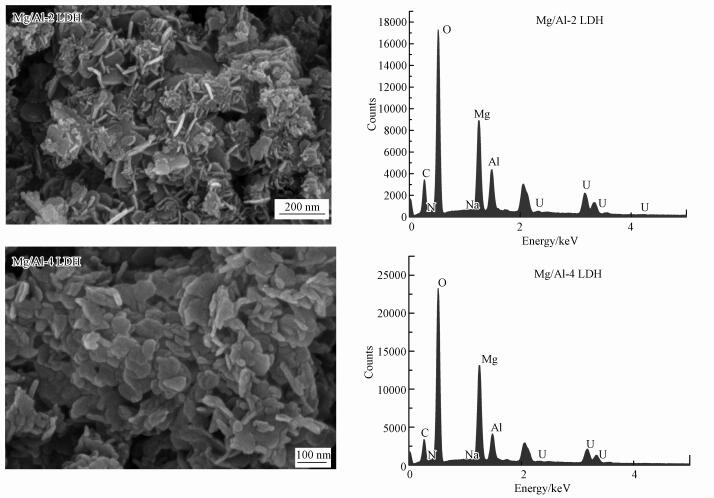
图 7分别为Mg/Al-2 LDH和Mg/Al-4 LDH吸附后的SEM和EDS图.发现吸附UO22+后, SEM图上仍保留着片状结构, 但片状结构上附着一些细小的碎片, 这些细小的额碎片可能是新生成的物质.将吸附后的Mg/Al LDH进行EDS分析, 发现材料上有大量的铀吸附.将吸附UO22+后的Mg/Al LDH进行煅烧处理分析, 发现Mg/Al-2 LDH的Mg/Al比由原来的2.239变化为2.029, 仍维持在2:1, 说明Mg/Al-2 LDH在吸附UO22+过程中稳定性较强;Mg/Al-4 LDH的Mg/Al比由原来的3.878降低为3.401, Mg/Al比明显降低, 说明Mg/Al-4 LDH的稳定较差.
 |
| 图 7 吸附后Mg/Al-2 LDH和Mg/Al-4 LDH的SEM和EDS图 Fig. 7 SEM micrograph and EDS plot of Mg/Al-2 LDH and Mg/Al-4 LDH after adsorption |
图 8所示为Mg/Al LDH吸附UO22+前后的XPS图谱, 其中, 图 8a为吸附反应前后的扫描全谱图, 吸附前有4个主要峰, 分别为Mg1s(1309.2 eV)、Al2p(81.93 eV)、O1s(539.8 eV)、C1s(293.88 eV), 吸附后图中出现了新的峰, 该峰为U的特征峰, 与此同时, O1s(539.8 eV)处的峰强明显增强, 这说明含氧官能团在Mg/Al LDH吸附UO22+吸附过程中起着重要作用.图 8b为Mg/Al LDH吸附UO22+后U(Ⅵ)的窄谱图, 在396.2 eV和381.6 eV出现特征峰, 这分别表示U4f5/2和U4f7/2.从XPS分析可以推断出, Mg/Al LDH吸附UO22+的吸附主要是Mg/Al LDH上的含氧官能团OH-和CO32-在起作用(Linghu et al., 2017).
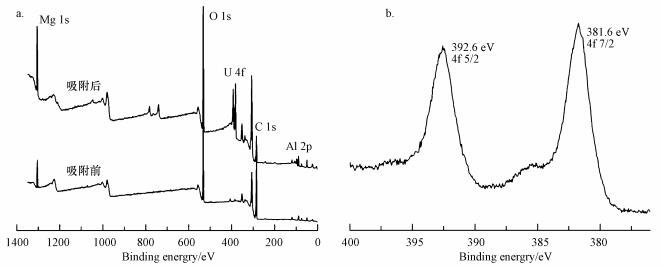 |
| 图 8 吸附UO22+前后Mg/Al-2 LDH (a)和吸附UO22+后Mg/Al-2 LDH的U(Ⅵ) (b)的XPS图 Fig. 8 XPS analysis of Mg/Al-2 LDH before and after UO22+ adsorption (a) and the high resolution of U after UO22+ adsorption (b) |
因为UO22+的离子半径要远大于Mg2+, 所以吸附反应不可能是因为晶格置换, 通过XRD表征发现吸附后并未产生新的LDH特征峰也可以证明.结合XRD、SEM、FT-IR、XPS分析, 吸附后, Mg/Al LDH上产生一些非晶体结构物质, 反应过程中Mg/Al LDH上的含氧官能团参与了吸附反应, 由此推断, UO22+在Mg/Al LDH上的吸附是由于UO22+与Mg/Al LDH上的氢氧根、碳酸根发生了相互作用, 形成了一种三元的络合物而被去除的.由此推断它的去除机理为:
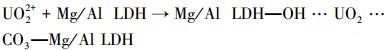
|
(7) |
1) Mg/Al-2 LDH对UO22+的吸附容量要高于Mg/Al-4 LDH, 吸附后Mg/Al-2 LDH的Mg/Al物质的量比几乎不变, Mg/Al-2 LDH相较于Mg/Al-4 LDH有更高的吸附性和稳定性.
2) UO22+在Mg/Al-2 LDH和Mg/Al-4 LDH上的吸附均更符合Langmuir等温吸附模型和Pseudo-second-order模型, 其最大吸附量分别是2087.1、1706 mg·g-1, 说明Mg/Al LDH是一种优良的UO22+吸附剂, 可用作为高浓度放射废水吸附材料和核泄漏事件的应急材料.
3) 经XRD、FT-IR、XPS分析, Mg/Al LDH吸附UO22+的机理是Mg/Al LDH上的氢氧根、碳酸根参与了反应, 与UO22+形成了一种三元络合物.
Amphlett J T M, Ogden M D, Foster R I, et al. 2018. Polyamine functionalised ion exchange resins:Synthesis, characterisation and uranyl uptake[J]. Chemical Engineering Journal, 334: 1361–1370.
DOI:10.1016/j.cej.2017.11.040
|
Asiabi H, Yamini Y, Shamsayei M. 2018. Highly efficient capture and recovery of uranium by reusable layered double hydroxide intercalated with 2-mercaptoethanesulfonate[J]. Chemical Engineering Journal, 337: 609–615.
DOI:10.1016/j.cej.2017.12.143
|
Chen L, Wang Y, Yuan X, et al. 2018. Highly selective extraction of uranium from nitric acid medium with phosphine oxide functionalized pillar[5]arenes in room temperature ionic liquid[J]. Separation and Purification Technology, 192: 152–159.
DOI:10.1016/j.seppur.2017.10.011
|
陈阳, 程宏飞, 邓宇涛. 2015. 粘土矿物对铀的吸附作用研究进展[J]. 化工矿产地质, 2015, 37(2): 93–98.
|
杜浪, 李玉香, 马雪. 2015. 偶氮胂Ⅲ分光光度法测定微量铀[J]. 冶金分析, 2015, 35(1): 68–71.
|
González M A, Pavlovic I, Barriga C. 2015. Cu(Ⅱ), Pb(Ⅱ) and Cd(Ⅱ) sorption on different layered double hydroxides.A kinetic and thermodynamic study and competing factors[J]. Chemical Engineering Journal, 269: 221–228.
DOI:10.1016/j.cej.2015.01.094
|
高旭, 李鹏, 王学刚. 2017. 絮凝与电絮凝对含铀废水的处理效果对比[J]. 环境工程学报, 2017, 11(2): 1–14.
|
胡遵素. 1994. 切尔诺贝利事故及其影响与教训[J]. 辐射防护, 1994, 14(5): 321–335.
|
Linghu W, Yang H, Sun Y, et al. 2017. One-pot synthesis of LDH/GO composites as highly effective adsorbents for decontamination of U(Ⅵ)[J]. ACS Sustainable Chemistry & Engineering, 5(6): 5608–5616.
|
Lv L, Sun P, Gu Z, et al. 2009. Removal of chloride ion from aqueous solution by ZnAl-NO(3) layered double hydroxides as anion-exchanger[J]. Journal of Hazardous Materials, 161(2/3): 1444–1449.
|
刘晨, 陈元涛, 张炜. 2017. KH-550改性埃洛石对水中铀酰离子吸附性能的研究[J]. 环境科学学报, 2017, 37(1): 243–248.
|
Merroun M L, Nedelkova M, Ojeda J J, et al. 2011. Bio-precipitation of uranium by two bacterial isolates recovered from extreme environments as estimated by potentiometric titration, TEM and X-ray absorption spectroscopic analyses[J]. Journal of Hazardous Materials, 197: 1–10.
DOI:10.1016/j.jhazmat.2011.09.049
|
Mohd Sidek H B, Jo Y K, Kim T W, et al. 2017. Enhancement of the water adsorptivity of metal-organic frameworks upon hybridization with layered double hydroxide nanosheets[J]. The Journal of Physical Chemistry C, 121(28): 15008–15016.
DOI:10.1021/acs.jpcc.7b02560
|
Nekhunguni P M, Tavengwa N T, and Tutu H. 2017. Sorption of uranium(Ⅵ) onto hydrous ferric oxide-modified zeolite:Assessment of the effect of pH, contact time, temperature, selected cations and anions on sorbent interactions[J]. Journal of Environmental Management, 204(Pt 1): 571–582.
|
Pan D, Fan Q, Fan F, et al. 2017. Removal of uranium contaminant from aqueous solution by chitosan@attapulgite composite[J]. Separation and Purification Technology, 177: 86–93.
DOI:10.1016/j.seppur.2016.12.026
|
Qin Q, Wang J, Zhou T, et al. 2017. Impact of organic interlayer anions on the CO2 adsorption performance of Mg-Al layered double hydroxides derived mixed oxides[J]. Journal of Energy Chemistry, 26(3): 346–353.
DOI:10.1016/j.jechem.2017.01.003
|
Rojas R. 2014. Copper, lead and cadmium removal by Ca Al layered double hydroxides[J]. Applied Clay Science, 87: 254–259.
DOI:10.1016/j.clay.2013.11.015
|
盛黎, 周斌, 孙明华. 2013. 日本福岛核事故对我国辐射环境影响的监测与分析[J]. 气象, 2013, 39(11): 1490–1499.
DOI:10.7519/j.issn.1000-0526.2013.11.013 |
Wang W, Zhou J, Achari G, et al. 2014. Cr(Ⅵ) removal from aqueous solutions by hydrothermal synthetic layered double hydroxides:Adsorption performance, coexisting anions and regeneration studies[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 457: 33–40.
|
Wang X, Li R, Liu J, et al. 2017. Melamine modified graphene hydrogels for the removal of uranium(Ⅵ) from aqueous solution[J]. New Journal of Chemistry, 41(19): 10899–10907.
DOI:10.1039/C7NJ01927K
|
Wang X, Li R, Liu J, et al. 2017. Melamine modified graphene hydrogels for the removal of uranium(ⅵ) from aqueous solution[J]. New Journal of Chemistry, 41(19): 10899–10907.
DOI:10.1039/C7NJ01927K
|
Wang X, Liu Q, Liu J, et al. 2017. 3D self-assembly polyethyleneimine modified graphene oxide hydrogel for the extraction of uranium from aqueous solution[J]. Applied Surface Science, 426: 1063–1074.
DOI:10.1016/j.apsusc.2017.07.203
|
王哲, 易发成, 冯媛. 2015. 铀在木纤维上的吸附行为及机理分析[J]. 原子能科学技术, 2015, 49(2): 263–272.
DOI:10.7538/yzk.2015.49.02.0263 |
Xie L, Zhong Y, Xiang R, et al. 2017. Sono-assisted preparation of Fe(Ⅱ)-Al(Ⅲ) layered double hydroxides and their application for removing uranium (Ⅵ)[J]. Chemical Engineering Journal, 328: 574–584.
DOI:10.1016/j.cej.2017.07.051
|
Yang D, Song S, Zou Y, et al. 2017. Rational design and synthesis of monodispersed hierarchical SiO2@layered double hydroxide nanocomposites for efficient removal of pollutants from aqueous solution[J]. Chemical Engineering Journal, 323: 143–152.
DOI:10.1016/j.cej.2017.03.158
|
Yang Y, Gao N, Deng Y, et al. 2012. Adsorption of perchlorate from water using calcined iron-based layered double hydroxides[J]. Applied Clay Science, 65-66: 80–86.
DOI:10.1016/j.clay.2012.04.030
|
Yin L, Wang P, Wen T, et al. 2017. Synthesis of layered titanate nanowires at low temperature and their application in efficient removal of U(Ⅵ)[J]. Environmental Pollution, 226: 125–134.
DOI:10.1016/j.envpol.2017.03.078
|
Yu X, Chang Z, Sun X, et al. 2011. Co-production of high quality NH4SCN and sulfur slow release agent from industrial effluent using calcined MgAl-hydrotalcite[J]. Chemical Engineering Journal, 169(1/3): 151–156.
|
Yue X, Liu W, Chen Z, et al. 2017. Simultaneous removal of Cu(Ⅱ) and Cr(Ⅵ) by Mg-Al-Cl layered double hydroxide and mechanism insight[J]. Journal of Environmental Sciences, 53: 16–26.
DOI:10.1016/j.jes.2016.01.015
|
Zakrzewska-Trznadel G. 2013. Advances in membrane technologies for the treatment of liquid radioactive waste[J]. Desalination, 321: 119–130.
DOI:10.1016/j.desal.2013.02.022
|
Zhang Q, Lu T, Wei N, et al. 2017. Synthesis of pure-phase uranium-doped YAG powder via co-precipitation method[J]. Materials Letters, 188: 396–398.
DOI:10.1016/j.matlet.2016.11.093
|
张钱, 吴平霄. 2011. 煅烧阴离子粘土(LDO)对低浓度活性艳橙X-GN的吸附研究[J]. 环境科学学报, 2011, 31(4): 770–776.
|
张琼, 陈金融, 张春明. 2012. 福岛事故后土壤放射性污染修复及启示[J]. 中国科技投资, 2012(18): 54–56.
DOI:10.3969/j.issn.1673-5811.2012.18.019 |
Zhu H, Duan S, Chen L, et al. 2017. Plasma-induced grafting of acrylic acid on bentonite for the removal of U(Ⅵ) from aqueous solution[J]. Plasma Science and Technology, 19(11): 38–47.
|
Zou Y, Wang P, Yao W, et al. 2017. Synergistic immobilization of UO22+ by novel graphitic carbon nitride@layered double hydroxide nanocomposites from wastewater[J]. Chemical Engineering Journal, 330: 573–584.
DOI:10.1016/j.cej.2017.07.135
|
Zou Y, Wang X, Wu F, et al. 2016. Controllable Synthesis of Ca-Mg-Al Layered Double Hydroxides and Calcined Layered Double Oxides for the Efficient Removal of U(Ⅵ) from Wastewater Solutions[J]. ACS Sustainable Chemistry & Engineering, 5(1): 1173–1185.
|
 2018, Vol. 38
2018, Vol. 38


