2. 密歇根科技大学, 林业资源与环境科学学院, 霍顿 MI 49932
2. School of Forest Resources and Environmental Science, Michigan Technological University, Houghton, MI 49932
从废水中回收重金属离子一直是环境领域的热点问题(王建龙等, 2011; Fu et al., 2011).采用以萃取、离子交换等原理为主的工程技术已被报道用于富集废水中的高浓度重金属离子(Fu et al., 2011; De Namor et al., 2012).研究发现, 在纯化低浓度重金属离子时, 多依靠具有特异官能团的络合试剂进行萃取(Okoro et al., 2011), 存在步骤繁琐、价格昂贵等不足(De Namor et al., 2012), 进而限制了该技术的广泛应用.
目前, 对于废水中低浓度重金属离子的去除多采用混凝沉淀方法, 通过投加混凝剂使重金属离子由水相转移到固相中(Tang et al., 2016).例如, 铁盐混凝剂, 其水解生成羟基官能团(≡Fe—O—H), 对水中重金属离子或胶体颗粒具有高亲和性, 可通过吸附和共沉淀方式将废水中低浓度的重金属离子去除(Tang et al., 2016; Jiang et al., 1998).然而, 混凝沉淀法产生的含重金属废泥属于典型的危险废物, 需要合理处置后才能安全填埋(Li et al., 2016).从这类废弃物中高纯富集重金属离子, 其关键在于去除杂质, 如铁盐混凝引入的含铁杂质.尽管铁是一种活泼金属离子, 可以通过pH调节促进铁离子水解生成沉淀而从水中去除, 包括硫化物沉淀、草酸沉淀、磷酸盐沉淀等(Binnemans et al., 2013), 但铁离子的共沉淀效应使重金属离子重新进入固相中, 进而产生新的含重金属固体废弃物(Lewis, 2010), 且会显著降低重金属的回收效率.
基于此, 本文采用铁混凝去除低浓度重金属, 并通过高效分离铁实现重金属离子的高纯富集, 以克服传统方法中重金属保留率低和杂质铁含量高的缺陷, 并为其在重金属离子回收与纯化方面的应用提供参考.
2 试验与方法(Experimental and methods) 2.1 电镀废水的预处理电镀废水取自吉林省某企业电镀车间出水口, 废水中Ni2+和Zn2+浓度分别为11.3 mg·L-1和7.2 mg·L-1.向5 m3的电镀废水反应槽中加入剂量为470 mg·L-1的聚铁混凝剂, 使用5% NaOH调节pH到8后, 在90~120 r·min-1下持续搅拌10 min, 静置24 h后收集底部的混凝污泥.收集的污泥在50 ℃下真空干燥24 h后备用.
2.2 污泥中铁的分离向1.5 mol·L-1硝酸溶液中加入污泥, 在90~120 r·min-1下持续搅拌, 待硝酸溶液的pH到0.6时停止加入污泥, 由此得到含有Fe3+、Ni2+和Zn2+的硝酸溶液.溶液中Fe3+浓度为12.2 g·L-1, Ni2+和Zn2+浓度分别为2.3 g·L-1和1.5 g·L-1, 是废水中Ni2+和Zn2+浓度的近200倍.
分别采用直接沉淀法(命名为M1)、水热沉淀法(命名为M2)和水热辅助沉淀法(命名为M3)对硝酸溶液进行处理, 具体步骤如下.
① 直接沉淀法M1:取500 mL硝酸溶液, 利用5% NaOH调节溶液的pH到5.5, 静置24 h后, 底部生成黄棕色沉淀, 上清液收集备检测;沉淀在5500 r·min-1下离心5 min后, 接着在-80 ℃下冷冻干燥12 h后收集备表征.
② 水热沉淀法M2:取30 mL硝酸溶液, 放入50 mL的聚四氟乙烯反应釜中, 将反应釜密封后放入鼓风干燥箱中, 直接升温到160 ℃后开始计时, 恒温6 h后取出, 自然冷却到室温, 反应釜底部生成红色沉淀;沉淀和上清液的处理方法同直接沉淀法M1.
③ 水热辅助沉淀法M3:取30 mL硝酸溶液, 放入50 mL的聚四氟乙烯反应釜中, 向反应釜中加入物质的量比为1的乙酰丙酸(乙酰丙酸与硝酸溶液中铁的物质的量比);将反应釜密封后放入鼓风干燥箱中, 后续处理方法与M2相同.
2.3 水热辅助沉淀法除铁试验向一系列50 mL反应釜中加入30 mL硝酸溶液, 加入物质的量比为1的乙酰丙酸, 按照2.2节中的水热辅助沉淀法进行后续试验.在时间间隔为0.25、0.5、1、2和4 h时取出3个反应釜, 分离底部沉淀和上清液, 按照前述步骤处理后备分析表征.
2.4 检测与表征采用离子色谱仪(881 pro, 瑞士万通)检测废水、酸溶液和上清液中的NO3-浓度.采用电感耦合等离子发射光谱仪(Avio-200, 美国PE)检测水中Fe3+、Ni2+和Zn2+浓度.产生的沉淀分别采用X-射线衍射仪(XRD, Rint2200, 日本理化)和扫描电镜(SEM, JSM-6400, 日本电子)进行分析.
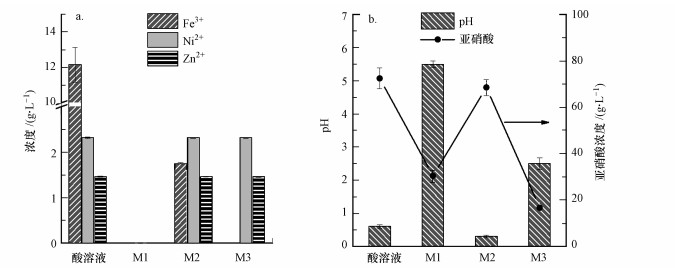
3 结果与讨论(Results and discussion) 3.1 三种方法的除铁效果高纯回收废水中的Ni2+和Zn2+, 其关键在于去除溶液中的主要杂质Fe3+.如图 1a所示, 硝酸溶液中Fe3+、Ni2+和Zn2+浓度分别为12.2、2.3和1.5 g·L-1.硝酸溶液经过直接沉淀法M1处理后, 上清液中Fe3+、Ni2+和Zn2+浓度分别为0.003、0.15和0.07 mg·L-1, 表示溶液中的Fe3+、Ni2+和Zn2+被去除.同时, 溶液中NO3-浓度由初始的72.5 g·L-1降低到30.5 g·L-1(图 1b).直接沉淀法不会导致溶液中发生明显的氧化还原反应, 因此, 溶液中Fe3+、Ni2+和Zn2+和硝酸盐的去除主要是由于pH调节诱发Fe3+的自然水解, 从而产生黄棕色的含铁水合物, 其表面具有丰富的表面位点可吸附溶液中的重金属离子和硝酸盐.吸附到含铁水合物表面的Ni2+和Zn2+与硝酸盐随着含铁水合物的进一步聚合, 最终进入到沉淀相中.由此可见, 直接调节溶液pH促使铁沉淀的过程中, 会出现Fe3+与Ni2+、Zn2+的共沉淀, 这不利于获得高纯度和高浓度的Ni2+和Zn2+.
 |
| 图 1 酸溶液和3种上清液中Fe3+、Ni2+和Zn2+的浓度(a)和pH值及亚硝酸浓度(b) Fig. 1 Concentrations of Fe3+, Ni2+ and Zn2+(a) and pH and nitrate concentration (b) of the acid leaching solution and the three supernatants |
采用水热沉淀法M2对硝酸溶液进行处理后, 上清液中Fe3+、Ni2+和Zn2+浓度分别为1.76、2.3和1.5 g·L-1(图 1a), 溶液中85.6%的铁被去除, 而Ni2+和Zn2+浓度保持不变, 表明直接水热法可以有效去除铁, 且具有高的Ni2+和Zn2+保留率.另外, 溶液中NO3-浓度由初始的72.5 g·L-1轻微降低到68.5 g·L-1 (图 1b), 这属于NO3-在水热条件下的自动分解, 产物主要为氮氧化物(Wieczorek-Ciurowa et al., 1999).经过直接水热处理后, 溶液的pH下降到0.3(图 1b), 这是由于溶液中Fe3+的水解消耗OH-, 进而产生H+的残留. Fe3+的水解行为将在3.5节中解释.经过直接水热处理后, 上清液中铁的残留量仍为1.76 g·L-1, 其作为杂质离子会影响Ni2+和Zn2+的纯度, 需要进一步深度去除.
为进一步去除溶液中的铁同时维持高的Ni2+和Zn2+保留率, 利用水热辅助沉淀法(M3)处理硝酸溶液, 通过添加乙酰丙酸作为辅助试剂, 促进溶液中Fe3+的沉淀.经过处理后, 上清液中Ni2+和Zn2+浓度保持不变, 而铁的残留浓度仅为0.78 mg·L-1, 显著低于水热沉淀法M2中铁的残留量.反应结束后上清液的pH上升到2.5, 硝酸盐浓度降低到16.8 g·L-1(图 1b), 这是由于乙酰丙酸的加入促进了硝酸盐的还原, 在这个过程中消耗了溶液中的H+.
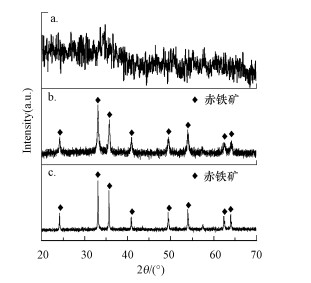
3种方法处理硝酸溶液后均产生了沉淀, 其晶型结构采用XRD进行分析, 结果如图 2所示.直接沉淀法M1产生沉淀的谱图(图 2a)显示, 在2θ=35.2°处出现了一个宽衍射峰, 对应弱结晶态的铁氢氧化物(Zhu et al., 2018).与M1产生的沉淀相比, 水热沉淀法M2产生沉淀的XRD谱(图 2b)中出现了强烈的赤铁矿衍射峰(JCPDS 33-0664), 显示直接水热法产生的沉淀是具有良好结晶的赤铁矿.水热辅助沉淀法M3产生沉淀的XRD谱(图 2c)显示了与M2相同的赤铁矿衍射峰.
 |
| 图 2 M1 (a)、M2(b)和M3(c)方法产生沉淀的X射线衍射谱分析 Fig. 2 XRD patterns of the precipitates generated by the method M1(a), M2(b) and M3 (c) |
3种方法产生沉淀的形貌如图 3所示.直接沉淀法M1产生的沉淀为铁氢氧化物, 是团聚的块状体(图 3a), 其对应EDS谱图中清晰地展示了铁、镍和锌的均匀分布, 证实溶液中Ni2+和Zn2+吸附到铁氢氧化物表面, 通过共沉淀从溶液中去除.直接水热法M2产生的赤铁矿沉淀是尺寸为200 nm~1 μm的球形颗粒(图 3b), 其对应EDS谱中没有明显的镍和锌分布, 表明产生的赤铁矿沉淀中没有明显的引入Ni2+和Zn2+.水热辅助沉淀法M3产生的赤铁矿颗粒其尺寸进一步减少到100~400 nm(图 3c), 颗粒表面呈现均匀的铁分布特征, 没有观察到明显的镍和锌的分布, 表明添加乙酰丙酸产生的赤铁矿沉淀与M2的相似, 没有掺杂Fe3+、Ni2+和Zn2+.
 |
| 图 3 M1(a)、M2(b)和M3(c)方法产生沉淀的形貌 Fig. 3 SEM images of the precipitates generated by the method M1(a), M2(b) and M3(c) |
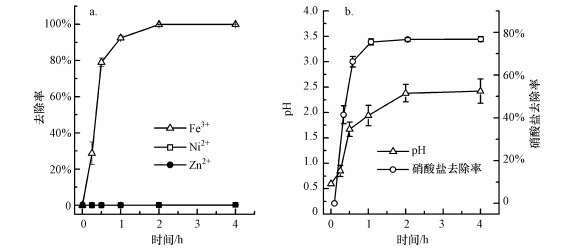
进一步分析了水热时间对水热辅助沉淀法除铁过程的影响, 结果如图 4所示.经过水热处理0.25 h后, 铁的去除率达到28.7%, 并在2 h后迅速增大到99.8%, 在4 h后接近100%, 而镍和锌的去除率低于0.05%(图 4a).溶液的pH变化呈现出与铁的去除率相似的规律, 初始阶段为0.6, 经过0.25 h水热处理后轻微增大到0.85, 在2 h后接近2.38, 最终稳定在2.42(图 4b).相应地, 硝酸盐的去除率在0.25 h为41.3%, 2 h后达到76.6%, 最终稳定在76.8%(图 4b).进一步使用SPSS软件进行相关性分析, 发现铁的去除与pH变化和硝酸盐去除的相关系数分别为0.971(p=0.006)和0.997(p=0.000), 表明铁的去除与溶液的pH变化和硝酸盐去除呈现显著相关性.
 |
| 图 4 水热时间对铁、镍、锌去除(a)及硝酸盐去除和pH变化(b)的影响 Fig. 4 Time-course of Fe, Ni and Zn removal(a), and nitrate removal and pH change(b) by hydrothermal treatment with the addition of acetylpropionic acid |
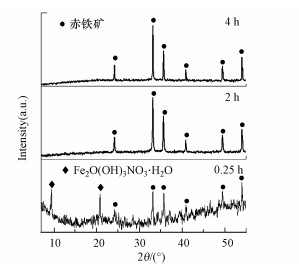
水热反应0.25 h生成的沉淀呈块状(图 5a), 表面有少量细小颗粒(图 5b), 其XRD谱中存在赤铁矿和氢氧化铁硝酸盐水合物(Fe2O(OH)3NO3·H2O, JCPDS No. 89-6191)的特征峰(图 6), 证明初期沉淀是赤铁矿和氢氧化铁硝酸盐水合物的混合物.经过2 h水热处理后, 产生的沉淀是细小颗粒的团聚体(图 5c), 其XRD谱中呈现明显的赤铁矿特征峰, 并未观察到氢氧化铁硝酸盐水合物的特征峰(图 6).推测氢氧化铁硝酸盐水合物为铁沉淀的初级产物, 其为块状团聚物, 通过原位相变生成细小的赤铁矿颗粒.继续延长水热时间到4 h, 产生的沉淀为分散细小颗粒(图 5d), 尺寸为20~100 nm, 其XRD谱与2 h时的谱图相似, 呈现明显的赤铁矿特征峰(图 6).
 |
| 图 5 水热处理0.25 h(a、b)、2 h(c)和4 h(d)产生沉淀的扫描电镜图 Fig. 5 SEM images of deposits after hydrothermal treatment for 0.25 h (a, b), 2 h (b), and 4 h (c) |
 |
| 图 6 水热时间分别为0.25 h、2 h和4 h产生沉淀的XRD图 Fig. 6 XRD patterns of the deposits after hydrothermal treatment for 0.25 h, 2 h and 4 h |
硝酸溶液中含有高浓度的NO3-和Fe3+, 在水热条件下Fe3+发生水解反应, 其步骤可分为两个部分.首先, 在密闭高温条件下, Fe3+发生水解生成Fe(OH)(NO3)2、Fe(OH)2(NO3)和Fe(OH)3(式(1)~(3))(Šubrt et al., 1992).接着, 两个相邻的初步水解产物表面的羟基基团缩聚脱水, 形成Fe—O—Fe结构并促使两个相邻的水解产物聚合(式(4))(Schwertmann et al., 1999).随着聚合反应的进行, 最终产物为高结晶度的赤铁矿(式(5)和(6)).在铁的水解过程中, OH-参与了铁的水解产物的形成, 剩余H+并导致溶液pH降低.在强酸性条件下, 铁水解聚合产生的中间产物, 其表面羟基基团(≡Fe—O—H)并不会参与配位溶液中的Ni2+和Zn2+.这是因为当羟基基团参与配位Ni2+和Zn2+后, 两个相邻中间产物之间的缩聚行为受到抑制, 此时, 溶液中含有高浓度的H+, 与产物表面羟基基团配位的Ni2+和Zn2+发生交换反应, 重新生成未配位的羟基基团(≡Fe—O—H)并参与缩聚反应, 最终生成高结晶度的赤铁矿.然而水热条件下, 溶液中H+的积累与浓度稳定, 会使铁的水解达到平衡状态, 导致溶液中存在残留的高浓度Fe3+.
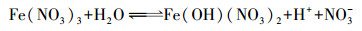
|
(1) |

|
(2) |

|
(3) |

|
(4) |
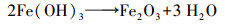
|
(5) |

|
(6) |
乙酰丙酸是一种有机物, 在水热条件下可以被溶液中的NO3-氧化为小分子有机物, 并进一步转化为CO2和H2O(式(7))(Fanning, 2000).在这个过程中, NO3-浓度下降, 相应地促进了铁水解中间产物的缩聚.另外, 乙酰丙酸与NO3-的反应会消耗溶液中的H+, 导致溶液pH上升到2.5, 这有助于水热条件下铁的水解, 促进高结晶度赤铁矿颗粒的生成.
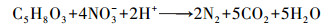
|
(7) |
在含重金属废水处理中, 通过投加混凝剂不仅可以高效去除水中低浓度的重金属离子, 还可以去除水中部分有机物, 其产生的沉淀属于危险废物.实现这类废弃物的资源化利用具有明显的经济效益与环境效益.本方法使用铁盐混凝剂可以直接取代当前重金属废水处理中普遍使用的铝盐混凝剂, 而不用改变重金属废水处理的主体工艺;产生的废泥经过硝酸溶解和水热处理后, 即可获得含高纯富集重金属离子的溶液和高纯的赤铁矿产品.其中, 含高纯重金属离子的溶液经过简单的pH调节或草酸沉淀后, 即可用于制备高纯的重金属产品.另外, 高纯的赤铁矿产品也是一种具有较高经济价值的工业原材料.
本方法不仅可用于富集废水中的低浓度重金属离子, 也可用于金属或金属氧化物产品中铁杂质的去除.如采用本方法可以将Nd-Fe-B废料中高含量的铁去除, 获得高纯度和高浓度稀土离子的溶液, 由此避免了使用昂贵的除铁萃取剂, 也提高了稀土萃取剂的利用效率.可见, 本方法在环境污染治理和冶金领域具有明显的应用前景.
4 结论(Conclusions)利用聚铁混凝剂处理电镀废水, 可以有效沉淀废水中的低浓度Ni2+和Zn2+, 由此产生的重金属污泥中的杂质铁可以通过硝酸溶解和水热辅助沉淀法去除.在水热过程中, Fe3+自动水解生成高纯度的纳米级赤铁矿颗粒, 上清液中Fe3+残留浓度小于1 mg·L-1, 而上清液中Ni2+和Zn2+没有明显损耗, 其浓度分别为2.3和1.5 g·L-1, 接近电镀废水中Ni2+和Zn2+浓度的200倍.本方法不仅可以高纯富集Ni2+和Zn2+, 而且可以产生高纯度的赤铁矿沉淀, 从而实现了废水中低浓度重金属离子的资源化利用.
Binnemans K, Jones P T, Blanpain B, et al. 2013. Recycling of rare earths:a critical review[J]. Journal of Cleaner Production, 51: 1–22.
DOI:10.1016/j.jclepro.2012.12.037
|
De Namor A F, Gamouz A E, Frangie S, et al. 2012. Turning the volume down on heavy metals using tuned diatomite.A review of diatomite and modified diatomite for the extraction of heavy metals from water[J]. Journal of Hazardous Materials, 241: 14–31.
|
Fanning J C. 2000. The chemical reduction of nitrate in aqueous solution[J]. Coordination Chemistry Reviews, 199(1): 159–179.
DOI:10.1016/S0010-8545(99)00143-5
|
Fu F, Wang Q. 2011. Removal of heavy metal ions from wastewaters:a review[J]. Journal of Environmental Management, 92(3): 407–418.
DOI:10.1016/j.jenvman.2010.11.011
|
Jiang J, Graham N J. 1998. Pre-polymerized inorganic coagulants and phosphorus removal by coagulation-A review[J]. Water S.A, 24(3): 237–244.
|
Lewis A E. 2010. Review of metal sulphide precipitation[J]. Hydrometallurgy, 104(2): 222–234.
DOI:10.1016/j.hydromet.2010.06.010
|
Li Y C, Min X B, Chai L Y, et al. 2016. Co-treatment of gypsum sludge and Pb/Zn smelting slag for the solidification of sludge containing arsenic and heavy metals[J]. Journal of Environmental Management, 181: 756–761.
DOI:10.1016/j.jenvman.2016.07.031
|
Okoro H K, Fatoki O S, Adekola F A, et al. 2012. A review of sequential extraction procedures for heavy metals speciation in soil and sediments[J]. Journal of Environmental and Analytical Toxicology.
DOI:10.4172/scientificreports.181
|
Schwertmann U, Friedl J, Stanjek H, et al. 1999. From Fe (Ⅲ) ions to ferrihydrite and then to hematite[J]. Journal of Colloid and Interface Science, 209(1): 215–223.
DOI:10.1006/jcis.1998.5899
|
Subrt J, Stengl V, Skokanek M, et al. 1992. Decomposition of ferrihydrite prepared from Fe(NO3)3 aqueous solutions under varying pH[J]. Thermochimica Acta, 211: 107–119.
DOI:10.1016/0040-6031(92)87011-X
|
Tang X, Zheng H, Teng H, et al. 2016. Chemical coagulation process for the removal of heavy metals from water:a review[J]. Desalination and Water Treatment, 57(4): 1733–1748.
DOI:10.1080/19443994.2014.977959
|
Wieczorek-Ciurowa K, Kozak A J. 1999. The thermal decomposition of Fe(NO3)3·9H2O[J]. Journal of Thermal Analysis and Calorimetry, 58(3): 647–651.
DOI:10.1023/A:1010112814013
|
王建龙, 陈灿. 2010. 生物吸附法去除重金属离子的研究进展[J]. 环境科学学报, 2010, 30(4): 673–701.
|
Zhu S, Zhu J, Fan W, et al. 2018. Influence of proteins on transport of ferrihydrite particles formed during recharge of groundwater containing Fe with reclaimed water[J]. Water, 10(10): 1329.
DOI:10.3390/w10101329
|
 2019, Vol. 39
2019, Vol. 39


