2. 上海污染控制与生态安全研究院, 上海 200092
2. Shanghai Institute of Pollution Control and Ecological Security, Shanghai 200092
目前全球范围内的水资源短缺和污染问题日趋严重, 而我国的水资源分布情况随地区和时间的不同存在着较大差异, 且随着经济持续增长、人口快速增加及城市化发展, 对水的需求也急剧增加, 这进一步加剧了水资源的短缺(张利平等, 2009).此外, 工业废水的排放、农业化肥的使用及城镇生活污水的排放, 导致地表水污染现状愈发严重, 其中, 氨氮已成为我国饮用水源水中主要的污染物质.调查表明, 氨氮在地表水体超标污染物中的出现频率非常高, 且呈逐年加重的趋势, 多数水体的氨氮含量均超过了《生活饮用水卫生标准》(GB5749- 2006)中的限值, 即在4 mg · L-1以上(刘刚, 2011).由此可见, 解决饮用水中氨氮污染问题已成为我国水处理领域的重要内容.
目前, 饮用水中氨氮的处理技术按照反应机理可划分为三大类:物理化学法、化学法和生物法.物理化学法包括离子交换、曝气、反渗透、吸附技术、电化学处理等, 化学法主要为折点加氯法, 生物法主要是硝化反硝化和藻类繁殖等, 但上述方法在控制氨氮问题方面均有局限性.近年来, 一种高级氧化-紫外/氯组合工艺被广泛应用于降解水体中的污染物, 相比UV/H2O2高级氧化工艺, 自由氯的摩尔吸光系数比H2O2要高得多, 且自由氯在紫外光照射下光解不仅可产生羟基自由基(· OH), 还会生成氯自由基(· Cl)等强氧化性活性物质, 这些具有强氧化性的自由基可有效降解水中的污染物质 (Nowell et al., 1992).有研究显示, 采用紫外/氯组合工艺可有效去除甲醇、氯苯甲酸、三氯乙烯等新兴污染物(Sichel et al., 2011;Wang et al., 2012).陈成等(2009)研究表明, 紫外/氯组合工艺能有效去除水中的内分泌干扰物阿特拉津, 使出水毒性大幅降低.Sichel等(2011)发现, 紫外/氯高级氧化工艺在降解苯并三唑、甲基苯并三氮唑和碘帕醇时效能明显高于紫外/双氧水组合工艺.Xiang等(2016)也证实了紫外/氯高级氧化工艺在去除新兴污染物方面较紫外/双氧水组合工艺具有显著的优势.但紫外/氯组合工艺对不同有机物的去除效率、影响因素和反应机理均不同(Fang et al., 2014), 这与有机物的分子结构以各类自由基与目标污染物的反应活性有关.
紫外/氯组合工艺机理虽已得到广泛而深入的研究, 但有关其去除水中氨氮的研究却鲜有报道.目前, 这方面的研究尚处于初级阶段, 且缺乏相应的实际经验.因此, 有关紫外/氯组合工艺对氨氮的去除效能及去除氨氮过程中的影响因素等研究均有待深入.基于此, 本文通过研究紫外/氯组合工艺对原水中氨氮的去除效能, 明确各工艺参数及水质情况对紫外/氯组合工艺去除氨氮的影响, 以更好地实现饮用水中氨氮的去除.
2 材料与方法(Materials and methods) 2.1 实验试剂与仪器实验中使用的无机试剂硫酸、氢氧化钠、磷酸二氢钾、氯化铵、无水硫酸钠、高锰酸钾、双氧水、氯化钠等均为优级和分析纯, 购自国药集团化学试剂有限公司(上海).常规水质指标溶解性有机碳(DOC)、氨氮(NH4+-N)、亚硝酸盐氮(NO2--N)、硝酸盐氮(NO3--N)、总溶解性氮(TN)的标准品和离子色谱混标标准品均购自国家环境保护总局标准样品研究所.实验中所需要使用的次氯酸纳溶液(5%有效氯)购自Sigma-Aldrich公司, 使用次氯酸钠前其有效氯含量采用DPD-AES法标定.实验配置的溶液均采用超纯水配置, 超纯水由Milli-Q(Reference型, 美国Millpore公司)纯水机制备.
实验中主要测试指标包括DOC、TN、NH4+-N、NO2--N、NO3--N和pH.DOC和TN的测试方法为燃烧法, 使用仪器设备为岛津TOC-L(Shimadzu, Japan).NH4+-N测定采用纳氏试剂法, 利用紫外分光光度计测定样品在420 nm波长处的吸光度.NO2--N和NO3--N采用戴安ICS-2000离子色谱进行测定.pH采用SensIon4 pH计(HACH, USA)测定.
2.2 实验方法取50 mL超纯水配置的氯化铵溶液于清洁烧杯中, 并将烧杯置于磁力搅拌器上搅拌.加入磷酸二氢钾-氢氧化钠缓冲液, 使得水样中缓冲液的浓度达到10 mmol · L-1.然后, 快速调节水样pH至设计的pH值.将水样倒入石英玻璃试管中, 加入一定量的自由氯后快速放入紫外反应器进行紫外照射并计时, 紫外/氯实验采用的紫外辐照反应器为南京胥江机电厂生产的XPA-7型多试管搅拌光化学反应仪, 由光源、石英冷阱、石英试管、反应容器、滤光装置、多试管搅拌装置、旋转装置、通气系统、水槽、微型水泵、挡光罩等部分组成.在实验过程中, 分别采用中压和低压汞灯照射, 中压汞灯的功率为300 W, 低压汞灯的功率为11 W, 在该反应器中, 样品在石英试管内围绕光源匀速旋转同时进行磁力搅拌并均匀接受光照.此外, 紫外辐照反应器还与一个恒温水浴箱相连, 通过内部微型水泵和外部蠕动泵的联合作用循环水槽中的水, 使得水槽中的水不断经过水浴箱, 从而保证试管中的反应样品温度恒定.照射结束后取出石英玻璃试管, 并取样测试所需指标.
3 结果与讨论(Results and discussion) 3.1 紫外剂量对紫外/氯组合工艺效能的影响超纯水配置的NH4Cl溶液的起始浓度为2 mg · L-1(以N计), 磷酸盐缓冲溶液浓度为10 mmol · L-1, 初始pH=7, 控制Cl2/N=0.8, 反应温度控制为25 ℃, 加氯后马上进行紫外照射, 采用低压汞灯照射, 汞灯的功率为11 W, 紫外照射强度为245 μW · cm-2, 分别在紫外辐照剂量为30、60、100、200、400、600、800和1000 mJ · cm-2时测定氨氮、一氯胺、亚硝酸盐氮、硝酸盐氮和总氮浓度, 实验结果如图 1所示.
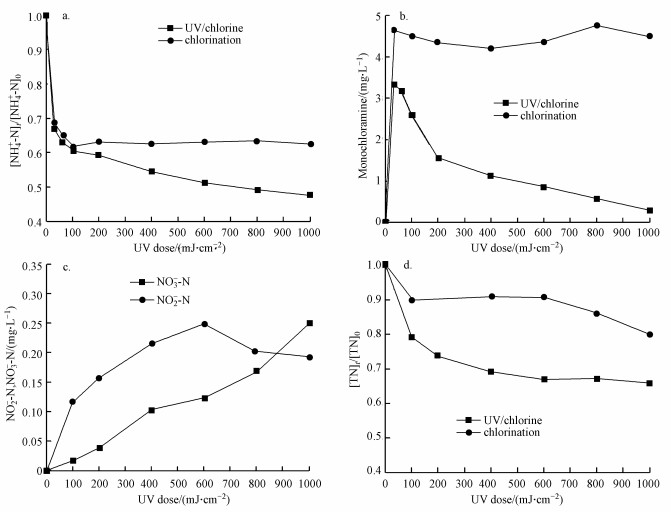 |
| 图 1 紫外/氯过程中氨氮(a)、一氯胺(b)、NO2--N和NO3--N (c)及总氮(d)随紫外剂量的变化规律 Fig. 1 Variation of NH4+-N(a), monochloramine(b), NO2--N/NO3--N (c) and TN (d)with UV dose during the UV/chlorine process |
从图 1a中可以看出, 随着紫外辐照剂量的增加, 氨氮含量逐渐减少, 当紫外辐照剂量达到1000 mJ · cm-2时, 氨氮的去除率达到53%, 比单独氯化条件下提高了近20%.但无论是在紫外/氯组合工艺条件还是在单独氯化工艺条件下, 氨氮含量都是在紫外辐照剂量为100 mJ · cm-2时陡减, 随后紫外/氯组合工艺下对氨氮的去除率缓慢减小, 而单独氯化工艺无法再去除氨氮.这是因为当Cl2/N=0.8时, 氨氮与次氯酸反应生成氯胺(一氯胺、二氯胺和三氯胺), 具体如反应式如(1)~(3)所示, 在该条件下生成一氯胺的反应速率常数远远高于其他氯胺(Deborde et al., 2008), 从而使氨氮含量迅速减少, 大量生成一氯胺.随着紫外辐照剂量的增加, 一氯胺在低压汞灯254 nm波长下逐渐光解(Chuang et al., 2017), 而在黑暗条件下一氯胺浓度(以Cl2计)基本不变(图 1b).从而有紫外存在的条件下氨氮会继续降解, 而单独氯化作用无法进一步降解生成的氯胺.
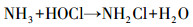
|
(1) |
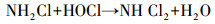
|
(2) |
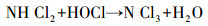
|
(3) |
据文献报道, 一氯胺在254 nm处的摩尔吸光系数为354 L · mol-1 · cm-1, 量子产率为0.68 mol · E-1, 254 nm紫外光能促进N—Cl键的裂解, 生成氨基和氯自由基(Li et al., 2009).此外, 次氯酸和次氯酸根在254 nm紫外光照下也能产生羟基自由基和氯自由基等, 这些活性自由基均能有效促进氨氮转化.在氧气存在条件下, 氨基能通过一系列反应生成硝酸根和亚硝酸根(De Laat et al., 2010), 反应式如式(4)~(8)所示.在紫外辐照剂量分别为30、60、100、200、400、600、800和1000 mJ · cm-2时测定硝酸盐和亚硝酸盐浓度, 其试验结果如图 1c所示, 可以发现, 随着紫外辐照剂量的增加, 硝酸盐的浓度呈现逐渐增加的趋势, 亚硝酸盐的浓度呈现先增加后减少的趋势.这是因为随着时间的增加, 亚硝酸盐会进一步被氧化为硝酸盐(式(8)).
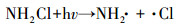
|
(4) |
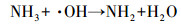
|
(5) |
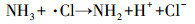
|
(6) |
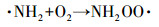
|
(7) |

|
(8) |
从图 1d中可以看出, 在紫外/氯组合工艺条件下, TN浓度逐渐减小, 当紫外辐照剂量达到1000 mJ · cm-2时, TN的去除率达到35%, 相比于单独氯化, 紫外/氯组合工艺对TN的去除率提高了15%.TN浓度的减小表明整个反应体系中有气态氮生成, 可能有N2产生.也有研究表明, 在一氯胺的光解过程中可能会产生N2O(Schreiber et al., 2007), 反应如式(9)~(10)所示.

|
(9) |
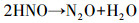
|
(10) |
超纯水配置的NH4Cl溶液的起始浓度为2 mg · L-1(以N计), 磷酸盐缓冲溶液浓度为10 mmol · L-1, 初始pH=7, 控制紫外辐照剂量为1000 mJ · cm-2, 反应温度控制为25 ℃, 控制Cl2/N(物质的量比)分别为0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6和1.8, 加氯后立刻进行紫外照射, 反应后分别测定不同Cl2/N比时的氨氮浓度, 结果如图 2所示.
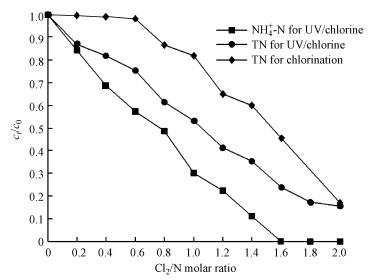 |
| 图 2 紫外/氯过程中氨氮和总氮随Cl2/N的变化规律 Fig. 2 Variation of NH4+-N and TN with Cl2/N during the UV/chlorine process |
从图 2中可以看出, 当Cl2/N≥1.6时, 紫外/氯组合工艺条件下氨氮的去除率接近100%.当Cl2/N<0.6时, 单独氯化工艺条件下TN浓度基本不变, 而当Cl2/N>1.6时, 氯化条件下TN浓度迅速减小, 这与折点加氯的结果一致.当Cl2/N<0.6时, 紫外/氯工艺条件下TN的去除率比单独氯化条件下提高了30%左右.因此, 在处理实际氨氮含量较高的原水时, 相比单独加氯的工艺, 采用紫外/氯组合工艺可以减少加氯量而不影响氨氮的去除效果.
3.3 pH对紫外/氯组合工艺效能的影响超纯水配置的NH4Cl溶液的起始浓度为2 mg · L-1(以N计), 磷酸盐缓冲溶液浓度为10 mmol · L-1, 分别控制pH=5.5、7.0和8.5, 控制紫外辐照剂量为1000 mJ · cm-2, 反应温度控制为25 ℃, 加氯后立刻进行紫外照射, 在不同pH条件下, 分别测定反应后不同Cl2/N时的氨氮浓度, 实验结果如图 3所示.
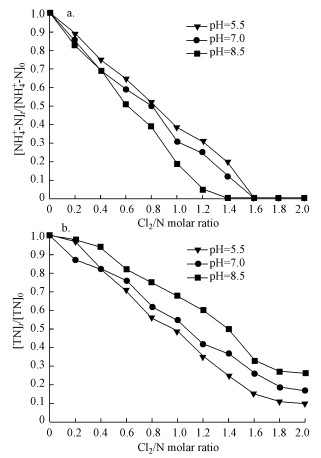 |
| 图 3 紫外/氯过程中不同pH条件下氨氮(a)和总氮(b)随Cl2/N的变化规律 Fig. 3 Variation of NH4+-N(a) and TN (b)with Cl2/N at different pH during the UV/chlorine process |
从图 3a中可以看出, 当Cl2/N<1.6时, 在相同的Cl2/N条件下, 不同pH下氨氮的去除率大小排序为:pH=8.5>pH=7>pH=5.5.这是因为当pH=8.5时, 加氯后生成的氯胺中一氯胺浓度较高, 从而通过一氯胺的光解实现了较高的氨氮去除率;而当pH=5.5时较容易生成二氯胺(Jafvert et al., 1992), 此时加氯后生成一氯胺的浓度相对较低, 通过光解作用去除的氯胺减少, 因此, 氨氮的去除率也相对降低.从图 3b中可以看出, 在相同的Cl2/N条件下, 不同pH下TN的去除率大小排序为:pH=5.5>pH=7>pH=8.5, 这与氨氮的去除率呈相反的规律.这是因为次氯酸光解会产生· OH和· Cl等活性自由基, 有研究表明, · OH和· Cl是起主要作用的活性基团, 而在pH=2和pH>7的条件下· Cl起主要作用(Li et al., 2016), 在酸性环境下· OH起主要作用, 且· OH的氧化性强于· Cl, 因此, 在pH=5.5的条件下, TN的去除率更高.
3.4 紫外光源对紫外/氯组合工艺效能的影响低压汞灯和中压汞灯都是水处理中常见的两种UV灯光源, 前者主要释放254 nm的单色光, 而后者可发射180~400 nm的紫外光.相比于传统的低压汞灯, 中压汞灯将输入的能量转化为杀菌输出时的效率更低, 但中压汞灯却能产生更高的总杀菌光强(Linden et al., 1997), 而且中压汞灯具有多谱段杀菌的特性, 对微生物不同部位都有很大的破坏作用.为了比较低压汞灯和中压汞灯光源在紫外/氯组合工艺中对氨氮的去除效果, 本文进行了以下研究:超纯水配置的NH4Cl溶液的起始浓度为2 mg · L-1(以N计), 磷酸盐缓冲溶液浓度为10 mmol · L-1, 初始pH=7, 控制Cl2/N=0.8, 反应温度控制为25 ℃, 加氯后立刻进行紫外照射, 分别使用低压和中压汞灯照射, 汞灯的功率分别为11 W和300 W, 紫外照射强度分别为245 μW · cm-2和3.15 mW · cm-2, 分别在紫外辐照剂量为30、60、100、200、400、600、800和1000 mJ · cm-2时测定氨氮浓度, 试验结果如图 4所示.
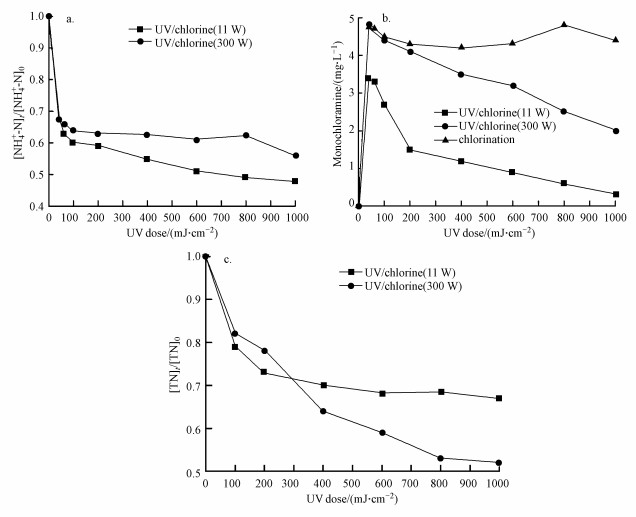 |
| 图 4 低压和中压汞灯照下紫外/氯过程中氨氮(a)、一氯胺(b)和总氮(c)随紫外剂量的变化规律 Fig. 4 Variation of NH4+-N(a), monochloramine(b) and TN(c) with UV dose during low pressure and medium pressure UV/chlorine process |
从图 4a中可以看出, 随着中压汞灯紫外辐照剂量的增加, 氨氮含量逐渐减少, 当紫外辐照剂量达到1000 mJ · cm-2时, 氨氮含量减少了45%.但氨氮在低压汞灯紫外条件下的去除率更高, 相比于中压汞灯紫外条件下提高了10%.这是因为低压汞灯主要释放的是254 nm的单色光, 中压汞灯释放的光的波长范围是分散的(200~400 nm), 而一氯胺在254 nm波长处具有较高的摩尔吸光系数(Li et al., 2018), 导致在相同的紫外辐照剂量条件下, 低压汞灯能释放更多的254 nm波长下的紫外光子光解一氯胺(Sun et al., 2019), 从而实现了更高的一氯胺光解率和氨氮去除率.这一点从图 4b中也可以看出, 随着紫外辐照剂量的增加, 一氯胺浓度逐渐减小, 相比中压汞灯紫外条件, 在低压汞灯紫外条件下一氯胺的光解速度更快, 而在黑暗条件下一氯胺浓度基本不变.这与此前文献结论一致, 254 nm紫外光能促进N—Cl键的裂解, 生成氨基和氯自由基, 从而促进一氯胺的降解(Li et al., 2009;Li et al., 2018).
另一方面, 从图 4c中可以看出, TN在中压汞灯紫外条件下的去除率更高, 当紫外辐照剂量达到1000 mJ · cm-2时, 比低压汞灯紫外条件下提高了15%, 这与氨氮的去除率呈现相反的趋势.这是因为在pH=4~10时, 自由氯在低压汞灯紫外(254 nm)条件下的量子产率约为1.2 mol · E-1;在pH=7时, 自由氯在中压汞灯紫外(200~350 nm)条件下的量子产率为1.2~1.7 mol · E-1(Cassan et al., 2006;Wang et al., 2012).因此, 相比低压汞灯紫外/氯组合工艺, 中压汞灯光解自由氯产生· OH和· Cl的浓度更高, 从而将氨氮更多的转化为气态氮.
4 结论(Conclusions)1) 紫外/氯组合工艺能够有效去除水中氨氮, 其去除氨氮的主要机理是紫外光对一氯胺的光解作用及自由基对氨氮的氧化作用.随着紫外辐照剂量的增加, 氨氮和TN含量逐渐减少, 当紫外辐照剂量达到1000 mJ · cm-2时, 氨氮和TN的去除率分别为53%和35%, 比单独氯化条件下分别提高了20%和15%.
2) 随着Cl2/N的增加, 氨氮和TN含量逐渐减少, 当Cl2/N≥1.6时, 紫外/氯组合工艺对氨氮的去除率接近100%, 当Cl2/N<1.6时, 紫外/氯工艺对TN的去除率比单独加氯工艺提高了30%左右.因此, 在处理实际氨氮含量较高的原水时, 相比单独加氯的工艺, 采用紫外/氯组合工艺可以减少加氯量而不影响总氮的去除效果.
3) 对于pH影响因素而言, 在相同的Cl2/N条件下, 氨氮的去除率大小排序为:pH=8.5>pH=7>pH=5.5, 而TN的去除率大小排序为:pH=5.5>pH=7>pH=8.5, 二者随pH值变化呈现相反的规律.
4) 对于低压/中压汞灯影响因素而言, 氨氮在低压汞灯紫外条件下的去除率更高, 当紫外辐照剂量达到1000 mJ · cm-2时, 相比中压汞灯紫外条件下提高了10%;TN在中压汞灯紫外条件下的去除率更高, 中压紫外/氯工艺能将氨氮更多的转化为气态氮.
Cassan D, Mercier B, Castex F, et al. 2006. Effects of medium-pressure UV lamps radiation on water quality in a chlorinated indoor swimming pool[J]. Chemosphere, 62(9): 1507–1513.
DOI:10.1016/j.chemosphere.2005.06.006
|
陈成, 杨绍贵, 孙成, 等. 2009. 阿特拉津在紫外-氯消毒中的转化特性及机理研究[J]. 农业环境科学学报, 2009, 28(6): 1302–1306.
DOI:10.3321/j.issn:1672-2043.2009.06.037 |
Chuang Y, Chen S, Chinn C, et al. 2017. Comparing the UV/Monochloramine and UV/Free chlorine advanced oxidation processes (AOPs) to the UV/hydrogen peroxide AOP under scenarios relevant to potable reuse[J]. Environmental Science and Technology, 51(23): 13859–13868.
DOI:10.1021/acs.est.7b03570
|
De Laat J, Boudiaf N, Dossier-Berne F. 2010. Effect of dissolved oxygen on the photodecomposition of monochloramine and dichloramine in aqueous solution by UV irradiation at 253.7 nm[J]. Water Research, 44(10): 3261–3269.
DOI:10.1016/j.watres.2010.03.009
|
Deborde M, von Gunten U. 2008. Reactions of chlorine with inorganic and organic compounds during water treatment-Kinetics and mechanisms:A critical review[J]. Water Research, 42(1): 13–51.
|
Fang J, Fu Y, Shang C. 2014. The roles of reactive species in micropollutant degradation in the UV/free chlorine system[J]. Environmental Science and Technology, 48(3): 1859–1868.
DOI:10.1021/es4036094
|
Jafvert C, Valentine R. 1992. Reaction scheme for the chlorination of ammoniacal water[J]. Environmental Science and Technology, 26(3): 577–586.
DOI:10.1021/es00027a022
|
Li J, Blatchley Ⅲ E R. 2009. UV Photodegradation of inorganic chloramines[J]. Environmental Science and Technology, 43(1): 60–65.
DOI:10.1021/es8016304
|
刘刚. 2011. 生活饮用水中的氨氮污染问题探讨[J]. 中国高新技术企业, 2011(27): 146–148.
|
Li T, Jiang Y, An X, et al. 2016. Transformation of humic acid and halogenated byproduct formation in UV-chlorine processes[J]. Water Research, 102: 421–427.
DOI:10.1016/j.watres.2016.06.051
|
Li W, Patton S, Gleason J M, et al. 2018. UV photolysis of chloramine and persulfate for 1, 4-Dioxane removal in reverse-osmosis permeate for potable water reuse[J]. Environmental Science and Technology, 52(11): 6417–6425.
DOI:10.1021/acs.est.7b06042
|
Linden K, Darby J. 1997. Estimating effective germicidal dose from medium pressure UV lamps[J]. Journal of Environmental Engineering, 123(11): 1142–1149.
DOI:10.1061/(ASCE)0733-9372(1997)123:11(1142)
|
Nowell L, Hoigné J. 1992. Photolysis of aqueous chlorine at sunlight and ultraviolet wavelengths-Ⅱ.Hydroxyl radical production[J]. Water Research, 26(5): 599–605.
DOI:10.1016/0043-1354(92)90233-T
|
Schreiber I, Mitch W. 2007. Enhanced nitrogenous disinfection byproduct formation near the breakpoint:Implications for nitrification control[J]. Environmental Science and Technology, 41(20): 7039–7046.
DOI:10.1021/es070500t
|
Sichel C, Garcia C, Andre K. 2011. Feasibility studies:UV/chlorine advanced oxidation treatment for the removal of emerging contaminants[J]. Water Research, 45(19): 6371–6380.
DOI:10.1016/j.watres.2011.09.025
|
Sun P, Meng T, Wang Z, et al. 2019. Degradation of organic micropollutants in UV/NH2Cl advanced oxidation process[J]. Environmental Science and Technology, 53(15): 9024–9033.
DOI:10.1021/acs.est.9b00749
|
Wang D, Bolton J R, Hofmann R. 2012. Medium pressure UV combined with chlorine advanced oxidation for trichloroethylene destruction in a model water[J]. Water Research, 46(15): 4677–4686.
DOI:10.1016/j.watres.2012.06.007
|
Xiang Y, Fang J, Shang C. 2016. Kinetics and pathways of ibuprofen degradation by the UV/chlorine advanced oxidation process[J]. Water Research, 90: 301–308.
DOI:10.1016/j.watres.2015.11.069
|
张利平, 夏军, 胡志芳. 2009. 中国水资源状况与水资源安全问题分析[J]. 长江流域资源与环境, 2009, 18(2): 116–120.
DOI:10.3969/j.issn.1004-8227.2009.02.004 |
 2019, Vol. 39
2019, Vol. 39


