2. 同济大学环境科学与工程学院, 上海 200092
2. School of Environmental Science and Engineering, Tongji University, Shanghai 200092
微塑料是指颗粒粒径小于5 mm的塑料微粒, 其在生态环境中的分布极为广泛.有研究显示, 微塑料广泛分布于海洋生态系统(Andrady, 2011; Cole et al., 2011), 湖泊、河流(Mccormick et al., 2014;Mani et al., 2015)等淡水生态系统(Wagner et al., 2014;Eerkes-Medrano et al., 2015), 以及沉积物(Vianello et al., 2013; Castaneda et al., 2014)和土壤(Rillig, 2012; Lwanga et al., 2016; Nizzetto et al., 2016)之中.微塑料部分悬浮于水体环境中, 或者下沉成为水体沉积物的组成成分.微塑料通过被摄食, 从而对生物体产生物理损伤, 与此同时, 其本身释放的毒物或其吸附的污染物对生物体会产生直接或者间接的毒理危害.
近年来, 研究表明污水处理厂污泥中截留了大量来自污水的微塑料, 导致高浓度的微塑料存在污泥中.Mahon等(2017)发现荷兰污水处理厂污泥中微塑料的含量达4196~15385个·kg-1干污泥.Lassen等(2015)研究表明德国污水厂污泥中微塑料的含量为1000~24000个·kg-1干污泥.据估计在欧盟和北美地区每年因污泥土地或农业利用输入土壤的微塑料总量分别可达6.3~43.0万t和4.4~30.0万t, 甚至超过全球海洋表层水中微塑料的总量(Nizzeto et al., 2016).Li等(2018)调研我国污水处理厂发现污泥中微塑料类型包括聚烯烃(如聚乙烯PE等)、聚酰胺(如尼龙)、聚脂(如绦纶)等, 微塑料含量为(1.6~56.4)×103个·kg-1干污泥, 平均含量达(22.7±12.1)×103个·kg-1干污泥, 高于Mahon等(2017)和Lassen等(2015)的报道.据估计目前我国污水处理厂污泥年产量高达4000万t(含水率80%)(戴晓虎, 2017), 其中土地利用和不当倾倒的比例达86%, 由此污泥微塑料每年进入土壤环境的总量可达15~51万亿个.因此探究污泥微塑料的分布特征及潜在风险具有重要科学意义.
污水和污泥含有高浓度的有机质, 对其中微塑料的提取及鉴定会有很大负面影响.因此, 为提高微塑料的分析准确性, 酸、碱、H2O2等化学预处理方法已被用于消化和去除有机物(Van Cauwenberghe et al., 2015; Dehaut et al., 2016).Hurley等(2018)比较了10 mol·L-1 NaOH溶液、10%KOH溶液、30%H2O2溶液和Fenton试剂用于去除污泥浮选时携带的有机物质的处理能力.然而, 目前关于化学预处理对微塑料颗粒的影响还没有定论.一些研究表明, 酸处理容易消化塑料本身(Dehaut et al., 2016), 碱处理会导致塑料表面降解, H2O2会引起PE和PP塑料的表面变化.另有研究表明, 大多数塑料品种不受H2O2氧化(70 ℃)的影响(Hurley et al., 2018).
现有研究表征化学预处理对微塑料影响的手段, 大多基于扫描电镜、红外光谱等定性分析方法, 很少从定量的角度探讨微塑料的变化特征, 这可能导致难以精确判断化学预处理对微塑料的影响程度.本文选择较为常见的5种化学预处理条件, 通过对比预处理前后6种常见微塑料颗粒对金属污染物Pb的吸附潜力变化, 有望从新的角度揭示化学预处理对微塑料表面的作用特征及相关机理.
2 实验材料和方法(Materials and methods) 2.1 实验材料购买6种不同材质塑料, 即聚乙烯(PE)、聚酰胺(PA)、聚丙烯(PP)、聚苯乙烯(PS)、聚对苯二甲酸乙二酯(PET)和聚甲基丙烯酸甲酯(PMMA), 使用破壁机将塑料产品打碎至粉末状, 经筛网筛选, 取30~50目大小的各类微塑料颗粒, 烘干后得到本实验所用的6种微塑料样品.硝酸铅(Pb(NO3)2)、氢氧化钠(NaOH)纯度均为99.0%, 30%过氧化氢溶液(H2O2)、盐酸(HCl)、硝酸(HNO3)购自中国上海的国药集团有限公司.使用去离子水制备1 g·L-1的金属储备液.所有标准金属溶液均购自中国上海的阿拉丁试剂官网.
2.2 微塑料Pb吸附特性研究为研究pH值对微塑料吸附特性的影响, 综合考虑Pb的水解及其与H+的竞争吸附特性, 共设置5组pH梯度(3、4、5、6和7)及2组Pb浓度(10 mg·L-1和20 mg· L-1).吸附时间为48 h, 并以PE微塑料作为代表.同时为探讨微塑料最佳吸附时间, 分别设置0.5、1、2、4、8、16、24、36、48和72 h等实验组, 按时取样.pH值为6, Pb溶液浓度20 mg·L-1.另外, 为确定微塑料Pb吸附平衡浓度, 分别设置2、4、8、10、15、20、30和50 mg·L-1等Pb溶液浓度.pH值为6, 吸附时间为72 h.
使用去离子水稀释贮备液得到各待测浓度梯度的溶液以及后续最佳吸附溶液浓度的溶液.使用0.1 mol·L-1 HCl和0.1 mol·L-1 NaOH调节pH值, 得到各待测pH值的溶液以及后续最适pH值的溶液.每组实验均将0.1 g微塑料样品与10 mL Pb溶液在离心管中混合均匀.每个探究组设置3组平行和一个空白对照组(不加微塑料样品).将离心管放置于摇床中进行充分混合, 摇床温度设置为20 ℃.探究最适吸附平衡时间组根据时间点分批取样, 后续实验组在最适吸附时间点进行取样.将样品中微塑料与溶液分离, 并将溶液通过0.45 μm膜滤头进行过滤.所得溶液放入4 ℃冰箱冷藏保存待测.使用电感耦合等离子体发射光谱仪(ICP-OES)测量滤液中的Cd浓度, 并通过测定对照组和样品滤液之间的差异来计算吸附在MP上的金属含量.
2.3 预处理对微塑料的影响研究5种化学预处理试剂溶液分别为1 mol·L-1 HCl、1 mol·L-1 HNO3、30% H2O2、1 mol·L-1 NaOH和5 mol·L-1 NaOH.将5 g微塑料与100 mL预处理溶液加入200 mL锥形瓶中, 在60 ℃的条件下充分混合24 h.使用循环水式真空泵连接抽滤瓶和布氏漏斗, 将混合样品中的微塑料和预处理溶液抽滤分离, 并用去离子水冲洗微塑料.将微塑料样品放入37 ℃恒温干燥箱充分烘干, 取得样品.每组3个平行, 一个空白对照组.
预处理前后6种微塑料对Pb的吸附实验条件同2.2节所示, 即溶液pH值为6、吸附时间为72 h、Pb浓度为30 mg·L-1.预处理前后微塑料的质量变化采用重量法进行分析, 取充分烘干后的微塑料样品, 分组称量, 记录数据.预处理前后微塑料尺寸变化采用显微镜与电子目镜连用的方式测量各组微塑料样品的尺寸.同时采用扫描电镜(SEM)与傅立叶红外光谱(FTIR)分析微塑料表面理化特性变化, 方法参考Li等(2019).
3 结果与讨论(Results and discussion) 3.1 微塑料Pb吸附特性研究不同pH值、吸附时间及Pb溶液浓度条件下微塑料的Pb吸附量变化情况如图 1所示.结果表明, 随着pH值、吸附时间及Pb溶液浓度的增加, 微塑料Pb吸附量均呈逐渐增加的趋势.结果表明微塑料的最大Pb吸附量为pH值6~7, 吸附时间48 h及以上.根据Pb的Ksp解离常数, 可计算出10 mg·L-1和20 mg·L-1 Pb离子浓度水解开始产生沉淀的pH值分别为6.23和6.09, 这与本研究结果较为一致.
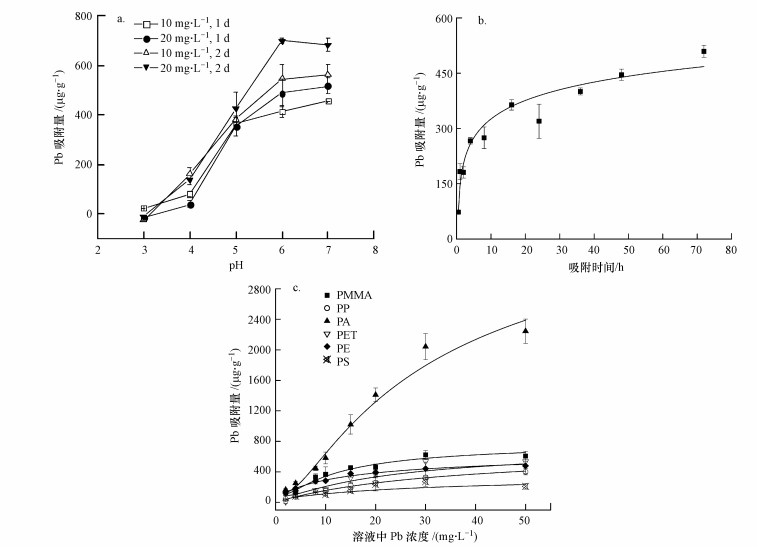 |
| 图 1 不同pH值(a)、吸附时间(b)、吸附浓度(c)条件下微塑料对Pb吸附量的变化情况 Fig. 1 The adsorption curve of Pb on the MPs with different pH, time and solution concentration |
6种微塑料的Pb吸附等温式均符合Langmuir模型(表 1), 这表明微塑料和Pb之间的吸附是单层吸附.根据Langmuir模型估算, PE、PA、PP、PS、PET和PMMA等微塑料对Pb的最大吸附潜力分别为510.2、2922.9、549.5、277.8、584.8、699.3 μg·g-1.由图 1可知, 6种微塑料对Pb吸附潜力的大小顺序为:PA>PMMA>PET> PP >PE>PS, 这与先前的研究结果较为一致(O′connor et al., 2016;Wang et al., 2018; Li et al., 2019).PA对金属污染物的吸附量最大, 这可能是由于其含有氢键和极性酰胺官能团(—CO—NH—)(Li et al., 2019).研究表明与PP和PS等塑料相比, PE对化学物的吸附能力更强(Alimi et al., 2018).因此, 微塑料种类对微塑料Pb吸附量可能有显著影响.
| 表 1 根据等温线模型, 微塑料对Pb吸附的常数 Table 1 The constant of adsorption isothem of Pb by microplastics according to the isotherm model |
5种预处理前后微塑料Pb吸附量的变化情况如图 2所示.结果表明碱性预处理方法可以使得微塑料对Pb的最大吸附量大大增加, 这可能是因为碱性溶液会使微塑料表面产生严重的腐蚀和剥离, 从而使得微塑料比表面积增加, 导致微塑料Pb吸附位点增加(Hurley et al., 2018).除PET和PMMA外, 酸性预处理会导致微塑料Pb吸附量减少, 这可能是由于酸性溶液处理过程中, 微塑料表面吸附了大量的H+, 从而导致微塑料表面吸附位点的减少.相比碱性和酸性预处理, 过氧化氢预处理对不同微塑料Pb吸附量影响不同, 会引起PE、PS、PMMA吸附量减少, 从而导致PA、PP和PET吸附量增加.
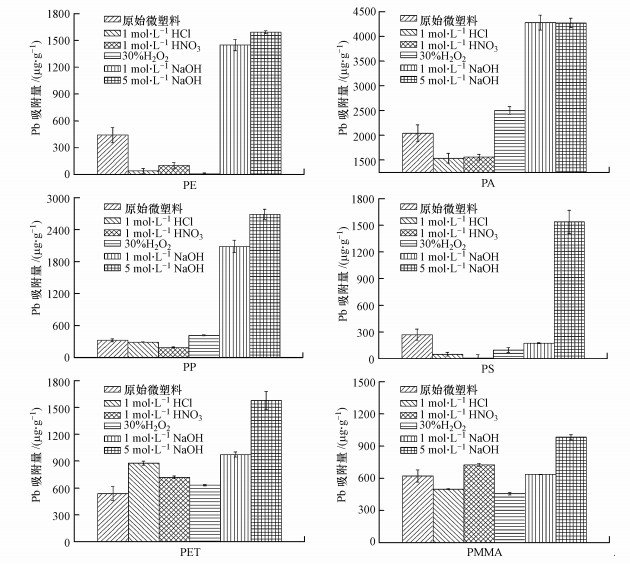 |
| 图 2 预处理前后6种微塑料对Pb的吸附潜力比较 Fig. 2 The comparison of adsorption potentials of six MPs to Pb before and after pretreatment |
为进一步揭示不同预处理对微塑料Pb吸附量的影响机理, 进一步研究了预处理前后微塑料质量、尺寸、表面官能团及特性的变化情况.
3.3.1 预处理前后微塑料质量及尺寸变化如表 2所示, 从处理方法的角度分析, 碱性溶液的预处理方法对微塑料的质量影响最大, 且影响程度随着溶液浓度增大而增高;酸性溶液的预处理方法中, 1 mol·L-1 HNO3对微塑料的质量减轻程度影响更大, 可能是与其氧化性有一定关系;30% H2O2对微塑料的质量影响不大.从微塑料种类分析, PET的质量减轻程度最大, 其他品种中橡胶态微塑料的质量减轻程度比玻璃态微塑料的普遍要高, 可能是其松散的空间结构增大了与预处理溶液的接触面积, 提高了反应的程度.
| 表 2 预处理前后微塑料质量变化 Table 2 The change of mass weight of MPs before and after pretreatment |
由表 3可知, 尺寸变化方面, 从预处理方法来看, 碱性溶液的预处理方法对尺寸的减量影响最为显著, 酸性溶液的预处理方法与30% H2O2影响程度的范围比较相近.从微塑料种类分析, PA与PET的尺寸变化范围较大, 减量程度更大.其他塑料在特定的预处理方法下有较大的尺寸减量程度, 总体上尺寸变化不大.这些结果可能仍然与微塑料颗粒的空间结构有关, PA、PET的松散程度较大, 同时含有一些相对不够稳定的基团, 在预处理的条件下细微结构处容易受到损伤而导致较大程度的尺寸减量.
| 表 3 预处理前后微塑料尺寸变化 Table 3 Microplastic size change before and after pretreatment |
从预处理后微塑料的的红外光谱图(图 3)可以发现, 预处理前后的微塑料的特征峰类型基本相同, 但部分特征峰的强度有所差异, 即在1000~1100 cm-1处的一级和二级醇的C—O拉伸峰, 以及1370~1376 cm-1处的醇和酚的C—H和O—H变形模式峰.Wijesekara等(2018)研究发现, 处理过的微塑料在1000~1100 cm -1和1370~1376 cm-1处出现含氧官能团的峰, 可能是由于伯醇和仲醇的C—O伸缩键、C—H和O—H变形键的变化.此外, 污泥微塑料中有含氧(C—O和O—H)基团的存在也有可能是由于微塑料的氧化和降解导致的(Ceccarini et al., 2018).Turner和Holmes表明, 在风化过程中微塑料与有机物的结合会影响金属的吸附(Turner et al, 2015).这些结果表明, 污泥微塑料上产生的含氧官能团在增强污泥微塑料对金属污染物的吸附潜力中起重要作用.红外谱图也表明了这几种预处理条件对微塑料表层含氧官能团产生了一定影响, 从而影响到微塑料对Pb的吸附潜力.
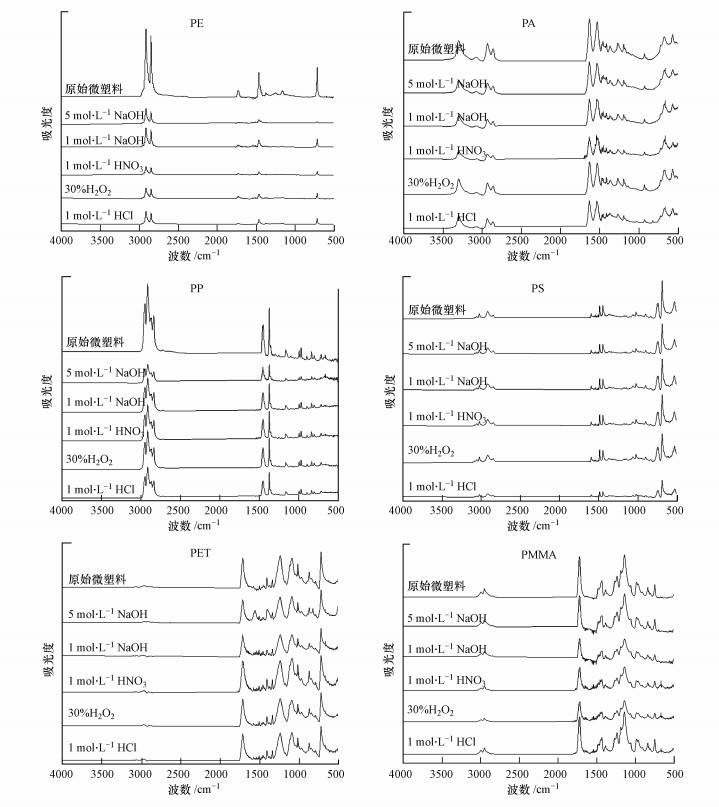 |
| 图 3 预处理前后6种微塑料的红外谱图变化情况 Fig. 3 Infrared spectrum of six MPs before and after pretreatment |
从SEM图(图 4)可以看出, 与原始微塑料光滑的表面相比, 预处理后的微塑料表面呈现出粗糙的皱褶结构.碱预处理对微塑料颗粒表面的腐蚀程度最重, 微塑料表面出现大范围残屑, 且表面粗糙程度明显增加, 同时这种变化随溶液浓度的提高而加深.此外, 与1 mol·L-1 HCl和30% H2O2预处理相比, 1 mol·L-1 HNO3的预处理对微塑料表面有着相对较严重的侵蚀, 可能是由于硝酸叠加了酸性与氧化性的处理作用, 共同影响了微塑料表面的形态变化.从微塑料的种类分析, 玻璃态微塑料(如PS)的表面比较容易产生区域性的破裂, 而不容易产生絮状残屑;橡胶态微塑料(如PE)表面所产生的粗糙褶皱结构较有纹理, 且容易产生层块状的翻起和絮状残屑(Li et al., 2019).Wang等(2018)也研究发现, 处理后的微塑料表面具有吸附更多持久性有机污染物的能力, 这可能与微塑料表面微观结构变化具有密切的关系.
 |
| 图 4 预处理前后6种微塑料的扫描电镜图变化情况 Fig. 4 Scanning electron micrograph of Six MPs before and after pretreatment |
1) 6种微塑料的Pb吸附等温式符合Langmuir模型, Pb吸附能力顺序分别为:PA>PMMA>PET>PP >PE>PS, 最大吸附量分别为2922.9、699.3、584.8、549.5、510.2、277.8 μg·g-1.
2) 5种预处理条件中, 碱预处理会导致微塑料Pb吸附量的增加, 而酸预处理会引起PE、PA、PP和PS等微塑料吸附量的减小, 过氧化氢预处理对不同微塑料的影响不同.
3) 微塑料理化特性研究表明碱预处理对微塑料的腐蚀作用最强, 导致微塑料表面粗糙, 从而引起吸附位点的增加, 而酸预处理可能导致微塑料表面吸附过多的H+, 从而与Pb离子产生了竞争吸附.
Alimi O S, Farner Budarz J, Hernandez L M, et al. 2018. Microplastics and nanoplastics in aquatic environments:Aggregation, deposition, and enhanced contaminant transport[J]. Environmental Science & Technology, 52: 1704–1724.
|
Andrady A L. 2011. Microplastics in the marine environment[J]. Marine Pollution Bulletin, 62(8): 1596–1605.
DOI:10.1016/j.marpolbul.2011.05.030
|
Castaneda R A, Avlijas S, Simard M A, et al. 2014. Microplastic pollution in St. Lawrence River sediments[J]. Canadian Journal of Fisheries and Aquatic Sciences, 71(12): 1767–1771.
DOI:10.1139/cjfas-2014-0281
|
Cole M, Lindeque P, Halsband C, et al. 2011. Microplastics as contaminants in the marine environment:A review[J]. Marine Pollution Bulletin, 62(12): 2588–2597.
DOI:10.1016/j.marpolbul.2011.09.025
|
戴晓虎. 2017. 城镇污水处理厂污泥稳定化处理的必要性和迫切性的思考[J]. 给水排水, 2017, 43: 1–5.
|
Dehaut A, Cassone A L, Frere L, et al. 2016. Microplastics in seafood:Benchmark protocol for their extraction and characterization[J]. Environmental Pollution, 215: 223–233.
DOI:10.1016/j.envpol.2016.05.018
|
Eerkes-Medrano D, Thompson R C, Aldridge D C. 2015. Microplastics in freshwater systems:a review of the emerging threats, identification of knowledge gaps and prioritisation of research needs[J]. Water Research, 75(15): 63–82.
|
Hurley R R, Lusher A L, Olsen M, et al. 2018. Validation of a method for extracting microplastics from complex, organic-rich, environmental matrices[J]. Environmental Science & Technology, 52(13): 7409–7417.
|
Lassen C, Hansen S F, Magnusson K, et al. 2015. Microplastics-occurrence, effects and sources of releases to the environment in Denmark[R]. Denmark: Danish Environmental Protection Agency. 104
|
Li X, Chen L, Mei Q, et al. 2018. Microplastics in sewage sludge from the wastewater treatment plants in China[J]. Water Research, 142: 75–85.
DOI:10.1016/j.watres.2018.05.034
|
Li X, Mei Q, Chen L, et al. 2019. Enhancement in adsorption potential of microplastics in sewage sludge for metal pollutants after the wastewater treatment process[J]. Water Research, 157: 228–237.
DOI:10.1016/j.watres.2019.03.069
|
Lwanga E H, Gertsen H, Gooren H, et al. 2016. Microplastics in the terrestrial ecosystem:Implications for Lumbricus terrestris (Oligochaeta, Lumbricidae)[J]. Environmental Science & Technology, 50(5): 2685–2691.
|
Mahon A M, O'Connell B, Healy M G, et al. 2017. Microplastics in sewage sludge:Effects of treatment[J]. Environmental Science & Technology, 51: 810–818.
|
Mani T, Hauk A, Walter U, et al. 2015. Microplastics profile along the Rhine river[J]. Scientific reports, 5: 17988.
|
Mccormick A, Hoellein T J, Mason S A, et al. 2014. Microplastic is an abundant and distinct microbial habitat in an urban river[J]. Environmental Science & Technology, 48(20): 11863–11871.
|
Nizzetto L, Langaas S, Futter M. 2016. Pollution:Do microplastics spill on to farm soils?[J]. Nature, 537(7621): 488–488.
|
O'connor I A, Golsteijn L, Hendriks A J. 2016. Review of the partitioning of chemicals into different plastics:Consequences for the risk assessment of marine plastic debris[J]. Marine Pollution Bulletin, 113(1/2): 17–24.
|
Rillig M C. 2012. Microplastics in terrestrial ecosystems and the soil[J]. Environmental Science & Technology, 46(12): 6453–6454.
|
Turner A, Holmes L A. 2015. Adsorption of trace metals by microplastic pellets in fresh water[J]. Environmental Chemistry, 12(5): 600–610.
DOI:10.1071/EN14143
|
Van Cauwenberghe L, Devriese L, Galgani F, et al. 2015. Microplastics in sediments:A review of techniques, occurrence and effects[J]. Marine Environmental Research, 111: 5–17.
DOI:10.1016/j.marenvres.2015.06.007
|
Vianello A, Boldrin A, Guerriero P, et al. 2013. Microplastic particles in sediments of Lagoon of Venice, Italy:First observations on occurrence, spatial patterns and identification[J]. Estuarine, Coastal and Shelf Science, 130: 54–61.
DOI:10.1016/j.ecss.2013.03.022
|
Wagner M, Scherer C, Alvarez-Muñoz D, et al. 2014. Microplastics in freshwater ecosystems:what we know and what we need to know[J]. Environmental Sciences Europe, 26(12): 1–9.
|
Wang F, Shih K M, Li X Y. 2015. The partition behavior of perfluorooctanesulfonate (PFOS) and perfluorooctanesulfonamide (FOSA) on microplastics[J]. Chemosphere, 119: 841–847.
DOI:10.1016/j.chemosphere.2014.08.047
|
Wang W, Wang J. 2018. Comparative evaluation of sorption kinetics and isotherms of pyrene onto microplastics[J]. Chemosphere, 193: 567–573.
DOI:10.1016/j.chemosphere.2017.11.078
|
Wijesekara H, Bolan N S, Bradney L. 2018. Trace element dynamics of biosolids-derived microbeads[J]. Chemosphere, 199: 331–339.
DOI:10.1016/j.chemosphere.2018.01.166
|
 2019, Vol. 39
2019, Vol. 39


