磷元素作为一种必需的营养物质, 几乎参与了所有的生物化学反应, 并存在于所有生物体的各种细胞中, 且在其生命活动中扮演着十分重要的角色(Jalali et al., 2016).随着世界人口的增长及人类生活水平的提高, 社会对磷的需求量也在不断增加, 然而磷是一种不可再生资源, 磷矿石的快速开采与消耗已造成磷资源面临衰竭的危机(郝晓地等, 2010; 2017).另一方面, 人类大量使用肥料、洗涤剂等含磷物质, 最终排入水体, 容易引起水体富营养化, 从而导致水生生态系统的破坏(van Dijk et al., 2016).
从污水污泥中合成蓝铁石的结晶法磷回收, 有望成为同时解决水体富营养化和磷矿石资源危机的有效途径(王珏, 2016).蓝铁石结晶法是在厌氧铁磷复合体系中, 利用异化金属还原微生物将三价铁还原为二价铁, 进而与磷酸盐结合生成蓝铁石, 从而达到磷回收的目的(程翔, 2010).与蓝铁石结晶法磷回收相比, 其他结晶法磷回收工艺具有一些限制因素:磷酸铵镁结晶法容易受到其投加镁盐的高成本及反应体系高pH(pH>8.5)的限制(Hao et al., 2013; Le Corre et al., 2009), 不易广泛应用;而羟基磷酸钙结晶法容易受到副产物碳酸钙沉淀的负面影响, 导致结晶产物纯度不高及磷回收效率低下, 此外, 羟基磷灰石难以溶解很难被植物吸收利用(Song et al., 2006).相较之下, 投加铁盐的蓝铁石结晶法更加经济有效, 一方面铁盐廉价、易得, 且在厌氧消化过程中具有防止硫化氢排放、充当絮凝剂改善污泥脱水性、控制气味等作用(Li et al., 2014; Zhang et al., 2009);另一方面, 生成蓝铁石所需的pH条件较为宽泛, 一般在pH为6~9的范围均可生成;除此之外, 结晶产物蓝铁石是一种很好的缓释肥料且具有较高的经济价值(郝晓地等, 2018).
兼性、专性厌氧微生物在厌氧、缺氧环境中氧化有机碳为小分子物质的同时还原Fe(Ⅲ)获得能量的过程被称为异化铁还原过程(Lovley, 2017).蓝铁石合成的核心机制是铁的异化还原, 因此, 提高异化铁还原速率与效率是强化蓝铁石合成的关键驱动力.而如何获得高产率的结晶产物, 对于蓝铁石结晶法磷回收技术的广泛应用具有至关重要的作用.本课题组之前系统研究了微生物对磷营养条件的竞争利用关系和蓝铁石成矿机制, 对生物诱导成矿及生物生长对磷酸盐的竞争利用关系有了初步认知(Wang et al., 2018).石墨因具有良好导电性, 可能会促进异化铁还原过程中关键微生物的活性或电子转移速率.因此, 本研究选用石墨作为强化材料, 考察不同投加量及不同粒径石墨对微生物异化铁还原合成蓝铁石过程的影响, 以期为碳材料强化蓝铁石结晶法磷回收提供科学依据.
2 材料与方法(Materials and methods) 2.1 石墨及微生物来源本实验所用石墨为商业高纯石墨, 购自青岛华泰石墨公司, 为天然鳞片石墨粉, 纯度>99.3%, 灰分 < 0.5%, 水分 < 0.3%.
本实验所用微生物来源于天津大学津南校区中水处理站进水, 经格栅渠和调节池处理之后, 水质稳定且无大颗粒杂质.采样后隔夜厌氧处理, 实验接种时取上清液进行离心获得所需废水微生物.
2.2 实验设计厌氧条件下, 以废水微生物为接种微生物, 以乙酸钠为电子供体, 柠檬酸铁为电子受体, 磷酸二氢钾为磷源, 并添加不同含量、不同粒径的石墨, 构建石墨强化微生物异化铁还原合成蓝铁石复合体系, 考察石墨对异化铁还原及蓝铁石结晶沉淀过程的影响.
以20 mL厌氧瓶作为反应容器, 培养基成分包括0.31 g·L-1氯化铵、0.13 g·L-1氯化钾、1.64 g·L-1乙酸钠、2.88 g·L-1柠檬酸铁、1.224 g·L-1磷酸二氢钾、5 mL·L-1维生素溶液(表 1)和12.5 mL·L-1金属溶液(表 2).每个实验组设置3个平行, 置于30 ℃恒温振荡箱培养22 d, 培养过程中定点测定可溶及可提取态铁磷含量, 实验末期分析微生物群落组成和蛋白含量及表征结晶产物.
| 表 1 维生素溶液成分 Table 1 Vitamin solution |
| 表 2 金属溶液成分 Table 2 Metal solution |
针对不同石墨投加量的研究, 分别向设置的实验组投加0、0.5、1.0、1.5、2.0 g·L-1的石墨, 实验组分别标记为CK、G0.5、G1、G1.5、G2.在筛选出的最适石墨添加量条件下, 考察不同粒径石墨(5、10、20、40、80 μm)的促进效果, 设置不添加石墨的对照组, 筛选出最佳粒径, 实验组分别标记为CK、G5、G10、G20、G40、G80.
2.3 不同形态铁磷的分析本实验利用紫外分光光度法测定体系液相与固相中总铁、亚铁、磷酸盐的浓度, 其中, 固相铁磷浓度测定之前需用盐酸进行消解, 从而确定固液两相中铁、磷两种元素的赋存状态.
铁含量的测定采用邻菲啰啉分光光度法, 该法基本原理为亚铁离子在pH为3~9的溶液中与邻菲啰啉生成稳定的橙红色络合物, 其测量波长为510 nm, 若用盐酸羟胺等还原剂将高铁离子还原, 则可以测定高铁离子及总铁含量.
磷含量的测定采用钼酸铵分光光度法, 该法的基本原理是在酸性介质中, 正磷酸盐与钼酸铵发生反应, 在锑盐存在下生成磷钼杂多酸后, 立即被抗坏血酸还原, 生成蓝色络合物, 其在700 nm波长处具有稳定的吸光度.
2.4 结晶产物的表征实验末期离心收集结晶产物, 真空干燥之后厌氧封存, 以便后续进行扫描电镜-能谱(Scanning Electron Microscopy-Energy Dispersive Spectrometer, SEM-EDS)分析和X射线衍射(X-ray Diffractometer, XRD)分析.
结晶样品进行XRD表征时, X射线衍射仪(Bruker AXS, GmbH, 德国)的参数设置为(Wang et al., 2018):采用Cu靶, 管电压为40 kV, 管电流为40 mA, 扫描角度2θ的范围为10°~90°, 扫描速度为10°·min-1.XRD所测数据结果采用Jade 6软件进行分析.
结晶样品的表面形貌采用扫描电镜(ZEISS, Merlin Compact-6164, 德国)进行观察, 利用能谱分析仪(OXFORD公司)测定样品表面的元素组成.在进行扫描电镜分析前, 需对样品表面进行喷金操作.
2.5 微生物分析微生物蛋白含量采用BCA蛋白法测定, 该法基本原理为:BCA(Bicinchonininc Acid)与二价铜离子的硫酸铜等其他试剂混合在一起显示为苹果绿色, 即BCA工作试剂.在碱性条件下, BCA与蛋白结合时, 蛋白质将Cu2+还原为Cu+, 一个Cu+螯合两个BCA分子, 工作试剂由原来的苹果绿色变成紫色复合物, 其在562 nm处有最大的吸收值, 最大光吸收强度与蛋白质浓度成正比.
将要进行微生物群落结构分析的实验样品依据土壤基因组DNA试剂盒的标准操作进行DNA提取(Zhou et al., 2017)后送样, 在北京诺禾致源生物信息科技有限公司MiSeq Illumina测序平台上对扩增子进行16S rRNA定量测序, 通过R语言进行生物相的分析.
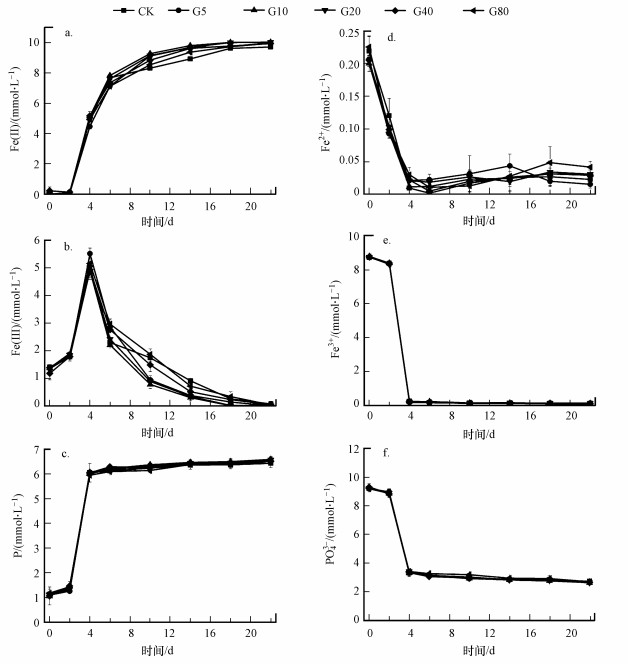
3 结果与讨论(Results and discussion) 3.1 不同投加量石墨对微生物异化铁还原合成蓝铁石的影响为研究石墨投加量对微生物异化铁还原合成蓝铁石的影响, 分别向厌氧瓶中投加0、0.5、1.0、1.5、2.0 g·L-1的石墨, 实验体系中整个阶段铁、磷浓度变化如图 1所示.其中, Fe(Ⅱ)、Fe(Ⅲ)及P表示体系固相中的亚铁、三价铁和磷酸盐, 而Fe2+、Fe3+及PO43-表示体系液相中的亚铁、三价铁和磷酸盐.整体来看, 各实验组随时间的变化趋势基本相似:Fe(Ⅱ)含量不断增加, Fe2+含量在很小范围内变化, Fe(Ⅲ)含量先增加后减少, Fe3+含量逐渐减少, PO43-含量的减少与P含量的增加相呼应.
 |
| 图 1 不同投加量石墨实验体系中铁、磷变化 Fig. 1 Variation of iron and phosphate in different concentrations of graphite experimental systems |
整个实验阶段, 各实验组Fe2+含量一直在0~0.35 mmol·L-1这个很小的范围内变化, 除了在初期4 d内波动稍大外, 之后第4~22 d无明显变化且浓度趋于0 mmol·L-1, 这表明体系基本不会积累Fe2+, 可能原因是实验过程中产生的Fe2+很快被转化为其他形式.图 1e显示, Fe3+在实验初期的4 d内几乎被消耗殆尽, 从最初的8.34~8.39 mmol·L-1降至0.18~0.28 mmol·L-1左右.类似地, 图 1f所示的PO43-浓度也在前4 d内大幅度降低, 从初始的9.49~9.65 mmol·L-1降至3.38~3.64 mmol·L-1, 随后18 d内缓慢减少至2.52~2.62 mmol·L-1, 整个实验过程约73%的PO43-被利用转化.引起Fe3+和PO43-迅速减少的原因可能是由于污水微生物比较复杂, 导致柠檬酸铁中柠檬酸被大量消耗, 从而向体系中释放出大量Fe3+, 其与PO43-及其他离子快速结合, 生成Fe(Ⅲ)-P沉淀存在于固相中.
较为关注的是Fe(Ⅱ)含量的变化, 因为它与蓝铁石产量直接相关.从图 1a来看, 各实验组Fe(Ⅱ)含量呈不断增加的趋势.在反应最初的2 d内变化不明显, 第2~10 d Fe(Ⅱ)含量由0.14~0.30 mmol·L-1迅速增加至7.90~8.96 mmol·L-1, 而第10~22 d增加缓慢, 但整体增加的趋势表明蓝铁石结晶持续积累.另外, 从图中可以看出, 与不添加石墨的对照组相比, 石墨组的促进效果在第4 d之后才慢慢显现, 0.5、1.0、1.5、2.0 g·L-1石墨组Fe(Ⅱ)含量在第6 d时分别达到6.61、6.97、6.66、6.86 mmol·L-1, 与对照组的6.16 mmol·L-1相比, 分别提高了7%、13%、8%、11%, 可见对铁还原促进效果最明显的是石墨添加量为1.0 g·L-1的G1组.除此之外, 经计算G1组Fe(Ⅱ)含量在第6、10、14、18、22 d比CK对照组分别提高13%、13%、12%、11%、10%, 随着三价铁的不断消耗, G1组的电子供体不足, 相比其他样本的性能提高率有所下降.
相比之下, 图 1b中Fe(Ⅲ)的变化稍显复杂, 其含量在前4 d随着时间的推移逐渐增加至5.90~6.10 mmol·L-1, 随后又不断降低, 至第22 d时各组含量分别为0.92、0.26、0.04、0.27、0.45 mmol·L-1, 石墨组降低幅度均大于对照组且G1组的降幅(6.01 mmol·L-1)最显著.前期增加的原因应该与前面提到的柠檬酸的消耗与Fe(Ⅲ)-P沉淀的形成有关, 而后期减少与微生物的异化铁还原作用直接相关, 三价铁在微生物的作用下被还原为二价铁.这表明异化还原微生物可利用Fe(Ⅲ)-P沉淀物作为电子转移的受体发生异化还原反应.从图 1c中可以看出, P含量在前4 d的迅速减少与PO43-的迅速增加相呼应.另外发现, 虽然整个实验阶段P含量在各实验组之间几乎无差别, 但各组与Fe(Ⅱ)和Fe(Ⅲ)结合的P含量不同.在第22 d时, G1组以Fe(Ⅱ)-P形式回收的P含量最高(6.62 mmol·L-1), 占P含量的98%, 而CK组最低(6.04 mmol·L-1), 占P含量的92%.对应地, G1组以Fe(Ⅲ)-P形式存在的P含量最低, 为0.04 mmol·L-1, 而CK组最高, 为0.92 mmol·L-1.
实验末期收集到的结晶产物的XRD结果如图 2所示, 各实验组结晶产物的衍射峰与蓝铁石标准品的特征峰匹配度较高, 峰形也较为吻合, 说明实验体系磷回收产物主要为蓝铁石.
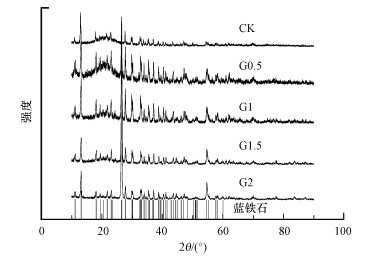 |
| 图 2 结晶产物的XRD图 Fig. 2 XRD analysis of the precipitates formed in different groups |
图 3所示为实验末期收集到的结晶产物的SEM结果, 根据对照组与石墨组的比较分析, 图中大量存在的光滑板状物体及由光滑板状组成的花状物体应该是蓝铁石结晶, 而表面略有凹凸的鳞片状物体应该是石墨颗粒.对其局部分别进行EDS分析, 结果如图 4所示, 也与该猜测十分吻合, 图 4b显示大量C元素的存在, 图 4d显示Fe和P原子比为1.42, 非常接近于蓝铁石中的铁磷原子比1.5.
 |
| 图 3 不同投加量石墨实验体系中结晶产物的SEM图 (a.CK, b.0.5 g·L-1, c.1.0 g·L-1, d.1.5 g·L-1, e.2.0 g·L-1) Fig. 3 SEM results of the precipitant in in different concentrations of graphite experimental systems |
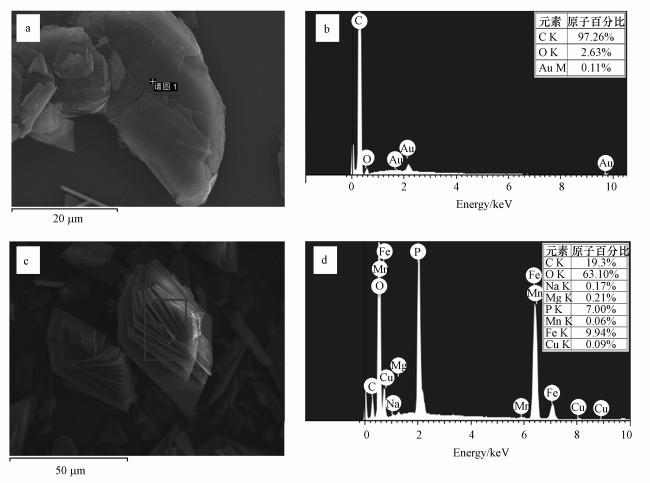 |
| 图 4 石墨(a、b)和蓝铁石(c、d)的SEM-EDS结果 Fig. 4 SEM-EDS analysis of graphite (a, b) and vivianite (c, d) |
实验结果表明, 石墨的添加确实能够促进铁磷复合体系中微生物异化铁还原合成蓝铁石, 并且筛选出最佳石墨投加量为1 g·L-1.
3.2 不同粒径石墨对微生物异化铁还原合成蓝铁石的影响根据3.1节的结果, 在石墨投加量为1.0 g·L-1的条件下, 考察不同粒径石墨(5、10、20、40、80 μm)对蓝铁石生成过程的影响, 以期筛选出最佳粒径.不同粒径石墨的实验组铁、磷浓度随时间变化情况如图 5所示, 实验过程中Fe3+含量和PO43-含量随时间推移而逐渐减少, Fe(Ⅱ)和P含量随时间推移而增加, Fe(Ⅲ)含量先增加再减少, Fe2+含量整体变化很小.
 |
| 图 5 不同粒径石墨实验体系中铁、磷变化 Fig. 5 Variation of iron and phosphate in different particle sizes of graphite experimental systems |
整个实验阶段Fe2+含量整体变化仍然很小, 仅为0.17~0.20 mmol·L-1, 可能是因为实验过程中产生的Fe2+很快被转化为固体形式存在.实验过程中Fe3+浓度与PO43-浓度随时间推移而逐渐减少, 反应末期Fe3+浓度基本趋于0 mmol·L-1, 表明其几乎被完全消耗, 此外, PO43-也被大量消耗但略有剩余, 终浓度趋于2.6 mmol·L-1, 表明磷营养充足.与PO43-浓度变化相对应的是P浓度的增加, 最终浓度达到6.43~6.59 mmol·L-1, 表明初始投加的磷能以固体形式被回收, 回收率为62%~64%.从图 5b中可以看出, Fe(Ⅲ)的含量依然是先迅速增加再缓慢减少.迅速增加的原因应该是柠檬酸被体系中复杂微生物快速消耗引起Fe3+的大量释放, 进而与体系中存在的PO43-结合形成沉淀, 之后在微生物异化铁还原作用下含量缓慢减少.最初4 d添加不同粒径石墨的反应体系中Fe(Ⅲ)含量无明显差别, 4 d之后进入异化铁还原成为驱动铁元素变化的核心反应过程, 而添加不同粒径石墨的反应体系中Fe(Ⅲ)含量开始出现差异.表明石墨并不影响Fe3+与PO43-的化学沉淀过程, 但会促进微生物作用的异化铁还原过程.粒径的变化会影响微生物异化铁还原过程, 各实验组(CK、G5、G10、G20、G40、G80)中Fe(Ⅲ)含量从第4~10 d分别从4.91、5.51、4.90、5.01、4.93、5.16 mmol·L-1降至1.74、0.94、0.78、0.88、1.48、1.87 mmol·L-1, 各组变化量依次为3.17、4.57、4.12、4.13、3.44、3.29 mmol·L-1, 可见其中减少量最多的是G5组, 减少量最少的是CK组.
直接与蓝铁石产量相关的Fe(Ⅱ)含量变化如图 5a所示, 随时间推移而不断增加.前4 d石墨组与对照组Fe(Ⅱ)含量的变化幅度几乎一致, 4 d之后石墨的促进作用逐渐显现出来, 石墨组在第6~18 d明显高于对照组, 且不同粒径的石墨促进程度也不一样, 第10 d和第14 d各组的Fe(Ⅱ)含量分别为8.31、9.11、9.26、9.14、8.83、8.53 mmol·L-1和8.92、9.67、9.80、9.68、9.61、9.37 mmol·L-1.其中, 对铁还原强化作用最明显的是G10组, 其Fe(Ⅱ)含量在第10 d和第14 d时分别比对照组高12%和10%, 而G20组的强化性能仅次于G10组, 第10 d和第14 d时分别比对照组高10%和9%.
为了进一步探讨石墨促进异化铁还原合成蓝铁石的机制, 针对未添加石墨的对照组(CK)和添加量为1.0 g·L-1、粒径为10 μm的石墨组(G10)进行比较, 考察石墨对微生物含量与群落结构变化的影响.
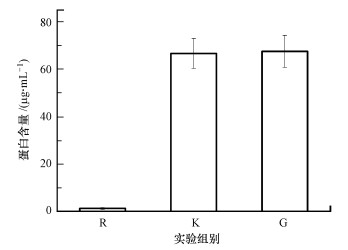
初始接种微生物的蛋白含量和实验末期体系微生物蛋白含量如图 6所示, 其中, R代表初始接种微生物, K代表对照组微生物, G代表G10石墨组微生物.从图中可以看出, 经过22 d的培养, 对照组和石墨组的微生物量都有很大程度的提高, 分别从1.3 μg·mL-1增加至66.64 μg·mL-1和67.50 μg·mL-1, 末期时这两组微生物蛋白含量并无明显差异, 表明石墨对体系微生物量的影响几乎可忽略不计.
 |
| 图 6 微生物蛋白含量变化 Fig. 6 Variation of microbial protein content |
混菌微生物体系比较复杂, 因此, 厌氧系统运行一段时间后, 微生物群落结构很有可能会发生变化.为进一步明确群落组成变化, 取原始污水水样、CK、G10 3组样本进行了生物相分析, 结果如图 7所示.从柱状图中可以看出, 与原始污水水样相比, 未添加石墨的对照组和添加石墨组的微生物群落生物多样性均有所降低, 变形菌门比例明显增加, 对照组增加21%, 石墨组的增幅更是达到30%, 表明石墨更利于变形菌的富集.此外, 对照组和石墨组的拟杆菌门比例均有下降, 厚壁菌门比例在对照组略有提高而在石墨组基本保持不变.
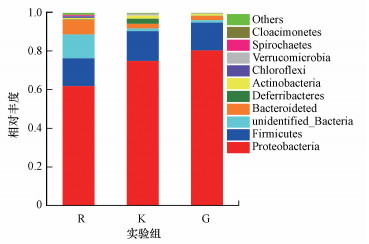 |
| 图 7 微生物群落结构分析(门水平) Fig. 7 Microbial community analysis of R, K and G at the phylum level |
本实验筛选出最佳石墨粒径为10 μm, 发现石墨的添加有利于混菌群落富集变形菌门细菌, 而大多数异化金属还原菌属于变形菌门, 这就解释了为什么添加石墨之后实验体系中微生物的异化铁还原作用明显增强, 进而促进了污水中蓝铁石的合成过程.
4 结论(Conclusions)1) 石墨可以促进微生物异化铁还原过程, 提高蓝铁石的产率.石墨投加量在0.5~2.0 g·L-1范围内, 投加1.0 g·L-1石墨对微生物异化铁还原的促进作用最明显, 其Fe(Ⅱ)含量在第6 d比未投加石墨组高13%, 通过XRD分析, 沉淀的主要成分为蓝铁石.
2) 在石墨添加量为1.0 g·L-1的条件下, 筛选出最佳粒径为10 μm, 其Fe(Ⅱ)含量在第10 d比对照组高12%.
3) 通过对微生物群落结构变化的分析发现, 石墨对微生物异化铁还原合成蓝铁石的促进可能源于体系中石墨对变形菌门细菌具有强化富集作用.
本实验结果有助于人们对石墨强化微生物异化铁还原合成蓝铁石效果的认识, 对于理解碳材料的强化作用及蓝铁石结晶法磷回收工艺具有重要意义.此外, 如何高效分离结晶后的蓝铁石与石墨颗粒, 是该技术进一步推进实用的重要步骤.考虑到蓝铁石本身具有顺磁性的特点, 因此, 通过磁性分选技术理论上可以将蓝铁石晶体与石墨颗粒分离.
程翔.2010.类水滑石吸附和蓝铁石沉淀回收污水中磷的研究[D].哈尔滨: 哈尔滨工业大学
http://cdmd.cnki.com.cn/article/cdmd-10213-2011016068.htm |
Hao X, Wang C, van Loosdrecht M C M, et al. 2013. Looking beyond struvite for P-recovery[J]. Environmental Science & Technology, 47(10): 4965–4966.
|
郝晓地, 宋鑫, MarkVan Loosdrecht, 等. 2017. 政策驱动欧洲磷回收与再利用[J]. 中国给水排水, 2017, 33(8): 35–42.
|
郝晓地, 衣兰凯, 王崇臣, 等. 2010. 磷回收技术的研发现状及发展趋势[J]. 环境科学学报, 2010, 30(5): 897–907.
|
郝晓地, 周健, 王崇臣, 等. 2018. 污水磷回收新产物-蓝铁矿[J]. 环境科学学报, 2018, 38(11): 4223–4234.
|
Jalali M, Jalali M. 2016. Relation between various soil phosphorus extraction methods and sorption parameters in calcareous soils with different texture[J]. Science of the Total Environment, 566-567: 1080–1093.
DOI:10.1016/j.scitotenv.2016.05.133
|
Le Corre K S, Valsami-Jones E, Hobbs P, et al. 2009. Phosphorus recovery from wastewater by struvite crystallization:A review[J]. Critical Reviews in Environmental Science and Technology, 39(6): 433–477.
DOI:10.1080/10643380701640573
|
Li T, Wang H, Dong W, et al. 2014. Performance of an anoxic reactor proposed before BAF:Effect of ferrous sulfate on enhancing denitrification during simultaneous phosphorous removal[J]. Chemical Engineering Journal, 248: 41–48.
DOI:10.1016/j.cej.2014.03.033
|
Lovley D R. 2017. Syntrophy goes electric:Direct interspecies electron transfer[J]. Annual Review of Microbiology, 71(1): 643–664.
DOI:10.1146/annurev-micro-030117-020420
|
Song Y, Weidler P G, Berg U, et al. 2006. Calcite-seeded crystallization of calcium phosphate for phosphorus recovery[J]. Chemosphere, 63(2): 236–243.
DOI:10.1016/j.chemosphere.2005.08.021
|
van Dijk K C, Lesschen J P, Oenema O. 2016. Phosphorus flows and balances of the European Union Member States[J]. Science of the Total Environment, 542: 1078–1093.
DOI:10.1016/j.scitotenv.2015.08.048
|
Wang S, An J, Wan Y, et al. 2018. Phosphorus competition in bioinduced vivianite recovery from wastewater[J]. Environmental Science & Technology, 52(23): 13863–13870.
|
王珏.2016.基于蓝铁石结晶的污水强化除磷法连续流试验研究[D].北京: 北京林业大学
http://cdmd.cnki.com.cn/Article/CDMD-10022-1016137524.htm |
Zhang L, Keller J, Yuan Z. 2009. Inhibition of sulfate-reducing and methanogenic activities of anaerobic sewer biofilms by ferric iron dosing[J]. Water Research, 43(17): 4123–4132.
DOI:10.1016/j.watres.2009.06.013
|
Zhou L, Li T, An J, et al. 2017. Subminimal inhibitory concentration (sub-MIC) of antibiotic induces electroactive biofilm formation in bioelectrochemical systems[J]. Water Research, 125: 280–287.
DOI:10.1016/j.watres.2017.08.059
|
 2019, Vol. 39
2019, Vol. 39


