随着社会经济的发展, 城市化进程加快造成城市不透水率增加, 导致非点源污染严重, 再加上人类日常生活对生态环境及生态循环产生一定的负面影响, 导致一些分布广泛、难降解且有毒有害的污染物增多, 这些都对人类生命健康及生活环境造成极大的威胁(Vicente et al., 2015; Xiong et al., 2017; Guidi et al., 2017; Weidemann et al., 2018).在中国北方城市中, 哈尔滨市气候属于中温带大陆性季风气候, 冬长夏短.集中降雪期为每年11月—次年1月, 2、3、4月为融雪期, 冬季平均气温为-22 ℃, 是典型的北方城市.冬季降雪时间长达5个月, 积雪累积时间长, 产生大量的污染物质, 因此, 研究春季融雪径流中的有毒有害污染物质是十分必要的, 这些污染物质会在春季随积雪融化进入地表水体成为主要污染源(Szklarek et al., 2015; Yuan et al., 2018).
在水环境中, PAHs是一种典型的持久性有机污染物, 广泛存在于水环境各介质中并能随之进行长距离迁移, 且因其具有较强的致癌、致崎、致突变的“三致”效应, 对水环境生态安全存在潜在的危害(Wei et al., 2017; Yao et al., 2017).因此, 对各介质中PAHs的空间分布及生态风险等方面进行深入研究已迫在眉睫.目前, 国内外研究己开展了大量关于河流、沉积物和饮用水源中PAHs生态风险评价的研究.例如, Wu等(2015)对九龙江河口水中多环芳烃进行风险评估显示PAHs对研究区内的水生生物构成的潜在风险较高. Habibullah-Al-Mamun等(2018)对孟加拉国沿海地区表层沉积物中多环芳烃进行风险评估, 结果显示沉积多环芳烃对生物造成了严重的破坏. Yu等(2018)对中国南方珠江三角洲饮用水源区中多环芳烃进行风险评估, 结果表明水中的生态风险被评为中等水平, 但与水摄入相关的不利健康风险很小. Galfi等(2017)对城市雨水和融雪径流中重金属浓度进行对比, 结果显示融雪径流比雨水中的浓度高出2~4倍.而对融雪径流中污染物的生态风险评价研究较少.基于此, 本文以我国哈尔滨市为研究区域, 利用BaP毒性当量法和风险熵值法评价融雪径流中不同下垫面及各采样点中PAHs风险等级、16种PAHs单体风险等级和对水生生物的影响, 以期为城市水污染控制提供依据.
2 材料与方法(Materials and methods) 2.1 研究区概况哈尔滨市地处中国东北平原, 黑龙江省南部.哈尔滨市区主要分布在松花江形成的三级阶地上:第一级阶地海拔在132~140 m之间, 主要包括道里区和道外区, 地面平坦; 第二级阶地海拔145~175 m, 由第一级阶地逐步过渡, 无明显界限, 主要包括南岗区和香坊区的部分地区, 面积较大, 长期流水侵蚀, 略有起伏, 土层深厚, 土质肥沃, 是哈尔滨市重要农业区; 第三级阶地海拔180~200 m, 主要分布在荒山嘴子和平房区南部等地, 再往东南则逐渐过渡到张广才岭余脉, 为丘陵地区.有松花江、阿什河、呼兰河、马家沟和何家沟贯穿城市(图 1).
 |
| 图 1 研究区位置及采样点 Fig. 1 The location of sampling points in the study area |
在哈尔滨市7个城区内选定48个采样点, 根据研究区的土地利用现状, 将各子汇水区分为绿地、水系、屋顶、小区内部道路、城市交通道路和人行道6种下垫面类型, 于2018-4-13在每个下垫面采取9个样品, 每个点采取3个平行样品, 同时对各排放口流量数据进行实时监测.采样点布设见图 1.融雪水样用采样器将地表径流引入棕色聚乙烯瓶中, 封口、编号、贴好标签运回实验室于4 ℃冷藏, 并于3 d内进行预处理和测定分析.
2.3 样品前处理及分析方法融雪径流样品采集后立即进行测定, 按照《HJ 478—2009水质多环芳烃的测定液液萃取和固相萃取高效液相色谱法》进行前处理.样品前处理方式采用液液萃取, 不经过滤直接进行萃取.用具有可调波长紫外检测器或荧光检测器和梯度洗脱功能的高效液相色谱仪(APS- 1806S), 测定USEPA公布的优先污染物中的16种多环芳烃, 即2~3环, 萘(NAP)、苊烯(ACY)、苊(ACE)、芴(FLU)、菲(PHE)、蒽(ANT); 4环, 荧蒽(FLA)、芘(PYR)、苯并[a]蒽(BaA)和(CHR); 5~6环, 苯并[b]荧蒽(BbF)、苯并[k]荧蒽(BkF)、苯并[a]芘(BaP)、茚并[1, 2, 3-cd]芘、二苯并[a, h]蒽(DahA)和苯并[ghi]苝(BghiP); 色谱柱:Hypersil Green PAH柱; 流速:0.80 mL · min-1; 检测波长:254 nm; 柱温:30 ℃; 梯度洗脱条件:27 min(V乙腈 : V水=65 : 35)、以2.5%乙腈/min的增量至100%乙腈/min, 保持至出峰完毕.进样量:20 μL样品溶液.
2.4 质量控制与保证整个实验分析过程按方法空白、样品空白、空白加标、基质加标、样品平行样进行质量保证和质量控制.以氘代PAHs(萘-d8、二氢-d10、菲-d10、-d12及苝-d12)作为内标.融雪径流样品中氘代标样的回收率为77.5%~93.2%.样品平行样相对标准偏差在20%以下.空白未检出目标污染物.用内标法计算PAHs的含量.
2.5 生态风险评价方法 2.5.1 BaP毒性当量生态风险评价法目前国内外较多采用PAHs单体相对于BaP的毒性当量因子(TEF, equivalence factor)来分析水环境中PAHs的健康风险.我国环保局发布的水体国家标准EBaP=2.8 ng · L-1. BaP毒性当量计算公式为:

|
(1) |
式中, EBaP为7种PAHs相对于BaP的毒性当量之和(ng · L-1);C表示各单体PAH在水中的浓度(ng · L-1).
2.5.2 风险熵值生态风险评价方法① 基于总等效质量浓度的风险熵值法:北方城市春季融雪期间形成的径流通过排水系统的传送或未经排水系统而直接进入下一级水体, 如河流、湖泊等, 使受纳水体的水质受到污染, 因而有必要对春季融雪径流水体PAHs进行生态风险评价(Bandowe et al., 2010; 周虹等, 2014; Abramova et al., 2016).本文在美国环保局毒性数据库(www. epa. gov /ec-otox)和有关文献(张克明, 1988)收集到9种PAHs对水生生物的急性毒性数据LC50见表 1, 涉及3~10种生物, 包括卤虫(Artemia salina)、大型蚤(Daphnia magna)、沼虾(Macrobrachiumkistnensis)、沙蚕(Neanthes arenaceodentata)、淡水虾(freshwater prawn)、胖头鲤鱼(pimephalespromelas)等, 毒性数据主要取24~96 h的LC50, 根据样本数量计算得到LC50均值.
| 表 1 9种PAHs对水生生物的急性毒性数据 Table 1 LC50 of 9 PAHs to aquatic organisms |
PAHs等效系数的计算:本研究采用推广风险系数法计算PAHs等效质量浓度, 定量研究有毒污染的生态危害以避免仅考虑单体PAH对水生生物的生态风险而对其危害造成低估.由于PAHs类污染物对生物的致毒机理相似, 所以采用等效系数来表征PAHs的联合作用效果.
计算等效系数的公式如下所示:

|
(2) |
式中, c为特定PAHs的实际测定质量浓度(μg · L-1); C等效为代表与此质量浓度化合物毒性相当的苯并[a]芘质量浓度(即等效质量浓度) (μg · L-1);lnLC50i为苯并[a]芘对水生生物的半致死质量浓度(均值) (μg · L-1);lnLC50e为化合物i对水生生物的半致死质量浓度(均值) (μg · L-1);对于简单的指数响应关系, 实际质量浓度与半致死质量浓度的关系见式(3).
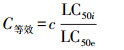
|
(3) |
在这种假设条件下, 各种PAHs均有确定的等效系数, 即C等效与c的比值.
PAHs风险熵的计算:采用商值法计算风险熵, 基于总等效质量浓度的风险熵可以进行PAHs的风险表征.
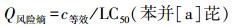
|
(4) |
Q风险熵> 1, 既存在风险; Q风险熵 < 1, 即风险有待进一步分析.
② 基于毒性当量因子的风险熵值法:在1997年提出的评价10种PAHs单体生态风险的风险熵值(RQ)法基础上, 利用相应的毒性当量因子(TEFs)推断出另外6种PAHs的最低风险浓度(NCs)和最高风险浓度(MPCs), 进而提出了水中16种PAHs单体及ΣPAHs的生态风险的RQ评价方法(Kalf et al., 1997; 曹治国等, 2010).RQ的计算公式如下所示:
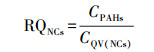
|
(5) |
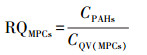
|
(6) |
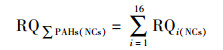
|
(7) |
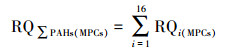
|
(8) |
式中, RQ为风险熵; CPAHs为介质中PAHs浓度; CQV为介质中PAHs的风险值; NCs为最低风险浓度; MPCs为最高风险浓度; CQV(NCs)为最低风险标准值; CQV(MPCs)为最高风险标准值.
水中各PAHs单体的NCs和MPCs值及生态风险等级划分标准见表 2~表 3.
| 表 2 水中各PAHs单体的NCs和MPCs值 Table 2 NCs and MPCs of individual PAHs in water |
| 表 3 单体和ΣPAH的生态风险等级划分 Table 3 Risk classification of individual PAHs and ΣPAH |
将不同采样点位的PAHs浓度数据利用SPSS进行分析, 得到偏度系数和峰度系数均小于1, 可认为数据近似呈正态分布.
3 结果与讨论(Results and discussion) 3.1 BaP毒性当量生态风险评价不同下垫面EBaP值空间分布如图 2所示.其中城市道路中所有采样点EBaP值均超过《地表水环境质量标准》(GB3838—2002)中限值2.8 ng · L-1, 中山路EBaP值最高, 为20.06 ng · L-1, 超过国家标准的7.16倍.最小值出现在新阳路, 为7.58 ng · L-1, 超过国家标准的2.7倍.内部道路中所有采样点EBaP值均超过我国水体标准2.8 ng · L-1, 哈平西路EBaP值最高, 为15.5 ng · L-1, 超过国家标准的5.54倍.最小值出现在一匡街, 为3.24 ng · L-1, 超过国家标准的1.16倍.绿地中只有安正街超过国家水体标准的1.14倍, 为3.2 ng · L-1.人行道中只有珠江路超过国家水体标准的1.05倍, 为2.94 ng · L-1.绿地和人行道其它采样点、屋面和冰面均未超出.
 |
| 图 2 不同下垫面EBaP值空间分布图 Fig. 2 Spatial distribution of EBaP values of snowmelt runoff in different underlying surfaces |
根据式(2)~式(4)和不同下垫面融雪径流中PAHs平均质量浓度值计算得到9种PAHs的等效系数和对于苯并[a]芘的等效质量浓度, 将多种PAHs的危害归于统一尺度下进行比较.等效系数在一定程度上能够反映各种PAHs的毒性差别, 等效系数越大, 对生物的毒性就越强.可以看出:水生生物对融雪径流中Pyr最为敏感, 等效系数为10.457;对Flu的耐受性最强, 等效系数为0.003;耐受性顺序依次为: Flu < Ace < Chr < Ant < Nap < Fla < BaP < Phe < Pyr; 即水生生物对融雪径流中Pyr的毒性最强, Flu的毒性最弱, Nap的毒性居中.城市道路、内部道路、人行道、绿地、屋面和冰面Pyr的等效质量浓度均最高并呈现出递减趋势, 分别为8.674、8.411、7.931、2.032、2.002和2.0001 μg · L-1. 6种下垫面9种PAHs的总等效质量浓度:城市道路>内部道路>人行道>屋顶>绿地>冰面.苯并[a]芘的平均LC50为470.6 μg · L-1, 最小LC50为48 μg · L-1, 最大LC50为1231μg · L-1.就总等效质量浓度而言, 城市道路融雪径流毒性最强, 冰面融雪径流毒性最小, 见表 4.基于风险熵值, 城市道路、内部带路和人行道融雪径流中PAHs对大型蚤(Daphnia magna)和胖头鲤鱼(pimephales promelas)的风险熵均大于1, 说明9种PAHs对这两种水生生物存在风险, 其风险影响不容忽视.
| 表 4 不同下垫面9种多环芳烃等效质量浓度 Table 4 Equivalent mass concentration of 9 polycyclic aromatic hydrocarbons on different underlying surfaces |
从图 3可以看出, 6种下垫面融雪径流中RQΣPAHs(NC)值为254.24~2155.41(均值为1276.43), 而RQ∑PAHs(MPCs)值则为2.54~21.55, 平均值为12.76.风险最低值位于冰面, 风险最高值出现在城市道路.采用表 2~表 3的生态风险等级划分对哈尔滨市融雪径流中PAHs污染水平进行评价:从各PAHs单体RQ均值来看, Ant和BbF最高, 其RQMPCs均值都为1.53, 其次是BaA 1.46, Pyr 1.2, BghiP 1.04, 均属高风险等级, 其余单体均有中等生态风险; 不同下垫面ΣPAHs的生态风险差异明显, 城市道路、内部道路、人行道和绿地融雪径流中PAHs污染处于高生态风险等级, 而屋面和冰面的生态风险处于较低水平.
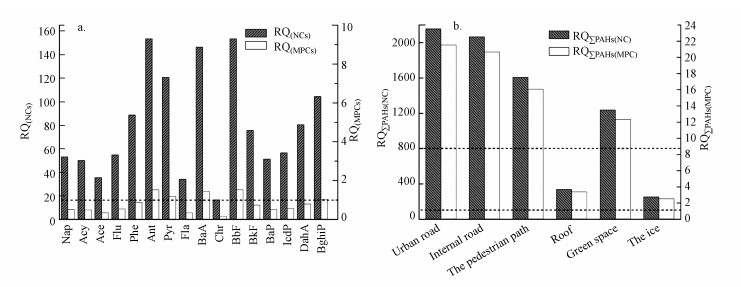 |
| 图 3 生态风险评估 (a.单体PAH RQ(NCs)和RQ(MPCs)值, 虚线表示风险阈值; 右y轴阈值设定为1; b.不同下垫面ΣPAHs的RQ(NC)和RQ(MPC)的值, 虚线表示风险阈值; 左侧y轴阈值设定为800;右侧y轴阈值设定为1) Fig. 3 Ecological risk assessment (a. RQ(NCs) and RQ(MPCs) of individual PAHs, dotted line indicates risk thresholds at 1; b. RQ(NC) and RQ(MPC)of total PAHs in different underlying surface, dotted line indicates risk thresholds at 800 for RQNC and 1 for RQMPC) |
互为同分异构体的多环芳烃通常具有相似的动力学质量转移系数与热力学分配系数, 因此能够根据其含量比值来区分不同热源与石油源等(崔杰石, 2016).哈尔滨市不同下垫面融雪径流中PAHs的来源(图 4).从ANT /(ANT + PHE)的比值(图 4a)可以看出人行道的比值小于0.10, 为石油来源.而城市道路、内部道路、屋顶、绿地和冰面比值均大于0.10, 为燃烧源.从BaA /(BaA + CHR)的比值(图 4a)可以看出城市道路的比值为0.19~0.42, 平均值为0.30;冰面的比值为0.23~0.46, 平均值为0.33.二者均为混合源.而人行道、内部道路和绿地的比值均小于0.35, 为石油源.从FLA /(FLA + PYR)的比值(图 4b)可以看出城市道路和内部道路比值平均值分别为0.20和0.23, 为石油源.从IcdP /(IcdP + BghiP)的比值(图 4b)可以看出人行道、屋顶和冰面的比值分别为0.30、0.35和0.50, 表明为石油燃烧.绿地的比值范围为0.50~0.70, 平均值为0.59, 表明为生物质和煤的燃烧.从BaP / BghiP的比值(图 4c)可以看出除人行道外其它5种下垫面(城市道路、内部道路、屋顶、绿地和冰面)比值的平均值均大于0.6, 分别为0.90、1.00、1.20、1.60和0.60, 表明来源为交通尾气排放.从FLO /(FLO + PYR)的比值(图 4c)可以看出内部道路和屋顶比值的平均值小于0.5, 为汽油车尾气排放.城市道路、人行道、绿地和冰面比值的平均值大于0.5, 为柴油车尾气排放.其中BghiP、IcdP and DahA代表了汽车尾气排放(Kavouras et al., 2001), ACY、ACE和FLO指示石油燃烧(Larsen et al., 2003), 而NAP是煤和木材的指标剂(Wu et al., 2014).总体而言, 哈尔滨主要城区的不同下垫面多环芳烃主要来源于燃烧过程, 其中交通排放源显著, 尤其是汽油车辆尾气排放.因此, 只有合理控制冬季燃煤的时间和数量, 合理管控汽车的出行才能保证城市良好的生态环境.
 |
| 图 4 融雪径流中多环芳烃污染散点图 Fig. 4 Scatter plot of polycyclic aromatic hydrocarbons in snowmelt runoff |
1) EBaP毒性当量评价结果为城市道路和内部道路所有采样点均超过《地表水环境质量标准》(GB3838—2002)中限值2.8 ng · L-1.绿地中只有安正街超过国家水体标准的1.14倍, 人行道中只有珠江路超过国家水体标准的1.05倍, 绿地和人行道其它采样点、屋面和冰面均未超出.
2) 基于总等效质量浓度的风险熵值法评价结果表明水生生物对融雪径流中Flu的毒性最强, Nap的毒性最弱, Pyr的毒性居中.耐受性顺序依次为: Nap > Ace> Chr > Ant > Pyr > Fla> BaP > Phe >Flu.城市道路内部道路和人行道融雪径流中PAHs对大型蚤和胖头鲤鱼的风险商均大于1, 说明9种PAHs对这两种水生生物存在风险.
3) 风险熵值评价结果, 不同下垫面ΣPAHs的生态风险差异明显, 城市道路、内部道路、人行道和绿地融雪径流中PAHs污染属于高生态风险等级, 而屋面和冰面处于较低水平.从各PAHs单体RQ均值来看, Ant和BbF最高, 其次是BaA、Pyr和BghiP, 均属高风险等级, 其余单体均有中等生态风险.
4) 对哈尔滨市不同下垫面融雪径流中PAHs来源用比值法进行分析, 结果显示融雪径流中PAHs主要来源于燃烧过程, 其中交通排放源显著, 尤其是汽油车辆尾气排放.
Abramova A, Chernianskii S. 2016. Distribution of polycyclic aromatic hydrocarbons in snow particulates around Longyearbyen and Barentsburg settlements, Spitsbergen[J]. Polar Record, 52(6): 645–659.
DOI:10.1017/S0032247416000243
|
Bandowe B A M, Shukurov N, Kersten M, et al. 2010. Polycyclic aromatic hydrocarbons (PAHs) and their oxygen-containing derivatives (OPAHs) in soils from the Angren industrial area, Uzbekistan[J]. Environmental Pollution, 158(9): 2888–2899.
DOI:10.1016/j.envpol.2010.06.012
|
曹治国, 刘静玲, 栾芸, 等. 2010. 滦河流域多环芳烃的污染特征、风险评价与来源辨析[J]. 环境科学学报, 2010, 30(2): 246–253.
|
崔杰石. 2016. 基于SWAT模型的汤河流域面源污染时空分布研究[J]. 水利规划与设计, 2016(2): 4–6 + 29.
DOI:10.3969/j.issn.1672-2469.2016.02.002 |
Galfi H, Österlund H., Marsalek J, et al. 2017. Mineral and Anthropogenic Indicator Inorganics in Urban Stormwater and Snowmelt Runoff:Sources and Mobility Patterns[J]. Water Air and Soil Pollution, 228(7): 263.
DOI:10.1007/s11270-017-3438-x
|
Guidi G D, Falciglia P P, Catalfo A, et al. 2017. Soil contaminated with PAHs and nitro-PAHs:contamination levels in an urban area of Catania (Sicily, southern Italy) and experimental results from simulated decontamination treatment[J]. Clean Technologies & Environmental Policy, 19(4): 1121–1132.
|
Habibullah-Al-Mamun M, Ahmed M K, Hossain A, et al. 2018. Distribution, source apportionment, and risk assessment of polycyclic aromatic hydrocarbons (PAHs) in the surficial sediments from the Coastal Areas of Bangladesh[J]. Archives of Environmental Contamination and Toxicology, 76(2): 178–190.
|
Kalf D F, Crommentuijn T, Vandeplassche E J. 1997. Environment quality objectives for 10 polycyclic aromatic hydrocarbons (PAHs)[J]. Ecotoxicology and Environmental Safety, 36(1): 89–97.
DOI:10.1006/eesa.1996.1495
|
Kavouras I G, Koutrakis P, Tsapakis M, et al. 2001. Source apportionment of urban particulate aliphatic and polynuclear aromatic hydrocarbons(PAHs) using multivariatemethods[J]. Environmental Science & Technology, 35(11): 2288–2294.
|
Larsen R K, Baker J E. 2003. Source apportionment of polycyclic aromatic hydrocarbons in the urban atmosphere:a comparison ofthree methods[J]. Environmental Science & Technology, 37(9): 1873–1881.
|
Szklarek S, Stolarska M, Wagner I, et al. 2015. The microbiotest battery as an important component in the assessment of snowmelt toxicity in urban watercourses-preliminary studies[J]. Environmental Monitoring and Assessment, 187(2): 16.
DOI:10.1007/s10661-014-4252-1
|
Vicente E D, Vicente A M, Bandowe B, et al. 2015. Particulate phase emission of parent polycyclic aromatic hydrocarbons (PAHs) and their derivatives (alkyl-PAHs, oxygenated-PAHs, azaarenes and nitrated PAHs) from manually and automatically fired combustion appliances[J]. Air Quality Atmosphere & Health, 9(6): 1–16.
|
Wei Y, Liu S S, Wang Z, et al. 2017. The distribution variation of polycyclic aromatic hydrocarbons between fresh snow and seasonal snowpack in campus in Changchun City, Northeast China[J]. Water, Air, & Soil Pollution, 228(7): 233.
|
Weidemann E, Buss W, Edo M, et al. 2018. Influence of pyrolysis temperature and production unit on formation of selected PAHs, oxy-PAHs, N-PACs, PCDDs, and PCDFs in biochar-a screening study[J]. Environmental Science & Pollution Research International, 25(4): 3933–3940.
|
Wu Y, Wang X, Li Y, et al. 2015. Polybrominated diphenyl ethers, organochlorine pesticides, and polycyclic aromatic hydrocarbons in water from the Jiulong River Estuary, China:levels, distributions, influencing factors, and risk assessment[J]. Environmental Science & Pollution Research, 24(10): 8933–8945.
|
Wu D, Wang Z S, Chen J H, et al. 2014. Polycyclic aromatic hydrocarbons (PAHs) in atmospheric PM2.5 and PM10 at a coal-based industrial city:implication for PAH control at industrial agglomeration regions, China[J]. Atmospheric ResEarch, 149: 217–229.
DOI:10.1016/j.atmosres.2014.06.012
|
Xiong G N, Zhang Y H, Duan Y H, et al. 2017. Uptake of PAHs by cabbage root and leaf in vegetable plots near a large coking manufacturer and associations with PAHs in cabbage core[J]. Environmental Science & Pollution Research, 24(23): 18953–18965.
|
Yao Y, Huang C L, Wang J Z, et al. 2017. Significance of anthropogenic factors to freely dissolved polycyclic aromatic hydrocarbons in freshwater of China[J]. Environmental Science & Technology, 51(15): 8304–8312.
|
Yuan D, Liu Y, Guo X, et al. 2018. Characteristic contaminants in snowpack and snowmelt surface runoff from different functional areas in Beijing, China[J]. Environmental Science and Pollution Research, 25(36): 36256–36266.
DOI:10.1007/s11356-018-3501-1
|
Yu Y, Yu Z, Wang Z, et al. 2018. Polycyclic aromatic hydrocarbons (PAHs) in multi-phases from the drinking water source area of the Pearl River Delta (PRD) in South China:Distribution, source apportionment, and risk assessment[J]. Environmental Science & Pollution Research, 25(13): 12557–12569.
|
张克明. 1988. 化学物质毒性数据库[J]. 环境科学, 1988(4): 73–73.
|
周虹, 曹银铃, 余朝琦, 等. 2014. 贡嘎山海螺沟新降雪中多环芳烃的组成差异及来源解析[J]. 应用化工, 2014, 43(1): 175–177.
|
 2019, Vol. 39
2019, Vol. 39


