2. 中国科学院生态环境研究中心, 环境化学与生态毒理学国家重点实验室, 北京 100085
2. State Key Laboratory of Environmental Chemistry and Ecological Toxicology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085
全氟化合物(perfluorinated compounds, PFCs)是一类碳链上的氢原子全部被氟原子所取代的人工合成有机物, 因其化学性质稳定、表面活性低、疏水疏油、耐高温等特性而被广泛应用于防水涂层、灭火泡沫、油漆、润滑剂、食品包装、纺织等领域(Plumlee et al., 2008;Dolman et al., 2011;Liu et al., 2015;孟娣等, 2017).全氟辛酸(PFOA)和全氟辛烷磺酸(PFOS)是目前应用最为广泛的两种全氟化合物, 它们已经在各种环境介质中被检测出来, 如饮用水、地下水、地表水、土壤、沉积物等(王之芬等, 2019).由于PFOA和PFOS难以生物降解, 可在环境中持久存在, 并具有一定的生物蓄积性、肝毒性、免疫毒性等多种毒性, 已经对生态系统和人类造成了潜在的威胁, 因此, 关于水中PFCs等物质的降解特性研究成为当今学者研究的重点(Jian et al., 2017;Sun et al., 2017;宋彦敏等, 2017).
目前, 关于PFCs的去除方法主要有吸附法、膜分离法、化学氧化法以及超声热解法等(Ma et al., 2015).不同去除方法下的PFCs降解效果如表 1所示, 其中电化学氧化法已被证实可以快速地分解、矿化PFCs, 且具有去除率高、反应条件温和、无二次污染等优点而被重点研究(Niu et al., 2016).然而, 电化学氧化工艺中, 电极材料对降解效果有着重要的决定作用(卓琼芳等, 2019).一般而言, 电化学反应中的阳极材料应具有高析氧电位、高稳定性及高催化活性.随着近些年的发展, 金属氧化物电极(又称形稳阳极, Dimensionally Stable Anode, DSA)因其良好的电催化特性及稳定性而被广泛应用于难降解污染物处理研究(牛军峰等, 2017;胡承志等, 2018).Lin等(2012)采用Ti/SnO2-Sb2O5电极对PFOA进行电解, 90.0 min后去除率可达90.3%.Zhou等(2017)以Ti/SnO2-Sb2O5/PbO2-PVDF为阳极, 在电流密度为40.0 mA · cm-2, pH为3.00的溶液中电解180 min后, 对100 mg · L-1的PFOA的去除率为92.1%, 但是随着极板使用时间的增加, 极板涂层易脱落导致降解效果的大幅降低.基于前期研究可知, 关于DSA电极的电化学氧化法对于PFCs的去除虽具有良好效果, 但由于活性涂层与基底之间结合不牢固, 易出现活性涂层剥落现象, 导致电极催化活性下降及基底钝化等现象.
| 表 1 不同去除方法下PFOA和PFOS的降解效果 Table 1 Degradation of PFOA and PFOS by different removal methods |
有研究表明, 在二氧化锡(SnO2)电极中掺入少许纳米氧化锌(ZnO)等金属氧化物不仅能够提高电极的导电性, 而且由于掺杂所增加的电子空穴, 还可增加电极表面的催化点位, 提高电极的催化性能(刘洁等, 2009;Duan et al., 2012; Rao et al., 2018).因此, 本文分别采用凝胶涂覆法和电沉积法制备改性DSA(Ti/SnO2-ZnO)电极, 以考察ZnO的掺杂对DSA电极的微观形貌和催化性能影响, 并在多因素参数条件下探究改性DSA电极对PFOA和PFOS等典型PFCs物质的去除效果.
2 材料与方法(Materials and methods) 2.1 材料与仪器材料及试剂:三氯化锑(SbCl3, AR)、氯化锌(ZnCl2, AR)和聚乙二醇(HO(CH2CH2)nOH, AR)购于国药集团化学试剂有限公司;柠檬酸(C6H8O7 · H2O, AR)、乙二醇(C2H6O2, AR)、无水硫酸钠(Na2SO4, AR)、氨水(AR)和无水乙醇(CH3CH2OH)购于北京化工厂;氯化亚锡二水合物(SnCl2 · H2O)购于阿拉丁试剂公司;次氯酸钠(AR)购于广东光华科技有限公司, 硝酸锌(Zn(NO3)2 · 6H2O, AR)购于山东西亚化学工业有限公司;PFOA标准品、PFOS标准品购于百灵威科技有限公司.
仪器:马弗炉(型号:SX2-4-10, 天津市中环实验电炉有限公司);PHS-3S型pH计(天津市科密欧化学试剂有限公司), DH-101电热恒温鼓风干燥箱(天津市中环实验电炉有限公司).
2.2 钛基改性DSA电极制备极板预处理:将钛板(90.0 mm× 80.0 mm× 3.00 mm)用粗、细砂纸打磨后, 经无水乙醇及去离子水超声洗涤20.0 min后, 放入90.0 ℃的50.0 mg · L-1的NaOH溶液中浸泡60.0 min, 以去除其表面油污, 随后用去离子水洗净后置入质量分数为30.0%的沸腾草酸溶液中刻蚀120 min, 处理完毕后将钛板置于质量分数为20.0%的草酸溶液中待用.
① 溶胶-涂覆法(Sol-gel)制备Ti/SnO2-ZnO电极:将含有锡锑摩尔比为9.5:1的金属盐溶于乙二醇溶液中, 40.0 ℃下搅拌至透明, 用氨水调至pH=8.00, 70.0 ℃下加热240 min后抽滤, 并用去离子水洗涤滤饼再次抽滤, 随后将滤饼及一定量Zn(NO3)2溶于1.00 mol · L-1柠檬酸溶液中, 并加入少量聚乙二醇作包裹剂, 得到橙黄色前驱体溶液, 超声15.0 min, 静置陈化120 min得涂液.用涂液将钛板涂刷均匀, 105 ℃烘干取出, 重复10次, 最后在600 ℃下热处理120 min, 取出干燥、备用.
② 电沉积法(Electrodeposition)制备Ti/SnO2-ZnO电极:采用恒电流法进行电极制备, 工作电极为预处理后的钛板, 对电极为同等面积的石墨电极, 电流密度为5.00 mA · cm-2, 沉积时间为30.0 min.电沉积溶液组成为:0.100 mol · L-1 SnCl2 · 2H2O、0.0100 mol · L-1 SbCl3、0.00800 mol · L-1 ZnCl2的乙醇溶液, 并加入少量盐酸以防止SnCl2水解.
2.3 实验过程优化采用自制的二维电极反应器(有机玻璃)为电解槽, 分别以溶胶涂覆法和电沉积法所制备的Ti/SnO2-ZnO作为阳极, 阴极为同等面积的普通钛板(电极反应面积约为65.0 cm2).极板间距固定为15.0 mm, 电解质为1.30 g · L-1次氯酸钠溶液, 分别探究不同电流密度(10.0~30.0 mA · cm-2)、溶液初始pH(3.50~9.50)及PFOA与PFOS初始浓度(10.0~100 mg · L-1)对PFCs降解效果的影响.
2.4 分析与表征方法电极表面涂层表征:采用Gemini300型电子显微镜(FEI公司)对电极表面形貌进行分析, 其中加速电压为5.00 kV.XRD测试采用D8 advance型X射线衍射仪(德国Bruker公司), 2θ范围为5.00°~90.0°, 扫描速度为15.0° · min-1.
电化学性能测试:采用AUT86329型电化学工作站(瑞士万通中国)进行电化学测试, 分别以两种方法所制的钛基改性DSA电极为工作电极, 铂网为对电极, Ag/AgCl为参比电极, 测试面积为20.0 mm× 20.0 mm, 支持电解质为0.100 mol · L-1 NaSO4溶液.伏安线性测试扫描范围0~2.00 V(vs.Ag/AgCl), 扫速为0.100 V · s-1.交流阻抗测试频率为0.100 Hz~100 kHz.
PFOA和PFOS分析方法:利用岛津LCMS-8040型高效液相色谱质谱联用仪测定反应液中的PFOA与PFOS.选用C18反相色谱分析柱shim-pack XR-ODS(2.00 i.d× 75.0 mm), 流动相—A泵进乙腈或者正己烷(色谱纯), B泵进磷酸二氢钠盐溶液(20.0 mmol · L-1, pH=2.00), 进样体积0.100 μL, 流速0.400 mL · min-1;梯度淋洗程序为B相:0~ 3.00 min, 70.0%;3.00~5.00 min, 30.0%, 样品检测时间为6.00 min, 具体检测过程可参见本研究之前的报道(Zhang et al., 2018).
3 结果与讨论(Results and analysis) 3.1 钛基改性DSA电极物化性能分析 3.1.1 极板表面涂层SEM-XRD分析溶胶涂覆法与电沉积法制备的Ti/SnO2-ZnO电极XRD图谱如图 1所示.与PDF标准卡片(卡片号77-0477、71-0143、89-0510)相比, 所得衍射峰基本吻合, 分别属于SnO2、Sb2O5和ZnO的特征峰, 且SnO2的衍射峰最强, 说明Sb、Zn元素成功的掺杂进SnO2中.且由图中可以直观地看出, 溶胶涂覆法制备的改性DSA电极涂层中ZnO衍射峰要明显强于电沉积法, 表明ZnO的掺杂量要更为丰富.
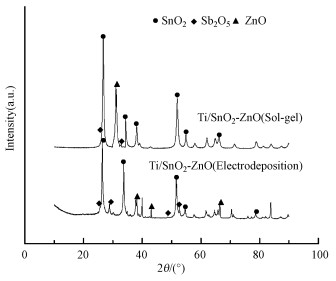 |
| 图 1 溶胶涂覆法和电沉积法制备的Ti/SnO2-ZnO电极XRD图 Fig. 1 XRD patterns of Ti/SnO2-ZnO electrodes by Sol-gel and Electrodeposition |
进一步对改性DSA电极的微观形貌分析, 其扫面电镜图如图 2所示.采用溶胶涂覆法所制备的Ti/SnO2-ZnO电极(图 2 a, 2 b)表面涂层较为致密, 颗粒粒径分布在0.2 μm左右, 且部分区域出现团聚现象, 几乎没有裸露的钛基体存在, 对防止电解过程中活性氧向基体扩散, 延长电极使用寿命具有保护的作用.而采用电沉积法制备的Ti/SnO2-ZnO电极(图 2 c, 2 d)涂层表面同样致密, 晶体颗粒饱满, 并呈现出枝状结构.与溶胶涂覆法相比, 其晶体颗粒更为细小, 够为电催化过程提供更多的催化位点.
 |
| 图 2 溶胶涂覆法(a、b)和电沉积法(c、d)制备的Ti/SnO2-ZnO电极SEM图 Fig. 2 SEM images of Ti/SnO2-ZnO electrodes by Sol-gel (a, b) and Electrodeposition (c, d) |
在阳极电化学氧化降解污染物过程中, 析氧反应是一个主要的副反应, 因此阳极材料的析氧电位越高, 电极的“非活性”越强, 对有机物的电催化活性越高.如图 3所示, 在0.100 mol · L-1 NaSO4溶液中, 采用溶胶涂覆法和电沉积法所制备的Ti/SnO2-ZnO电极析氧过电位分别为1.56、1.72 V(vs.Ag/AgCl), 表明锑和锌的掺杂, 产生了更多的电子空穴, 使得电极具有良好的导电性和电化学性能.因此采用电沉积法所制备的Ti/SnO2-ZnO的析氧过电位高于溶胶涂覆法所制备的电极, 其· OH产率更高, 物理吸附态的· OH与电极表面的相互作用较弱, 使其具有更高的电催化活性.
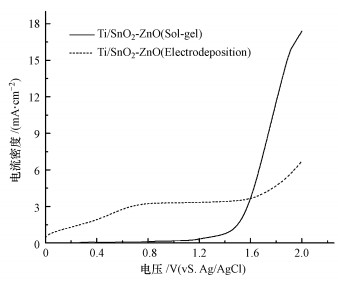 |
| 图 3 Ti/SnO2-ZnO电极线性伏安曲线 Fig. 3 Linear sweep voltammetry of the Ti/SnO2-ZnO electrode |
从图 4a的Tafel曲线中可以看出, 与溶胶涂覆法相比电沉积法所制得Ti/SnO2-ZnO电极腐蚀电位正移, 说明电沉积法所制备的电极活性更低、耐腐蚀性能更强.两种制备方法下的Ti/SnO2-ZnO的Tafel曲线阴极分支斜率要明显大于阳极分支斜率, 说明Ti/SnO2-ZnO电极的腐蚀过程主要由阴极控制, 同时在阳极区, 电沉积法制备的电极电流变化幅度要小于溶胶涂覆法, 表明采用电沉积法所制备的电极稳定性要优于溶胶涂覆法.
 |
| 图 4 Ti/SnO2-ZnO电极的Tafel曲线(a)和Nyquist图(b) Fig. 4 The Tafel plot and Nyquist plots of the Ti/SnO2-ZnO electrode |
从图 4b可以看出, 两种制备方法下的电极Nyquist曲线近似成半圆形, 说明其电极过程的控制步骤为电荷传递过程(电化学反应步骤)控制.其中两种制备方法下的内阻RΩ相差不大, 在3.00 Ω左右, 而采用电沉积法所制备的Ti/SnO2-ZnO电极电荷转移电阻Rct(47.9 Ω)要明显大于溶胶涂覆法所制备的电极Rct(13.1 Ω), 从一定意义上来说两种制备方法下的电极都具有良好的电化学性能, 而较大电荷转移电阻使得阳极的析氧反应更加难以发生, 因而增大了电极的催化活性.极板材料的电化学腐蚀过程主要与电荷传递过程有关, 这表明电沉积法所制备的Ti/SnO2-ZnO电极的耐腐蚀性能更优, 这也与Tafel曲线的分析结果相一致.
3.2 实验参数优化 3.2.1 电流密度对PFCs去除效果的影响在溶液初始pH为3.50, 初始浓度分别为100 mg · L-1的PFOA和PFOS溶液中, 不同电流密度下(10.0、20.0、30.0 mA · cm-2)PFOA和PFOS的去除效果如图 5所示.随着电流密度的提高, 两种制备方法下的Ti/SnO2-ZnO电极对PFOA和PFOS的去除率均不断增大, 当电流密度为30.0 mA · cm-2, 150 min内, Ti/SnO2-ZnO电极对PFOA的去除率为95.2%(Electrodeposition)和92.6%(Sol-gel), 对PFOS的去除率为93.4%(Electrodeposition)和89.1%(Sol-gel), 主要是因为采用电沉积法所制备的电极, 在相同电流密度下· OH产率更高, 电催化性能更强.当电流密度从10.0 mA · cm-2增大到20.0 mA · cm-2时, PFOA和PFOS的去除率增长较快, 这是因为随着电流密度的增加, 增强了电子传递和电极的催化活性, 从而增加了PFCs的去除效果, 而当电流密度从20.0 mA · cm-2增大到30.0 mA · cm-2时, PFOA和PFOS的去除率增长并不明显, 这是由于随着电流密度的增加, 促进了析氢、析氧反应的发生, 使得大量气泡附着在极板表面, 从而影响了· OH等催化活性物质的产生, 同时电流密度过大不仅会造成电能的浪费, 还可能会导致阳极极板的极化和钝化, 因此本实验选取电流密度为20.0 mA · cm-2作为最佳参数.
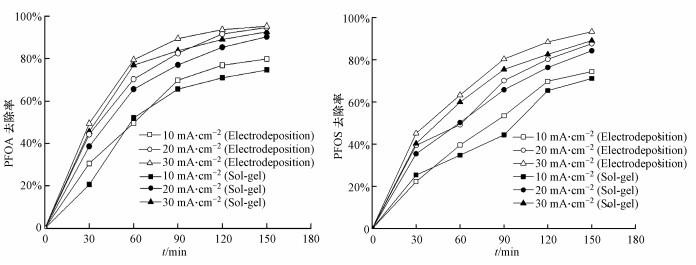 |
| 图 5 电流密度对PFOA和PFOS去除效果的影响 Fig. 5 Effect of current density on the PFOA and PFOS degradation |
固定电流密度为20.0 mA · cm-2, 初始浓度分别为100 mg · L-1的PFOA和PFOS溶液中, 不同pH下(pH=3.50、pH=6.50、pH=9.50) PFOA和PFOS的去除效果如图 6所示.
 |
| 图 6 pH对PFOA和PFOS去除效果的影响 Fig. 6 Effect of pH on the PFOA and PFOS degradation |
当pH=9.50时PFOA和PFOS的去除效果最差, 此时较多的氢氧根由于静电吸引而附着在阳极表面, 占据了· OH的活性点位, 导致PFCs的去除效果下降(Niu et al., 2016).当pH=3.50, 离子态的PFOA更容易被吸附到阳极表面而被催化降解. PFOS在pH=6.50的去除效果要优于pH=3.50时, 这主要是因为离子态的PFOS其电荷主要集中在末端的磺酸基端, 易发生解离反应, 当溶液酸性较大时, 则会抑制其解离, 从而影响PFOS的降解(薛倩倩, 2013).因此本实验确定PFOA和PFOS最佳降解初始pH分别为3.50和6.50.
3.2.3 初始浓度对PFCs去除效果的影响在上述实验确定的最佳参数:电流密度为20.0 mA · cm-2, PFOA溶液pH=3.50、PFOS溶液的pH=6.50时, 探究不同初始浓度下(10.0、50.0、100 mg · L-1) PFOA和PFOS的去除效果, 结果如图 7所示.
 |
| 图 7 初始浓度对PFOA和PFOS去除效果的影响 Fig. 7 Effect of initial concentration on the PFOA and PFOS degradation |
由图 7可以看出, 两种制备方法下的Ti/SnO2-ZnO电极对于初始浓度为10.0、50.0、100 mg · L-1的PFOA和PFOS均具有良好的电化学氧化降解效果, 且去除率均高于90.0%, 对于相同浓度的PFOA和PFOS, 电沉积法制备的Ti/SnO2-ZnO其电化学氧化降解效果更佳.随着PFOA和PFOS的浓度升高, 去除率逐渐降低, 这主要是因为在相同的反应体系中, 阳极区域所产生的· OH的量是一定的, 对于PFCs的降解能力相同, 随着PFCs浓度的升高, 会出现更多的中间产物与PFCs竞争· OH, 从而导致去除率逐渐降低(智丹等, 2018).
3.3 极板稳定性及降解动力学分析上述实验结果表明采用电沉积法所制备的Ti/SnO2-ZnO的电催化性能要优于溶胶涂覆法, 故在最优条件下电流密度为20.0 mA · cm-2, 极板间距15.0 mm, 电解质为1.30 g · L-1次氯酸钠溶液, 电解时间150 min, 进行重复降解实验, 分别探究两种制备方法对100 mg · L-1的PFOA(pH=3.50)和PFOS (pH=6.50)的降解效果稳定性.其结果如图 8所示.
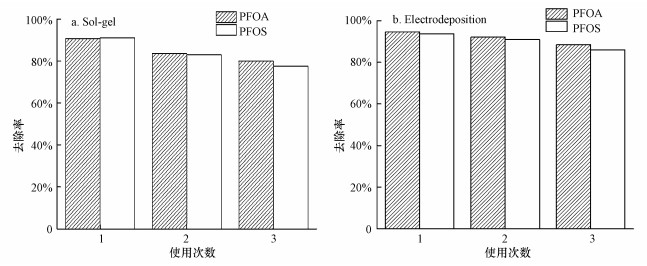 |
| 图 8 使用次数对PFOA和PFOS去除效果的影响(a.溶胶涂覆法, b.电沉积法) Fig. 8 Effect of frequency of use on the PFOA and PFOS degradation(a. Sol-gel, b.Electrodeposition) |
在循环使用3次后, 溶胶涂敷法和电沉积法制备的Ti/SnO2-ZnO电极对PFOA的去除率分别从90.6%、94.6%降为79.9%和88.5%, 相比初次使用, 降低了11.8%和6.40%;而对PFOS的去除率, 分别从91.0%和93.7%降为77.5%和88.3%, 降幅超过14.8%和7.50%, 由此, 可进一步断定电沉积法所制备的Ti/SnO2-ZnO稳定性较好, 可在实际应用中使用较长时间.在3次电化学降解循环实验中, PFOA和PFOS在2种制备方法下的Ti/SnO2-ZnO电极上相关动力学参数, 如表 2所示.
| 表 2 Ti/SnO2-ZnO降解PFCs动力学参数 Table 2 Kinetic parameters of degradation of PFCs by Ti/SnO2-ZnO |
从表 2可以看出, 两种制备方法下的Ti/SnO2-ZnO电极对PFCs的降解更符合准一级反应动力学方程, 这与之前的研究类似(Niu et al., 2016), 即可用准一级反应动力学对反应程度进行预测.两种制备方法下的Ti/SnO2-ZnO电极对PFOS的降解速率常数大致相同(0.0180 s-1), 而采用电沉积法制备的极板对PFOA的降解速率常数要明显高于凝胶涂敷法, 这可能由于溶胶涂敷法所制备的极板涂层稳定性差, 而电沉积法制备的Ti/SnO2-ZnO电极更加稳定, 且具有更高的电催化活性, 对PFCs的去除效果较好.
3.4 PFCs去除机理讨论经本研究改性后的DSA电极(Ti/SnO2-ZnO)具有较高的析氧电位, 其所产生的· OH, 除可直接参与PFCs的降解外, 还可作为降解PFCs时诱发链反应的引发剂(牛军峰等, 2017), 在此反应过程中, PFOA和PFOS首先在Ti/SnO2-ZnO极板表面发生反应, 被夺取一个电子, 形成CnF2n+1COO ·或CnF2n+1SO3 ·, 随后发生脱羧反应或去磺化反应, 形成全氟烷基(CnF2n+1 ·)(Lin et al., 2015).而CnF2n+1 ·与· OH相互作用, 生成CnF2n+1OH, 由于其分子不稳定, 易发生分子重排, 形成全氟酰氟(Cn-1F2n-1COF), 并脱去一个HF, 然后发生水解, 形成短链全氟羧酸, 不断重复该循环, 最终PFCs被矿化为CO2和HF.除此之外, 在降解的过程当中, 改性后的DSA电极由于涂层有少量的纳米ZnO物质, 可推测在电化学反应过程中也有微弱的光催化作用加入, 在光照的条件下, ZnO粒子进一步发生能级跃迁, 产生了· OH, 协助了PFOA等物质的降解.结合本实验及前期的研究, PFOA和PFOS的降解可认为主要是由极板的电化学氧化和· OH的辅助降解, 该过程可简述为以下反应方程式:

|
(1) |

|
(2) |
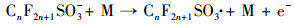
|
(3) |
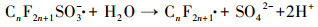
|
(4) |
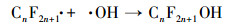
|
(5) |
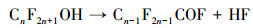
|
(6) |
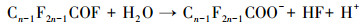
|
(7) |
1) 通过SEM、XRD对溶胶涂覆法和电沉积法制备的Ti/SnO2-ZnO电极进行表征, 两种制备方法下的电极表面涂层均匀致密, 且SnO2的衍射峰最强, Sb、Zn元素成功的掺杂进SnO2中, 其中Ti/SnO2-ZnO(Sol-gel)涂层表面出现团聚现象, Ti/SnO2-ZnO(Electro-deposition)涂层部分区域成枝状.采用0.100 mol · L-1 NaSO4溶液作为电解液, 溶胶涂覆法和电沉积法所制备的Ti/SnO2-ZnO析氧过电位分别为1.56、1.72 V(vs.Ag/AgCl), 且Ti/SnO2-ZnO(Electro deposition)较Ti/SnO2-ZnO(Sol-gel)电极腐蚀电位正移, 电极过程的控制步骤均为电荷传递过程控制.
2) 在二维电极体系中, 极板面积约为65.0 cm2, 电流密度为20.0 mA · cm-2, 极板间距15.0 mm, 电解质为1.30 g · L-1次氯酸钠溶液, 电解时间150 min, 溶胶涂覆法和电沉积法所制备的Ti/SnO2-ZnO对100 mg · L-1的PFOA(pH=3.50)的去除率为90.6%和94.6%, 对100 mg · L-1的PFOS(pH=6.50)的去除率为91.0%和93.7%, 其降解过程符合准一级反应动力学方程.循环降解3次后, 电沉积法制备的改性DSA电极去除率降低不明显, 展现了更高效、稳定的去除效果.
Apisara B, Suwanna K B, Narin B. 2016. Removal of perfluorooctanoic acid (PFOA) in groundwater by nanofiltration membrane[J]. Water Science and Technology, 11: 2627–2632.
|
Cao M H, Wang B B, Yu H S, et al. 2010. Photochemical decomposition of perfluorooctanoic acid in aqueous periodate with VUV and UV light irradiation[J]. Journal of Hazardous Materials, 179: 1143–1146.
|
Chad D V, Hyunwoong P, Cheng J, et al. 2008. Kinetics and mechanism of the sonolytic conversion of the aqueous perfluorinated surfactants, perfluorooctanoate (PFOA), and perfluorooctane sulfonate (PFOS) into inorganic products[J]. Journal of Physical Chemistry A, 112: 4261–4270.
|
Duan P Z, Hu X, Ji Z Y, et al. 2018. Enhanced oxidation potential of Ti/SnO2-Cu electrode forelectrochemical degradation of low-concentration ceftazidime in aqueous solution:Performance and degradation pathway[J]. Chemosphere, 212: 594–603.
|
Dolman S, Pelzing M. 2011. An optimized method for the determination of perfluorooctanoic acid, perfluorooctane sulfonate and other perfluorochemicals in different matricesusing liquid chromatography/ion-trap mass spectrometry[J]. Journal of Chromatography B, 879: 2043–2050.
|
胡承志, 刘会娟, 曲久辉. 2018. 电化学水处理技术研究进展[J]. 环境工程学报, 2018, 12(3): 677–696.
|
Jian J M, Guo Y, Zeng L X, et al. 2017. Global distribution of perfluorochemicals (PFCs) in potential human exposure source:A review[J]. Environment International, 108: 51–62.
|
Lin H, Niu J F, Ding Y, et al. 2012. Electrochemical degradation of perfluorooctanoic acid (PFOA)by Ti/SnO2-Sb, Ti/SnO2-Sb/PbO2 and Ti/SnO2-Sb/MnO2 anodes[J]. Water Research, 46: 2281–2289.
|
Lin Y C, Chandana P, Chang C Y, et al. 2012. Removal of perfluorooctanoic acid and perfluorooctane sulfonate via ozonation under alkaline condition[J]. Journal of Hazardous Materials, 243: 272–277.
|
Lin Y M, Chen S, Quan X, et al. 2015. Efficient mineralization of perfluorooctanoate by electro-fenton with H2O2 electro-generated on hierarchically porous carbon[J]. Environmental Science and Technology, 49(22): 28–33.
|
Liu B L, Zhang H, Yao D, et al. 2015. Claus catalysis.1 Perfluorinated compounds (PFCs) in the atmosphere of Shenzhen, China:Spatial distribution, sources and health risk assessment[J]. Chemosphere, 135: 511–518.
|
刘洁, 宁伟, 汪庆卫, 等. 2009. 掺杂ZnO对SnO2电极烧结性能的影响[J]. 化工新型材料, 2009, 37(2): 76–78.
|
Ma Q C, Liu L, Cui W, et al. 2015. Electrochemical degradation of perfluorooctanoic acid (PFOA) by Yb-doped Ti/SnO2-Sb/PbO2 anodes and determination of the optimal conditions[J]. RSC Advances, 5: 84856–84864.
|
孟娣, 王潇, 王赛赛, 等. 2018. 水体中典型重金属和全氟化合物对水生生物的联合毒性[J]. 生态毒理学报, 2018, 13(2): 13–22.
|
Niu J F, Li Y, Shang E X, et al. 2016. Electrochemical oxidation of perfluorinated compounds in water[J]. Chemosphere, 146: 526–538.
|
牛军峰, 王冲, 商恩香. 2017. 水中全氟化合物电化学去除技术研究进展[J]. 中国科学, 2017, 47(12): 1233–1255.
|
Plumlee M H, Larabee J, Reinhard M. 2008. Perfluorochemicals in water reuse[J]. Chemosphere, 72: 1541–1547.
|
Rao A, Venkatarangaiah V. 2018. Preparation and characterization of Ti/Sb-SnO2/Ni-Sb-SnO2 anode; application in electrochemical degradation of Acid Red I dye[J]. Materials Today, 5: 25006–25015.
|
苏长罗, 李铮, 王凯, 等. 2018. 钛负载纳米银电极去除水中PFOA与PFOS[J]. 矿业科学学报, 2018, 3(6): 604–609.
|
Sun T F, Xiang L, Chen L, et al. 2017. Research progresses of determination of perfluorinated compounds in environmental water and solid samples[J]. Chinese Journal of Analytical Chemistry, 45(4): 601–610.
|
宋彦敏, 周连宁, 郝文龙, 等. 2017. 全氟化合物的污染现状及国内外研究进展[J]. 环境工程, 2017, 35(10): 82–86.
|
王之芬, 梁新秀, 占笔成, 等. 2019. 快速城市化流域全氟化合物的污染特征及生态风险[J]. 北京大学学报, 2019, 55(3): 543–552.
|
薛倩倩.2013.持久性有机污染物PFOS/PFOA在TiO2表面吸附行为的密度泛函研究[D].青岛: 中国海洋大学
http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D326606 |
余强.2010.水中典型全氟化合物的吸附去除研究[D].北京: 清华大学
http://cdmd.cnki.com.cn/Article/CDMD-10003-2010215134.htm |
周浩, 孙敏. 2017. 净水厂中全氟化合物分布特征及UV/SO32-的去除机理[J]. 中国给水排水, 2017, 33(19): 6–15.
|
Zhuo Q F, Xiang Q, Yi H, et al. 2017. Electrochemical oxidation of PFOA in aqueous solution using highly hydrophobic modified PbO2 electrodes[J]. Journal of Electroanalytical Chemistry, 801: 235–243.
|
卓琼芳, 罗梅清, 李永铭. 2019. 新型钛基二氧化铅电极的制备及其对全氟辛酸的降解[J]. 工业水处理, 2019, 39(3): 30–34.
|
张健, 赵长伟, 宋娜, 等. 2013. 纳滤去除饮用水中的PFOS[J]. 环境工程学报, 2013, 7(11): 4237–4239.
|
Zhang C H, Jiang S, Tang J W, et al. 2018. Adsorptive performance of coal based magnetic activated carbon for perfluorinated compounds from treated landfill leachate effluents[J]. Process Safety and Environmental Protection, 117: 383–389.
|
智丹, 王建兵, 周云惠, 等. 2018. 钛基锡锑阳极电化学氧化去除水中的四环素[J]. 环境工程学报, 2018, 12(1): 57–64.
|
 2019, Vol. 39
2019, Vol. 39


