2. 清华大学深圳研究生院, 深圳市环境微生物利用与安全控制重点实验室, 深圳 518055
2. Key Laboratory of Microorganism Application and Risk Control of Shenzhen, Graduate School at Shenzhen, Tsinghua University, Shenzhen 518055
我国是纺织品生产大国, 年产量占全球纺织品总产量的1/2以上(Li et al., 2018).其中, 印染废水是一类典型的难处理纺织行业废水(Chen et al., 2019), 且排放量大, 据统计, 每生产1 kg印染纺织产品至少排放200 L印染废水(Tabrizi et al., 2011;Khan et al., 2018).印染废水成分复杂, 印染染料的基本原料多为苯系、萘系、蒽醌、苯胺及联苯胺类等化合物, 且在生产工艺过程中常与金属盐类物质螯合, 造成印染废水多为含氯化物或溴化物、金属离子、高色度、高COD、具有“三致”(致癌、致畸、致突变)毒性的难降解有机废水.
为此, 我国制定了严格的《纺织染整工业水污染物排放标准》, 明确规定了COD、苯胺、色度等典型污染物排放限值.目前, 印染废水的处理工艺相对成熟(Su et al., 2016; Cinperi et al., 2019), 但印染废水中含有大量有毒有害污染物, 且污水处理厂各工艺环节对污染物的处理特性尚不明晰, 生物处理段受难降解有毒有害污染物的影响也缺乏研究.尤其由于技术和经济性等原因, 导致国内对于印染废水处理过程中有毒有害污染物的监测研究极少, 信息缺乏.因此, 掌握印染废水处理工艺对污染物的去除特性和生物毒性转化特点, 对印染废水处理提质增效和污染物控制具有重要意义.
现有标准主要以化学/生物需氧量、氨氮、色度及特定污染物(如有机卤素、苯胺类、重金属)等常规理化指标的监测分析为主, 这对保护印染废水受纳水体水质起到了重要作用.然而这些指标只能反映一种或几种污染物的浓度水平, 并不能反映废水的综合生物毒性效应.同时, 印染废水污染物种类繁多, 许多化学物质尚不为人熟知, 能够被鉴定出来的有毒有害物质仅占实际污染物的少数, 因此, 在达标排放的印染废水中可能存在低浓度已知污染物及未知复杂污染物.毒性物质具有毒性、难降解性和生物积累性等特点, 且毒性物质之间具有加和、拮抗等生物联合作用, 会产生“三致”或内分泌干扰效应, 对水生生物及人体健康危害极大, 因此, 有必要结合生物毒性测试进行综合水质评价.在众多生物毒性测试中, 发光细菌试验具有灵敏度高、测试时间短的特点, 目前已被广泛用于样品急性毒性检测(Wang et al., 2019; Xie et al., 2019).
基于此, 本文以掌握典型印染废水处理中污染物去除特性和毒性转化机制为目标, 解析印染废水水质特征及其在典型处理工艺中的变化, 探明典型处理工艺中对污染物和生物毒性控制的重要处理阶段, 探究印染废水处理过程中急性毒性的变化规律, 以阐明印染废水的主要毒性因子, 为尽快实现印染废水高标准排放和毒性减排, 提升水环境质量, 以及保护水环境安全提供理论支撑.
2 材料与方法(Materials and methods) 2.1 典型印染废水处理工艺流程简介以某印染废水处理厂为研究对象.该厂采用“一厂一管”的管理办法, 直接收集经过印染企业预处理的印染废水, 处理工艺为A/O与氯氧化组合, 出水水质执行《城镇污水处理厂污染物排放标准》一级A标准.
该印染废水处理厂污水处理流程如图 1所示.污水厂进水在水解池末端混合均匀后进入调节池.一沉池对调节池出水进行泥水分离, 部分污泥回流到水解池, 部分污泥经过处理后外排.曝气池出水投加体积分数为0.5‰的聚铁溶液以去除水中总锑.二沉池对曝气池出水进行泥水分离, 部分污泥回流进入曝气池和水解池, 部分污泥经过处理后外排.在加氯池中向印染废水二级出水投加体积分数为0.15‰的次氯酸钠溶液和0.17‰的聚合氯化铝溶液.三沉池对加氯池出水进行泥水分离后, 沉降污泥全部经过处理后外排, 三沉池出水经过暗渠外排至厂外的人工湿地内, 进行进一步处理.
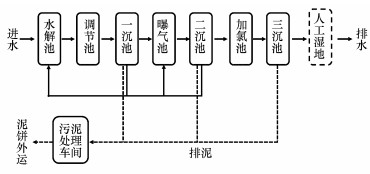 |
| 图 1 某印染废水处理厂污水处理流程图 Fig. 1 Scheme of treatment process for dyeing wastewater in Suzhou |
印染废水具有污染物成分复杂、有毒有害物质含量高的特点.本研究对某典型印染废水处理厂进水及处理全流程进行采样, 运用理化分析手段研究COD、BOD5、苯胺类物质、色度等指标在印染废水处理过程中的去除规律, 对印染废水进行毒性诊断, 并采用发光细菌急性毒性评价印染废水毒性.发光细菌急性毒性以HgCl2毒性当量浓度和最低无效应稀释度两种方法表征.其中, HgCl2毒性当量浓度可形象反映印染废水的风险;最低无效应稀释度可直观反映印染废水需要稀释到何种程度才会对水环境无不良影响(胡洪营等, 2011).
2.2.2 采样点分布该印染废水处理厂全流程共设置5个采样点, 分别采集印染废水总进水、一沉池出水、曝气池出水、二沉池出水、三沉池出水.
2.2.3 取样及预处理自2017年3月至8月期间, 对某印染废水处理厂全流程进行6次取样, 每个采样点采集印染废水2 L, 存放到冰盒中并迅速运回实验室.使用0.45 μm玻璃纤维滤膜过滤水样, 随后采用固相萃取法分离水样中溶解性有机物和无机离子, 将收集到的无机离子溶液转移到棕瓶中;用氮气将收集到的固相萃取小柱洗脱液吹干, 将溶解性有机物固定在玻璃离心管内, 真空袋封存, 放入4 ℃冰箱内保存备用.使用耗材包括:固相萃取柱(Oasis HLB)、高纯氮气、甲醇(色谱纯)、丙酮(色谱纯)、二氯甲烷(色谱纯)、超纯水.
2.3 相关参数测定 2.3.1 典型有机污染物检测方法水样检测项目包括COD、BOD5、苯胺类物质、色度.其中, 色度检测采用ADMI真色色度法, 其余项目的检测采用国家标准检测方法(表 1).检测所用仪器设备和药品均符合相应国家标准检测方法的要求.样品检测之前, 均经过0.45 μm玻璃纤维滤膜过滤, 实验用水均为超纯水.样品从采样至检测, 时间间隔不超过24 h.
| 表 1 检测项目及方法 Table 1 Testing items and methods |
依据GB/T15441—1995《发光细菌法》方法, 检测水样发光细菌急性毒性.试验所用发光细菌T3小种购于南京土壤所, 为同一批次分装密封保存的发光细菌冻干粉, 发光细菌的发光亮、活性等基础参数相同.
2.4 数据分析数据处理使用SPSS 20.0 (IBM, USA)软件, 差异显著水平为p < 0.05;图形处理利用Origin 9 (OriginLab, USA)完成.
3 结果与讨论(Results and discussion) 3.1 印染废水水质特征及处理过程中典型有机污染物去除特性 3.1.1 印染废水水质特征对印染废水混匀后的总进水水质进行检测, 结果发现(图 2), 进水COD主要分布在200 mg · L-1左右, BOD5约为90 mg · L-1, 苯胺类物质集中分布在0.6 ~1.2 mg · L-1范围内, 色度集中分布在40~60倍之间, 对进水可生化性进行分析, 总进水BOD5/COD集中分布在0.4附近.
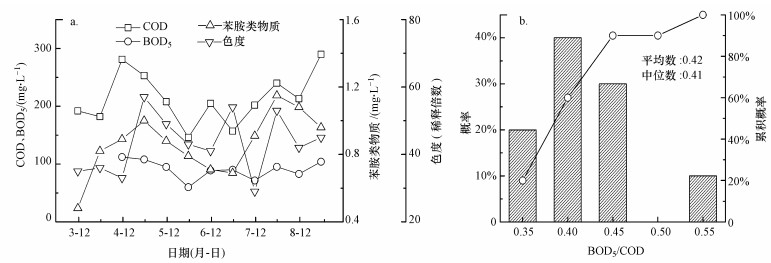 |
| 图 2 总进水水质变化(a)及可生化性(b) Fig. 2 The water quality variation (a) and BOD5/COD (b) of influent |
印染原水COD极高, 经印染厂预处理后COD可降低至1000 mg · L-1以下(Selcuk, 2005), 常规的生化处理很难将COD降低到100 mg · L-1以下, 在此需要使用高级氧化工艺(Khatri et al., 2018).同时, 印染废水中残留的染料及发色基团使印染废水的色度远高于其他污水, 这也给印染废水处理增加了难度(O′Neill et al., 2015).该典型印染污水处理厂采用A/O与氯氧化相结合的工艺进行处理, 研究发现, 该污水厂总进水的水质状况存在波动, COD主要分布在200 mg · L-1左右.这主要是由于排入污水厂的印染废水均已经过各印染公司的水解酸化和好氧预处理, 且各印染公司生产工艺、原料和预处理水平等存在差异, 但该污水厂纳管废水的基本水质参数特征与类似印染废水处理厂相当(孙艳等, 2014; 刘亚琴等, 2018; 张波等, 2018).
印染废水具有难以生物降解的特性.COD是反映水体有机物污染参数的综合性指标, 一般认为当污水BOD5/COD低于0.4时, 该污水可生化性较差, 不适用于微生物处理, 而印染废水的BOD5/COD值大多介于0.06~0.35(Bilińska et al., 2016).本研究中, 印染进水的BOD5/COD集中分布在0.4左右, 具有较好的可生化性.
3.1.2 印染废水处理过程中典型有机物去除特性印染废水处理过程中COD、苯胺类、色度的去除变化如图 3所示.进水COD为210 mg · L-1, 且进水COD具有很大的波动性.水解池和酸化池对进水COD的去除效果较差, 一沉池COD去除率仅为5%.微生物生化反应对印染废水COD具有良好的去除效果, 曝气池COD去除率达到60%.曝气池出水投加聚铁药剂对COD去除效果一般, 二沉池出水COD去除率为10%.次氯酸钠和聚合氯化铝对印染废水二级出水COD几乎没有去除效果, 三沉池COD去除率仅为1.5%.进水经过印染废水处理厂处理后, 出水COD总去除率为78%, 达到46 mg · L-1, 符合一级A水质要求.该污水处理厂对印染废水COD的处理能力达到当地较好水平.
 |
| 图 3 印染废水处理过程中COD、苯胺类和色度的变化 Fig. 3 The variation of COD, anilines and colority during the wastewater treatment |
苯胺类物质是具有致癌性的优控污染物(Li et al., 2017; Gang et al., 2019), 在大型印染废水处理厂中均能检测到不同含量的苯胺类物质, 去除率多为60%~85%(Ning et al., 2015).本研究中某印染废水处理厂进水苯胺类物质为0.86 mg · L-1, 经水解池和调节池处理后略有上升, 为0.88 mg · L-1, 曝气池去除率达到50%, 二沉池去除率为7%, 三沉池去除率达到40%.经过该厂处理后, 尾水苯胺类物质浓度为0.04 mg · L-1, 平均去除率达到95%以上, 效果优于多数污水厂, 接近采用芬顿-混凝法去除的效果(陈新才等, 2015).
色度是重要的水质感官指标, 在印染废水色度去除方面, 进水色度为43倍, 经过一沉池、曝气池微生物生化反应、二沉池聚铁药剂添加、三沉池次氯酸钠和聚合氯化铝反应对色度去除均有一定的去除效果, 对色度的平均去除率分别为7%、23%、28%、40%, 经过该厂处理后, 尾水色度为6倍, 平均去除率达到86%以上, 出水色度达到一级A水质要求.
3.2 印染废水处理过程中毒性诊断与去除特性 3.2.1 印染废水处理过程中急性毒性去除特性研究表明, 印染废水溶解性有机物中包含大量残留染料及印染纺织助剂, 这些物质具有很高的生物毒性(Khan et al., 2018).研究发现, 超过3000种染料对鱼类胚胎有急性毒性, 2%的染料对鱼胚胎急性毒性的EC50低于1 mg · L-1, 96%的染料对鱼胚胎的急性毒性EC50高于10 mg · L-1, 其余2%的染料对鱼胚胎急性毒性EC50介于1~10 mg · L-1(O′Neill et al., 2015).
本研究定期检测了印染废水处理过程中的急性毒性与最低无效应稀释度, 结果如图 4所示.印染废水进水急性毒性约为90 μg · L-1 HgCl2.污水厂A/O工艺处理可以有效降低印染废水急性毒性, 使得曝气池出水急性毒性达到最低, 约为50 μg · L-1 HgCl2, 毒性去除率达到48%.氯氧化工艺会提高印染废水急性毒性, 污水厂出水发光细菌急性毒性超过200 μg · L-1 HgCl2, 印染废水急性毒性上升了150%.印染废水进水最低无效应稀释度(LID)约为23倍.污水厂A/O工艺可以有效降低印染废水急性毒性, 曝气池出水急性毒性达到最低, 最低无效应稀释度约为12倍, 最低无效应稀释度降低达50%.氯氧化工艺会提高印染废水急性毒性, 污水厂出水最低无效应稀释度约为105倍, 最低无效应稀释度增加了350%.
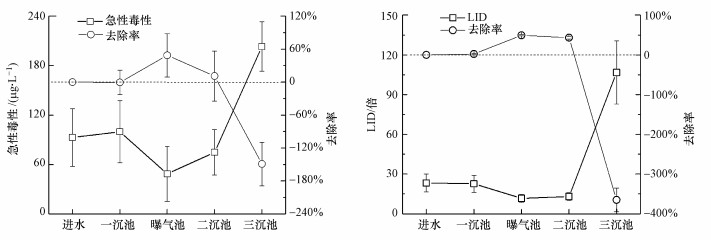 |
| 图 4 印染废水处理过程中急性毒性与LID变化图 Fig. 4 The variation of acute toxicity and LID during the wastewater treatment |
上述研究发现, 污水处理厂A/O工艺可以有效降低印染废水急性毒性.为进一步探究A/O工艺对印染废水的解毒原理, 将A/O工艺进水与曝气池出水进行组分分离, 并对比A/O工艺进水和A/O工艺曝气池出水溶解性有机物和无机离子的毒性变化, 结果如图 5所示, 实验过程中以0.5%的二甲基亚砜(DMSO)作为阴性对照.印染废水经过A/O工艺处理后, 最低无效应稀释度下降1.3倍.对应到印染废水组分中, 溶解性有机物最低无效应稀释度(LID)下降1.3倍, 无机离子最低无效应稀释度不变.研究表明, 印染废水A/O工艺主要通过去除印染废水溶解性有机物毒性以实现对印染废水的解毒, 其本质为依靠微生物降解印染废水中的有毒有机物, 从而降低印染废水毒性(Chys et al., 2017; Fu et al., 2019).
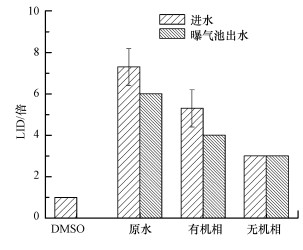 |
| 图 5 A/O工艺对印染废水各组分急性毒性的去除效果 Fig. 5 The toxicity removal efficiency of A/O on the component of dyeing wastewater |
上述全流程毒性检测发现, 氯氧化工艺会提高印染废水急性毒性, 在此进一步探究氯氧化工艺对印染废水的致毒原理.分别采集某印染废水处理厂进水(原水)、氯氧化出水样品, 检测到氯氧化出水中余氯含量约为4.8 mg · L-1, 以Na2SO3与余氯按1.1 : 1的比例对氯氧化出水进行脱氯, 并将原水、氯氧化出水、脱氯出水分别进行组分分离, 3个样品各个组分的急性毒性变化如图 6所示.由图可知, 印染废水经过氯氧化工艺处理后, 最低无效应稀释度显著上升至128倍, 对应到印染废水组分中, 溶解性有机物最低无效应稀释度上升69.4倍, 无机离子最低无效应稀释度上升34.3倍.
 |
| 图 6 氯氧化对印染废水各组分急性毒性的增加效果 Fig. 6 The toxicity increase of chlorine oxidation on the component of dyeing wastewater |
研究指出, 印染废水氯氧化工艺会提高印染废水溶解性有机物和无机离子的毒性, 从而导致印染废水毒性显著增加.氯氧化出水经过脱氯处理可显著降低无机离子急性毒性, 表明余氯的存在会导致印染废水无机离子毒性显著上升.该厂氯氧化印染废水致使其急性毒性明显上升的原因为氯氧化印染废水溶解性有机物会产生消毒副产物, 增加印染废水急性毒性(Vacchi et al., 2013;Rawat et al., 2016; Du et al., 2017), 氯氧化出水中残留的余氯可进一步提高印染废水急性毒性(Vacchi et al., 2013).
3.2.4 某印染废水处理厂出水毒性因子识别对某印染废水处理厂出水进行组分分离, 并对不同组分毒性进行线性拟合, 结果如图 7所示.由图可知, 污水处理厂出水、溶解性有机物、无机离子对发光细菌的抑制率均约为100%, 稀释8倍后, 各组分对发光细菌的抑制率分别降低至95%、66%、57%.稀释过程中, 无机离子毒性下降最快, 污水厂出水毒性下降最慢.有溶解性有机物和无机离子混合液毒性基本恢复到污水厂出水毒性水平.此现象表明可以通过稀释的方法快速降低印染废水溶解性有机物和无机离子的急性毒性.研究表明, 印染废水溶解性有机物和无机离子急性毒性具有协同作用, 导致使用稀释的方法对印染废水急性毒性的降低效果不明显(Khan et al., 2018).
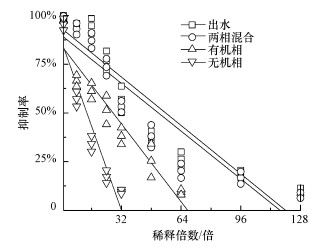 |
| 图 7 污水厂出水各组分剂量效应曲线 Fig. 7 The dose-effect curve of acute toxicity in the component of effluent |
检测污水厂出水不同组分的最低无效应稀释度, 结果如图 8所示, 其中, 试验阴性对照为含量为0.5%的DMSO溶液.由图可知, 污水厂出水溶解性有机物的LID为74倍, 无机离子的LID为37倍, 二者混合后LID为128倍, 恢复到原水LID为128倍的毒性水平.
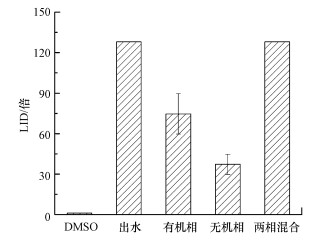 |
| 图 8 污水厂出水各组分的LID分布 Fig. 8 The variation of LID in the component of effluent |
综合A/O工艺对印染废水各组分急性毒性去除和氯氧化对印染废水各组分急性毒性增加的检测结果, 发现污水厂出水毒性因子为溶解性有机物和无机离子, 其中, 溶解性有机物急性毒性明显高于无机离子急性毒性, 无机离子的急性毒性主要来源于出水中残留的余氯.
4 结论(Conclusions)1) 某印染废水处理厂纳管经水解酸化预处理后的印染废水, 混合总进水COD主要分布在200 mg · L-1左右, 苯胺类物质集中分布在0.6~1.2 mg · L-1范围内, 色度集中分布在40~60倍之间, 总进水BOD5/COD集中分布在0.4附近, 具有一定的可生化性, 总进水急性毒性约为90 μg · L-1 HgCl2.
2) A/O工艺对印染废水有机污染物去除效果良好, COD、苯胺类物质、色度的去除率分别为76%、52%、47%.采用氯氧化工艺深度处理印染废水二级出水, 污水厂对印染废水COD、苯胺类物质、色度的去除率分别为78%、95%、86%, 出水水质基本达到城市污水厂一级A水质要求.
3) A/O工艺通过削减印染废水溶解性有机物急性毒性而有效降低印染废水急性毒性, 急性毒性去除率达到48%, 最低无效应稀释度降低50%;氯氧化工艺处理印染废水二级出水会产生消毒副产物并在出水中残留余氯, 二者相互作用可导致氯氧化出水急性毒性上升, 污水厂出水发光细菌急性毒性上升了150%, 最低无效应稀释度约为105倍, 增加了350%.
4) 本研究发现, 印染废水中溶解性有机物和无机离子均具有急性毒性, 建议后续研究进一步分离印染废水溶解性有机物和无机离子, 更加精确地诊断印染废水毒性因子.
Bilińska L, Gmurek M, Ledakowicz S. 2016. Comparison between industrial and simulated textile wastewater treatment by AOPs-biodegradability, toxicity and cost assessment[J]. Chemical Engineering Journal, 306: 550–559.
|
Chen H, Liu Y, Xu X, et al. 2019. How does iron facilitate the aerated biofilter for tertiary simultaneous nutrient and refractory organics removal from real dyeing wastewater?[J]. Water Research, 148: 344–358.
|
陈新才, 潘辉环, 吴勇民, 等. 2015. 芬顿-混凝法去除印染废水中的苯胺类物质化合物[J]. 环境科学与技术, 2015(5): 144–147.
|
Chys M, Demeestere K, Ingabire A S, et al. 2017. Enhanced treatment of secondary municipal wastewater effluent:comparing (biological) filtration and ozonation in view of micropollutant removal, unselective effluent toxicity, and the potential for real-time control[J]. Water Science & Technology, 76(1/2): 236–246.
|
Cinperi N C, Ozturk E, Yigit N O, et al. 2019. Treatment of woolen textile wastewater using membrane bioreactor, nanofiltration and reverse osmosis for reuse in production processes[J]. Journal of Cleaner Production, 223: 837–848.
|
Du Y, Lv X T, Wu Q Y, et al. 2017. Formation and control of disinfection byproducts and toxicity during reclaimed water chlorination:A review[J]. Journal of Environmental Sciences, 58: 51–63.
|
Fu J, Lee W N, Coleman C, et al. 2019. Removal of pharmaceuticals and personal care products by two-stage biofiltration for drinking water treatment[J]. Science of the Total Environment, 664: 240–248.
|
Gang X, Wang Q, Qian Y, et al. 2019. Simultaneous removal of aniline, antimony and chromium by ZVI coupled with H2O2:Implication for textile wastewater treatment[J]. Journal of Hazardous Materials, 368: 840–848.
|
胡洪营, 吴乾元, 杨扬, 等. 2011. 面向毒性控制的工业废水水质安全评价与管理方法[J]. 环境工程技术学报, 2011, 1(1): 46–51.
|
Khan S, Malik A. 2018. Toxicity evaluation of textile effluents and role of native soil bacterium in biodegradation of a textile dye[J]. Environmental Science & Pollution Research, 25(5): 1–13.
|
Khatri J, Nidheesh P V, Singh T S A, et al. 2018. Advanced oxidation processes based on zero-valent aluminium for treating textile wastewater[J]. Chemical Engineering Journal, 348: 67–73.
|
Li X, Jin X, Zhao N, et al. 2017. Efficient treatment of aniline containing wastewater in bipolar membrane microbial electrolysis cell-Fenton system[J]. Water Research, 119: 67–72.
|
Li Y, Shen J, Lu L, Luo Y, et al. 2018. Water environmental stress, rebound effect, and economic growth of China's textile industry[J]. Peer J, 6: e5112.
|
刘亚琴, 倪慧成, 蒋素英, 等. 2018. 印染园区污水处理厂工艺改造与运行[J]. 工业水处理, 2018, 38(7): 104–107.
|
Ning X A, Liang J Y, Li R J, et al. 2015. Aromatic amine contents, component distributions and risk assessment in sludge from 10 textile-dyeing plants[J]. Chemosphere, 134: 367–373.
|
O'Neill C, Hawkes F R, Hawkes D L, et al. 2015. Colour in textile effluents-sources, measurement, discharge consents and simulation:a review[J]. Journal of Chemical Technology & Biotechnology, 74(11): 1009–1018.
|
Rawat D, Mishra V, Sharma R S. 2016. Detoxification of azo dyes in the context of environmental processes[J]. Chemosphere, 155: 591–605.
|
Selcuk H. 2005. Decolorization and detoxification of textile wastewater by ozonation and coagulation processes[J]. Dyes & Pigments, 64(3): 217–222.
|
Su X H, Low L W, Teng T T, et al. 2016. Combination and hybridisation of treatments in dye wastewater treatment:A review[J]. Journal of Environmental Chemical Engineering, 4(3): 3618–3631.
|
孙艳, 张逢, 胡洪营, 等. 2014. 天津市污水处理厂进水水质特征的统计学分析[J]. 环境工程技术学报, 2014, 4(3): 173–180.
|
Tabrizi M T F, Glasser D, Hildebrandt D. 2011. Wastewater treatment of reactive dyestuffs by ozonation in a semi-batch reactor[J]. Chemical Engineering Journal, 166(2): 662–668.
|
Vacchi F I, Albuquerque A F, Vendemiatti J A, et al. 2013. Chlorine disinfection of dye wastewater:implications for a commercial azo dye mixture[J]. Science of the Total Environment, 442: 302–309.
|
Wang W L, Hu H Y, Liu X, et al. 2019. Combination of catalytic ozonation by regenerated granular activated carbon (rGAC) and biological activated carbon in the advanced treatment of textile wastewater for reclamation[J]. Chemosphere, 231: 369–377.
|
Xie P, Zou Y, Jiang S, et al. 2019. Degradation of imipramine by vacuum ultraviolet (VUV) system:Influencing parameters, mechanisms, and variation of acute toxicity[J]. Chemosphere, 233: 282–291.
|
张波, 戚永洁, 蒋素英, 等. 2018. 铁碳微电解-生物膜法-高级氧化工艺处理印染废水中试研究[J]. 环境工程, 2018, 36(3): 44–48.
|
 2019, Vol. 39
2019, Vol. 39


