发酵制药废水具有有机物浓度高、酸碱性变化大、硫酸盐含量高、色度高的特点, 属于难处理的工业废水之一(Lester et al., 2013; Gadipelly et al., 2014; Shi et al., 2017), 经一级预处理和二级生物处理后, 大部分的有机物得以去除, 但二级出水仍具有色度高、溶解性有机物(DOM)含量高、盐分含量高等特点, 不能满足排放或回用要求.二级出水中DOM不仅跟进水中有机物的组成和性质有关, 还包含生化处理过程中产生的溶解性微生物代谢产物(SMPs), 二级出水DOM主要由腐殖质类、蛋白类、多糖类、脂质类和小分子的氨基酸等组成(Michael-Kordatou et al., 2015; Wang et al., 2018).DOM排放进入水环境后影响重大, 可与水体中的金属离子(Wang et al., 2015)、持久性有机污染物(Derrien et al., 2017)及其他污染物质相互作用而影响其迁移和转化;在污水膜分离深度处理中, DOM可在膜表面和孔径内沉积堵塞或在表面形成胶体保护导致较大的渗透压差, 造成膜污染问题(Guan et al., 2018);DOM中疏水组分(HOS)作为消毒副产物的前驱物(DBPs)会增加出水生态环境风险(Michael-Kordatou et al., 2015).Wang等(2014)研究指出市政出水中DOM占COD和TOC的比重较大, 分别为78.1%~86.5%、82.6%~86.6%.DOM中含有生色基团、助色基团的发色有机物导致出水中色度较高(Griffin et al., 2018).因此可知, DOM是影响废水深度处理效果的主要因素.
废水深度处理工艺主要有混凝沉淀、活性炭吸附、高级氧化、膜分离及以上工艺的相互组合.崔凤国等(2015)用混凝、吸附及其组合工艺对内蒙古制药二级出水深度处理, 组合工艺对CODCr去除率为76%, 荧光光谱表明, 相较于单一混凝, 组合工艺对SMPs、类腐殖酸组分有更好的去除效果达90%;张国威等(2013)用O3/H2O2的单一、组合工艺对东北某合成制药厂二级出水深度氧化处理, 臭氧投加量为49.9 mg·L-1、pH=9、H2O2投加量2 mL·L-1、氧化时间2 h对CODCr去除率最大为83%;由于混凝简单、经济的特点而成为广泛应用的深度处理工艺, 聚合氯化铝(PAC)可以去除水中部分大分子有机物和悬浮物, 张鹏等(2010)对山西某化学合成制药厂二级出水进行混凝深度处理, 研究表明PAC投加量为220 mg·L-1、pH在6~8之间对CODCr、浊度去除率分别为51.67%、90.88%;制药废水二级出水作为一种组成复杂的难降解废水, DOM不同组分在混凝反应时的去除效果不同(Tabatabai et al., 2014), 仅以CODCr、浊度、色度等指标表示具有局限性, 为了充分表征DOM及其在混凝过程中有机物的可去除性, 需要进行化学分级和物理分馏, 这对于优化深度处理工艺至关重要.
废水中DOM的组成、性质的表征是深度处理工艺设计和优化运行的前提(Pan et al., 2018; Ravndal et al., 2018), 二级出水DOM受进水水质、环境温度、pH、水中的阴、阳离子等的影响, 使得DOM的化学性质具有高度异质性(Li et al., 2017; Heinz et al., 2018), 对DOM的认知可从相对分子量、亲疏水性及荧光结构等表征:①废水中的DOM分子量分布较广.Wu等(2019)指出分子量 < 1 kDa的SMPs为市政出水DOM的主要组分;Hamid等(2019)通过体积排阻色谱(SEC)指出市政出水中DOM分子量范围为100 Da~100 kDa;②DOM亲疏水性不同.Zhang等(2009)用树脂将市政出水DOM分离为6个组分;金鹏康等(2015)利用XAD-8将市政出水DOM分为富里酸、腐殖酸和亲水物质(HIS)3个组分, 出水DOM以HIS为主;③荧光结构不同.Xiao等(2018)以市政MBR出水为对象研究三维荧光光谱(EEM)的变化结果表明全波长荧光强度与DOM的疏水/亲水性显著相关.
本研究以发酵制药废水二级出水的DOM为研究对象, 考察不同混凝剂投加量下, 二级出水中DOM分子量和亲疏水性分级后不同组分的转化规律, 并利用三维荧光光谱结合平行因子法分析荧光组分的变化, 以期阐述混凝深度处理过程DOM的组分变化规律和去除特征, 为制药废水二级出水DOM的混凝深度去除工艺条件选择和优化提供参考依据.
2 材料和方法(Materials and methods) 2.1 样品采集实验所用的废水来源于浙江某抗生素类制药厂, 该厂废水处理量约为3000 m3·d-1, 废水处理流程如下:调节池→气浮池→水解酸化池→A/A/O池→MBBR池→二沉池, 采集二沉池出水作为研究对象并于24 h内运往实验室, 过0.45 μm滤膜后放置于4 ℃冰箱避光保存.二级出水水质基础指标为:pH为7.69~8.26、COD为563~628 mg·L-1、DOC为128.5~142.2 mg·L-1、蛋白质为167.8 mg·L-1、腐殖酸为215.66 mg·L-1.
2.2 实验方法以聚合氯化铝(PAC)作为混凝剂, 以制药废水二级出水作为研究对象, 在六联搅拌器进行烧杯混凝实验, PAC投加量为150、200、250 mg·L-1, 反应体积为200 mL.混凝实验操作条件如下:快速搅拌250 r·min-1, 反应时间3 min, 慢速搅拌60 r·min-1, 反应时间20 min, 反应后静置30 min;取部分上清液过0.45 μm滤膜保存, 待测;剩余的上清液测定出水剩余浊度和Zeta电位.对混凝前、后水中DOM进行不同分子量和亲疏水性的组分分级表征, 并进行三维荧光光谱扫描, 进一步来揭示混凝去除DOM的规律.
2.3 样品分析和表征 2.3.1 样品基础指标测定溶解性有机碳(DOC)的测定:采用德国耶拿Multi C/N 3100型总有机碳分析仪测定样品DOC含量(mg·L-1), 以DOC含量反映溶解性有机物的浓度.
紫外全扫描荧光光谱:采用日本岛津UV-2450紫外-可见分光光度计对样品进行200~700 nm范围内的全波段扫描, UV254可以反映出含苯环的芳香族化合物和含多个共轭双键有机物的相对含量.
采用美国哈希浊度计对水中的浊度(NTU)进行测定, 每组测定10次, 计算浊度的去除效果;快速混合后, 取5 mL样品进行Zeta电位测定(ZP)(Nano ZS90, Malvern);对样品色度使用铂-钴比色法进行色度的测定;采用改性Lowry法测定腐殖酸含量(mg·L-1);使用BCA蛋白质定量试剂盒(南京生物工程研究所)测定蛋白质含量(mg·L-1).
2.3.2 分子量分离不同分子量组分的分离使用美国Millipore Model 8400型超滤杯对样品进行分级, 超滤膜为聚醚砜材质(PES), 截留分子量分别为:1、5、10 kDa.首次进行过滤时, 将超滤膜置于纯水中清洗浸泡, 再将200 mL超纯水进行膜分离预过滤, 将一定体积的样品按照截留分子量从大到小依次过滤, 并收集滤液待测, 以DOC含量表示各组分的含量和占比.
2.3.3 亲疏水性分离采用XAD-8(Amberlite)和XAD-4(Supelite)大孔树脂对样品进行亲疏水性的分离, 将DOM分离为5种组分:亲水物质(HIS, hydrophilic substances)、疏水中性物质(HON, hydrophobic neutral)、疏水性碱(HOB, hydrophobic bases)、疏水性酸(HOA, hydrophobic acids)、弱疏水酸(WHOA, Weak hydrophobic acid), 以DOC和UV254表示各组分的含量和占比.
2.3.4 三维荧光分析采用日本岛津RF-6000型荧光光谱仪对样品进行荧光分析, 荧光光谱测定条件:激发光源为150 W氙弧灯, 光电倍增管电压为700 V, 激发波长(Ex)范围240~450 nm, 间隔为5 nm, 发射波长(Em)范围为280~550 nm, 间隔为2 nm, 扫描速度12000 nm·min -1, 激发和发射波长带宽均为5 nm.测定前样品稀释数10倍, 以确保其UV254 < 0.1 cm-1.平行因子分析方法(PARAFAC)在Matlab 2018a软件中利用DOMFlour工具包进行分析, 识别荧光峰的种类和荧光强度.
2.4 数据统计与分析对各指标进行测定并计算去除率, 所有的结果至少分析3次, 结果以平均值±标准偏差表示.C0代表反应前进水各指标的浓度, Ce代表混凝出水各指标的浓度, 去除率计算如下所示.

|
(1) |
数据的处理和绘图采用软件Microsoft Excel 2018和Origin 2018.使用单因素差异性方差(One-Way analysis of variance, ANOVA)检验显著性, 所有统计分析使用SPSS 23.0软件(p < 0.05时认为两组数据有显著性差异).
3 结果与讨论(Results and discussion) 3.1 混凝剂PAC投加量对混凝处理二级出水效果的影响在保持原水pH值8.06不变时, 研究不同PAC投加量下制药废水二级出水中DOC、UV254、色度、浊度指标的变化情况(图 1).由图 1可知, 随着PAC投加量在50 ~300 mg·L-1范围内的增加, 出水中DOC、UV254、色度、浊度各指标的去除率也相应的增大, PAC投加量为250 mg·L-1时, 混凝后出水中各指标均达到最大去除率, 分别为13.98%±0.26%、21.83%±0.33%、12.66%±1.34%、63.67%±0.89%, 当PAC投加量大于250 mg·L-1后, 各指标去除率几乎不再变化.PAC对出水中剩余浊度的去除效果较为显著, 在较低的投加量下即可对浊度进行较大的去除;UV254是用来衡量不饱和有机物含量的指标, PAC对UV254值较低的小分子污染物有着很好的去除, 对UV254值较高的相对分子量较大的污染物去除能力有限, 混凝不能完全去除有机物只能将基团破坏, 因而对出水UV254的去除率均高于对DOC的去除率(Filloux et al., 2012).崔凤国等(2015)对内蒙古某发酵制药生化出水进行PAC混凝处理, 当PAC投加量为360 mg·L-1时, 对COD的去除率约为35%, 主要是通过将有机物吸附在PAC水解形成的氢氧化物絮体表面来实现对有机物的去除.
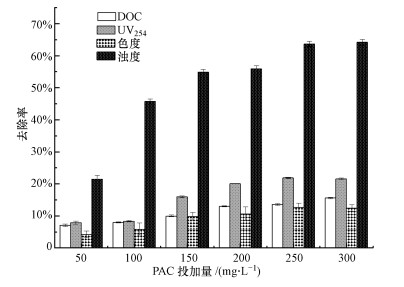 |
| 图 1 不同PAC投加量对二级出水各指标去除效果的影响 Fig. 1 The effect of different PAC dosage on removal of secondary effluent |
pH是强化混凝条件中起决定性作用的因素, 最佳pH取决于混凝水质和混凝剂种类.在固定PAC投加量为200 mg·L-1时, 改变初始溶液pH值, 探究不同pH值对制药废水二级出水中DOC、UV254、色度、浊度去除率变化的影响(图 2).如图 2a所示, 在pH < 5.0条件下, DOC和UV254去除率较低, 分别为10.05%±0.14%、17.84%±0.508%;在pH为6~8时, DOC和UV254的去除率均较高, 最大去除率分别为13.05%±0.29%、23.65%±0.75%, Liu等(2011)研究投加PAC混凝去除藻类污染的地表水中有机质时, 在最佳pH=8.0时对COD去除率较高;Wang等(2011)通过响应面法预测并证实了PAC在最佳pH=8.35时对造纸废水浊度去除率较好.
 |
| 图 2 初始溶液pH对二级出水各指标去除效果的影响(a.去除率; b. Zeta电位) Fig. 2 The effect of initial solution pH on the removal of secondary effluent |
pH的变化会影响废水中DOM的性质和组成, 制药二级出水主要以疏水组分为主, 改变初始溶液的pH, 色度去除率随pH值增大也降低, 但pH对浊度去除率影响不大.水处理来降低悬浮物及胶体的色度和浊度效果较好, 去除浊度或色度的最佳条件并不总是与去除DOM的条件相同(Lin et al., 2014;Wang et al., 2019).pH的变化还会对混凝剂的水解形态产生影响(张永利等, 2012), 赵华章等(2006)指出PAC在pH < 5条件下多水解成带有正电荷的Al(OH)63+存在, 而在pH>9时水解形成带有负电荷的偏铝酸盐(解林等, 2010).由图 2b可知, 制药废水带负电荷, 在弱酸性条件下Zeta绝对值较小, 投加阳离子型聚合氯化铝, 相较于碱性环境下, 铝基混凝剂PAC的金属Al3+通过水解作用产生氢氧化物絮体Al(OH)63+(Lai et al., 2007), 将大分子的腐殖酸类物质吸附在表面从而去除, 混凝后Zeta绝对值在pH为5~8之间的各指标去除效果均较好且相差不大, 且原废水pH值范围是7.69~8.26, 考虑到实际应用中调节pH较低则成本过大, 因此选择pH范围为6~8.
3.3 混凝处理后DOM组分分级表征由图 1和图 2可知, 混凝深度处理过程, 通过提高PAC投加量和调节原水pH值是提高混凝去除DOM的两种常用方法.混凝剂的投加量和最佳pH值可根据DOC、UV254、色度、浊度去除率等参数进行优化, 最佳pH为6~8, 最佳PAC投加量为250 mg·L-1.因此, 在调节原水pH为6~8的条件下, PAC投加量分别为0、150、200、250 mg·L-1时进行混凝反应, 对出水进行三维荧光光谱扫描, 并根据相对分子量和亲疏水性不同对4组出水进行分级表征, 探究在不同PAC投加量下, 混凝前、后DOM组分的变化规律.
3.3.1 混凝处理后DOM分级表征分子量分布图 3为在pH=7.06条件下, PAC投加量为0、150、200、250 mg·L-1时, 对4组DOM样品进行分子量的分级表征, 以DOC(mg·L-1)表示不同混凝条件出水不同DOM分子量组分的变化.原水中DOM分子量 < 1 kDa、1~5 kDa、5~10 kDa和10 kDa~0.22 μm的组分占比分别为59.79%、20.74%、11.21%、8.26%, 二级出水中DOM以分子量 < 5 kDa的组分为主.图 3a、3b为投加不同量PAC后不同分子量组分的DOC含量及去除率变化图.随着PAC的投加量增加, 出水中大分子DOM的浓度逐渐降低, DOC去除率也逐渐增大, 而小分子组分的DOC含量变化较小.PAC投加量为150、200、250 mg·L-1时, 分子量为10 kDa~0.22 μm的DOM去除率分别为:20.61%±0.48%、33.20%±1.26%、50.33%±0.98%, 3种投加量下, 混凝对分子量>10 kDa的DOM组分去除效果均较好且有显著差异(p < 0.05).对于 < 1 kDa的DOM去除率分别为:1.43%±0.07%、1.71%±0.04%、2.26%±0.12%, 表明混凝对分子量 < 1 kDa的组分去除能力微弱.张晓飞等(2016)在pH=7、PAC投加量为1.5 mg Al·mg TOC-1时对不同分子量的天然腐殖酸模拟物各组分进行混凝反应, 发现混凝对 < 1 kDa的组分的COD去除率为20%, 但对分子量10~30 kDa的组分的COD去除率可到45%.Yan等(2017)以富营养化水为对象, 考察PAC投加量为0.5 mg Al·mg DOC-1时探究DOM分子量的变化, 结果表明出水中分子量较大(>10 kDa)的组分其DOC含量的降低值较高, 混凝预处理有利于减轻大分子有机物导致的膜堵塞;郑淑平等(2013)利用混凝-活性炭对垃圾渗滤液进行处理, 采用超滤杯对出水不同分子量组分进行分离, 发现垃圾渗滤液以小分子量组分为主, 因此单一混凝处理有机物效果不佳.
 |
| 图 3 不同PAC投加量下出水中溶解性有机物各组分分子量的变化(a.混凝进、出水DOC含量变化, b.不同组分分子量DOC去除率变化) Fig. 3 Changes of molecular weight of DOM with different PAC dosages(a. Change of DOC content during PAC coagulation, b. Change of DOC removal rate during PAC coagulation) |
混凝出水中DOM的分子量分布及占比可以反映出混凝对DOM不同组分的去除特性(Nebbioso et al., 2013).由图 3可知, 混凝对二级出水的DOM的色度去除效果较差的原因是, 混凝主要去除分子量>10 kDa的较大分子有机物, 而对 < 5 kDa的小分子有机物的去除效果不佳, 但制药废水二级出水是以小分子有机物为主, 分子量 < 5 kDa DOM组分占比为80.43%, 该组分的紫外吸收值较高, 对于废水的色度贡献率较大, 而分子量>10 kDa的组分对色度的贡献值较小(胡小兵, 2009), 导致混凝对色度去除较差.
3.3.2 混凝处理后DOM分级表征亲疏水性分布图 4为在pH=7.06条件下, PAC投加量为150、200、250 mg·L-1时, 对3种混凝出水及二级出水4组DOM样品进行亲疏水性的分级表征, 经过树脂分离得到5组分HON、HOB、HIS、HOA、WHOA, 以DOC占比和UV254值表示不同混凝条件下对于不同亲疏水各组分的去除率变化.由图 4可知, 疏水中性组分(HON)和弱疏水酸性组分(WHOA)可以通过混凝得到有效地去除, 由这两组分的DOC占比和UV254变化值可以看出, 投加不同量PAC混凝剂后, 经树脂分离后的出水中HON分别降低了21.56%、18.75%和16.9%, 混凝出水中HON组分的UV254值减小, 但对亲水组分(HIS)的去除效果较差(Wang et al., 2018).
 |
| 图 4 不同PAC投加量下出水中溶解性有机物的亲疏水各组分变化(a.混凝进、出水DOC含量变化, b.混凝进、出水UV254含量变化) Fig. 4 Changes of hydrophilic and hydrophobic components of DOM with different PAC dosages(a. Change of DOC content during PAC coagulation, b. Change of UV254 content during PAC coagulation) |
Liu等(2009)对市政出水进行混凝, 发现出水树脂分离分级后亲水组分(HIS)DOC值、UV254值均有所上升, 而疏水组分HON由于羧基和酚基等离子化基团的存在, 疏水分子具有很高的负电荷, 疏水性组分在水的胶体电荷特性中占主导地位, 因而带有较高负电荷的疏水组分更易于去除.Yuan等(2017)研究发现垃圾渗滤液中疏水性腐殖酸占DOM约60%~75%, 相比亲水组分, 混凝后DOM的疏水部分去除效率更高.因此可知, 投加PAC混凝剂对于制药废水二级出水中DOM不同亲疏水性的各组分的去除有较大的差异, 由于DOM的组成不同, 对水中特定类型的DOM分子的去除机理也有所不同(Chon et al., 2017).混凝优先去除疏水中性和弱疏水酸性组分.
3.3.3 混凝处理后DOM分级表征三维荧光光谱特征分布三维荧光光谱通过对样品的荧光峰的位置强度以及分布的扫描结果, 不仅可以提供丰富的光谱信息, 还具有快速、灵敏的特点(Yang et al., 2015).二级处理出水的三维荧光光谱等值线图是将EEM谱图划分为5个区域, 根据相关研究可知, 荧光物质在Ex/Em 250~420/380~520 nm代表的有机物是腐殖酸类腐殖质, 在Ex/Em 250~360/280~380 nm范围内代表的是含苯环蛋白质、溶解性微生物代谢产物的类蛋白物质, Ex/Em 220~280/380~480 nm代表的是富里酸类腐殖质(Li et al., 2013, Carstea et al., 2016, Trubetskoj et al., 2018).由图 5a可以看出, 原水中荧光物质主要在Ex/Em为240~380/325~475 nm范围内其峰强度值较高, 主要是3个峰, 分别为峰A(腐殖酸类腐殖质):Ex/Em 325/425 nm, 最大荧光峰强为1033.53, 峰B(蛋白类物质):Ex/Em 265/370 nm, 最大荧光峰强为960.06, 峰C(富里酸类腐殖质):Ex/Em 275/400 nm, 最大荧光峰强为400.24.二级出水中峰A、B的强度均较高, 结合水质测定中蛋白质含量为167.8 mg·L-1、腐殖酸含量为215.66 mg·L-1, 说明该制药废水二级出水中主要含有大量腐殖酸类有机物和蛋白质类有机物, 造成了较高的色度.
 |
| 图 5 混凝前后4种出水荧光光谱变化(PAC投加量:a.原水, b.150 mg·L-1, c.200 mg·L-1, d.250 mg·L-1) Fig. 5 EEM spectra of the four EfOM before and after coagulation (a. PAC 0mg·L-1, b. PAC 150mg·L-1, c. PAC 200mg·L-1, d. PAC 250 mg·L-1) |
PAC投加量分别为150、200、250 mg·L-1时, 由图 5b~5d可以看出, 混凝出水中峰A、B、C各荧光峰强度逐渐降低, 说明混凝剂的投加将原水中荧光物质的特征基团发生反应, 从而部分破坏其荧光基团的结构导致荧光峰强度降低(别楚君等, 2017).当PAC投加量为250 mg·L-1时, 峰B (Ex/Em 265/370 nm)几乎消失, 表明投加PAC混凝后, 对腐殖酸类和蛋白类荧光有机物具有一定的去除作用, 有机物的含苯环的不饱和共轭键的数量减少, 使得混凝出水荧光峰出现一定的改变(虞敏达等, 2017).混凝出水色度去除率不高, 腐殖质类、蛋白类物质是造成二级出水中色度较高的主要原因(Trubetskoj et al., 2018).
结合平行因子分析法(PARAFAC), 可以将复杂的荧光矩阵分解开来得到单独的荧光组分.利用PARAFAC法对混凝出水及树脂分离分级后共计36个样品进行分析, 设置2、3、4、5、6、7组分模型, 经离群值检验、残差分析、半数分析法检验以及最小平方和验证(Stedmon, 2008; Murphy et al., 2011), 得出3组分模型时半数分析验证是有效的, 且此时平方和误差最小, 最终确定3组分模型成立.图 6为经PARAFAC法后得到的3组分荧光光谱图及其Ex、Em对应的最大载荷值, 组分1(C1)峰位置Ex/Em =325/425 nm, 主要是类腐殖质物质为主的物质;组分2(C2)峰位置Ex/ Em =275/370 nm, 主要是氨基酸类或者结合类蛋白质为主的物质;组分3(C3)有两个峰, 主峰位置Ex/ Em =360/475 nm, 次峰位置为Ex/Em=265/475 nm, 主要是类富里酸为主的物质.
 |
| 图 6 平行因子分析得出的3组分荧光光谱图及其Ex, Em对应的最大载荷值 Fig. 6 PARAFAC components and wavelengths loadings (C1~C3) of the four components based on PARAFAC analysis |
3种荧光组分与混凝剂PAC的反应特性可以通过三维荧光光谱中的最大荧光强度值(Fmax)进行表征, 如图 7所示, 在PAC投加量从150、200、250 mg·L-1逐渐增大时, 3组分其最大荧光强度值的去除率逐渐增大.在原水中类腐殖质物质组分1的荧光强度值较大, 在PAC投加量为250 mg·L-1时, 各组分的最大荧光强度值的去除率达到最大, 尤其C1组分的去除率可达46.22%, 表明大分子的类腐殖质物质在混凝剂PAC的作用下, 其芳香烃和不饱和程度下降.随着PAC投加量的增加, 对C1腐殖酸类腐殖质的去除率较高, 也表明混凝优先与C1发生反应, 使其荧光强度迅速降低.C2、C3的荧光强度也有一定的去除率, 但是低于对C1的处理效果.腐殖质类有机物多为大分子, 且为疏水性有机物, 混凝结果表明, 混凝去除类腐殖质物质的效果显著优于蛋白类物质.上述的分子量和亲疏水性分布特性说明混凝对大分子和中分子的有机物具有一定的去除效果, 结合荧光分析, 混凝适合去除大分子疏水性腐殖质类有机物, 而对小分子亲水性蛋白类物质的去除效果较差.
 |
| 图 7 不同PAC投加量下3组分最大荧光强度值去除率 Fig. 7 The removal rate of 3 components′ maximum fluorescence intensity values under different PAC dosages |
1) 投加聚合氯化铝PAC对制药废水二级出水进行混凝深度处理, 对有机物的去除效果一般, 在投加量为250 mg·L-1、pH为7~8条件下对DOC、UV254、色度、浊度去除率分别为13.05%±0.29%、23.65%±0.75%、12.66%±1.34%、63.67%±0.89%, 其中对于UV254的去除率高于对DOC的去除率, 可以作为预处理工艺一定程度上降低有机物浓度.
2) 通过对混凝出水DOM进行分子量和亲疏水性的分级和表征, 混凝对分子量>10 kDa的组分和疏水中性组分有较好的去除, 去除率分别为50.33%±0.98%、21.56%±0.42%, 而对分子量 < 1 kDa组分去除率较低为2.26%±0.12%;对亲水组分的去除效果较差.
3) 通过EEM分析, 二级出水中溶解性有机物主要为腐殖质类, 也是造成水的色度较高的原因.通过结合平行因子分析法的三维荧光光谱表征水中DOM, 确定混凝出水及分级组分的最佳组分模型为3组分, 分别为类腐殖质物质(C1)、氨基酸类或者结合类蛋白质(C2)、类富里酸物质(C3), 通过最大荧光强度值Fmax的去除率可知, 混凝对C1的去除效果较好, Fmax去除率最高为46.22%, 而对C2、C3去除效果一般.混凝对制药废水二级出水中DOM具有一定的去除能力, 但效果不显著, 仅适合作为一种预处理工艺.
Carstea E M, Bridgeman J, Baker A, et al. 2016. Fluorescence spectroscopy for wastewater monitoring:A review[J]. Water Research, 95: 205–219.
DOI:10.1016/j.watres.2016.03.021
|
Chon K, Chon K, Cho J. 2017. Characterization of size fractionated dissolved organic matter from river water and wastewater effluent using preparative high performance size exclusion chromatography[J]. Organic Geochemistry, 103: 105–112.
DOI:10.1016/j.orggeochem.2016.11.003
|
崔凤国, 杨鹏, 张伟军, 等. 2015. 混凝和活性炭吸附深度处理制药废水中有机物去除特征[J]. 环境工程学报, 2015, 9(9): 4359–4364.
|
Derrien M, Yang L, Hur J. 2017. Lipid biomarkers and spectroscopic indices for identifying organic matter sources in aquatic environments:A review[J]. Water Research, 112: 58–71.
DOI:10.1016/j.watres.2017.01.023
|
Filloux E, Gallard H, Croue J P. 2012. Identification of effluent organic matter fractions responsible for low-pressure membrane fouling[J]. Water Research, 46(17): 5531–5540.
DOI:10.1016/j.watres.2012.07.034
|
Gadipelly C, Pérez-González A, Yadav G D, et al. 2014. Pharmaceutical Industry Wastewater:Review of the Technologies for Water Treatment and Reuse[J]. Industrial & Engineering Chemistry Research, 53(29): 11571–11592.
|
Griffin C G, Finlay J C, Brezonik P L, et al. 2018. Limitations on using CDOM as a proxy for DOC in temperate lakes[J]. Water Research, 144: 719–727.
DOI:10.1016/j.watres.2018.08.007
|
Guan Y F, Qian C, Chen W, et al. 2018. Interaction between humic acid and protein in membrane fouling process:A spectroscopic insight[J]. Water Research, 145: 146–152.
DOI:10.1016/j.watres.2018.08.019
|
胡小兵. 2012.发酵制药废水有色物质特征解析与脱色机理研究[D].南京: 南京大学.39-49
http://cdmd.cnki.com.cn/Article/CDMD-10284-1016044274.htm |
Heinz M, Zak D. 2018. Storage effects on quantity and composition of dissolved organic carbon and nitrogen of lake water, leaf leachate and peat soil water[J]. Water Research, 130: 98–104.
DOI:10.1016/j.watres.2017.11.053
|
Hamid K I A, Sanciolo P, Gray S, et al. 2019. Comparison of the effects of ozone, biological activated carbon (BAC) filtration and combined ozone-BAC pre-treatments on the microfiltration of secondary effluent[J]. Separation and Purification Technology, 215: 308–316.
DOI:10.1016/j.seppur.2019.01.005
|
金鹏康, 石彦丽, 任武昂. 2015. 城市污水处理过程中溶解性有机物转化特性[J]. 环境工程学报, 2015, 9(1): 1–6.
|
解林, 刘伟京, 涂勇, 等. 2010. 混凝法深度处理废纸造纸废水实验研究[J]. 环境工程学报, 2010, 10: 2190–2194.
|
Lai P, Zhao H Z, Wang C, et al. 2007. Advanced treatment of coking wastewater by coagulation and zero-valent iron processes[J]. Journal of Hazardous Materials, 147(1-2): 232–239.
DOI:10.1016/j.jhazmat.2006.12.075
|
Lester Y, Mamane H, Zucker I, et al. 2013. Treating wastewater from a pharmaceutical formulation facility by biological process and ozone[J]. Water Research, 47(13): 4349–4356.
DOI:10.1016/j.watres.2013.04.059
|
Li W T, Xu Z X, Li A M, et al. 2013. HPLC/HPSEC-FLD with multi-excitation/emission scan for EEM interpretation and dissolved organic matter analysis[J]. Water Research, 47(3): 1246–1256.
DOI:10.1016/j.watres.2012.11.040
|
Li Y, Harir M, Uhl J, et al. 2017. How representative are dissolved organic matter (DOM) extracts? A comprehensive study of sorbent selectivity for DOM isolation[J]. Water Research, 116: 316–323.
DOI:10.1016/j.watres.2017.03.038
|
Lin J L, Huang C, Dempsey B, et al. 2014. Fate of hydrolyzed Al species in humic acid coagulation[J]. Water Research, 56: 314–324.
DOI:10.1016/j.watres.2014.03.004
|
Liu H, Cheng F, Wang D. 2009. Interaction of ozone and organic matter in coagulation with inorganic polymer flocculant-PACl:Role of organic components[J]. Desalination, 249(2): 596–601.
DOI:10.1016/j.desal.2008.06.032
|
Liu T, Chen Z L, Yu W Z, et al. 2011. Effect of two-stage coagulant addition on coagulation-ultrafiltration process for treatment of humic-rich water[J]. Water Research, 45(14): 4260–4268.
DOI:10.1016/j.watres.2011.05.037
|
Michael-Kordatou I, Michael C, Duan X, et al. 2015. Dissolved effluent organic matter:Characteristics and potential implications in wastewater treatment and reuse applications[J]. Water Research, 77: 213–248.
DOI:10.1016/j.watres.2015.03.011
|
Murphy K R, Hambly A, Singh S, et al. 2011. Organic matter fluorescence in municipal water recycling schemes:toward a unified PARAFAC model[J]. Environmental Science & Technology, 45(7): 2909–2916.
|
Nebbioso A, Piccolo A. 2013. Molecular characterization of dissolved organic matter (DOM):a critical review[J]. Analytical and Bioanalytical Chemistry, 405(1): 109–124.
DOI:10.1007/s00216-012-6363-2
|
Pan H, Yu H, Wang Y, et al. 2018. Investigating variations of fluorescent dissolved organic matter in wastewater treatment using synchronous fluorescence spectroscopy combined with principal component analysis and two-dimensional correlation[J]. Environmental Technology, 39(19): 2495–2502.
DOI:10.1080/09593330.2017.1357759
|
Ravndal K T, Opsahl E, Bagi A, et al. 2018. Wastewater characterisation by combining size fractionation, chemical composition and biodegradability[J]. Water Research, 131: 151–160.
DOI:10.1016/j.watres.2017.12.034
|
Shi X, Leong K Y, Ng H Y. 2017. Anaerobic treatment of pharmaceutical wastewater:A critical review[J]. Bioresource Technology, 245: 1238–1244.
DOI:10.1016/j.biortech.2017.08.150
|
Stedmon C A, Bro R. 2008. Characterizing dissolved organic matter fluorescence with parallel factor analysis:a tutorial[J]. Limnology and Oceanography:Methods, 6(11): 572–579.
DOI:10.4319/lom.2008.6.572
|
Tabatabai S A A, Schippers J C, Kennedy M D. 2014. Effect of coagulation on fouling potential and removal of algal organic matter in ultrafiltration pretreatment to seawater reverse osmosis[J]. Water Research, 59: 283–294.
DOI:10.1016/j.watres.2014.04.001
|
Trubetskoj O A, Richard C, Voyard G, et al. 2018. Molecular size distribution of fluorophores in aquatic natural organic matter:Application of HPSEC with multi-wavelength absorption and fluorescence detection following LPSEC-PAGE fractionation[J]. Environmental Science & Technology, 52(9): 5287–5295.
|
Wang J P, Chen Y Z, Wang Y, et al. 2011. Optimization of the coagulation-flocculation process for pulp mill wastewater treatment using a combination of uniform design and response surface methodology[J]. Water Research, 45(17): 5633–5640.
DOI:10.1016/j.watres.2011.08.023
|
Wang L F, He D Q, Chen W, et al. 2015. Probing the roles of Ca2+ and Mg2+ in humic acids-induced ultrafiltration membrane fouling using an integrated approach[J]. Water Research, 81: 325–332.
DOI:10.1016/j.watres.2015.06.009
|
Wang M, Chen Y. 2018. Generation and characterization of DOM in wastewater treatment processes[J]. Chemosphere, 201: 96–109.
DOI:10.1016/j.chemosphere.2018.02.124
|
Wang N, Xu Z, Xu W, et al. 2018. Comparison of coagulation and magnetic chitosan nanoparticle adsorption on the removals of organic compound and coexisting humic acid:A case study with salicylic acid[J]. Chemical Engineering Journal, 347: 514–524.
DOI:10.1016/j.cej.2018.04.131
|
Wang P, Jiao R, Liu L, et al. 2019. Optimized coagulation pathway of Al13:Effect of in-situ Aggregation of Al13[J]. Chemosphere, 230: 76–83.
DOI:10.1016/j.chemosphere.2019.05.053
|
Wang S, Zhang X, Wang Z, et al. 2014. In-depth characterization of secondary effluent from a municipal wastewater treatment plant located in Northern China for advanced treatment[J]. Water Science and Technology, 69(7): 1482–1488.
DOI:10.2166/wst.2014.040
|
Xiao K, Shen Y, Liang S, et al. 2018. Characteristic Regions of the Fluorescence Excitation-Emission Matrix (EEM) To Identify Hydrophobic/Hydrophilic Contents of Organic Matter in Membrane Bioreactors[J]. Environmental Science & Technology, 52(19): 11251–11258.
|
虞敏达, 何小松, 檀文炳, 等. 2017. 污水厂出水颗粒态与溶解态有机物的红外和荧光光谱特征[J]. 光谱学与光谱分析, 2017, 37(8): 2467–2473.
|
Yan Z, Liu B, Qu F, et al. 2017. Control of ultrafiltration membrane fouling caused by algal extracellular organic matter (EOM) using enhanced Al coagulation with permanganate[J]. Separation and Purification Technology, 172: 51–58.
DOI:10.1016/j.seppur.2016.07.054
|
Yang L, Hur J, Zhuang W. 2015. Occurrence and behaviors of fluorescence EEM-PARAFAC components in drinking water and wastewater treatment systems and their applications:A review[J]. Environmental Science and Pollution Research, 22(9): 6500–6510.
DOI:10.1007/s11356-015-4214-3
|
Yuan Z, He C, Shi Q, et al. 2017. Molecular Insights into the Transformation of Dissolved Organic Matter in Landfill Leachate Concentrate during Biodegradation and Coagulation Processes Using ESI FT-ICR MS[J]. Environmental Science & Technology, 51(14): 8110–8118.
|
张国威, 刘东方, 宋现财, 等. 2013. O3/H2O2深度处理制药废水二级出水试验研究[J]. 水处理技术, 2013, 2: 74–77.
|
赵华章, 王红宇, 栾兆坤. 2006. 高Alb聚氯化铝的混凝性能与机理研究[J]. 中国给水排水, 2006, 22(23): 30–34.
DOI:10.3321/j.issn:1000-4602.2006.23.008 |
张鹏, 王增长, 陈宏平, 等. 2010. 制药废水二级出水混凝沉淀对比试验[J]. 科技情报开发与经济, 2010, 6: 136–139.
|
郑淑平, 李亚静, 孙力平. 2013. 聚合氯化铝与粉末活性炭联合强化混凝处理垃圾渗滤液[J]. 环境工程学报, 2013, 7(7): 2443–2446.
|
张晓飞. 2016.不同级分的腐殖酸混凝预处理控制及对膜污染的影响研究[D].哈尔滨: 哈尔滨工业大学.26-27
http://cdmd.cnki.com.cn/Article/CDMD-10213-1016914856.htm |
张永利, 李润宣, 方梓恩, 等. 2012. PAC混凝沉降法处理陶瓷废水操作条件的优化[J]. 环境工程学报, 2012, 6(8): 2619–2623.
|
Zhang H, Qu J, Liu H, et al. 2009. Characterization of isolated fractions of dissolved organic matter from sewage treatment plant and the related disinfection by-products formation potential[J]. Journal of Hazardous Materials, 164(2/3): 1433–1438.
|
 2019, Vol. 39
2019, Vol. 39


