2. 天津市城市河道水质生态净化技术工程中心, 天津 300350
2. Tianjin Engineering Research Center of Urban River Eco-Purification Technology, Tianjin 300350
目前, 传统的深度脱氮处理方法有超滤膜、反渗透膜分离或活性炭吸附等.膜分离技术或吸附技术的除氮效果较好, 但由于污水厂的水量大、流速快, 使得上述技术的运行成本较高且易受到水量和流速的限制, 难以实现大规模应用.生物脱氮与物化技术相比, 具有灵活性强、效率高、成本低等优点, 因而得到了广泛应用.电极生物膜技术用于硝酸盐的去除, 阴极水电解产生的H2能够作为自养反硝化的电子供体, 在低有机碳源的条件下将异养反硝化过程与自养反硝化过程相结合.
电化学强化电极生物膜反应器脱氮过程的关键在于提高反应器中生物膜上的微生物量及体系的电子传递效率, 从而促进生物反硝化过程.电极生物反应器中阴极材料的理化性质直接影响着电极生物膜的反硝化效率(Ghafari et al., 2008), 如电极材料的导电性能、机械强度、微生物吸附性能等.电极生物膜反应器常用的阴极材料主要有金属类材料和碳质材料, 其中, 金属类材料(铜、钛、不锈钢)制成的网状或片状电极具有较好的稳定性和较高的导电性能, 但由于其表面一般比较光滑而不利于微生物的附着;碳质材料往往具有较好的生物相容性, 因此, 可以附着更高的生物量.
研究发现, 通过改性电极能够增加电极比表面积和提高生物相容性, 进而使得电极和生物膜之间的电子转移效率得到提高, 从而有效提高电极生物膜反应器的生物电化学性能(Kun et al., 2013).目前常用的电极改性方法有酸浸、热处理、导电聚合物覆膜、电化学氧化、碳纳米管覆膜等.其中, 导电聚合物是由聚合物经电化学或化学掺杂后形成的一类高分子材料, 经过掺杂过程可从绝缘体变为导体.Diaz等早在1979年就用电化学法在电极表面形成聚吡咯(Polypyrrole, PPy)薄膜, 随后对聚噻吩(Polythiophene, PTh)和聚苯胺(Polyaniline, PANi)等导电聚合物同样进行了研究(Diaz et al., 1979), 这类导电聚合物由于具有长程共轭的大π键, 使其为刚性链结构, 以及易于表面修饰、环境稳定性强等优点而应用最为广泛.
通过电化学方法合成导电聚合物的同时可以利用不同的物质作为掺杂离子进一步提高改性材料的生物相容性.电子穿梭体是一类氧化还原介体, 其能够作为电子的载体参与微生物的氧化还原过程, 从而使得生物氧化还原反应的速率提高(Fp et al., 2009; Watanabe et al., 2009).醌类物质是可以循环利用的电子载体, 所以其具有绝对的优势(Smith et al., 2015), 其中, 蒽醌-2, 6-二磺酸盐(Anthraquinone-2, 6-disulfonate, AQDS)就是最典型外生电子穿梭体, 能够介导间接电子转移(Abraham et al., 2010).有研究将PPy/AQDS改性电极应用到MFC中, 结果表明, 改性后电极强化了电极和微生物之间的电子传递效率, 同时增大了电极表面的微生物附着量, 应用改性电极的最大功率密度为对照组的13倍(Feng et al., 2010).
基于此, 本研究利用导电聚合物和电子穿梭体化合物的优点, 通过电化学法制备PTh和PTh/AQDS改性石墨毡, 并将其应用于小型双环式电极生物膜反应器, 考察不同C/N条件对BER体系反硝化性能的影响, 同时对应用不同改性阴极BER体系的微生物群落结构进行分析, 揭示应用PTh/AQDS改性阴极的强化机制.
2 材料和方法(Materials and methods) 2.1 试验材料 2.1.1 反应装置该电极生物膜反应装置有效容积为800 mL, 反应器主体为有机玻璃制圆筒, 实际反应装置图见图 1.该BER电极采用双环式布局模式, 石墨毡和不锈钢网分别作为阴极和阳极.直流稳压电源通过导线连接至反应器中的阴极和阳极, 为BER提供稳定电流.反应器主体上方添加橡胶密封圈和特殊构型盖子, 通过螺丝连接密封盖和反应器主体以保证体系的厌氧条件.将铝箔集气袋与该反应装置盖子上预留的气口通过软管相连, 收集反应体系气体进行成分分析.
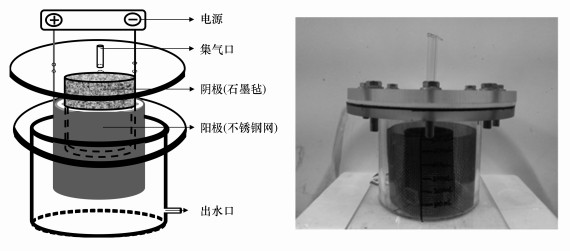 |
| 图 1 电极生物膜反应装置图 Fig. 1 Schematic of the biofilm electrode reactor (BER) |
阳极材料为不锈钢网, 由国标SUS 304不锈钢丝制成, 不锈钢丝直径为0.5 mm, 不锈钢网孔径为1.0 mm, 具有结构稳定、耐腐蚀、导电性好等特性, 购于无锡润裕筛网制品有限公司(中国).
阴极材料为石墨毡, 聚丙烯腈基石墨毡由丙烯腈基碳毡经高温石墨化处理后获得, 具有质量轻、碳含量高、纯度高和抗腐蚀等特性, 厚度为3.0 mm, 购于北京晶龙特碳科技有限公司(中国).石墨毡经过酸预处理后, 去除材料本身携带的杂质, 并调至中性.应用电化学法将噻吩单体(0.1 mol·L-1)和AQDS(0.05 mol·L-1)在电极表面聚合成导电聚合物薄膜, 整个电化学聚合过程在0.9 V聚合电压下聚合300 s, 得到自制的改性石墨毡.以未处理石墨毡电极作为对照, 将其应用于电极生物膜反应器.
2.1.3 接种污泥与模拟废水接种污泥取自连续运行6个月的连续流双环式电极生物膜反应器(7.5 L).该电极生物膜反应器在不同运行参数下进行硝酸盐氮的去除, 表现出较好的脱氮效果.将反应器阴极和载体上的生物膜剥落, 制成泥水混合液, 每个小型BER反应装置中分别注入100 mL泥水混合液.
进水NO3--N浓度为20.0 mg·L-1, 以甲醇作为碳源.进水配方为:NaNO3 121.4 mg·L-1、K2HPO4·3H2O 58.8 mg·L-1、CH3OH 0.04~0.20 mL·L-1、MgSO4·7H2O 20.0 mg·L-1、FeSO4·7H2O 2.5 mg·L-1、ZnSO4·7H2O 0.3 mg·L-1、CaCl2·2H2O 1.0 mg·L-1、CoCl2·6H2O 0.05 μg·L-1和MoO3 1.5 μg·L-1.进水初始pH值为7.0±0.2左右.
2.2 试验方法 2.2.1 不同水力停留时间和C/N对体系脱氮效能的影响试验设置3个电极生物膜反应器, 分别应用未改性石墨毡(Control)、聚噻吩改性石墨毡(PTh)、聚噻吩/AQDS改性石墨毡(PTh/AQDS)作为阴极材料.进水NO3--N浓度维持在20.0 mg·L-1, 外加电流设置为10 mA, 水力停留时间为4 h, 考察不同C/N(2.0、2.5、3.0、3.5、4.0)对体系反硝化效能的影响, 从而优化BER体系的运行参数.
2.2.2 电极性能的测定与分析采用扫描电子显微镜(Nanosem 430, FEI, 美国)对电极表面形貌进行观察, 后接X射线能谱仪EDS(Genesis, EDAX, 德国)对其元素组成进行分析.
应用传统三电极电解池体系对石墨毡电极进行循环伏安扫描(Cyclic Voltammetry, CV), 工作电极为石墨毡电极(1.0 cm×1.0 cm), 对电极为铂丝, 参比电极为Ag/AgCl电极, 电解溶液为0.1 mol·L-1的氯化钠溶液.氮吹10 min后静置30 min, 使用电化学工作站(CHI6000E, 上海辰星科技有限公司)对参数进行控制并进行CV扫描, 电压范围为-1.0~1.0 V, 扫描速率为100 mV·s-1, 重复扫描3次, 以平均值做图.
BER的电压数据通过采集系统(Neware, 中国)对其进行实时监测, 每20 min记录1组电压数据.
2.2.3 常规水质参数的测定与分析定期取水样测定pH值、硝酸盐氮、氨氮、亚硝酸盐氮浓度和COD, 各水质指标的测定均采用标准法(国家环境保护总局, 2002).气体成分测定参考Jiang等(2013)的方法, 利用气象色谱对该装置连接的集气袋内的气体(H2、CO2、N2)组分进行分析.
2.2.4 电极表面生物相分析为考察阴极生物膜表面的微生物形貌, 剪取运行100 d的生物阴极1 cm2(1.0 cm×1.0 cm), 用磷酸盐缓冲溶液对其进行反复冲洗, 将清洗后的生物阴极置于2.5%的戊二醛固定液中进行固定, 将其保存于4 ℃冰箱中12 h, 每4 h用磷酸盐缓冲溶液清洗一遍, 随后用乙醇溶液(25.0%、50.0%、75.0%、95.0%、100.0%)进行梯度脱水, 每次置换时间为10 min, 完成梯度脱水后生物阴极置于冷冻干燥机中冷冻干燥48 h进行电镜扫描.
为进一步了解体系微生物群落结构的变化, 选用E.Z.N.A. Soil DNA Isolation Kit快速提取试剂盒(Omega Biotech, 美国)对第100 d时采集的生物膜样品进行DNA提取, 将提取的DNA样品交由华大基因有限公司在HiSeq平台上进行Illumina高通量测序.基于Illumina HiSeq测序平台, 构建小片段文库, 进行双末端测序.测序结束后, 低质量的reads被滤除, 高质量的Clean data用于后期分子分析.基于reads之间的Overlap关系将其拼接成Tags, 在95.0%的相似度下Tags被聚成OTU(Operational Taxonomic Unit).通过将OTU与已有的细菌数据库进行比对, 完成物种注释.基于OTU和物种注释结果, 分别在各分类水平界、门、纲、目、科、属、种级别上进行群落组成分析, 进行样品物种丰度分析.
3 结果与讨论(Results and discussion) 3.1 改性石墨毡电极表征电极生物膜反应器启动前, 对改性石墨毡材料电极的表面形貌和元素组成进行了表征和分析, 结果分别见图 2和表 1.从图 2a可以看出, 未处理石墨毡电极的碳纤维表面光滑, 无其他物质负载在碳纤维上, 通过EDS多点扫描发现未改性电极石墨纤维上的主要成分是C元素(93.20%~94.81%), 除此之外还含有少量的O元素.经PTh和PTh/AQDS改性后的石墨毡电极纤维表面变得粗糙(图 2b和2c), 在碳纤维丝上形成均匀导电聚合物聚噻吩的薄膜, 特别是掺杂了AQDS离子的石墨纤维表面附着了某些颗粒状物质.改性后电极具有更大的比表面积, 增大了其与微生物的作用.结合改性石墨毡表面的组成成分分析, 经EDS多点扫描发现了除C和O以外的S元素(7.72%~9.07%).噻吩单体的化学式为C4H4S, AQDS的化学式为C14H6Na2O8S2, 从改性电极表面的成分证明噻吩和AQDS通过电化学方法成功负载在石墨毡材料的纤维表面.
 |
| 图 2 不同石墨毡电极表面形貌观察图 (a.未处理石墨毡, b.聚噻吩改性石墨毡, c.聚噻吩/AQD改性石墨毡) Fig. 2 SEM of unmodified graphite felt(a), PTh modified graphite felt (b) and PTh/AQDS modified graphite felt (c) |
| 表 1 不同石墨毡电极表组成成分 Table 1 Composition of different graphite felt before operation |
测定相同面积电极材料的电阻, 发现未处理石墨毡、PTh改性石墨毡和PTh/AQDS改性石墨毡的电阻分别为232、17.28和19.89 kΩ, 由此可见, 改性后的石墨毡电极材料在导电性上有了数量级上的增强.这是由于PTh和AQDS在石墨纤维表面形成, 导电聚合物薄膜与石墨纤维之间的联接架桥作用使得不同纤维丝之间更均匀地接触, 从而有效降低了电子与电极材料的电子的外回路传输过程阻力, 显著提高了电极材料的导电性(Wang et al., 2011).
3.2 不同C/N条件对体系脱氮效能的影响控制进水硝酸盐浓度为20.0 mg·L-1、电流为10 mA和HRT为4 h, 考察不同C/N(4.0、3.5、3.0、2.5和2.0)对不同改性电极BER体系脱氮效能的影响.异养反硝化过程中, 一部分碳源参与硝酸盐氮还原, 其理论化学计量C/N为2.86(式(1));一部分碳源被异养微生物生长所利用, 生长系数约为0.4, 理论C/N比值为4.01, 故设置体系初始C/N为4.
由图 3a可知, 当体系C/N大于3.0时, 3个处理组的脱氮效果无明显差异, 出水NO3--N在参数发生变化时出现轻微波动, 出水NO3--N平均值低于0.8 mg·L-1.应用PTh/AQDS的BER反应器中C/N=2.5时, 其硝酸盐氮去除率仍能达到94.0%以上, 应用未改性电极的BER反应器的硝酸盐氮去除率仅为66.5%±9.1%.充足的碳源保证了生物膜中异养反硝化细菌的生长和硝酸盐的生物转化过程, 从而提高了反硝化速率(Zhou et al., 2007).C/N为2.5时接近异养反硝化C/N理论值(2.86), 且有一部分碳源会被微生物生长利用, 所以碳源严重不足将直接导致脱氮效果变差.
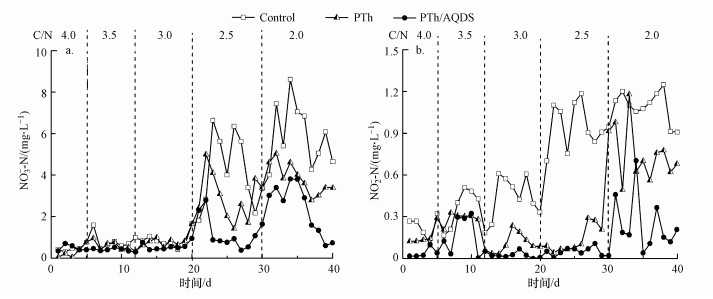 |
| 图 3 不同C/N条件下BER体系的反硝化效能 (a.NO3--N浓度, b.NO2--N浓度) Fig. 3 Denitrification performance of different C/N in BER system with different modified electrode (a.NO3--N concentration, b.NO2--N concentration) |
BER体系在电化学作用下能够原位产氢从而构建多电子供体体系, 为氢自养反硝化细菌提供电子供体.体系外加电流为10 mA时的电压大于1.8 V, 满足电解水产氢(式(3))的理论电压(1.23 V).对反应器连接气袋内的气体组成进行分析, 确实检测到氢气(0.65%~3.16%)(表 2), 表明BER体系能够原位产氢为氢自养反硝化细菌提供电子供体, 从而保障了体系自养反硝化过程的进行.应用PTh/AQDS改性电极的BER体系的氢气比重并未有明显的优势, 可能是因为氢气是电子供体, 参与了反应而被消耗.此外, BER体系中异养反硝化过程产生CO2, CO2可以同时作为无机碳源参与氢自养反硝化过程(式(2)).应用改性电极的BER体系中, PTh/AQDS复合薄膜提高了体系的电子传递能力, 故应用PTh/AQDS改性电极的BER体系能更高效地完成反硝化过程.
| 表 2 各气体组分含量 Table 2 Gas composition |

|
(1) |
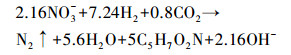
|
(2) |
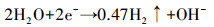
|
(3) |
当C/N持续降低时, 所有处理组的反硝化效能均受到了明显抑制, 出水NO2--N发生响应, 特别是对照组的出水NO2--N最大值达到1.2 mg·L-1 (图 3b).应用PTh改性电极的BER体系的NO2--N在C/N低于3.0时也表现出明显的波动.掺杂了AQDS改性电极的BER体系的亚硝酸盐出水浓度相对比较稳定, 具体原因将在3.3节和3.4节进行讨论.
不同C/N条件下BER体系的出水COD变化如图 4所示, 当C/N为3.0时所有处理组出水COD最低, 对照组、PTh改性电极组和PTh/AQDS改性电极组的出水COD分别为(29.4±4.7)、(21.3±4.7)和(17.5±8.1) mg·L-1.采用方差分析(ANOVA)检验不同电流条件下的出水COD, 计算得到的F值为12.785, p值为0.003, 由此说明不同C/N条件下COD的降解有显著的统计学差异.但随着体系C/N的进一步降低, 不同处理组出水COD的差异性缩小, 这可能是由于有机碳源不足的条件下体系微生物最大程度的将其利用.相较于C/N=3.0条件下, COD出水略有升高, 这是由于异养微生物在贫碳源条件下竞争有机碳源的过程可能会造成微生物死亡, 而细菌胞内物质的释放导致出水COD在一定程度上增加.
 |
| 图 4 不同C/N条件下BER体系中COD的变化 Fig. 4 COD variation of different C/N in BER system with different modified electrode |
不同改性石墨毡材料生物阴极表面的微生物附着情况见图 5.由图 5a可知, 未改性石墨毡阴极表面生物膜稀疏, 有些许杂质, 可能是由于石墨纤维表面比较光滑, 附着的少量微生物在预处理过程中易从纤维表面脱落.从图 5b可以看出, PTh改性后使生物阴极的表面微生物附着量明显增多, 且多为短杆菌.这是由于通过电沉积作用在石墨纤维表面形成的导电聚合物薄膜使其表面变得粗糙, 增大了电极的比表面积, 使电极能够附着更多的生物量.由于细菌细胞的表面带负电荷, PTh改性后电极表面带正电荷, 从而增强了细菌细胞粘附和生物膜的形成(Jia et al., 2014), 因此, 更多的微生物被富集在聚噻吩改性阴极的表面.但PTh改性石墨毡在BER反应体系应用一段时间后, 电极表面的导电聚合物薄膜有脱落现象, 因为通过电化学作用负载的导电聚合物薄膜不稳定, 是一个硬而脆的薄膜, 长时间的电化学作用下可能导致其脱落, 这一缺点限制了其广泛使用.
 |
| 图 5 不同生物阴极表面形貌观察图 (a.未处理石墨毡, b.聚噻吩改性石墨毡, c.聚噻吩/AQD改性石墨毡) Fig. 5 SEM of different biocathode (a.unmodified graphite felt, b.PTh modified graphite felt, c.PTh/AQDS modified graphite felt) |
PTh/AQDS改性后石墨毡电极表面的薄膜上有颗粒物(图 5c), 在增加电极比表面积的同时提供了更多的电化学活性位点, 从而为电活性细菌和生物膜附着生长提供了更多位点和空间.改性电极表面的杆菌分布不均, 某点聚簇生长.PTh和AQDS复合薄膜降低了反应底物、电极和微生物三相界面间的电极传递阻力及传质阻力(Pantarotto et al., 2003; Yuan et al., 2013), 从而提高了体系的电子传递能力, 使反硝化过程能更高效的发生.虽然PTh/AQDS修饰的石墨毡电极表面的复合薄膜在运行一段时间后也出现了一些裂缝, 但由于AQDS掺杂到聚噻吩的链状结构中, 使得制备的聚吡咯薄膜结构更稳定, 具有良好的电化学稳定性.
由阴极材料表面的微生物附着量可知, PTh/AQDS改性电极的生物膜与电极的比重为0.26±0.04, 而未改性电极的生物膜与电极的比重仅为0.11±0.03, 证明经过噻吩和AQDS复合改性的电极具有更优的生物相容性.
3.4 BER体系菌群特性分析生物系统中微生物的群落结构、动态变化与反应器中污染物的去除效能有直接关系.BER体系的脱氮性能与生物膜反硝化微生物种类的丰度和活性密切相关.为了分析不同石墨毡电极对BER体系微生物菌群特性的影响, 取阴极表面生物膜样品进行高通量测序.
应用不同电极的BER体系中OTUs、Shannon指数、Chao指数和Simpson指数见表 3.其中, OTU指数和Chao指数反映样品的物种丰富度, Shannon指数和Simpson指数则反映样品的物种多样性.从表 3可看出, 改性电极表面附着生物膜的OTUs指数、Chao指数和Shannon指数均有一定的提高.虽然BER启动初期各处理组接种相同浓度的活性污泥, 由于改性后的电极生物相容性更优, 悬浮液中的微生物能更好地附着在改性电极表面;同时, 由于改性后的电极具有更好的导电性, 微电流能够在一定程度上刺激微生物的生长并强化其生物转化作用(Ailijiang et al., 2016).因此, 相较于对照组, 改性电极表面的生物膜的微生物群落物种丰富度和多样性更优.
| 表 3 不同石墨毡电极条件下OTU、Shannon、Chao和Simpson指数 Table 3 OTU, Shannon, Chao and Simpson indexes under different graphite felt |
不同电极体系的微生物种群结构和丰度变化如图 6所示.由图 6a可知, 在纲水平上, 主要微生物有α-Proteobacteria(7.4%~11.7%)、β-Proteobacteria(29.1%~35.3%)、δ-Proteobacteria(10.7%~14.2%)、Flavobacteriia(3.4%~6.8%)、Anaerolineales(2.8%~4.6%)和Clostrudiai(1.8%~2.4%).绝大多数反硝化细菌属于Proteobacteria门(Kizito et al., 2017), β-Proteobacteria纲属于Proteobacteria门, 是能够参与异养反硝化和氢自养反硝化过程的重要优势微生物物种(Park et al., 2006).Anaerolineales则是反硝化生物阴极中最主要的菌, 属于Anaerolineae纲Chloroflexi门(Wrighton et al., 2010).从图 6a还可以看出, α-Proteobacteria、β-Proteobacteria和Anaerolineales的相对丰度在应用PTh/AQDS改性石墨毡电极的BER中最高, 分别为11.7%、35.3%和4.6%, 说明其微生物菌群中反硝化细菌所占的比重可能最大.相较于β-Proteobacteria纲, δ-Proteobacteria纲中产电菌所占的比例较高(Butler et al., 2007; Xu et al., 2017; Zhou et al., 2015), 特别是Geobacteraceae科是重要的产电菌, 其所占比重可达45%~89%(Lu et al., 2015), 而应用不同电极的BER体系中产电菌没有明显的差异性.
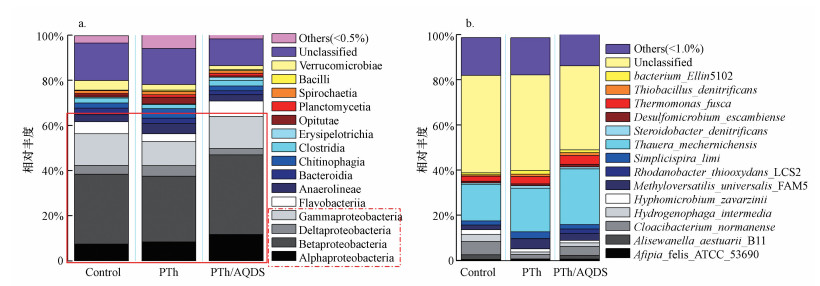 |
| 图 6 不同电极BER中细菌DNA序列的分类及相对丰度 (a.纲水平, b.种水平) Fig. 6 Taxonomic classification of bacterial DNA sequences from different communities and the relative abundances at class level(a) and species level(b) |
从种水平上可以看出(图 6b), 相对丰度最高的物种为Thauera_mechernichensis, 其在对照组、PTh组和PTh/AQDS组中的相对丰度分别为16.2%、19.3%和24.6%.其次是Methyloversatilis_universalis_FAM5, 其在3组生物膜体系中的相对丰度为3.1%~4.5%.Thauera_mechernichensis和Methyloversatilis_universalis_FAM5分别属于Thauera属和Methyloversatilis属, PTh/AQDS体系中β-Proteobacteria纲的相对丰度较高就归因于这两个菌属的富集.Thauera_mechernichensis和Methyloversatilis_universalis_FAM5是典型的异养反硝化细菌, 推断BER体系中自养-异养协同作用下起主导作用的仍然是异养反硝化过程.
Methyloversatilis_universalis_FAM5由于缺乏亚硝酸盐氮还原酶(Nir), 该微生物只能将NO3--N转化为NO2--N, 但NO2--N不能进一步转化为N2(Lu et al., 2012; Liu et al., 2016), 可能造成NO2--N的积累.同时有研究表明, 低C/N条件下生物脱氮体系更易发生亚硝酸盐的积累, 这是由于亚硝酸盐氮还原酶与硝酸盐氮还原酶在低C/N条件下争夺电子供体(Ghafari et al., 2009), 从而导致少量NO2--N的积累.但NO2--N在BER体系出水中的浓度仍然较低, 这是由于Thauera_mechernichensis能够完成完全反硝化过程, 且其相对丰度为Methyloversatilis_universalis_FAM5相对丰度的5倍左右.因此, Methyloversatilis_universalis_FAM5产生的NO2--N可被Thauera_mechernichensis进一步转化.
研究表明, 微电流对特定细菌生长有一定的刺激和强化作用(Ailijiang et al., 2016).由于改性后的电极具有更好的导电性和生物相容性, 因此, 应用改性后的电极某些特定微生物得到了富集.PTh/AQDS复合改性电极中特定微生物的相对丰度更高, 可能是由于仅应用PTh改性电极, 其表面薄膜的脱落使生物多样性和丰富度受到影响.AQDS是典型的外生电子穿梭体, AQDS掺杂不仅能够加速电子传递速率, 而且还能促进反硝化生物质的代谢过程(Aulenta et al., 2007; Liu et al., 2011).同时, AQDS能够强化反硝化过程酶的活性, Xie等(2014)发现100 μmol·L-1 AQDS加入反应体系后亚硝酸盐还原酶(Nir)的活性是对照组的2.8倍.PTh/AQDS处理组由于特定微生物的富集和反硝化酶活性的强化, 从而保证其在C/N为2.0时仍具有较好的反硝化效能.
4 结论(Conclusions)1) 与未处理的石墨毡电极相比, PTh改性和PTh/AQDS改性石墨毡电极表现出更优的电化学性能和生物相容性, 应用改性阴极强化了BER体系的脱氮效能.
2) 当C/N低于2.5时, 对照组的NO3--N去除率仅为66.5%±9.1%, 而应用PTh/AQDS改性石墨毡电极的BER体系中硝酸盐氮去除率仍能达到94.0%以上.
3) 电化学作用下, BER体系能够原位产氢构建多电子供体体系, 为氢自养反硝化细菌提供电子供体氢气(0.65%~3.16%), 在低碳氮比条件下实现自养-异养协同反硝化.
4) AQDS在噻吩聚合过程中掺杂到链状结构中有助于维持体系的电中性, PTh/AQDS改性电极显著增加了微生物的附着量和丰富度, PTh/AQDS复合改性石墨毡生物膜上Thauera_mechernichensis的相对丰度为24.6%, 分别为PTh改性处理组和对照组的1.2倍和1.5倍.
5) PTh导电聚合物薄膜提高了体系的电子传递能力, 故应用改性电极的BER体系能更高效地完成反硝化过程, 而AQDS掺杂有效地促进了特定细菌的生长及强化了亚硝酸盐还原酶(Nir)的活性, 从而促进了反硝化生物质的代谢过程, 保证了BER体系在低C/N条件下的反硝化效能.
Abraham E, Julian S, Pablo V, et al. 2010. Fluorescent properties of c-type cytochromes reveal their potential role as an extracytoplasmic electron sink in Geobacter sulfurreducens[J]. Environmental Microbiology, 10(2): 497–505.
|
Ailijiang N, Chang J, Liang P, et al. 2016. Electrical stimulation on biodegradation of phenol and responses of microbial communities in conductive carriers supported biofilms of the bioelectrochemical reactor[J]. Bioresource Technology, 201: 1–7.
DOI:10.1016/j.biortech.2015.11.026
|
Aulenta F, Catervi A, Majone M, et al. 2007. Electron transfer from a solid-state electrode assisted by methyl viologen sustains efficient microbial reductive dechlorination of TCE[J]. Environmental Science & Technology, 41(7): 2554–2559.
|
Butler J E, He Q, Nevin K P, et al. 2007. Genomic and microarray analysis of aromatics degradation in Geobacter metallireducens and comparison to a Geobacter isolate from a contaminated field site[J]. BMC genomics, 8(1): 180.
DOI:10.1186/1471-2164-8-180
|
Diaz L, Frydman R B, Valasinas A, et al. 1979. Biosynthesis of uroporphyrinogens. Synthesis of alpha-aminomethylbilanes and their interaction with the enzymic system[J]. Journal of the American Chemical Society, 101(10): 2710–2716.
DOI:10.1021/ja00504a036
|
Feng C, Ma L, Li F, et al. 2010. A polypyrrole/anthraquinone-2, 6-disulphonic disodium salt (PPy/AQDS)-modified anode to improve performance of microbial fuel cells[J]. Biosensors & Bioelectronics, 25(6): 1516–1520.
|
Fp V D Z, Cervantes F J. 2009. Impact and application of electron shuttles on the redox (bio) transformation of contaminants:a review[J]. Biotechnology Advances, 27(3): 256–277.
DOI:10.1016/j.biotechadv.2009.01.004
|
Ghafari S, Hasan M, Aroua M K. 2008. Bio-electrochemical removal of nitrate from water and wastewater-a review[J]. Bioresource Technology, 99(10): 3965–3974.
DOI:10.1016/j.biortech.2007.05.026
|
Ghafari S, Hasan M, Aroua M K. 2009. Improvement of autohydrogenotrophic nitrite reduction rate through optimization of pH and sodium bicarbonate dose in batch experiments[J]. Journal of Bioscience & Bioengineering, 107(3): 275–280.
|
Jia L, Liu J, He W, et al. 2014. Enhanced electricity generation for microbial fuel cell by using electrochemical oxidation to modify carbon cloth anode[J]. Journal of Power Sources, 265(4): 391–396.
|
Jiang Y, Su M, Zhang Y, et al. 2013. Bioelectrochemical systems for simultaneously production of methane and acetate from carbon dioxide at relatively high rate[J]. International Journal of Hydrogen Energy, 38(8): 3497–3502.
DOI:10.1016/j.ijhydene.2012.12.107
|
Kizito S, Lv T, Wu S, et al. 2017. Treatment of anaerobic digested effluent in biochar-packed vertical flow constructed wetland columns:role of media and tidal operation[J]. Science of the Total Environment, 592: 197–205.
DOI:10.1016/j.scitotenv.2017.03.125
|
Kun G, Stefano F, Dennis P G, et al. 2013. Effects of surface charge and hydrophobicity on anodic biofilm formation, community composition, and current generation in bioelectrochemical systems[J]. Environmental Science & Technology, 47(13): 7563–7570.
|
Liu R H, Sheng G P, Sun M, et al. 2011. Enhanced reductive degradation of methyl orange in a microbial fuel cell through cathode modification with redox mediators[J]. Applied Microbiology & Biotechnology, 89(1): 201–208.
|
Liu Y, Feng C, Chen N, et al. 2016. Bioremediation of nitrate and Fe (Ⅱ) combined contamination in groundwater by heterotrophic denitrifying bacteria and microbial community analysis[J]. RSC Advances, 6(110): 375–383.
|
Lu H, Kalyuzhnaya M, Chandran K. 2012. Comparative proteomic analysis reveals insights into anoxic growth of Methyloversatilis universalis FAM5 on methanol and ethanol[J]. Environmental Microbiology, 14(11): 2935–2945.
DOI:10.1111/j.1462-2920.2012.02857.x
|
Lu L, Xing D, Ren Z J. 2015. Microbial community structure accompanied with electricity production in a constructed wetland plant microbial fuel cell[J]. Bioresource Technology, 195: 115–121.
DOI:10.1016/j.biortech.2015.05.098
|
Pantarotto D, Partidos C D, Graff R, et al. 2003. Synthesis, structural characterization, and immunological properties of carbon nanotubes functionalized with peptides[J]. Journal of the American Chemical Society, 125(20): 6160–6164.
DOI:10.1021/ja034342r
|
Park H I, Ji S K, Dong K K, et al. 2006. Nitrate-reducing bacterial community in a biofilm-electrode reactor[J]. Enzyme & Microbial Technology, 39(3): 453–458.
|
Smith J A, Nevin K P, Lovley D R. 2015. Syntrophic growth via quinone-mediated interspecies electron transfer[J]. Frontiers in Microbiology, 6(121): 121.
|
Wang K, Chizari K, Liu Y, et al. 2011. Catalytic synthesis of a high aspect ratio carbon nanotubes bridging carbon felt composite with improved electrical conductivity and effective surface area[J]. Applied Catalysis A General, 392(1/2): 238–247.
|
Watanabe K, Wake T. 2009. Measurement of unfrozen water content and relative permittivity of frozen unsaturated soil using NMR and TDR[J]. Cold Regions Science & Technology, 59(1): 34–41.
|
Wrighton K C, Virdis B, Clauwaert P, et al. 2010. Bacterial community structure corresponds to performance during cathodic nitrate reduction[J]. Isme Journal Emultidisciplinary Journal of Microbial Ecology, 4(11): 1443–1455.
|
Xin Y, Qiao S, Zhou J, et al. 2014. Effects of redox mediators on nitrogen removal performance by denitrifying biomass and the activity of Nar and Nir[J]. Chemical Engineering Journal, 257(6): 90–97.
|
Xu P, Xiao E R, Xu D, et al. 2017. Internal nitrogen removal from sediments by the hybrid system of microbial fuel cells and submerged aquatic plants[J]. Plos One, 12(2): e0172757.
DOI:10.1371/journal.pone.0172757
|
Yuan Y, Zhou S, Liu Y, et al. 2013. Nanostructured macroporous bioanode based on polyaniline-modified natural loofah sponge for high-performance microbial fuel cells[J]. Environmental Science & Technology, 47(24): 14525–14532.
|
Zhou J, He Z, Yang Y, et al. 2015. High-throughput metagenomic technologies for complex microbial community analysis:Open and closed formats[J]. Mbio, 6(1): e02288–14.
|
Zhou M, Fu W, Gu H, et al. 2007. Nitrate removal from groundwater by a novel three-dimensional electrode biofilm reactor[J]. Electrochimica Acta, 52(19): 6052–6059.
DOI:10.1016/j.electacta.2007.03.064
|
 2019, Vol. 39
2019, Vol. 39


