溶解性有机质(Dissolved organic matter, DOM)通常是指水体中能通过0.45 μm滤膜的有机质(Perdue et al., 2003).DOM广泛存在于土壤、沉积物及各类水体环境中, 是生态系统的重要组成部分.例如, 湖泊沉积物DOM主要来源于水体周边生物的降解及水生动植物的分解(Meyers et al., 2002).DOM是联系陆地生态系统和水生生态系统之间碳转移的纽带, 在全球碳生物地化循环中扮演着极其重要的角色(刘堰杨等, 2018a).并且DOM对生态系统的能量输入和物质转化也具有重要影响, 如DOM可通过离子交换、吸附、氧化还原等反应改变土壤、沉积物和水体中重金属的迁移转化、生物毒性及空间分布等(高洁等, 2015).水环境中的DOM不仅可以影响重金属在颗粒物上的富集、赋存形态和迁移转化, 还可以影响有机污染物在环境中的吸附解吸、光降解、微生物降解等环境行为(张菊等, 2011; Zhang et al., 2016).因此, 研究环境中DOM结构组成、来源等对于了解其对环境的影响具有重大意义.
有色溶解性有机质(CDOM)是DOM的重要组分, 荧光溶解性有机质(FDOM)则是CDOM中吸收紫外-可见光后发出荧光的部分, 其光谱特性为认识DOM结构和特征提供了重要依据(Zhang et al., 2011;2018).目前, 有关DOM光谱分析的技术主要有紫外-可见吸收光谱法(UV-vis)和三维荧光光谱法(3D-EEM)(刘堰杨等, 2018b).3D-EEM是利用CDOM的荧光特性来分析有机质的来源、结构组成和沉降转化的一种操作简便、灵敏度和信息分辨率较高的方法.UV-vis因具有样品量少、操作简单、灵敏度高等优点, 现已成为表征DOM吸收光谱特征的一种便捷手段.这两种方法是目前研究水体中DOM性质非常重要的手段(Judd et al., 2006; 李丹等, 2016).
水溶性有机质(WSOM)是环境中溶解性有机质(DOM)的重要组成部分, 是土壤、沉积物等固相介质中能溶于水、且在一定条件下能够在“固相-溶解相”之间相互转化的那部分有机质(Chantigny, 2003; Gabor et al., 2015).例如, 土壤WSOM可在溶解相、矿物颗粒表面、固相颗粒中动态转换, 并在降雨或融雪时被淋溶(Chantigny, 2003).研究表明, 干燥度、盐度、酸化、土地利用等均能够影响WSOM的化学特性(Akagi et al., 2007; Provenzano et al., 2008;SanClements et al., 2012; Gabor et al., 2015).因此, 研究环境中WSOM的化学特性有助于了解环境中DOM的迁移过程及化学特性, 从而为探明环境中DOM对污染物环境归趋作用提供依据.WSOM可通过纯水振荡从土壤中提取, 但该提取方法容易导致土壤粘粒的分散从而使溶液混浊不易分离, 因此, 通常采用稀盐溶液振荡来提取WSOM(Murphy et al., 2000).稀盐溶液可破坏土壤表面的吸附平衡, 如磷酸根离子与配位体交换, 从而释放出部分吸附在土壤矿物颗粒上的有机物(Qualls et al., 1992).但由于提取液不同, 提取时间长短相差较大, 以及离子浓度、水土比例等不同, 使得不同研究间的可比性较差(赵劲松等, 2003).目前, 关于不同离子浸提液对WSOM光谱特性影响的研究还非常少.Gabor等(2015)对比了K2SO4、CaCl2、KCl及水溶液中土壤WSOM的荧光特性差异, 结果发现, 3种盐溶液中的WSOM荧光指数及腐殖化指数均高于水溶液.Provenzano等(2010)研究发现, CaCl2对土壤WSOM中总有机碳的提取能力低于水溶液, 但对荧光强度的提取能力较高. Rennert等(2007)分析了K2SO4、CaCl2及水溶液中WSOM的化学特性, 发现K2SO4溶液中的WSOM浓度最高, CaCl2溶液中的浓度最低.为了系统地了解天然水环境离子对WSOM理化性质的影响, 本文使用不同种类及浓度的离子溶液提取沉积物中的WSOM, 通过UV-vis和3D-EEM分析不同来源沉积物DOM的地化特征与差异, 以期为深入研究环境中DOM提取与特征分析提供理论依据和数据支持.
2 材料与方法(Materials and methods) 2.1 样品采集与处理本研究选取3个湖泊沉积物样品进行分析(表 1).样品冷冻干燥后经研磨、过100目筛后于棕色广口瓶中低温避光保存.
| 表 1 样品信息 Table 1 Description of the sediment samples |
WSOM采用稀盐溶液振荡提取法(Murphy et al., 2000)提取.具体操作为:称取土样0.5 g于离心管中, 加入10 mL浸提液;在25 ℃环境中于黑暗处振荡24 h, 然后利用低速离心机在3600 r·min-1下离心10 min, 重复2次, 接着用0.45 μm针孔滤膜过滤, 低温保存在离心管中.所有样品的光谱测试均在滤液提取后3 d内完成.浸提液离子种类及浓度的选取根据文献报道的鄱阳湖实际水体化学离子种类及浓度确定, 并于室内利用超纯水制备完成(表 2).研究报道, 鄱阳湖水体的主要阳离子为K+、Na+、Ca2+、Mg2+, 阴离子为SO42-、Cl-、NO3-、HCO3-, 且浓度因季节及采样点的不同差异较大(胡春华等, 2011; 翟大兴等, 2012).为了减少过多离子对实验结果的干扰, 当研究阳离子对WSOM提取的影响时, 阴离子统一引入Cl-;当研究阴离子对其影响时, 阳离子统一引入Na+.
| 表 2 不同离子种类溶液的浓度设计 Table 2 The concentration of the chemical ions |
水样紫外-可见吸收光谱测定采用岛津UV-2600型紫外分光光度计.仪器参数如下:以Milli-Q水为空白, 以校正由于仪器漂移和光散射引起的偏移;用1 cm光路径比色皿在200~800 nm范围内扫描, 扫描间隔为1 nm(聂明华等, 2018).
三维荧光光谱采用英国爱丁堡FLS980荧光光谱仪测定.分析方法具体如下:以Milli-Q超纯水为空白, 激发波长λEx及发射波长λEm的范围分别为200~450 nm、250~600 nm, 增量均为5 nm, 激发和发射狭缝Δλ为4 nm.所有结果利用Matlab软件对原始数据进行拉曼和瑞利散射校正(Zepp et al., 2004), 利用超纯水在λEx=350 nm下的拉曼光谱进行水拉曼单位校正(r.u.)(Lawaetz et al., 2009), 同时根据样品浓度使用超纯水对样品进行不同浓度的稀释, 以使其260 nm波长下的吸光度小于0.02, 从而去除样品的内滤效应(Coble et al., 1998).经过测定, 由于PY和FH样品中荧光物质过少, 低于仪器检测限, 故只得到XH样品在不同种类及浓度离子浸提液中的三维荧光光谱数据.
2.4 数据处理研究中利用吸收光谱数据计算了WSOM的UV254值、CDOM丰度、吸光度比值及光谱斜率比值等指标.UV-vis特征参数的计算方法及描述见表 3, 其中, 光谱斜率计算时使用SigmaPlot 12.3进行回归拟合.
| 表 3 紫外-可见光特征参数计算方法及描述 Table 3 Calculation method and description of UV-visible characteristic parameters |
采用平行因子分析法(PARAFAC)对XH样品WSOM的32个(8种离子×4个浓度)3D-EEM数据进行模拟分析.利用Matlab软件的DOMFluor工具箱进行分析及检验, 具体方法参照前期工作(Stedmon et al., 2008; Yan et al., 2018).模型最终组分个数由最小平方和误差决定, 结果的可靠性通过折半分析及残差、载荷分析来保证;平行因子组分的浓度采用荧光峰最高处的荧光强度即Fmax(r.u.)来表示.对分析出的各荧光团利用其激发波长λEx及发射波长λEm波长数据, 于在线OpenFluor数据库平台进行物质判定(http://www.openfluor.org) (Murphy et al., 2014).
本文采用Fn(280)及Fn(355)代表浸提液中WSOM的类蛋白物质及类腐殖物质浓度.Fn(280)定义为λEx=280 nm时, λEm为340~360 nm时的最大荧光强度, 表示类腐殖物质的相对浓度水平;Fn(355)定义为λEx=355 nm时, λEm为440~470 nm时的最大荧光强度, 表示类蛋白物质的相对浓度水平(Zhang et al., 2009).
3 结果与讨论(Results and discussion) 3.1 紫外-可见吸收光谱参数分析 3.1.1 不同离子条件下WSOM的UV254值UV254值可表征DOM的芳香度, 一般该值越高其组分中不饱和键越多(Nishijima et al., 2004), 同时研究中常利用该值来间接表征溶解性有机碳(DOC)的浓度(Dadi et al., 2015).不同离子条件下3种沉积物的UV254值分别为0.17~1.00(PY)、0.30~0.64(XH)、0.26~3.31(FH), 均值分别为0.47、0.40、0.97, 这与文献报道的UV254值基本一致(Nishijima et al., 2004).不同种类离子浸提液中WSOM的UV254值均值以K+浸提液最高(0.99)、Mg2+浸提液最低(0.46), 具体排序为SO42- > NO3- > Cl- > HCO3-(阴离子)、K+ > Ca2+ > Na+> Mg2+(阳离子).该结果说明WSOM在SO42-及K+浸提液中的DOC含量较高, 有机碳的芳香度高、C=C不饱和键多, 而在HCO3-及Mg2+浸提液中相反.本文进一步分析了不同浓度离子浸提液中WSOM的UV254值变化趋势(图 1).总体而言, 不论阴离子或阳离子, 高浓度离子浸提液均不利于WSOM从固相介质中解吸出来, 这一结果与融雪水离子浓度变化对浸提DOM影响的实验结果相近(王茜等, 2016).这是因为固相溶液中的WSOM一般带负电, 颗粒间依靠静电斥力保持溶液稳定性;但当溶液离子浓度增加时, 颗粒间距离减小、范德华力增加, 从而导致溶液絮凝(Ritvo et al., 2003).
 |
| 图 1 不同离子条件下沉积物中可提取WSOM的UV254值 (浓度1~4化学离子浓度逐渐递增, 具体浓度见表 1) Fig. 1 UV254 value of WSOM from sediments in different ion conditions |
CDOM是DOM的重要组成部分, 一般用吸收系数α355值表示其丰度(Guéguen et al., 2011).不同离子条件下3种沉积物的α355值分别为14~108 m-1(PY)、16~49 m-1(XH)、17~345 m-1(FH), 均值分别为55、27、90 m-1.相关分析结果表明(表 4), α355值与UV254值呈显著正相关(r=0.851, p < 0.01), 说明不同离子条件下WSOM的CDOM丰度越高, 其芳香性亦越高、有机碳中不饱和键越多.不同种类离子浸提液中WSOM的α355值均值以K+浸提液最高(97 m-1)、Mg2+浸提液最低(41 m-1), 具体排序为Cl- > NO3- > SO42- >HCO3-(阴离子)、K+ > Ca2+ > Na+> Mg2+(阳离子).该结果说明WSOM在Cl-及K+浸提液中可获得更多的CDOM, 在HCO3-及Mg2+浸提液中则相反.不同浓度离子浸提液中WSOM的α355值变化趋势(图 2)与UV254值相似, 即不论阴离子或阳离子, 随离子浓度增加, WSOM的CDOM丰度呈减小趋势.这与文献报道的河口区水体中CDOM丰度随盐度增加而降低的趋势一致(Granskog et al., 2007).
| 表 4 紫外-可见参数间的相关关系(N=96(4个浓度×3个样品×8种离子)) Table 4 Intercorrelations between the UV-visible parameters |
 |
| 图 2 不同离子条件下沉积物中可提取WSOM的α355值 (化学离子浓度变化同图 1) Fig. 2 α355 value of WSOM from sediments in different ion conditions |
在DOM理化性质的相关研究中常用吸光度比值来表征其性质, 以排除单一特定波长的不确定性造成的干扰(李丹等, 2016).UV250/UV365常用来表征有机质中腐殖酸和富里酸的比例, 该值越大, 富里酸比例越高, 但DOM分子量越小(谢理等, 2013).不同离子条件下沉积物的UV250/UV365分别为1.78~2.49(PY)、2.83~5.97(XH)、2.03~3.19(FH), 均值分别为2.16、4.04、2.55.沉积物中XH的UV250/UV365远高于其他沉积物, 约为天然水体沉积物(即PY、FH)的1.5~2.0倍, 说明城市内湖水体沉积物在不同离子条件下WSOM的富里酸比例较高, 但分子量小, 该结果与天然河流水体吸收光谱特性一致(聂明华等, 2018).不同种类离子浸提液中WSOM的UV250/UV365均值以Na+浸提液最高(3.23)、Ca2+浸提液最低(2.51), 具体排序为NO3- > Cl- > SO42- >HCO3-(阴离子)、Na+ > K+ > Mg2+ > Ca2+ (阳离子).该结果说明WSOM在NO3-、Na+浸提液中的富里酸含量较高、分子量较小, HCO3-、Ca2+浸提液相反.
总体来说, 不同浓度离子浸提液中WSOM的UV250/UV365变化趋势(图 3)与UV254、α355值相似, 即随离子浓度增加, WSOM的UV250/UV365呈减小趋势.换言之, 随浸提液离子浓度增强, 颗粒间斥力减小、范德华力增加, 浸提液中由于絮凝作用大颗粒WSOM比例增加.但不同种类离子浸提液中UV250/UV365随离子浓度的变化趋势与UV254、α355值略有差异.例如, 在K+浸提液中FH样品的UV250/UV365以浓度3略高, 而其UV254、α355值均以浓度1远高于其他浓度, 这说明随离子浓度增强, WSOM各光谱参数并不是同步变化的.
 |
| 图 3 不同离子条件下沉积物中可提取WSOM的吸光度比值(UV250/UV365) (化学离子浓度变化同图 1) Fig. 3 Absorption ratio (i.e UV250/UV365) of WSOM from sediments in different ion conditions |
UV253/UV220常用来表征芳环取代情况, 该值越小, 说明芳环上取代基以脂肪链为主;反之, 则芳环上取代基以羰基、羧基、酯类为主(Peuravuori et al., 1997).不同离子条件下沉积物的UV253/UV220分别为0.42~0.79(PY)、0.54~0.71(XH)、0.54~0.80(FH), 均值分别为0.61、0.62、0.70.可以看出, 相较于其他指标, UV253/UV220在沉积物间的差异较小.相关性分析结果表明, UV253/UV220与UV254、α355值呈显著正相关, r值均为0.588(p < 0.01), 说明WSOM中芳香度、CDOM丰度越高, 芳环中羰基、羧基、酯类等取代基越多.不同种类离子浸提液中WSOM的UV253/UV220均值总体差异不大, 以K+浸提液稍高(0.71)、NO3-浸提液稍低(0.58).虽然不同浓度离子浸提液中UV253/UV220仍存在高浓度受抑制的现象, 但差别并不大(图 4).这些结果说明不同种类、不同浓度的离子浸提液对WSOM的UV253/UV220提取效果差别不大, 即离子条件变化对WSOM芳环取代基的影响较小.
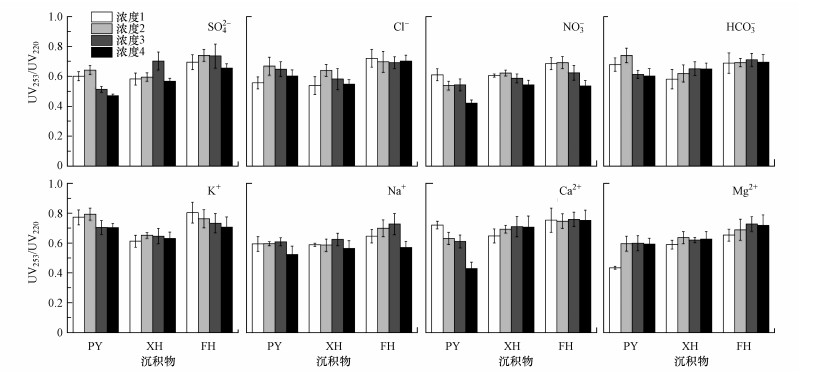 |
| 图 4 不同离子条件下沉积物中可提取WSOM的吸光度比值(UV253/UV220) (化学离子浓度变化同图 1) Fig. 4 Absorption ratio (i.e UV253/UV220) of WSOM from sediments in different ion conditions |
DOM的SR值与其分子量通常呈反比, 即SR值越高, 分子量越低(Xiao et al., 2013).当DOM分子量较低时, 意味着DOM多为新近产生或DOM以外源输入为主, 光漂白作用较强(Fichotc et al., 2012).不同离子条件下沉积物的SR值分别为0.63~0.95(PY)、0.81~2.56(XH)、0.25~0.92(FH), 均值分别为0.75、1.14、0.80.这表明XH沉积物中WSOM分子量较小, 且主要为新近产生的外源输入DOM.相关性分析结果表明, SR值与UV250/UV365呈显著正相关(r=0.577, p < 0.01), 这说明SR值和UV250/UV365在表征分子量情况上具有一致性.不同种类离子浸提液中WSOM的SR均值仍以K+浸提液最高(1.20)、Mg2+浸提液最低(0.76), 具体排序为HCO3->SO42->Cl->NO3-(阴离子)、K+>Ca2+>Na+>Mg2+(阳离子).该结果说明WSOM在HCO3-、K+浸提液中的分子量较小, 在NO3-、Mg2+浸提液中相反.不同浓度离子浸提液中WSOM的SR值变化趋势如图 5所示.除K+浸提液外, 其他种类离子浸提液中WSOM的SR值随浓度的变化并不大, 但仍存在高浓度受抑制的现象, 该结果与UV250/UV365相似, 即高浓度离子条件下, 范德华力增强导致分子絮凝, WSOM的分子量较大.
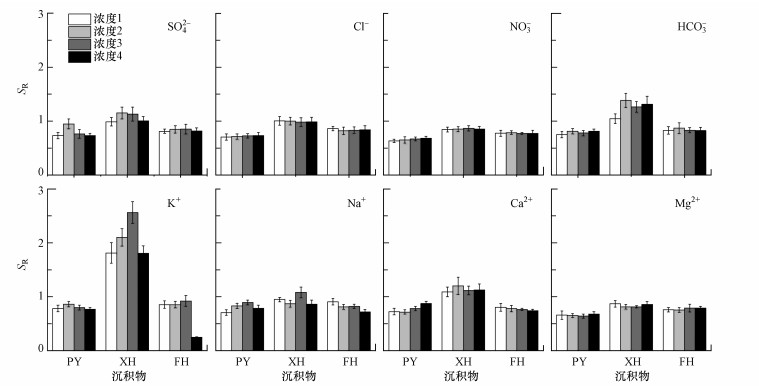 |
| 图 5 不同离子条件下沉积物、土壤、灰尘中可提取WSOM的SR值 (化学离子浓度变化同图 1) Fig. 5 SR values of WSOM from sediments, soil and dust in different ion conditions |
PARAFAC分析结果得到4种荧光组分C1~C4(图 6).为了了解PARAFAC组分的具体物质, 利用在线OpenFluor数据库分析其物质组成, 结果如表 5所示.该模型中利用Tucker收敛系数(Tucker convergence coefficient, TCC)对λEx和/或λEm进行拟合判定, 并与数据库中的已有模型进行比较, 从而判定荧光组分的具体物质(Murphy et al., 2014).该方法相较于传统方法(仅利用荧光团峰值位置与文献对比的方法)具有准确度和可信度高的优势, 现已成为PARAFAC组分物质判别的主流方法(Yan et al., 2018).通过与模型对比, C1和C4在数据库中的TCC值较高, 且TCCEx & Em>0.9的模型数远多于C2和C3, 说明C1和C4为环境介质中较常见的荧光组分.其中, C1为可见腐殖酸, 与富营养水体中DOM的荧光团相似(Murphy et al., 2011).C4为微生物源类腐殖质(Bingfa et al., 2018), 与首次在海水中发现的类腐殖质荧光团相似(Coble, 1996).C2和C3在数据库中没有TCCEx&Em大于0.9的模型, 仅TCCEx或TCCEm满足大于0.9的条件, 均为土壤富里酸(Søndergaard et al., 2003; Wünsch et al., 2017).
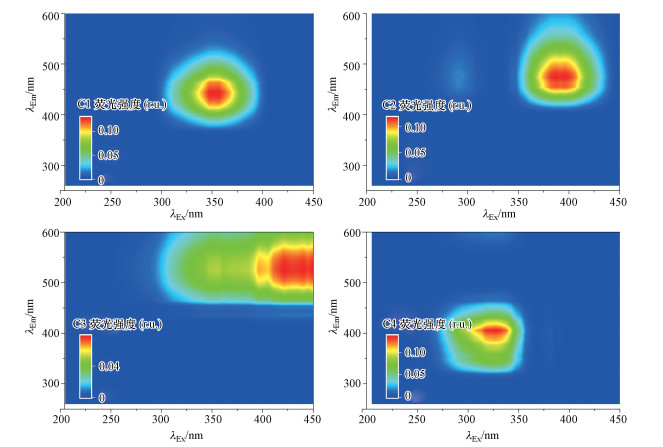 |
| 图 6 不同离子条件下XH中可提取WSOM的平行因子组分3D-EEM Fig. 6 3D-EEM of PARAFAC components from XH sample in different ion conditions |
| 表 5 OPENFluor数据库中PARAFAC组分的最大TCC值 Table 5 The max value of TCC for the PARAFAC components between the present study and in the OpenFluor database |
不同离子条件下XH样品的4种荧光物质浓度分布特征如图 7所示.除NO3-和Ca2+浸提液外, 其他种类离子浸提液中WSOM的4种荧光组分浓度分布均为C1>C2>C3>C4.不同种类离子浸提液中, C1和C2组分以SO42-、K+浸提液荧光强度较高, 而C3和C4组分以NO3-、K+浸提液荧光强度较高;4种荧光组分的荧光强度最低值均出现在Ca2+浸提液.这说明不同种类离子浸提液中沉积物释放WSOM的荧光能力差异较大.因此, 在自然环境中, 水体化学离子的差异能够影响其解析沉积物中WSOM荧光物质的能力, 进而可影响到水环境中污染物的迁移转化.不同浓度离子浸提液对WSOM荧光强度的影响随离子浓度增加呈下降趋势, 这与海洋水体中DOM的荧光强度随盐度增加呈下降趋势一致(Guo et al., 2011), 但二者成因不同.海水中DOM随盐度变化与海洋中DOM主要来源于陆源河流有关.而不同离子条件下, 由于大粒径胶体的荧光强度较小(Yan et al., 2018), 当浸提液离子浓度较高时, 小粒径胶体发生絮凝碰撞, 比表面积减小, 表面官能团相应发生改变, 从而造成荧光强度的下降.
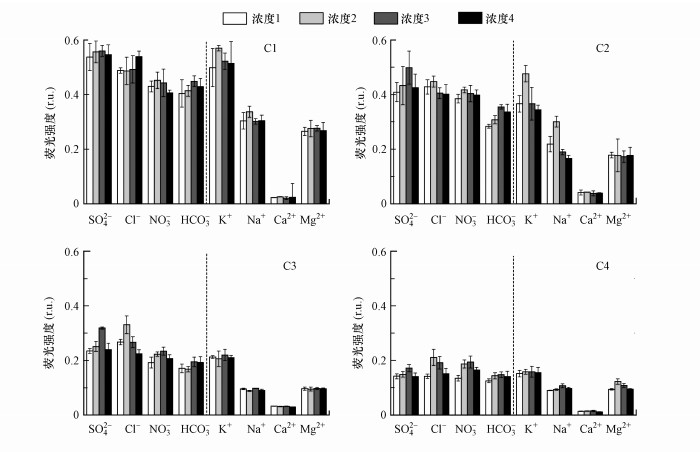 |
| 图 7 不同离子条件下XH中可提取WSOM的PARAFAC组分荧光强度 (化学离子浓度变化同图 1) Fig. 7 Fluorescence intensity of PARAFAC components from XH sample in different ion conditions |
Fn(280)及Fn(355)代表的WSOM中类蛋白物质及类腐殖物质浓度可表征浸提液中自生源及陆源来源DOM的解析情况, 结果如图 8所示.XH样品的Fn(280)及Fn(355)分别为0.006~0.077、0.046~0.828 r.u., 可以看出, Fn(280)比Fn(355)低得多(低一个数量级), 这与PARAFAC结果中未发现类蛋白荧光团的结果一致.不同种类离子浸提液中, Fn(280)以HCO3-、K+浸提液较高, Fn(355)以SO42-、K+浸提液较高, 且都以Ca2+浸提液最低, 这一结果与PARAFAC结果亦一致.以上结果说明, 浸提液离子种类对WSOM荧光物质解析的影响受样品来源本身的限制, 即类蛋白物质与类腐殖质的相对浓度基本不变, 但可改变二者的绝对浓度.不同浓度离子浸提液对WSOM类蛋白物质及类腐殖物质浓度的影响亦随离子浓度增加呈下降趋势, 这一规律与其他光谱参数一致.
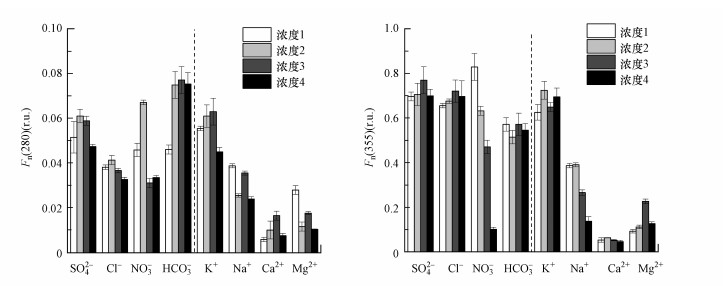 |
| 图 8 不同离子条件下XH中可提取WSOM的类蛋白(Fn(280))和类腐殖(Fn(355))物质浓度 (化学离子浓度变化同图 1) Fig. 8 Fn(280) and Fn(355) values from XH sample in different ion conditions |
1) 紫外-可见光谱分析表明:①不同种类离子浸提液中沉积物的WSOM以SO42-及K+浸提液中的DOC含量较高, 有机碳的芳香度高, HCO3-及Mg2+浸提液相反;以Cl-及K+浸提液中的CDOM丰度高, HCO3-及Mg2+浸提液相反;以NO3-、Na+浸提液中的富里酸含量较高、分子量较小, HCO3-、Ca2+浸提液相反.②随离子浓度增加, 浸提液中沉积物WSOM的DOC含量及有机碳芳香度、CDOM丰度呈先增后减的趋势, 同时, 大颗粒WSOM比例逐渐增加, 但芳环取代基变化不大.③相关分析表明, 当浸提液中的WSOM分子量较小时, 其CDOM丰度越高、芳香性越高、有机碳中不饱和键越多、富里酸比例越高、芳环中羰基、羧基、酯类等取代基越多.
2) 三维荧光光谱分析表明:①利用PARAFAC解析出浸提液中XH沉积物共有4种荧光组分(C1~C4), 分析其物质组成分别为:C1为可见腐殖酸, C2和C3均为土壤富里酸, C4为微生物源类腐殖质, 其中以C1和C2浓度较高.②不同种类离子浸提液中WSOM以SO42-、K+浸提液荧光强度较高, Ca2+浸提液较低.③随离子浓度增加,WSOM的荧光强度、类蛋白物质及类腐殖物质浓度均表现为高浓度受抑制的现象, 这与紫外-可见光谱分析结果一致.
Akagi J, Zsolnay Á, Bastida F. 2007. Quantity and spectroscopic properties of soil dissolved organic matter (DOM) as a function of soil sample treatments: Air-drying and pre-incubation[J]. Chemosphere, 69(7): 1040–1046.
DOI:10.1016/j.chemosphere.2007.04.036
|
Bingfa C, Wei H, Shuzhan M, et al. 2018. Characterization of chromophoric dissolved organic matter in the littoral zones of eutrophic lakes Taihu and Hongze during the algal bloom season[J]. Water, 10(7): 861.
DOI:10.3390/w10070861
|
Bricaud A, Morel A, Prieur L. 1981. Absorption by dissolved organic matter of the sea (Yellow substance) in the UV and visible domains[J]. Limnology and Oceanography, 26(1): 43–53.
DOI:10.4319/lo.1981.26.1.0043
|
Chantigny M H. 2003. Dissolved and water-extractable organic matter in soils:a review on the influence of land use and management practices[J]. Geoderma, 113(3/4): 357–380.
|
Coble P G, Del Castillo C E, Avril B. 1998. Distribution and optical properties of CDOM in the Arabian Sea during the 1995 Southwest Monsoon[J]. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 45(10/11): 2195–2223.
|
Coble P G. 1996. Characterization of marine and terrestrial DOM in seawater using excitation-emission matrix spectroscopy[J]. Marine Chemistry, 51: 325–346.
DOI:10.1016/0304-4203(95)00062-3
|
Dadi T, Völkner C, Koschorreck M. 2015. A sediment core incubation method to measure the flux of dissolved organic carbon between sediment and water[J]. Journal of Soils & Sediments, 15(12): 2350–2358.
|
Fichotc G, Benne R R. 2012. The spectral slope coefficient of chromophoric dissolved organic matter (S275~295) as a tracer of terrigenous dissolved organic carbon in river-influenced ocean margins[J]. Limnology and Oceanography, 57(5): 1453–1466.
DOI:10.4319/lo.2012.57.5.1453
|
Gabor R S, Burns M A, Lee R H, et al. 2015. Influence of leaching solution and catchment location on the fluorescence of water-soluble organic matter[J]. Environmental Science & Technology, 49(7): 4425–4432.
|
高洁, 江韬, 李璐璐, 等. 2015. 三峡库区消落带土壤中溶解性有机质(DOM)吸收及荧光光谱特征[J]. 环境科学, 2015, 36(1): 151–162.
DOI:10.3969/j.issn.1673-288X.2015.01.042 |
Granskog M A, Macdonald R W, Mundy C J, et al. 2007. Distribution, characteristics and potential impacts of chromophoric dissolved organic matter (CDOM) in Hudson Strait and Hudson Bay, Canada[J]. Continental Shelf Research, 27(15): 2032–2050.
DOI:10.1016/j.csr.2007.05.001
|
Guéguen C, Granskog M A, McCullough G, et al. 2011. Characterization of colored dissolved organic matter in Hudson Bay and Hudson Strait using parallel factor analysis[J]. Journal of Marine Systems, 88(3): 423–433.
DOI:10.1016/j.jmarsys.2010.12.001
|
Guo W, Yang L, Hong H, et al. 2011. Assessing the dynamics of chromophoric dissolved organic matter in a subtropical estuary using parallel factor analysis[J]. Marine Chemistry, 124(1/4): 125–133.
|
Helms J R, Stubbins A, Ritchie J D, et al. 2008. Absorption spectral slopes and slope ratios as indicators of molecular weight, source, and photobleaching of chromophoric dissolved organic matter[J]. Limnology and Oceanography, 53(3): 955–969.
DOI:10.4319/lo.2008.53.3.0955
|
胡春华, 周文斌, 夏思奇. 2011. 鄱阳湖流域水化学主离子特征及其来源分析[J]. 环境化学, 2011, 30(9): 1620–1626.
|
Judd K E, Crump B C, Kling G W. 2006. Variation in dissolved organic matter controls bacterial production and community composition[J]. Ecology, 87(8): 2068–2079.
DOI:10.1890/0012-9658(2006)87[2068:VIDOMC]2.0.CO;2
|
Lawaetz A J, Stedmon C A. 2009. Fluorescence intensity calibration using the Raman scatter peak of water[J]. Applied Spectroscopy, 63(8): 936–940.
DOI:10.1366/000370209788964548
|
李丹, 何小松, 高如泰, 等. 2016. 紫外-可见光谱研究堆肥水溶性有机物不同组分演化特征[J]. 中国环境科学, 2016, 36(11): 3412–3421.
DOI:10.3969/j.issn.1000-6923.2016.11.027 |
刘堰杨, 秦纪洪, 刘琛, 等. 2018a. 基于三维荧光及平行因子分析的川西高原河流水体CDOM特征[J]. 环境科学, 2018a, 39(2): 720–728.
|
刘堰杨, 秦纪洪, 孙辉. 2018b. 川西高海拔河流中溶解性有机质(DOM)紫外-可见光吸收光谱特征[J]. 环境科学学报, 2018b, 38(9): 3662–3671.
|
Meyers P A, Teranes J L.2002.Sediment Organic Matter//Tracking Environmental Change Using Lake Sediments[M].Dordrecht: Springer.239-269
|
Minero C, Lauri V, Falletti G, et al. 2007. Spectrophotometric characterisation of surface lakewater samples:Implications for the quantification of nitrate and the properties of dissolved organic matter[J]. Annali Di Chimica:Journal of Analytical, Environmental and Cultural Heritage Chemistry, 97(10): 1107–1116.
|
Murphy D V, Macdonald A J, Stockdale E A, et al. 2000. Soluble organic nitrogen in agricultural soils[J]. Biology and Fertility of Soils, 30(5/6): 374–387.
|
Murphy K R, Hambly A, Singh S, et al. 2011. Organic matter fluorescence in municipal water recycling schemes:toward a unified PARAFAC model[J]. Environmental Science & Technology, 45(7): 2909–2916.
|
Murphy K R, Stedmon C A, Wenig P, et al. 2014. OpenFluor-an online spectral library of auto-fluorescence by organic compounds in the environment[J]. Analytical Methods, 6(3): 658–661.
DOI:10.1039/C3AY41935E
|
Nishijima W, Gerald E, Speitle J. 2004. Fate of biodegradable dissolved organic carbon produced by ozonation on biological activated carbon[J]. Chemosphere, 56(2): 113–119.
DOI:10.1016/j.chemosphere.2004.03.009
|
聂明华, 刘慧慧, 熊小英, 等. 2018. 南昌市湖泊水体中不同粒径胶体的三维荧光光谱特征研究[J]. 环境科学学报, 2018, 38(5): 1929–1938.
|
Perdue E M, Ritchie J D. 2003. Dissolved organic matter in freshwaters[J]. Treatise on Geochemistry, 5: 605.
|
Peuravuori J, Pihlaja K. 1997. Isolation and characterization of natural organic matter from lake water:comparison of isolation with solid adsorption and tangential membrane filtration[J]. Environment International, 23(4): 441–451.
DOI:10.1016/S0160-4120(97)00049-4
|
Provenzano M R, Caricasole P, Brunetti G, et al. 2010. Dissolved organic matter extracted with water and a saline solution from different soil profiles[J]. Soil Science, 175(6): 255–262.
DOI:10.1097/SS.0b013e3181e457a6
|
Qualls R G, Haines B L. 1992. Biodegradability of dissolved organic matter in forest throughfall, soil solution, and stream water[J]. Soil Science Society of America Journal, 56(2): 578–586.
DOI:10.2136/sssaj1992.03615995005600020038x
|
Ritvo G, Dassa O, Kochba M. 2003. Salinity and pH effect on the colloidal properties of suspended particles in super intensive aquaculture systems[J]. Aquaculture, 218(1/4): 379–386.
|
SanClements M D, Oelsner G P, McKnight D M, et al. 2012. New insights into the source of decadal increases of dissolved organic matter in acid-sensitive lakes of the Northeastern United States[J]. Environmental Science & Technology, 46(6): 3212–3219.
|
Søndergaard M, Stedmon C A, Borch N H. 2003. Fate of terrigenous dissolved organic matter (DOM) in estuaries:Aggregation and bioavailability[J]. Ophelia, 57(3): 161–176.
DOI:10.1080/00785236.2003.10409512
|
Stedmon C A, Bro R. 2008. Characterizing dissolved organic matter fluorescence with parallel factor analysis:a tutorial[J]. Limnology and Oceanography:Methods, 6(11): 572–579.
DOI:10.4319/lom.2008.6.572
|
王茜, 薛爽, 刘影, 等. 2016. 融雪对土壤溶解性有机质溶析作用的影响[J]. 环境科学学报, 2016, 36(12): 4461–4471.
|
Wunsch U J, Murphy K R, Stedmon C A. 2017. The one-sample PARAFAC approach reveals molecular size distributions of fluorescent components in dissolved organic matter[J]. Environmental Science & Technology, 51(20): 11900–11908.
|
Xiao Y H, Sara-Aho T, Hartikainen H, et al. 2013. Contribution of ferric iron to light absorption by chromophoric dissolved organic matter[J]. Limnology and Oceanography, 58(2): 653–662.
DOI:10.4319/lo.2013.58.2.0653
|
谢理, 杨浩, 渠晓霞, 等. 2013. 滇池典型陆生和水生植物溶解性有机质组分的光谱分析[J]. 环境科学研究, 2013, 26(1): 72–79.
|
Yan C, Liu H, Sheng Y, et al. 2018. Fluorescence characterization of fractionated dissolved organic matter in the five tributaries of Poyang Lake, China[J]. Science of the Total Environment, 637: 1311–1320.
|
Zepp R G, Sheldon W M, Moran M A. 2004. Dissolved organic fluorophores in southeastern US coastal waters:correction method for eliminating Rayleigh and Raman scattering peaks in excitation-emission matrices[J]. Marine Chemistry, 89(1/4): 15–36.
|
翟大兴, 杨忠芳, 柳青青, 等. 2012. 鄱阳湖流域水化学特征及影响因素分析[J]. 地学前缘, 2012, 19(1): 264–276.
|
张菊, 邓焕广, 王东启, 等. 2011. 上海郊区小城镇街道灰尘理化性质及重金属时空分布特征[J]. 长江流域资源与环境, 2011, 20(6): 705–710.
|
Zhang J, Hua P, Krebs P. 2016. The influences of dissolved organic matter and surfactant on the desorption of Cu and Zn from road-deposited sediment[J]. Chemosphere, 150: 63–70.
DOI:10.1016/j.chemosphere.2016.02.015
|
Zhang Y, Liu M, Qin B, et al. 2009. Photochemical degradation of chromophoric-dissolved organic matter exposed to simulated UV-B and natural solar radiation[J]. Hydrobiologia, 627(1): 159–168.
DOI:10.1007/s10750-009-9722-z
|
Zhang Y, Yin Y, Feng L, et al. 2011. Characterizing chromophoric dissolved organic matter in Lake Tianmuhu and its catchment basin using excitation-emission matrix fluorescence and parallel factor analysis[J]. Water Research, 45(16): 5110–5122.
DOI:10.1016/j.watres.2011.07.014
|
赵劲松, 张旭东, 袁星, 等. 2003. 土壤溶解性有机质的特性与环境意义[J]. 应用生态学报, 2003, 14(1): 126–130.
DOI:10.3321/j.issn:1001-9332.2003.01.028 |
Zhou Y, Yao X, Zhang Y, et al. 2018. Response of dissolved organic matter optical properties to net inflow runoff in a large fluvial plain lake and the connecting channels[J]. Science of the Total Environment, 639: 876–887.
DOI:10.1016/j.scitotenv.2018.05.180
|
朱伟健, 沈芳, 洪官林. 2010. 长江口及邻近海域有色溶解有机物(CDOM)的光学特性[J]. 环境科学, 2010, 31(10): 2292–2298.
|
 2019, Vol. 39
2019, Vol. 39


