2. 绍兴市环境监测中心站, 绍兴 312000
2. Shaoxing Environmental Monitoring Center, Shaoxing 312000
挥发性有机化合物(Volatile organic compounds, VOCs)是引起大气污染的主要原因之一, 对人类和环境具有较大的危害(Li et al., 2014).氯苯是一种常见的VOCs, 常被用作染料、有机溶剂(任志远等, 2013)及医药工业有机合成中间体(Zhu et al., 2015).研究发现, 氯苯毒性大、稳定性高、疏水性强(Jiang et al., 2017), 使用时极易挥发到空气中(Field et al., 2008), 其大量使用往往会带来持久性、全球性的污染, 甚至在非常低的浓度下也会导致环境问题(Tang et al., 2013).同时, 氯苯具有“三致”作用(陈东之等, 2015), 进入人体后会产生积蓄作用, 轻则导致头晕和神经衰弱, 重则造成肝脏、胰脏和肾脏的损害, 长期接触还会大大增加患癌症的几率(Zhang et al., 2007).
目前对于氯苯废气的处理主要采用生物法, 其原理是基于微生物代谢机理对有机废气进行净化(Zhang et al., 2011), 具有操作简单、无二次污染、处理能力大、成本低及效果好等优点(Lhotsky et al., 2017;Cheng et al., 2017;Sun et al., 2017;聂国锋等, 2017).然而, 氯苯作为一种疏水性VOCs, 从气相转移到水相的传质阻力大、传质速率低, 使用传统生物法的处理效果并不好(Raul et al., 2007).
研究发现, 通过使用两相分配体系可以提高疏水性废气的生物可利用性, 从而实现VOCs的快速转化降解(徐百龙等, 2014).Munro等(1997)提出了液/液两相分配技术, 并设计了两相分配生物反应器(Two-phase partitioning bioreactor, TPPB), 即加入非水相介质(Non-aqueous phase, NAP)以克服从气相到液相的传质限制.因此, 利用两相分配技术净化氯苯废气具有一定的可行性, 但迄今还未见相关文献报道.
硅油是两相分配体系中最常见的NAP, 但存在易发泡、难回收、成本高等缺点, 因而限制了其规模化应用(Águila-Hernández et al., 2007;Muñoz et al., 2007;Tomei et al., 2008;Rocharios et al., 2009).Morrish(2008)等和Daugulis等(2011)提出了固/液两相体系, 以固态多聚物作为NAP来加快疏水性污染物的传质过程.Ye等(2018)利用固/液两相搅拌罐对疏水性二氯甲烷进行净化, 发现通过添加硅胶作为固态非水相介质(Solid non-aqueous phase, SNAP), 可以将反应关键步骤从生物过程转化为传质过程.目前所用的SNAP多为高分子聚合物, 价格通常比较昂贵, 且容易在反应器运行过程中沉积在底部, 从而限制了反应器内的液相循环.
硅酮母粒作为一种新型材料, 密度略低于水, 且价格低廉.因此, 本文首次以硅酮母粒作为SNAP强化氯苯处理, 考察其分配系数, 研究其生物毒性和可生物降解性, 并以气升式两相分配生物反应器处理氯苯废气, 考察硅酮母粒的强化效果.
2 材料与方法(Materials and methods) 2.1 菌株来源及培养基组成实验菌株为本实验室筛选的可以氯苯为唯一碳源生长的高效降解菌—Delftia tsuruhatensis LW26.
无机盐培养基:4.5 g·L-1 Na2HPO4·12H2O、2.5 g·L-1 (NH4)2SO4、1.0 g·L-1 KH2PO4、0.2 g·L-1 MgSO4·7H2O、0.023 g·L-1 CaCl2、1 mL·L-1微量元素母液;溶剂为水, pH=7.0~7.5, 110 ℃下灭菌40 min.
微量元素母液:1.0 g·L-1 FeSO4、0.10 g·L-1 MnSO4、0.10 g·L-1 ZnSO4、0.02 g·L-1 CoSO4·6H2O、0.02 g·L-1 Na2MoO4·2H2O、0.014 g·L-1 H3BO3.
2.2 实验装置本实验选用汇和堂生物工程有限公司(上海)制造的内循环气升式反应器, 用以分别构建单相和两相分配体系.实验装置流程图如图 1所示, 反应器总体积为5 L, 工作体积为4.5 L;罐体高度为0.43 m, 罐体内径为0.12 m, 导流筒内径为0.06 m.
 |
| 图 1 内循环气升式反应器装置图 (1.空气泵, 2.质量流量计, 3, 4.转子流量计, 5.气体混合瓶, 6.底物吹脱瓶, 7.微孔曝气头, 8.导流筒, 9.出气口, 10.控制装置开关, 11.冷凝水控制装置, 12.碱液, 13.蠕动泵, 14.控制显示屏) Fig. 1 Setup diagram of the internal circulating airlift bioreactor |
分配系数的测定参考Montes等(2011)的方法.氯苯在气相/SNAP及水相/SNAP中的分配系数均在250 mL厌氧瓶中进行测定, 设置3组平行试验.具体操作为:在厌氧瓶中加入5 mL硅酮母粒, 并分别添加1、5、10、15、20、25 μL的氯苯, 聚四氟乙烯塞密封瓶口后于摇床中振荡3 h, 通过气相色谱测定气相中的氯苯浓度, 再根据质量平衡计算硅酮母粒中的氯苯浓度, 所得曲线的斜率即为氯苯在气相/SNAP的分配系数.氯苯在水相/SNAP中的分配系数测定与此类似, 在厌氧瓶中加满无机盐培养基和5 mL硅酮母粒, 分别加入1、5、10、15、20、25 μL的氯苯后, 用聚四氟乙烯塞密封瓶口, 并通过磁力搅拌器搅拌3 h使之完全混匀, 再将厌氧瓶静置3 h, 通过液相色谱测定水相中的氯苯浓度, 再依据质量平衡计算硅酮母粒相中的氯苯浓度, 所得曲线的斜率即为氯苯在水相/SNAP的分配系数.按照实验结果可以分别得到氯苯在气相/SNAP和水相/SNAP间的分配系数, 进而得到氯苯在气相/水相/SNAP三相间的分配系数.
2.3.2 生物毒性和可生物降解性取250 mL厌氧瓶若干并分成4组, 分别设置空白组、以10 mL硅酮母粒为碳源组、以5 μL氯苯为碳源组和以10 mL硅酮母粒+5 μL氯苯为碳源组, 再加入一定量的无机盐培养基和1 mL培养至对数期的LW26菌液(OD600为0.1), 使液相总体积为50 mL, 聚四氟乙烯塞密封瓶口后于振荡培养箱中振荡48 h, 期间检测瓶中CO2的变化.
2.3.3 单相和两相分配气升式生物反应器实验两个反应器均在氯苯进气浓度1000 mg·m-3、停留时间90 s、pH=7.5、温度30 ℃的条件下进行, 模拟氯苯废气从反应器底部进入, 由塔顶排出.首先利用反应器进行LW26菌的扩大培养;当反应器达到稳定去除后, 向其中一反应器中加入10%(V/V)的硅酮母粒, 另一反应器不含硅酮母粒并作为对照.反应器采用连续式运行, 每天测定进、出气口的氯苯浓度及实验所需的参数.反应器每天更换500 mL营养液.
去除率(Removal efficiency, RE)、进气负荷(Inlet loading, IL)、去除负荷(Effective capacity, EC)和空床停留时间(Empty bed residence time, EBRT)的计算方法分别如下:

|
(1) |
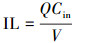
|
(2) |

|
(3) |
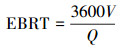
|
(4) |
式中, Q为进气流量(m3·h-1);Cin为进气氯苯浓度(mg·m-3);Cout为出气氯苯浓度(mg·m-3);V为反应器的实际工作体积(m3).
2.3.4 不同硅酮母粒比例的影响在进气负荷0~400 g·m-3·h-1、pH=7.5、温度30 ℃、空床停留时间90 s的条件下, 改变硅酮母粒体积比(0、5%、10%、15%), 考察其对气升式反应器去除氯苯效果的影响.
2.3.5 不同空床停留时间的影响在进气负荷0~400 g·m-3·h-1、pH=7.5、温度30 ℃、硅酮母粒比例10%的条件下, 改变空床停留时间(30、60、90和120 s), 考察其对气升式反应器去除氯苯效果的影响.
2.3.6 平均分配系数Dumont等(2008)曾提出平均分配系数的概念, 即两相体系在平衡条件下, 平均分配系数(Kmixture)可以用气相/水相分配系数(Kwater)、气相/SNAP分配系数(KSNAP)和非水相比例(φSNAP)表示, 具体计算如公式(5)所示.
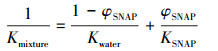
|
(5) |
在未接菌的单相和两相分配反应器内测定氯苯的传质系数(Hernández et al., 2011).设定氯苯废气的浓度为1000 mg·m3, 停留时间分别为30、60和90 s.每次更改停留时间都需要更换液相和固相, 以确保反应器中没有残留的氯苯.在反应器运行的过程中定时检测进、出口的氯苯浓度, 直至氯苯在液相和固相中均达到饱和, 即进出口氯苯浓度比趋向于0.99.根据公式(6)绘制ln(1-Cout/Ci n)和t的线性关系, 即可得到氯苯由气相至液相或固/液伪均相的最大传质分数βs*(无量纲).
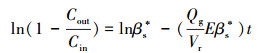
|
(6) |
式中, Cin和Cout分别表示进气和出气氯苯浓度(g·m-3);Qg为气体流速(m3·s-1);Vr为反应器的总体积(m3);E则为无量纲参数.
2.4 分析方法 2.4.1 氯苯浓度检测采用气相色谱仪(Agilent 6890, 美国)定量分析气相中的氯苯浓度.色谱柱为HP-Innowax型毛细管柱(30 m×0.32 mm×0.5 μm), FID检测器, 汽化室、检测器温度分别为200 ℃和180 ℃, 柱温为100 ℃.载气为氮气, 柱流量为1 mL·min-1, 分流比为30:1, 进样量为800 μL.
采用液相色谱仪(Agilent Technologies 1200 Series, 美国)定量分析水相中的氯苯浓度.色谱柱为Eclipse XDB-C18反相柱(4.6 mm×150 mm×5 μm), 紫外检测器, 检测波长为200 nm, 柱温为25 ℃.流动相为体积比7:3的甲醇/水混合溶液, 流速为1.5 mL·min-1, 进样量为20 μL.
2.4.2 二氧化碳浓度检测采用气相色谱仪(Agilent 6890, 美国)定量分析气相中的CO2浓度.色谱柱为HP-Plot-Q型毛细管柱(30 m×0.32 mm×20 μm), TCD检测器.进样口、检测器温度分别为90 ℃和180 ℃, 柱温为40 ℃.载气为N2, 总流量为107 mL·min-1, 分流比为50:1, 气体进样量为800 μL.
2.4.3 菌体浓度检测采用紫外/可见分光光度计(Hitachi High Technologies, 日本)在600 nm的波长下测定菌体的吸光度(OD600), 并且根据OD600与生物量干重间的标准曲线计算出菌体细胞干重.本文中测定菌体与细胞干重(mg·L-1)间的曲线为:Y=910X-2.8, R2=0.974.
硅酮母粒表面吸附菌体检测方法:将丙酮、乙醇、三氯甲烷按10:10:2的体积比制备溶液, 取与硅酮母粒等体积的溶液进行混合, 充分振荡15 min后离心, 将底层分离出的菌体用无机盐溶液多次冲洗, 然后将细胞超声破碎并通过考马斯亮蓝法测定蛋白量, 计算相应生物量.
3 结果与讨论(Results and discussion) 3.1 硅酮母粒的分配系数利用固/液两相分配体系净化氯苯废气时, SNAP的选择尤为重要, 其分配系数越小表明氯苯在该SNAP中的溶解性能越好.根据测得的分配系数(表 1)可以看出, 两相分配体系中氯苯在硅酮母粒相、液相和气相间的浓度比为167.71:3.87:1, 可见硅酮母粒对于氯苯具有较高的亲和力, 可以作为合适的SNAP.
| 表 1 氯苯在气相和硅酮母粒相、液相间的分配系数 Table 1 Partition coefficients of chlorobenzene in three phases |
根据公式(5)绘制出硅酮母粒比例与平均分配系数之间的关系图(图 2).当硅酮母粒比例为0时, 平均分配系数值为0.26.随着硅酮母粒比例的增加, 平均分配系数大幅降低, 说明硅酮母粒比例的增加能明显增强其吸收氯苯的能力.然而, 当硅酮母粒比例超过20%时, 平均分配系数减小的趋势变得不明显.
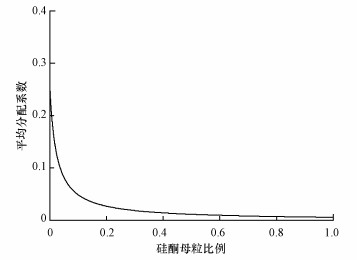 |
| 图 2 硅酮母粒比例与平均分配系数之间的关系 Fig. 2 The relationship between equivalent partition coefficient and the volume fraction of silicone masterbatch |
不具有生物毒性和可生物降解性是硅酮母粒能够用作SNAP的必备条件.根据实验结果绘制CO2产量变化图(图 3), 结果显示, 以10 mL硅酮母粒为碳源组连续培养48 h后, 摇瓶中的CO2产量仅为0.4 mg, 与不添加硅酮母粒的空白对照组基本一致, 且硅酮母粒前后质量不变(数据略), 说明硅酮母粒不能被生物降解.在以5 μL氯苯及5 μL氯苯+10 mL硅酮母粒为碳源连续培养48 h的情况下, 氯苯均被微生物完全降解, 且两者的CO2变化趋势和产量相近, 均可达到10 mg以上, 说明硅酮母粒对微生物没有毒性.综上, D.tsuruhatensis LW26对硅酮母粒没有降解效果, 且硅酮母粒不会影响菌株LW26的活性, 可满足两相分配体系对SNAP的基本要求.
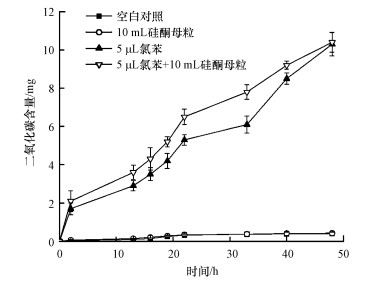 |
| 图 3 硅酮母粒或氯苯作为碳源后CO2变化情况 Fig. 3 Changes of CO2 over time with silicone masterbatch or chlorobenzene as carbon source in the nutrient solution |
硅酮母粒对于氯苯的高亲和力是其作为两相分配体系中SNAP不可或缺的条件.由于微生物降解反应往往发生在水相或两相界面, 因此, 硅酮母粒表面会粘附菌体, 可能减少其与氯苯的接触面积.为了考察硅酮母粒表面菌体吸附对氯苯吸收的影响, 表 2列出了硅酮母粒在不同菌液条件下的菌体吸附量和分配系数.随着菌液浓度的升高, 菌体吸附量缓慢上升, 但表面菌体吸附对硅酮母粒的分配系数影响很小, 不会影响硅酮母粒本身对于氯苯的吸收.
| 表 2 不同OD600下硅酮母粒的菌体吸附量和相应分配系数 Table 2 Cell adsorption capacity and partition coefficient under various OD600 |
为了获得足够的生物量, 实验中两个反应器均在单相条件下运行了6 d.从图 4可以看出, 两者能较快完成启动且去除性能接近, 启动期后期OD600和氯苯去除率分别在0.9和60%左右.第7 d向其中一反应器加入10%(V/V)的硅酮母粒, 发现次日该反应器的氯苯去除率提高到80%, 并且后续能达到90%的去除率, 而未添加硅酮母粒的单相反应器的氯苯去除率仍稳定在60%, 说明两相体系对氯苯的去除效果优于单相体系.在反应器的稳定运行阶段定期取适量硅酮母粒对其分配系数进行测定, 发现与0.0059相差不大, 说明在实际运行过程中菌体的吸附不会影响硅酮母粒的分配比.
 |
| 图 4 反应器运行性能曲线 Fig. 4 Operating performance of these two airlift bioreactors |
为了考察单相和两相体系中氯苯浓度对于去除性能的影响, 将两个反应器中的氯苯进气浓度从1000 mg·m-3缓慢提升至9000 mg·m-3, 结果发现, 单相和两相分配反应器的去除性能均随进气浓度的升高而下降, 且两相分配反应器的净化能力始终更为优越.在进气浓度较低的情况下, 反应器性能主要受传质的限制, 硅酮母粒的加入提高了氯苯的传递速率;随着进气浓度的提高, 氯苯的传质速率加快, 微生物对氯苯的降解速率就成为整个反应的限速步骤.浓度梯度实验过后, 将进气浓度调回1000 mg·m-3, 发现两个反应器均能恢复到原先的降解效率, 说明高浓度氯苯没有对菌体造成严重毒害.
目前尚未见关于两相分配反应器去除氯苯废气的研究报道.王灿等(2008)以竹子为填料构建生物过滤塔, 发现在氯苯进气浓度为200~1500 mg·m-3、停留时间为122 s的条件下, 反应器可以达到80%的最高去除效率及50%的平均去除效率.Jiang等(2016)将低温等离子体和生物滴滤塔结合, 发现反应器在氯苯进气负荷为179.4 g·m-3·h-1时可达到最大去除负荷85.2 g·m-3·h-1.本文中的两相分配气升式生物反应器能在进气负荷为1000 mg·m-3时维持近90%的去除率, 并且能在进气负荷为407.5 g·m-3·h-1时达到最大去除负荷199.0 g·m-3·h-1.与文献记载的生物反应器相比, 本研究的反应器对氯苯的去除负荷具有一定的优势.
3.5 单相和两相分配反应器中的CO2矿化率在反应器的运行过程中, 氯苯一方面会在菌体的作用下被降解成CO2和水, 另一方面也会作为碳源供菌体自身的物质合成.因此, CO2矿化率也是评估生物反应器性能的一个重要依据.理论CO2产量与氯苯总去除负荷的关系可表示为Y=2.347X.由图 5可知, 将单相和两相分配反应器中的CO2产量与去除负荷进行线性回归拟合, 其表达式分别为Y=1.315X(单相)和Y=1.414X(两相), 即单相反应器和两相分配反应器对于氯苯的矿化率分别为56%和60%.两相分配反应器的矿化率较高, 可能是因为硅酮母粒的存在缓冲了液相中的氯苯浓度, 从而保证了菌体更少地受到高浓度底物的影响, 维持其降解矿化的能力.
 |
| 图 5 单相(a)和两相(b)气升式反应器二氧化碳产量随氯苯去除负荷的变化 Fig. 5 Relationship between CO2 production and chlorobenzene removal loading in single-phase and two-phase partitioning bioreactors |
从图 6可以看出, 在一定范围内, 反应器内的氯苯去除负荷随着进气负荷的增加而增加.单相体系的最大去除负荷为137.1 g·m-3·h-1, 而加入5%、10%和15%硅酮母粒的两相分配体系的最大去除负荷分别为164.7、199.0和212.1 g·m-3·h-1.由此可见, 硅酮母粒比例的提高在一定程度上有利于气升式生物反应器去除性能的提升.然而, 当停留时间为90 s、硅酮母粒体积比为15%时, 观察到反应器内不能够实现完全流化, 部分硅酮母粒会滞留在反应器的上部, 造成资源浪费.综合考虑运行成本与去除效果, 确认10%为较适宜的硅酮母粒投加比.
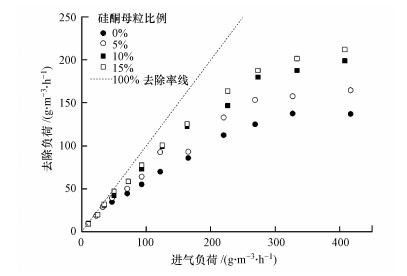 |
| 图 6 硅酮母粒比例对氯苯去除效果的影响 Fig. 6 Effect of silicone masterbatch ratio on chlorobenzene removal |
由图 7可知, 随着停留时间的增加, 氯苯废气与固/液伪均相的接触更完全, 去除负荷随之提升.然而实验中发现, 当停留时间为120 s时, 进气气速较小, 不足以使硅酮母粒在整个导流筒中实现完全流化.综合考虑去除效果和流化状况, 选择反应器较适宜的停留时间为90 s.此时进气流量为180 L·h-1, 且硅酮母粒完全分散在导流筒中, 既保证了液体循环供给氯苯废气和氧气, 又可以避免过短的停留时间导致氯苯与微生物的接触不够而不能被微生物利用, 经过导流筒后直接被鼓泡挥发.
 |
| 图 7 不同停留时间对氯苯去除效果的影响 Fig. 7 Effect of EBRT on chlorobenzene removal |
由图 8可知, 单相反应器需要20 min达到吸收饱和, 而两相分配反应器需要60 min.硅酮母粒的添加使得氯苯与固/液伪均相的亲密度增加, 进而提高了其吸收容量, 因此, 达到吸收饱和的时间随之加长.在不同停留时间下, 两相分配反应器中的βs*值均高于单相反应器(表 3), 说明经硅酮母粒强化后的两相分配反应器传质速率明显大于单相反应器, 且硅酮母粒的添加对传质有大约20%的提升.此外, 氯苯流速越大, βs*值越小.提高氯苯进气流量会导致氯苯废气的停留时间变短, 与液相(或固/液伪均相)的接触时间不充分, 从而容易对氯苯的传质过程产生负面影响.
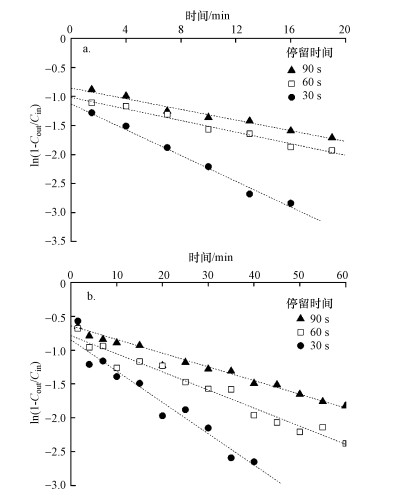 |
| 图 8 单相(a)和两相分配(b)气升式反应器中氯苯在不同停留时间下βs*的测定 Fig. 8 Determination of βs* of chlorobenzene in single-phase (a) and two-phase partitioning (b) airlift reactors at different EBRTs |
| 表 3 单相和两相分配气升式反应器中氯苯传质过程拟合得到的参数结果 Table 3 Mass transfer parameters of chlorobenzene in single-phase and two-phase partitioning airlift reactors |
1) 硅酮母粒无生物毒性和生物降解性, 可以作为两相分配体系中的SNAP.
2) 硅酮母粒的分配系数为0.0059;硅酮母粒表面菌体吸附量会随着OD600的增加而增加, 对分配系数无明显影响.
3) 当进气浓度为1000 mg·m-3、停留时间为90 s时, 单相反应器对氯苯的去除效率为60%, 而含有10%(体积比)硅酮母粒的气升式两相分配反应器对氯苯的去除效率为90%, 且其抗冲击能力更强, 底物耐受性更高.
4) 在本研究考察的进气负荷下(< 400 g·m-3·h-1), 从去除负荷和反应器流化两方面综合考虑, 选择10%和90 s作为实验所用反应器较适宜的硅酮母粒体积比和停留时间.
5) 两相分配体系的最大传质分数相对于单相体系提高了20%以上, 两相的传质更为优越.
Águila-Hernández J, Trejo A, García-Flores B E. 2007. Surface tension and foam behaviour of aqueous solutions of blends of three alkanolamines, as a function of temperature[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 308(1): 33–46.
|
陈东之, 缪孝平, 欧阳杜娟, 等. 2015. 生物滴滤塔净化氯代烃混合废气的研究[J]. 环境科学, 2015, 36(9): 3168–3174.
|
Cheng Z W, Li C, Kennes C, et al. 2017. Improved biodegradation potential of chlorobenzene by a mixed fungal-bacterial consortium[J]. International Biodeterioration and Biodegradation, 123: 276–285.
DOI:10.1016/j.ibiod.2017.07.008
|
Daugulis A J, Tomei M C, Guieysse B. 2011. Overcoming substrate inhibition during biological treatment of monoaromatics:recent advances in bioprocess design[J]. Applied Microbiology and Biotechnology, 90(5): 1589–1608.
DOI:10.1007/s00253-011-3229-z
|
Dumont E, Darracq G, Couvert A, et al. 2010. Determination of partition coefficients of three volatile organic compounds (dimethylsulphide, dimethyldisulphide and toluene) in water/silicone oil mixtures[J]. Chemical Engineering Journal, 162(3): 927–934.
DOI:10.1016/j.cej.2010.06.045
|
Field J A, Sierra-Alvarez R. 2008. Microbial degradation of chlorinated benzenes[J]. Biodegradation, 19(4): 463–480.
DOI:10.1007/s10532-007-9155-1
|
Hernández M, Quijano G, Muñoz R, et al. 2011. Modeling of VOC mass transfer in two-liquid phase stirred tank, biotrickling filter and airlift reactors[J]. Chemical Engineering Journal, 172(2/3): 961–969.
|
Jiang L Y, Li H, Chen J M, et al. 2016. Combination of non-thermal plasma and biotrickling filter for chlorobenzene removal[J]. Journal of Chemical Technology and Biotechnology, 91: 3079–3087.
DOI:10.1002/jctb.4984
|
Jiang L Y, Nie G F, Zhu R Y, et al. 2017. Efficient degradation of chlorobenzene in a non-thermal plasma catalytic reactor supported on CeO2/HZSM-5 catalysts[J]. Journal of Environmental Science, 55: 266–273.
DOI:10.1016/j.jes.2016.07.014
|
Lhotsky O, Krakorova E, Masin P, et al. 2017. Pharmaceuticals, benzene, toluene and chlorobenzene removal from contaminated groundwater by combined UV/H2O2 photo-oxidation and aeration[J]. Water Research, 120: 245–255.
DOI:10.1016/j.watres.2017.04.076
|
Li Y Z, Fan Z Y, Shi J W, et al. 2014. Post plasma-catalysis for VOCs degradation over different phase structure MnO2 catalysts[J]. Chemical Engineering Journal, 241: 251–258.
DOI:10.1016/j.cej.2013.12.036
|
Montes M, Daugulis A J, Veiga M C, et al. 2011. Characterization of absorbent polymers for the removal of volatile hydrophobic pollutants from air[J]. Journal of Chemical Technology and Biotechnology, 86(1): 47–53.
DOI:10.1002/jctb.2517
|
Morrish J L E, Daugulis A J. 2008. Improved reactor performance and operability in the biotransformation of carveol to carvone using a solid liquid two-phase partitioning bioreactor[J]. Biotechnology and Bioengineering, 101(5): 946–56.
DOI:10.1002/bit.21957
|
Muñoz R, Villaverde S, Guieysse B, et al. 2007. Two-phase partitioning bioreactors for treatment of volatile organic compounds[J]. Biotechnology Advances, 25(4): 410–422.
DOI:10.1016/j.biotechadv.2007.03.005
|
Munro D R, Daugulis A J. 1997. The use of an organic solvent and integrated fermentation for improved xenobiotic degradation[J]. Resource and Environmental Biotechnology, 1(3): 207–225.
|
聂国锋, 李莎, 姜理英, 等. 2017. DBD协同CuO/MnO2耦合生物滴滤塔降解氯苯的工艺性能分析[J]. 环境科学学报, 2017, 37(2): 528–537.
|
Raul M., Santiago V, Benoit G, et al. 2007. Two-phase partitioning bioreactors for treatment of volatile organic compounds[J]. Biotechnology Advances, 25(4): 410–422.
DOI:10.1016/j.biotechadv.2007.03.005
|
Rocharios J, Bordel S, Hernández S, et al. 2009. Methane degradation in two-phase partition bioreactors[J]. Chemical Engineering Journal, 152(1): 289–292.
|
任志远, 陈楠. 2013. 氯苯行业生产现状及二恶英类污染物管理分析[J]. 中国氯碱, 2013(12): 26–29.
DOI:10.3969/j.issn.1009-1785.2013.12.011 |
Sun P F, Wang W L, Dai X X, et al. 2017. Mechanism study on catalytic oxidation of chlorobenzene over MnxCe1-xO2/H-ZSM5 catalysts under dry and humid conditions[J]. Applied Catalysis B-Environmental, 198: 389–397.
|
Tang X J, Feng F D, Ye L L, et al. 2013. Removal of dilute VOCs in air by post-plasma catalysis over Ag-based composite oxide catalysts[J]. Catalysis Today, 211: 39–43.
DOI:10.1016/j.cattod.2013.04.026
|
Tomei M C, Annesini M C, Rita S, et al. 2008. Biodegradation of 4-nitrophenol in a two-phase sequencing batch reactor:concept demonstration, kinetics and modelling[J]. Applied Microbiology and Biotechnology, 80(6): 1105–1112.
DOI:10.1007/s00253-008-1604-1
|
王灿, 席劲瑛, 胡洪营, 等. 2008. 白腐真菌生物过滤塔处理氯苯气体的研究[J]. 环境科学, 2008, 29(2): 500–505.
DOI:10.3321/j.issn:0250-3301.2008.02.037 |
徐百龙, 夏银锋, 王向前, 等. 2014. 硅油对生物滴滤塔处理邻二甲苯废气的影响[J]. 高校化学工程学报, 2014, 28(5): 1154–1159.
DOI:10.3969/j.issn.1003-9015.2014.05.033 |
Ye J X, Qiu J F, Chen J, et al. 2018. Removal of gaseous dichloromethane using a solid-liquid partitioning bioreactor under gradual and stepped load increase[J]. International Biodeterioration and Biodegradation, 133: 79–85.
DOI:10.1016/j.ibiod.2018.06.013
|
Zhang L F, Sawell S, Moralejo C, et al. 2007. Heterogeneous photocatalytic decomposition of gas-phase chlorobenzene[J]. Applied Catalysis B-Environmental, 71(3/4): 135–142.
|
Zhang L L, Leng S Q, Zhu R Y, et al. 2011. Degradation of chlorobenzene by strain Ralstonia pickettii L2 isolated from a biotrickling filter treating a chlorobenzene-contaminated gas stream[J]. Applied Microbiology and Biotechnology, 91(2): 407–415.
DOI:10.1007/s00253-011-3255-x
|
Zhu R Y, Mao Y B, Jiang L Y, et al. 2015. Performance of chlorobenzene removal in a nonthermal plasma catalysis reactor and evaluation of its byproducts[J]. Chemical Engineering Journal, 279: 463–471.
DOI:10.1016/j.cej.2015.05.043
|
 2019, Vol. 39
2019, Vol. 39


