2. 聊城大学环境与规划学院, 聊城 252059;
3. 中国科学院大学, 北京 100049;
4. 杭州市环境保护科学研究院, 杭州 310014
2. School of Environment and Planning, University of Liaocheng, Liaocheng 252059;
3. University of Chinese Academy of Sciences, Beijing 100049;
4. Institute of Environmental Protection Science, Hangzhou 310014
溶解性有机物(DOM)是全球最大的碳库, 广泛存在于各类水体, 有色可溶性有机物(CDOM)是DOM中能强烈吸收紫外辐射及蓝光的部分, 其蓝光波段吸收与Chla(叶绿素a)相重叠进而影响初级生产力的遥感反演(Coble, 2007; 宋开山等, 2007; Bianchi, 2011).CDOM在吸收紫外光后会发生光漂白, 分子量随之降低, 同时产生大量中间产物, 进而为浮游生物及微生物生长提供碳、氮、磷等生源物质(Raymond et al., 2013; Zhang et al., 2009a; 2009b).CDOM测量过程相对简单, 仅需过滤即可检测且灵敏度高, 主要借助其对短波辐射的吸收特性及荧光特性来反映水质状况(Stedmon et al., 2005a; 2005b; 2015c).目前国际上常以254和350 nm处吸收系数a(254)、a(350)表征CDOM浓度(Coble, 2007; Spencer et al., 2013; Zhang et al., 2018).已有研究表明CDOM在紫外及蓝光波段吸收光谱随波长增加呈指数函数递减, 指数函数拟合斜率S275~295随CDOM相对分子量增大而减小(Helms et al., 2008; Fichot et al., 2012).紫外比吸收系数(SUVA254)定义为254 nm处CDOM吸光度与溶解性有机碳(DOC)浓度的比值.SUVA值随CDOM腐殖化程度的升高而增大(Weishaar et al., 2003).三维荧光技术(Three-dimensional excitation-emission matrices, EEMs)可提供大量有关CDOM来源及组成结构的信息, 结合平行因子分析法(parallel factor analysis, PARAFAC)能将重叠错交的荧光图谱解析为多个独立的具有单个发射波长极大值的荧光团, 用以解译CDOM相对丰度及组成结构的变化情况, 其光谱组成变化常被用来表征CDOM库的组成变化(Yamashita et al., 2008; 刘笑菡等, 2012; Murphy et al., 2013).
千岛湖又名新安江水库, 水面面积为580 km2, 平均深度为34 m, 最大深度为108 m, 库容达1.78×1010 m3;该湖是受国家重点保护的饮用水供给水库, 其水质状况直接影响钱塘江流域城市的饮用水安全(张姗姗等, 2014;徐高福等, 2017).以往研究表明上游新安江是该湖有机物的主要来源, 近年来伴随上游黄山市及周边淳安县的旅游业发展, 两个城市点源污染排放对该湖泊CDOM库的贡献愈加显著(Zhou et al., 2016a; Liu et al., 2016).然而, 两个城市生活污水释放及上游农业面源污染将如何影响千岛湖CDOM光谱组成及其空间分布在很大程度上为未知.其次, 千岛湖透明度较高, CDOM可能在很大程度上受到光降解的影响;然而, 该湖CDOM荧光光谱组成的空间变化对有机物迁移转化规律的指示意义亦鲜见报道.再次, CDOM荧光光谱在千岛湖水质监测中的应用潜力值得进一步探究(Stedmon et al., 2011; Liu et al., 2014; Zhou et al., 2016b; 吕伟伟等, 2018).
本次研究拟借助a(350)、S275~295、SUVA254等指标及Chla、DOC等水质参数, 探究千岛湖有机物的来源特点;结合平行因子分析法揭示该湖泊有机物组成结构的空间变化, 并指出有机物迁移转化规律的指示意义;同时, 进一步探究CDOM光谱在水质监测中的应用潜力.本研究有助于环保部门了解千岛湖营养物质来源和动态, 便于实现饮用水库富营养化监测并及时应对水质突发事件.
2 材料与方法(Materials and methods) 2.1 换水周期的计算水文数据由太湖流域片水文信息服务系统中浙闵地区钱塘江流域水量信息表(http://218.1.102.107:8100/indexWater.html)获取.2018年新安江坝下站点(出库控制站)出流量即为当年出库水量, 依据式(1)计算年度出湖水量和换周期(王冼民等, 2017).
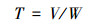
|
(1) |
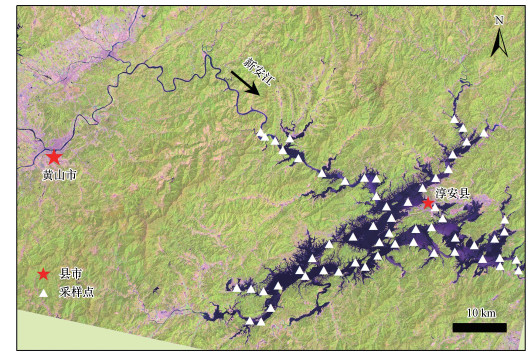 |
| 图 1 千岛湖地理位置及2018年10月采样点分布 Fig. 1 Location of Lake Qiandao and sampling sites in October 2018 |
式中, W为年度出湖水量(m3·a-1), T为换水周期(a), V为湖泊贮水量(m3).
2.2 样品采集与处理使用5 L Niskin塑料桶采集表层水样.所使用的塑料桶先经稀盐酸浸泡24 h, 再使用超纯水润洗3遍并烘干, 样品采集前先使用现场原水润洗3遍.样品采集后置于装有冰块的黑暗保温箱保存, 采样结束后立即将样品送往实验室过滤.滤后水置于棕色玻璃瓶中并在4 ℃的冰箱冷藏保存.在测样前拿出, 待恢复至室温后再进行检测, 其中CDOM光谱吸收及三维荧光光谱的测定在3 d内完成, 其它水质参数测量在样品采集后4 d之内完成.
2.3 参数测定及计算方法 2.3.1 DOC浓度的测定使用0.7 μm孔径的Whatman GF/F滤膜过滤原水, 将滤后水置于岛津总有机碳分析仪(TOC-L)高温环境(~680 ℃)下灼烧测定DOC的浓度.仪器内置稀磷酸及稀盐酸用于去除无机碳干扰, 其中检测范围为0.5~500 mg·L-1, 检测精度为0.1 mg·L-1.
2.3.2 Chla浓度的测定首先采用GF/F滤膜(0.7 μm孔径)过滤一定体积的水样,将所得滤膜置于冰箱中冷冻48 h以上后,使用90%的热乙醇提取并使用岛津公司生产的UV-2550(型号)的分光光度计测定665及775 nm处吸光度再经换算得到Chla浓度(陈宇炜等, 2006).
2.3.3 透明度(SD)的测定使用30 cm塞氏盘现场测定(刘翀等, 2017).
2.3.4 CODM吸收系数的测定通过Shimazdu UV-2550 PC UV-Vis分光光度计测定CDOM光谱, 所需的样品是经过0.22 μm滤膜过滤后的水样, 以Milli-Q水作为空白, 在200~800 nm和间隔1 nm的设置下测量CDOM的吸光度, 然后根据公式(2)的计算得到对应波长的吸收系数.

|
(2) |
式中, a(λ)表示在波长λ时的CDOM吸收系数(m-1), D(λ)表示在波长λ处吸光度, r为光程路径(m).在本文中使用a(350)表示CDOM的浓度.
2.3.5 S275~295、SUVA254的计算CDOM光谱斜率S275~295代表275~295 nm波长范围内拟合得到的指数函数的曲线光谱斜率.S275~295值越小, 表示CDOM的陆源类腐殖酸输入信号越强(Helms et al, 2008; Fichot et al., 2012).根据公式(3)计算相应波段S值.

|
(3) |
式中, a(λ)和a(λ0)分别是在波长λ和波长λ0=440 nm下校正后的CDOM吸收系数.
紫外比吸收系数(SUVA254)定义为254 nm处CDOM吸光度与溶解性有机碳(DOC)浓度的比值, SUVA254值越大表明有机物的芳香性程度越高, 腐殖化程度也越高(Weishaar et al, 2003), 下文均简化为SUVA.
2.3.6 三维荧光光谱的测定及平行因子分析使用Hitachi公司生产的F-7000分子荧光光度计测定CDOM三维荧光光谱, 激发光谱范围是200~450 nm, 间隔为5 nm, 发射光谱为250~600 nm, 间隔为1 nm.超纯水Milli-Q的电阻率控制为18.25 MΩ·cm.扣除纯水空白以修正EEMs拉曼散射, 并用drEEM工具包插值的方法消除瑞利散射(Murphy et al., 2013), 内滤波效应校正以相应激发发射波长处的吸光度来校正(Mcknight et al, 2001).使用超纯水EEMs光谱中350 nm下的荧光强度将所有EEMs定标为拉曼单位(Raman unit, R.U.)以消除仪器自身误差(Lawaetz, 2009).
使用MATLAB R2015b的drEEM工具箱(ver.0.2.0)进行平行因子分析(PARAFAC), 该分析采用交替最小二乘原理的迭代型三维数阵分解算法, 将三维荧光光谱数据解析为若干个具有唯一对应发射波长极大值的荧光组分(Mcknight et al., 2001; Stedmon et al., 2005a; Murphy et al., 2013).共选取60个EEMs矩阵进行运算, 每个矩阵对应251个发射波长、45个激发波长.数据被剖分成6个随机子集, 取3个子集用于建模, 另外3个用于模型验证, 每个EEMs子集均逐步从3个组分模型逐步到6个组分检验.最终确定4个组分模型能很好地通过对半检验(split-half analysis)、随机初始化分析(random initialization analysis)及残差分析(residual analysis).采用每个荧光组分的最大荧光强度(Fmax)作为各类荧光物质浓度和荧光组分强度的表征(Yamashita et al, 2008; Stedmon et al., 2011).
2.4 统计分析使用IBM SPSS Statistics 23软件进行统计分析, 其中包括最大值、最小值、平均数和标准差以及独立样本均值差异显著性水平t检验;使用ArcGIS 10.2绘制点位图, 并使用“反距离权重法”进行插值分析;使用R 3.5.3对CDOM各荧光组分与其它水质参数进行拟合分析.
3 结果与分析(Results and analysis) 3.1 千岛湖换水周期坝下站年平均流量为122 m3·s-1, 年度出湖流量为3.85×109 m3·a-1, 千岛湖贮水量为173×108 m3;经计算得千岛湖换水周期为4.5 a.
3.2 平行因子分析结果PARAFAC所得4个荧光组分C1~C4的模型能很好地通过对半检验(图 2).通过与以往湖库等水体研究结果对比, 发现C1(Ex/Em = 255 (315)/428 nm)可归为陆源类腐殖酸(Stedmon et al., 2005a; Murphy et al., 2011; Kowalczuk et al., 2009), C2(Ex/Em = 270/300 nm)和C3(Ex/Em = 275/340 nm)分别归为类酪氨酸和类色氨酸(Murphy et al., 2006; Stedmon et al., 2008; Kowalczuk et al., 2009; Murphy et al., 2011; Osburn et al., 2011);C4(Ex/Em = 230(290)/404 nm)归为微生物作用的类腐殖酸(Murphy et al., 2011; Osburn et al., 2011; Walker et al., 2013).
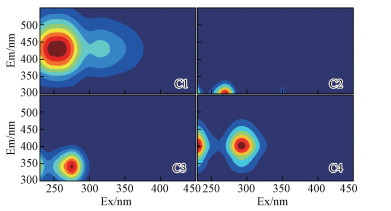 |
| 图 2 平行因子分析得到的4个荧光组分 Fig. 2 Spectral shape of the four fluorescent components identified by PARRAFAC |
以往研究中借助DOC、Chla等水质参数可在一定程度上了解湖泊的富营养化状态, 本次结果中DOC浓度平均值及标准差为(1.36±0.11) mg·L-1, Chla浓度平均值及标准差为(4.53±0.18) μg·L-1.透明度(SD)平均值及标准差为(4.70±1.20) m;参照中国湖泊富营养化评价标准判断该湖泊目前大致尚处于中贫营养状态(表 1)(蔡庆华, 1997).CDOM荧光光谱中陆源类腐殖酸C1和类色氨酸C3荧光强度最大, 为主要的荧光信号(表 1).
| 表 1 千岛湖水质参数和有色可溶性有机物各组分荧光强度平均值及变化范围 Table 1 Mean values and ranges of water quality parameters and fluorescence intensity of the four PARAFAC-derived components of chromophoric dissolved organic matter |
DOC、a(350)和Chla等直接和间接反映有机物浓度的指标均大致呈现出由西北湖区至其它湖区递减的趋势, 值得指出的是DOC虽具有这种趋势但是在靠近淳安县的湖心区及东南湖区, 其浓度均值也相对较高.反映CDOM分子量大小的S275~295低值主要集中在西北入湖河口, 高值主要集中在西南湖区, 说明受新安江影响较大的西北湖区CDOM分子量较大而水质状况较好的西南湖区CDOM分子量较小.陆源类腐殖酸C1和微生物作用的类腐殖质C4均呈现出由西北湖区至其它湖区递减的趋势, 与DOC及a(350)具有相似的空间变化特征;类酪氨酸C2及类色氨酸C3分布具有高度的空间异质性, 主要集中分布在靠近淳安县的湖心区及东南湖区大坝出水口水域.从上游西北湖区至下游大坝出水口方向CDOM光谱组成由类腐殖酸为主逐步转变为类蛋白质为主, 即类腐殖酸C1和C4占比降低, 类蛋白组分C2和C3占比升高(图 3).
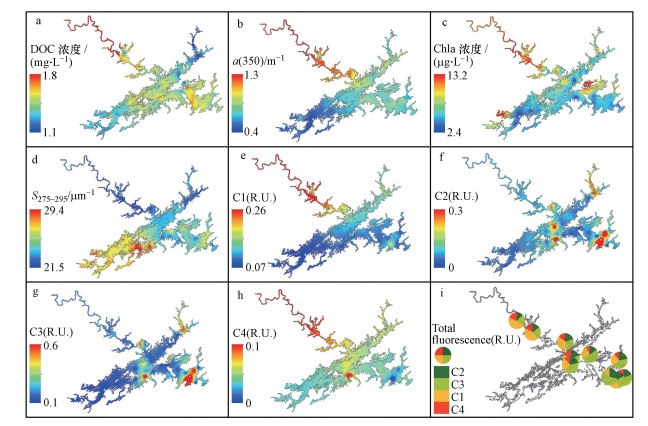 |
| 图 3 千岛湖主要水质参数及有色可溶性有机物荧光组分的分布特征 (图a~d为主要水质和CDOM相关参数分布特征, 图e~h为各荧光组分分布特征, 图i为各荧光组分占比空间变化) Fig. 3 Distribution characteristics of various water quality parameters and fluorescent components of CDOM in Lake Qiandao (the spatial distribution of water quality and CDOM optical parameters were shown in panels a~d, the spatial distribution of each fluorescence component and the proportion of each fluorescence component were shown in panels e~i, respectively) |
以往研究中藻类的降解也可能是CDOM蛋白类荧光组分的来源之一, 尤其是类色氨酸组分往往来源于生活污水的释放和藻类的降解(Zhang et al., 2009a; Henderson et al., 2009; Stedmon et al., 2011);然而结果表明两种蛋白类荧光组分C2和C3与Chla均无显著相关性.陆源类腐殖酸C1(R2= 0.38, p < 0.01)和微生物作用的类腐殖酸C4(R2= 0.24, p < 0.01)与Chla均为显著正相关, 其中C1与Chla具有更好的线性拟合优度.陆源类腐殖酸C1、微生物作用的类腐殖质C4和Chla与SUVA均为显著正相关(p < 0.01), 类酪氨酸C2和类色氨酸C3与SUVA均无显著相关性(图 4).
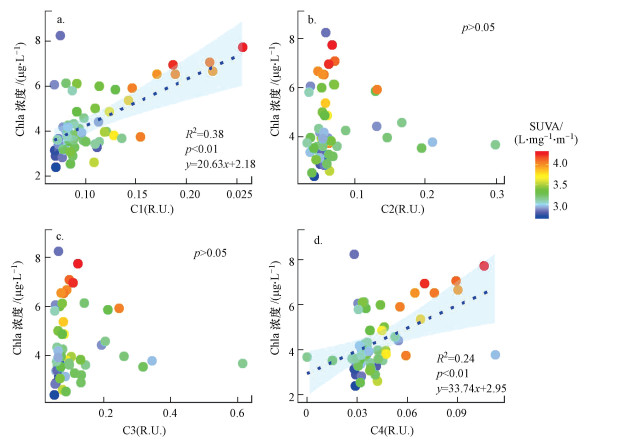 |
| 图 4 各荧光组分荧光强度与Chla的相关性分析 (散点颜色表示SUVA值) Fig. 4 Correlation between between fluorescence intensity of each fluorescent component and concentration of Chla (dot′s color represents the value of SUVA) |
陆源类腐殖酸C1 (R2 = 0.58, p < 0.01)、微生物作用的类腐殖质C4 (R2 = 0.42, p < 0.01)与DOC均为显著正相关, 陆源类腐殖酸C1与DOC具有更好的线性拟合优度;两种类蛋白荧光组分类酪氨酸C2和类色氨酸C3与DOC无显著相关性;DOC与SUVA呈现显著正相关(p < 0.01)(图 5).
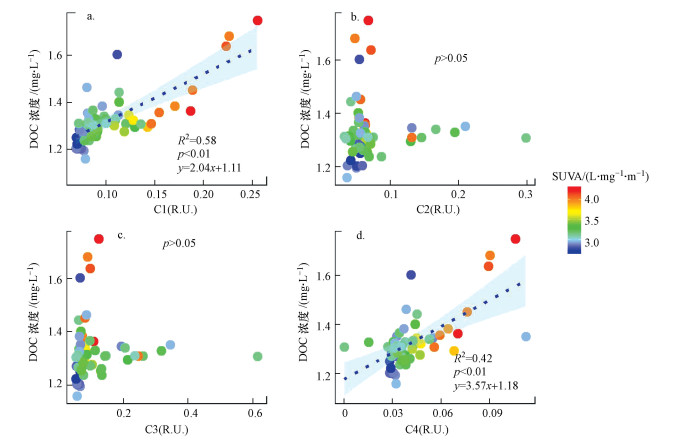 |
| 图 5 各荧光组分荧光强度与DOC浓度的相关性分析 (散点颜色表示SUVA值) Fig. 5 Correlation between fluorescence intensity of each fluorescent component and DOC concentrations (dot′s color represents the value of SUVA) |
陆源类腐殖酸C1 (R2 = 0.86, p < 0.01)、微生物作用的类腐殖质C4 (R2 = 0.52, p < 0.01)与a(350)均为显著正相关, 其中陆源类腐殖质C1与a(350)的线性拟合优度更好;两种类蛋白荧光组分类酪氨酸C2和类色氨酸C3与a(350)无显著相关性, a(350)与SUVA为显著正相关(p < 0.01)(图 6).
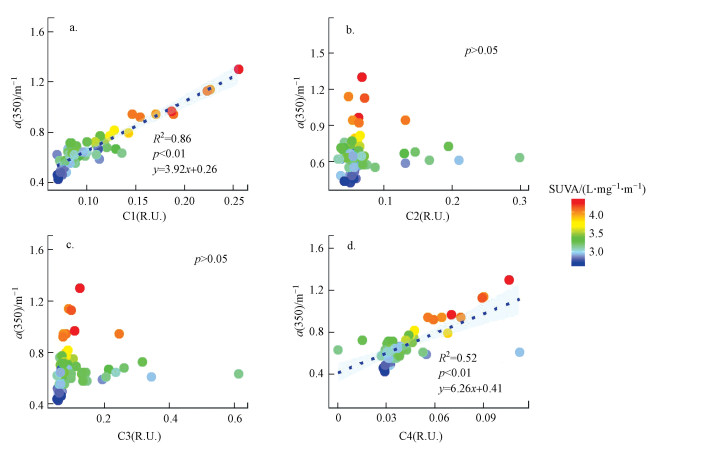 |
| 图 6 各荧光组分荧光强度与吸收系数a(350)的相关性分析 (散点颜色表示SUVA值) Fig. 6 Correlation between fluorescence intensity of each fluorescent component and absorption coefficient a(350) (dot′s color represents the value of SUVA) |
新安江的输入是千岛湖有机物的主要来源, 主要为类腐殖酸.首先, 两种类腐殖酸C1和C4与DOC和a(350)具有很好的相关性及相同的分布特征即由西北湖区至其它湖区递减的趋势(图 3, 图 5~图 6), 这与Liu等之前的研究结果具有一定的相似性(Liu et al., 2014).其次, 陆源类腐殖酸C1、微生物作用的类腐殖质C4、DOC、a(350)与SUVA均为显著正相关;而类酪氨酸C2和类色氨酸C3与DOC、a(350)、SUVA均无显著相关性(图 5~6), 这意味着伴随上游有机物来源增多将致使CDOM库中类腐殖酸占比增大, 说明上游新安江输入的有机物以类腐殖酸为主.千岛湖周边经济发展主要以农业为主, 周边茶园及橘树林较为广布, 周边存在荒地开垦等行为(文军等, 2004), 因而类腐殖酸可能来源于土壤淋溶.以往研究中指出河流经过人口聚集的城市, CDOM组成结构往往发生变化, 类蛋白组分或类腐殖酸组分占比升高均有报道(Hosen et al., 2014; 程琼等, 2019).新安江上游黄山市人口密集可能存在生活污水的释放, 并伴随新安江输入千岛湖.Zhou等指出伴随新安江流量的增大, 千岛湖陆源类腐殖酸浓度占比升高, 分子量增大, 说明农业面源输入的类腐殖酸可能在千岛湖有机物输入中发挥主导作用(Zhou et al., 2016a).然而, Liu等2013年5月研究结果却表明类色氨酸组分也存在由西北湖区至其它湖区递减的趋势, 说明黄山市可能存在蛋白类组分释放(Liu et al., 2014).本次研究中未发现蛋白类荧光组分存在这一趋势, 这一方面可能与PARAFAC所得荧光组分多寡有关(Zhou et al., 2016a);另一方面可能与季节、天气等因素有关, 因而黄山市在不同季节及其水文情景下将如何影响千岛湖有机物浓度及其组成结构仍需进一步探究.湖心区及东南湖区周边淳安县释放的生活污水对千岛湖有机物的贡献也处于不可忽视的地位.首先, 两种类蛋白荧光组分C2和C3主要集中分布在湖心区及东南湖区(图 3);以往研究表明类蛋白物质尤其是类色氨酸一般来源于生活污水及藻类等水生植物的降解(Zhang et al., 2009a; Henderson et al., 2009; Stedmon et al., 2011), 然而Chla浓度相对较低, 对千岛湖CDOM贡献比较有限;类酪氨酸C2和类色氨酸C3与Chla均无显著相关性且Chla和C2及C3具有不同的分布特征, 说明Chla的降解不是两种蛋白类组分的主要来源.基于以上分析可知湖心区及东南湖区类蛋白组分高值可能在很大程度上与周边居民区生活污水释放有关.值得指出的是, 千岛湖为受国家重点保护的饮用水供给湖泊, 该湖周边较少存在排污口, 未经处理的污水一般不得直接排放.然而淳安县居民区可能存在地下水管道破损等问题, 降水所形成的径流将居民区生活污水输送至湖泊.Zhou等研究结果表明从西北湖区至东南湖区, 湖泊深度大致逐渐增大, 在湖心区及东南湖区深层水比较清洁, 有机物主要集中在表层(Zhou et al., 2016a).以往结果表明千岛湖东南湖区表层水有机物空间分布特征在暴雨前后快速发生改变, 因而表明有机物在湖心区及东南湖区表层水中可比较快速的扩散和转移(石亮亮等, 2018).这在一定程度上解释了两种类蛋白组分未集中在淳安县周边, 而是分布在湖心区及东南湖区靠近大坝水域的原因.
4.2 光辐射对千岛湖CDOM迁移转化的潜在影响湖泊有机物的迁移转化规律及其归宿是近几年被关注的热点问题, 对湖泊生态系统运转、水质保护具有重要意义.以往研究表明光降解和生物降解是CDOM迁移转化的两个主要过程(Repeta et al., 2002; Stepanauskas et al., 2005; Zhang et al., 2013; Gonsior et al., 2014).分子量较小的类蛋白组分容易被微生物快速降解, 而分子量较大的类腐殖酸不易被微生物利用, 因而生物降解致使CDOM分子量增大, 类腐殖酸累积(Repeta et al., 2002; Stepanauskas et al., 2005).光降解一般可将分子量较大的类腐殖酸转化为分子量较小的类蛋白组分, 类蛋白组分不易被光降解, 因而光降解可致使湖泊CDOM分子量减小(Zhang et al., 2013; Gonsior et al., 2014).本次研究表明千岛湖CDOM迁移转化过程中光降解可能发挥着主导作用, 光降解转化而来的类蛋白组分对湖心区及东南湖区类蛋白组分具有一定量的补充.首先, 千岛湖水质良好, 其透明度较高, 其均值高达4.7 m(表 1), 具备很好的光化学条件;其次, 以往研究表明清洁的源头水陆源类腐殖酸占有较大的比重, 分子量较大(Hosen et al., 2014).西南湖区水质比较清洁受上游新安江陆源输入和淳安县生活污水释放影响较小;然而S275~295表现为高值表明该湖区CDOM分子量较小, 这说明将分子量减小的光降解是CDOM迁移转化的主要过程.再次, 从西北入湖口至下游大坝方向类腐殖酸占比逐步减小而类蛋白组分占比逐步增大, 说明除淳安县释放生活污水外, 光降解过程中迁移转化而来的蛋白质可能也是重要补充.CDOM库的组成结构也会因湖水的滞留时间而发生变化(Evans et al., 2017), 以往研究表明光辐射可以提高CDOM的生物利用度(Sankar et al., 2019), 千岛湖具有较长的换水周期, 具有较好的光化学条件使得大分子的类腐殖酸转化为小分子的类蛋白物质最终被微生物去除, 因而该湖可能具有较高的生物去除率, 具有较好的自净能力.
4.3 荧光光谱在千岛湖富营养化监测中的应用以往的研究中, 诸多学者着眼于CDOM吸收系数及CDOM荧光强度对水质参数的反演, 以期更便捷的了解水质状况(石玉等, 2018).本次研究发现陆源类腐殖酸C1(Ex/Em = 255 (315)/428 nm)可比较稳定灵敏的反演该湖有机物的浓度, 较少受到有机物迁移转化等因素的影响.首先, 类腐殖酸C1和C4与DOC、a(350)、Chla均具有很好的相关性;其次, 相比于微生物作用的类腐殖质C4, C1具有更高的线性拟合优度且为主要的荧光信号, 说明C1受迁移转化的影响相对较小.以往研究指出类色氨酸可作为生活污水的指示荧光峰(Henderson et al., 2009; Stedmon et al., 2011), Zhou等研究指出类色氨酸荧光峰(Ex/Em =275/342 nm)可用于千岛湖点源污染的识别(Zhou et al., 2016b), 本次研究发现类酪氨酸C2和类色氨酸C3集中分布在湖心区和东南湖区, 可能与淳安县生活污水释放有关, 然而两种类蛋白组分并未分布在淳安县周边说明类色氨酸浓度及空间分布可能还受到水文、光降解转化等多方面因素的影响, 因而借助类色氨酸判别点源污染时需更为谨慎.
5 结论(Conclusions)1) DOC浓度、CDOM吸收系数及类腐殖酸组分C1和C4荧光强度表现出由西北湖区至其他湖区递减的趋势, 说明上游新安江输入的类腐殖酸是千岛湖CDOM的主要来源.类蛋白组分的分布具有高度空间异质性并且主要集中在湖心区及东南湖区, 说明淳安县周边的点源释放对该区域CDOM具有较大贡献.
2) 陆源类腐殖酸C1(Ex/Em = 255 (315)/428 nm)与DOC, a(350)呈显著正相关;相比与微生物作用的类腐殖酸C4, C1为主要荧光信号且与DOC、a(350)具有更好线性拟合优度, 因而C1可更稳定灵敏的反演千岛湖有机物丰度.
3) 类色氨酸C3(Ex/Em = 275/340 nm)可在一定程度上识别点源污染, 但可能受到水文、光降解转化等因素的影响, 因此该组分用以判别点源污染时需更为谨慎.
致谢: 感谢邢晓晟、笪文怡、张成英、季鹏飞及叶小锐等同志在野外采样及室内实验过程中给予的帮助.
Bianchi T S. 2011. The role of terrestrially derived organic carbon in the coastal ocean: A changing paradigm and the priming effect[J]. Proceedings of the National Academy of Sciences, 108(49): 19473–19481.
DOI:10.1073/pnas.1017982108
|
Coble P G. 2007. Marine optical biogeochemistry: The chemistry of ocean color[J]. Chemical Reviews, 107(2): 402–418.
DOI:10.1021/cr050350+
|
蔡庆华. 1997. 湖泊富营养化综合评价方法[J]. 湖泊科学, 1997, 9(1): 9–94.
|
程琼, 庄婉娥, 王辉, 等. 2019. 夏季闽江CDOM的空间分布与降解特征[J]. 环境科学, 2019, 40(1): 59–165.
|
陈宇炜, 陈开宁, 胡耀辉. 2006. 浮游植物叶绿素a测定的"热乙醇法"及其测定误差的探讨[J]. 湖泊科学, 2006, 18(5): 550–552.
DOI:10.3321/j.issn:1003-5427.2006.05.019 |
Evans C D, Futter M N, Moldan F, et al. 2017. Variability in organic carbon reactivity across lake residence time and trophic gradients[J]. Nature Geoscience, 10: 832–835.
DOI:10.1038/ngeo3051
|
Fichot C, Benner R. 2012. The spectral slope coefficient of chromophoric dissolved organic matter (S275~295) as a tracer of terrigenous dissolved organic carbon in river-influenced ocean margins[J]. Limnology and Oceanography, 57(5): 1453–1466.
DOI:10.4319/lo.2012.57.5.1453
|
Gonsior M, Hertkorn N, Conte M H, et al. 2014. Photochemical production of polyols arising from significant photo-transformation of dissolved organic matter in the oligotrophic surface ocean[J]. Marine Chemistry, 163: 10–18.
DOI:10.1016/j.marchem.2014.04.002
|
Helms J R, Stubbins A, Ritchie J D, et al. 2008. Absorption spectral slopes and slope ratios as indicators of molecular weight, source and photobleaching of chromophoric dissolved organic matter[J]. Limnology & Oceanography, 53(3): 955–969.
|
Henderson R K, Baker A, Murphy K R, et al. 2009. Fluorescence as a potential monitoring tool for recycled water systems: A review[J]. Water Research, 43(4): 863–881.
DOI:10.1016/j.watres.2008.11.027
|
Hosen J D, Mcdonough O T, Febria C M, et al. 2014. Dissolved organic matter quality and bioavailability changes across an urbanization gradient in headwater streams[J]. Environmental Science & Technology, 48(14): 7817–7824.
|
Kowalczuk P, Durako M J, Young H, et al. 2009. Characterization of dissolved organic matter fluorescence in the South Atlantic Bight with use of PARAFAC model: Interannual variability[J]. Marine Chemistry, 113(3/4): 182–196.
|
刘笑菡, 张运林, 殷燕, 等. 2012. 三维荧光光谱及平行因子分析法在CDOM研究中的应用[J]. 海洋湖沼通报, 2012, 3: 133–145.
|
刘翀, 朱立平, 王君波, 等. 2017. 基于MODIS的青藏高原湖泊透明度遥感反演[J]. 地理科学进展, 2017, 36(5): 597–609.
|
Lawaetz A J, Stedmon C A. 2009. Fluorescence intensity calibration using the Raman scatter peak of water[J]. Applied Spectroscopy, 63(8): 936–940.
DOI:10.1366/000370209788964548
|
Liu X H, Zhang Y L, Shi K, et al. 2014. Absorption and fluorescence properties of chromophoric dissolved organic matter: Implications for the monitoring of water quality in a large subtropical reservoir[J]. Environmental Science and Pollution Research, 21(24): 14078–14090.
DOI:10.1007/s11356-014-3319-4
|
吕伟伟, 姚昕, 张保华. 2018. 大汶河-东平湖CDOM的荧光特征及与营养物质的耦合关系[J]. 生态环境学报, 2018, 27(3): 565–572.
|
Mcknight D M, Boyer E W, Westerhoff P K, et al. 2001. Spectrofluorometric characterization of dissolved organic matter for indication of precursor organic material and aromaticity[J]. Limnology and Oceanography, 46(1): 38–48.
DOI:10.4319/lo.2001.46.1.0038
|
Murphy K R, Hambly A, Singh S, et al. 2011. Organic matter fluorescence in municipal water recycling schemes: Toward a unified PARAFAC model[J]. Environmental Science & Technology, 45(7): 2909–2916.
|
Murphy K R, Ruiz G M, Dunsmuir W T M, et al. 2006. Optimized parameters for fluorescence-based verification of ballast water exchange by ships[J]. Environmental Science & Technology, 40(7): 2357–2362.
|
Murphy K R, Stedmon C A, Graeber D, et al. 2013. Fluorescence spectroscopy and multi-way techniques. PARAFAC[J]. Analytical Methods, 5(23): 6557–6566.
DOI:10.1039/c3ay41160e
|
Osburn C L, Wigdahl C R, Fritz S C, et al. 2011. Dissolved organic matter composition and photoreactivity in prairie lakes of the U.S. Great Plains[J]. Limnology and Oceanography, 56(6): 2371–2390.
DOI:10.4319/lo.2011.56.6.2371
|
Raymond P A, Hartmann J, Lauerwald R, et al. 2013. Global carbon dioxide emissions from inland waters[J]. Nature, 503(7476): 355–359.
DOI:10.1038/nature12760
|
Repeta D J, Quan T M, Aluwihare L I, et al. 2002. Chemical characterization of high molecular weight dissolved organic matter in fresh and marine waters[J]. Geochimica Et Cosmochimica Acta, 66(6): 955–962.
DOI:10.1016/S0016-7037(01)00830-4
|
Sankar M S, Padmanava D, Shatrughan S, et al. 2019. Effect of photo-biodegradation and biodegradation on the biogeochemical cycling of dissolved organic matter across diverse surface water bodies[J]. Journal of Environmental Sciences, 77(3): 133–150.
|
Spencer R G M, Aiken G R, Dornblaser M M, et al. 2013. Chromophoric dissolved organic matter export from U.S. rivers[J]. Geophysical Research Letters, 40(8): 1575–1579.
DOI:10.1002/grl.50357
|
石亮亮, 毛志华, 刘明亮, 等. 2018. 暴雨事件对千岛湖CDOM及颗粒物吸收光谱特征的影响[J]. 湖泊科学, 2018, 30(2): 358–374.
|
石玉, 周永强, 张运林, 等. 2018. 太湖有色可溶性有机物组成结构对不同水文情景的响应[J]. 环境科学, 2018, 39(11): 4915–4924.
|
Stedmon C A, Bro R. 2008. Characterizing dissolved organic matter fluorescence with parallel factor analysis: A tutorial[J]. Limnology Oceanography: Methods, 6(11): 572–579.
DOI:10.4319/lom.2008.6.572
|
Stedmon C A, Markager S. 2005a. Resolving the variability in dissolved organic matter fluorescence a temperate estuary and its catchment using PARAFAC analysis[J]. Limnology Oceanography, 50: 686–697.
DOI:10.4319/lo.2005.50.2.0686
|
Stedmon C A, Markager S. 2005b. Tracing the production and degradation of autochthonous fractions of dissolved organic matter by fluorescence analysis[J]. Limnology and Oceanography, 50(5): 1415–1426.
DOI:10.4319/lo.2005.50.5.1415
|
Stedmon C A, Granskog M A, Dodd P A. 2015c. An approach to estimate the freshwater contribution from glacial melt and precipitation in East Greenland shelf waters using colored dissolved organic matter (CDOM)[J]. Journal of Geophysical Research Oceans, 120(2): 1107–1117.
DOI:10.1002/2014JC010501
|
Stedmon C A, Seredynska-Sobecka B, Boe-Hansen R. 2011. A potential approach for monitoring drinking water quality from groundwater systems using organic matter fluorescence as an early warning for contamination events[J]. Water Research, 45: 6030–6038.
DOI:10.1016/j.watres.2011.08.066
|
Stepanauskas R, Moran M A, Bergamaschi B A, et al. 2005. Sources, bioavailability, and photoreactivity of dissolved organic carbon in the Sacramento-SanJoaquin River Delta[J]. Biogeochemistry, 74: 131–149.
DOI:10.1007/s10533-004-3361-2
|
宋开山, 张柏, 王宗明, 等. 2007. 吉林查干湖水体叶绿素a含量高光谱模型研究[J]. 湖泊科学, 2007, 19(3): 275–282.
DOI:10.3321/j.issn:1003-5427.2007.03.008 |
Walker S A, Amon R M W, Stedmon C A. 2013. Variations in high-latitude riverine fluorescent dissolved organic matter: A comparison of large Arctic rivers[J]. Journal of Geophysical Research: Biogeosciences, 118(4): 1689–1702.
DOI:10.1002/2013JG002320
|
Weishaar J L, Aiken G R, Bergamaschi B A, et al. 2003. Evaluation of specific ultraviolet absorbance as an indicator of the chemical composition and reactivity of dissolved organic carbon[J]. Environmental Science&Technology, 37(20): 4702–4708.
|
王冼民, 翟淑华, 张红举, 等. 2017. 基于水质改善目标的太湖适宜换水周期分析[J]. 湖泊科学, 2017, 29(1): 9–21.
|
文军, 骆东奇, 罗献宝, 等. 2004. 千岛湖区域农业面源污染及其控制对策[J]. 水土保持学报, 2004, 18(3): 126–129.
DOI:10.3321/j.issn:1009-2242.2004.03.032 |
徐高福, 章德三, 李贺鹏, 等. 2017. 千岛湖水位变化特征和消落带梯级造林策略研究[J]. 浙江林业科技, 2017, 5: 4–12.
|
Yamashita Y, Rudolf Jaffé, Maie N, et al. 2008. Assessing the dynamics of dissolved organic matter (DOM) in coastal environments by excitation emission matrix fluorescence and parallel factor analysis(EEM-PARAFAC)[J]. Limnology & Oceanography, 53(5): 1900–1908.
|
Zhang Y L, Dijk M A V, Liu M L, et al. 2009a. The contribution of phytoplankton degradation to chromophoric dissolved organic matter (CDOM) in eutrophic shallow lakes: Field and experimental evidence[J]. Water Research, 43(18): 4685–4697.
DOI:10.1016/j.watres.2009.07.024
|
Zhang Y L, Liu M L, Qin B Q, et al. 2009b. Photochemical degradation of chromophoric dissolved anic matter exposed to simulated UV-B and natural solar radiation[J]. Hydrobiologia, 627(1): 159–168.
DOI:10.1007/s10750-009-9722-z
|
Zhang Y L, Liu X H, Osburn C L, et al. 2013. Photobleaching response of different sources of chromophoric dissolved organic matter exposed to natural solar radiation using absorption and excitation-emission matrix spectra[J]. PLoS ONE, 8(10): e77515.
DOI:10.1371/journal.pone.0077515
|
Zhang Y L, Zhou Y Q, Shi K, et al. 2018. Optical properties and composition changes in chromophoric issolved organic matter along trophic gradients: Implications for monitoring and assessing lake eutrophication[J]. Water Research, 131: 255–263.
DOI:10.1016/j.watres.2017.12.051
|
Zhou Y Q, Zhang Y L, Jeppesen E, et al. 2016a. Inflow rate-driven changes in the composition and dynamics of chromophoric dissolved organic matter in a large drinking water lake[J]. Water Research, 100: 211–221.
DOI:10.1016/j.watres.2016.05.021
|
Zhou Y Q, Jeppesen E, Zhang Y L, et al. 2016b. Dissolved organic matter fluorescence at wavelength 75/342 nm as a key indicator for detection of point-source contamination in a large Chinese drinking water lake[J]. Chemosphere, 144: 503–509.
DOI:10.1016/j.chemosphere.2015.09.027
|
张姗姗, 张落成, 李刚, 等. 2014. 千岛湖流域水质变化与经济发展耦合协调性分析[J]. 湖泊科学, 2014, 26(6): 948–954.
|
 2019, Vol. 39
2019, Vol. 39


