长期以来, 畜禽养殖场粪污排放是北京市水污染的重要来源(杨博琼等, 2015).作为唯一一条发源于北京市境内的河流, 温榆河是北京市主要的防洪排涝和排污导污的河道(杨丽蓉等, 2011).相关研究表明, 2012年温榆河干流周边至少存在20个规模化养殖场, 猪牛鸡类动物共计33.88万头·只-1, 实际N、P排放量分别为1906.28 t和318.49 t, 流域内畜禽养殖的实际承载量已经远远超过当地的土地理论承载力(潘涛, 2017).除此之外, 该区域2017年污水排放总量合计18.73亿m3, 尽管以污水处理厂为主的集中处理设施的污水处理率已经高达92.4%, 流域内仍面临着1.42亿m3·a-1的污水直排(北京市统计局等, 2018).人类活动及畜禽养殖所产生的粪便污染通过各种传输途径进入地表水体后, 会极大的增加暴露人群感染胃肠道疾病和呼吸道疾病的风险.为了评估环境水域中粪便污染的程度, 通常以粪便指示细菌(Fecal Indicator bacteria, FIB)为指标进行监测(McBride et al., 2013).
目前, 世界范围内普遍使用的常规FIB包括粪大肠菌群(Fecal Coliform, FC)、大肠杆菌(Escherichia coli, EC)和肠球菌(Enterococcus, ENT)等.2009—2010年监测期间, 温榆河流域中普遍存在较为严重的微生物污染, 并且不同河段的污染浓度波动较大, 上游粪大肠菌群浓度为5.01 × 102~5.37 × 106个·L-1; 下游受排水河道的影响浓度均值高达6.3 × 106个·L-1以上(杨勇等, 2012).以化学需氧量(Chemical oxygen demand, COD)、氨氮与FC作为评价因子判断水质类别, 温榆河90%以上河段的水质处于劣Ⅴ类水平, 微生物指标已经逐渐成为环境水体中的主要污染指标(王江权等, 2017).以FC、EC和ENT作为微生物健康风险评价(QMRA)指标发现, 从单次暴露微生物健康风险角度(风险下限为0.017), 温榆河作为景观娱乐水体是不可接受的, 其风险值介于0.1~0.5之间(陈晨等, 2017).
畜禽养殖作为北运河流域(北京段)减排潜力最大的行业, 其污染防治是流域水环境质量改善的关键因素(刘桂中等, 2015; 潘涛, 2017).为防治畜禽养殖污染, 改善水质, 北京市政府实施了包括《北京市畜禽养殖场污染治理规划》和《北京市农业产业布局指导意见》等多项措施.但常规的FIB存在无法判别粪便污染来源的局限性, 不利于粪便污染防治工作的精准对接与事后评估.因此, 本研究以北京温榆河为研究对象, 选择了常规FIB (包括FC、EC和ENT)及溯源FIB (包括不同宿主来源的特异性生物标记, 主要为拟杆菌), 从温榆河各支流的汇入情况及不同气象条件下, 明确流域内微生物污染物的分布特征;同时, 利用微生物溯源方法, 探究温榆河粪便污染的主要宿主来源, 对温榆河中普遍的微生物污染做出合理归因, 以更准确的评估北京一系列防治畜禽粪便污染措施的管控效果, 对流域微生物健康风险的削减及微生物污染控制提供一定的指导意义.
2 材料与方法(Materials and methods) 2.1 研究区域概况温榆河起自沙河闸, 止于北关闸, 全长47.5 km, 是北京市城市总体规划(2004—2020)中的绿色生态走廊(于淼等, 2012).多年平均降雨量为619 mm, 但是雨量季节分布不均且集中在6—9月(杨柳等, 2015).流域地下水埋深大于20 m且超采较严重, 难以得到地下水的补给(北京市地质矿产勘查开发局扥, 2008).沿途主要有支流蔺沟河、龙道河、清河和坝河, 流域终点北关闸断面流量的40.65%和30.03%来自于清河和坝河流量的汇入, 而清河和坝河的主要补给水源分别来自于清河污水处理厂、肖家河污水处理厂、酒仙桥污水处理厂和北小河污水处理厂的排水, 温榆河整体表现出以城市污水处理厂退水等非常规水源补给为主的河流特征(王亚炜等, 2013).
结合温榆河的河流走向、水文、气象、主要污染入河支流汇入情况及周边主要排水污水处理厂分布等信息资料, 本研究共设立了10个采样点, 如图 1所示.为防止支、干流汇入节点处混合水流的影响, 支流采样点皆设置在支流汇入节点前500 m以上, 为使污水处理厂排口处尾水与河道水流充分混合, 污水处理厂采样点皆设置在排口下游500 m后.
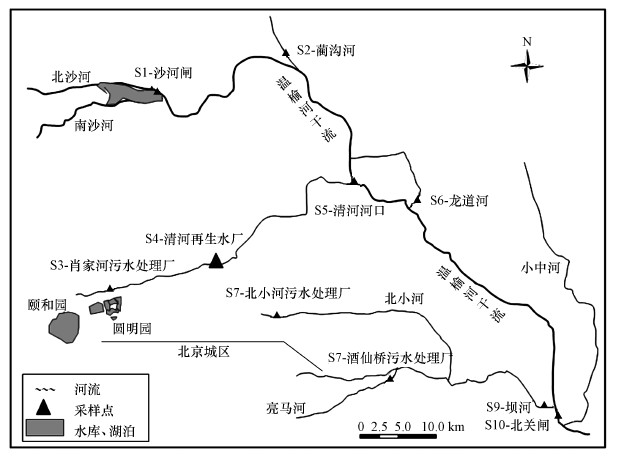 |
| 图 1 温榆河微生物污染溯源采样点图 Fig. 1 Sampling point of microbial source tracking in the Wenyu River |
本研究在2018年6月份(雨前)及7月份(雨后)进行了两次基于两种不同天气下的温榆河微生物污染物来源调研, 晴天采样保证采样前24 h无雨, 雨后采样选择采样前一晚及采样当天有雨的状态, 以确保采样过程中能捕捉到降雨带来的污染物对温榆河水流的冲击.
每次采样尽量在1 d内完成, 沿着温榆河水流流向依次进行, 采样容器选用1.5 L紫外消毒后的纯净水瓶, 每个点取两瓶作为平行水样.每次取完水样后即放入车载冰箱低温保存, 样品运回实验室后检测, 以防理化指标的改变和微生物的繁殖及消亡.除了常规理化指标的监测, 同时检测了粪大肠菌群、大肠杆菌、肠球菌和具有不同宿主来源的特异性生物标记.
2.3 理化指标分析测量所有水样品的常规物理化学参数, 包括水温、气温、浊度、pH、电导率、COD和氨氮等指标.通过哈纳H19125N便携式防水型酸度/ORP测量仪对pH和水温进行现场测定, 通过便携式浊度计(哈纳HI93703)现场测定浊度指标, 采用快速消解分光光度法(HJ/T399—2007)和纳氏试剂分光光度法(HJ-535—2009)分别测定COD和氨氮.
2.4 常规FIB的富集粪便指示菌的检测采用传统平板培养法, 其中粪大肠菌群的测定参照我国行业标准HJ-T347-2007, 大肠杆菌和肠球菌参照美国环境保护局标准EPA Method1603和EPA Method1600, 分别使用M-FC、M-TEC和M-EI培养基进行培养(王江权等, 2017).采集的水样利用0.45 μm的水系滤膜进行过滤, 倒贴在已凝固的培养基上, 放入恒温培养箱中进行相应温度的培养.
2.5 溯源FIB的检测 2.5.1 DNA提取利用0.22 μm的水系滤膜对采集的水样进行过滤以获得水体中的菌体进而采用MP公司的FastDNA® Spin Kit for Soil试剂盒, 提取富集在滤膜上的菌体DNA, 提取后的DNA样品置于-20 ℃冰箱中保存.
2.5.2 溯源FIB引物的选取为了验证具有宿主特异性来源引物的敏感性及特异性, 常规的微生物溯源方法往往重视耗时耗力且实际操作不便的粪便测试, 而对这些已经过测试的引物缺乏实际水体的应用.目前已经有大量研究者设计了具有不同宿主来源的拟杆菌特异性引物, 并成功识别了当地水体微生物污染来源(Kildare et al., 2007; Okabe et al., 2007; Mieszkin et al., 2009; Siefring et al., 2008; Mieszkin et al., 2010; Kobayashi et al., 2013; Villemur et al., 2015).而近年来我国研究者针对目前常用的一些具有宿主特异性拟杆菌引物进行了扩增特异性及灵敏度验证, 结果表明部分引物在我国北京及珠江三角洲流域中具有良好的特异性及敏感度(王显贵等, 2013; 王海鹰等, 2014; 张杨等, 2018).因此, 本文选取这些引物针对北京温榆河水体运用了微生物溯源方法, 旨在探明该水体中粪源微生物污染物的来源, 具有宿主特异性的生物标记引物信息见表 1.
| 表 1 不同宿主的特异性生物标记引物 Table 1 Host-specific primers of biomarker |
PCR反应体系为25 μL: DNA模板(10 ng·μL-1) 2.5 μL, Primer Mix (5 μmol·L-1) 1.0 μL, 2X phanta Max Master Mix 12.5 μL, RNase-free Water 9 μL.PCR扩增条件: 95 ℃一个循环预加热5 min, 使模板DNA充分变性;95 ℃变性20 s, 60 ℃ (不同基因不同)保持30 s, 使引物与模板充分退火, 72 ℃保持30 s, 使引物在模板上延伸, 合成DNA, 重复40个循环;72 ℃一个循环5 min, 使产物延伸完整;8 ℃降温保存.PCR产物取5 μL, 以100 bp DNA Marker为标准, 在100 V电压下, 持续约45 min, 用2%琼脂糖进行凝胶电泳.
2.5.4 定量PCR (qPCR)检测根据凝胶电泳检测结果, 对阳性率高的引物进行qPCR绝对定量.qPCR反应体系为20 μL: DNA模板(10 ng·μL-1) 1.0 μL, 2× SYBR 10.0 μL, Primer F (10 μmol·L-1) 0.4 μL, Primer R (10 μmol·L-1) 0.4 μL, RNase-free Water 8.2 μL.PCR扩增条件:95 ℃一个循环预变性30 s;95 ℃变性15 s, 60 ℃延伸30 s, 共40个循环.退火温度和反应时间随引物不同而调整.
3 结果与讨论(Results and discussion) 3.1 水质状况如表 2所示, 可见所有采样点的水质概况.两次采样期间pH值和浊度分别介于7.05~9.02和1.22~86.00 NTU之间, 电导率在647~1145 μS·cm-1之间波动, COD和氨氮分别分布在3~86 mg·L-1和0.07~19.50 mg·L-1之间.以COD为代表的有机污染和以氨氮为代表的营养污染进行水质评价发现两次采样期间15%和40%采样点处的COD和氨氮浓度都超过了我国地表水环境质量标准(GB 3838 2002) Ⅴ类水体标准限值, 其中COD最高超标2.15倍, 氨氮最高超标9.75倍, 皆位于S6 (龙道河)采样点处.
| 表 2 溯源采样点的水质概况 Table 2 Water quality of sampling points for microbial source tracking |
温榆河粪便污染常规FIB检测指标包括不同气候条件下的FC、EC和ENT.图 2所示为2018年温榆河干流起终点、主要来水支流及污水处理厂采样点常规指示微生物的时空分布.流域内各采样点处的FC、EC与ENT浓度范围分别介于4×101~4.38×107 CFU·L-1、0~2.2× 107 CFU·L-1和0~5.95 ×105 CFU·L-1之间, 这与孙傅等关于城市地表水体中传统粪便指示微生物的浓度最高可达107 CFU·L-1的研究结果相似(孙傅等, 2012).由图 2可知, 不同采样点处的微生物浓度差异明显, 可高达6个数量级以上, 至少有60%以上采样点处的指示菌皆超过了国内外标准限值, 对周边的暴露人群存在潜在的健康风险.
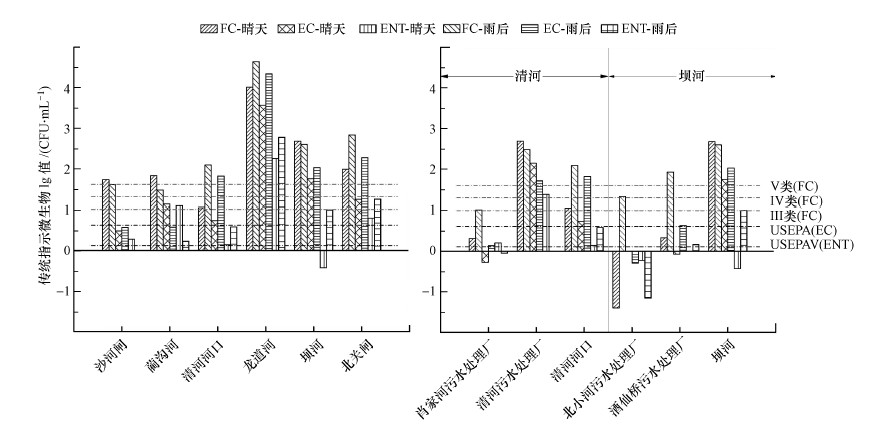 |
| 图 2 各采样点常规指示微生物时空分布 注:如图中虚线1和2所示分别为USEPA水质标准中规定的ENT和EC限值, 限值标准规定:ENT≤130 CFU/100 mL且EC≤410 CFU/100 mL, 超过任一阈值时, 人体感染肠胃疾病的概率大概是36‰; 虚线中Ⅲ、Ⅳ、Ⅴ类是我国《地表水环境质量标准》(GB3838—2002)中规定的FC限值, 依次为10000、20000、40000 CFU·L-1. Fig. 2 Spatial-temporal distribution of conventional microbial indicators at each sampling point |
为准确捕捉到降雨样本, 本研究选择在前一晚与采样当天持续有雨的状态下进行样品采集.降雨采样当天以间歇性短促暴雨为主, 降雨强度0.99 mm·h-1, 历时13 h.从时间分布来看, 常规FIB的浓度在两次采样内的变化十分显著(图 2).降雨期间, 对于常规指示微生物来说, 有50%~80%样本中FC、EC和ENT的浓度增高, 最高增幅达38倍以上.通常情况下, 降雨事件会使各种来源中的粪便物质进入接收水域(Parker et al., 2010).一场风暴事件相当于24.4 d来自干燥天气基流的微生物负荷(Reano et al., 2015).
从现场观测来看, 温榆河流域沿河两岸主要以水泥硬化道路为主, 持续且急速的降雨形式加重了城市地表的冲刷效应, 晴天积累下的大量地表微生物随雨水进入该流域, 从而造成河流中粪源微生物浓度的普遍上升.众多研究均表明, 降雨径流对粪源微生物含量的时空变化存在非常显著的影响(李小锋等, 1990; 江磊等, 2015).陈磊等(2019)发现, 北运河粪源微生物丰水期污染最为严重, FC浓度超过105 MPN·L-1, 降雨径流引发的非点源污染是其重要来源, 与本研究结果一致.
3.2.3 空间分布特征从空间分布来看, 整个研究区域常规FIB的检出率高达90%以上(图 2).如图 2a所示, 温榆河干流主要来水支流中的微生物普遍呈现出龙道河>坝河>清河河口>蔺沟河的污染现状.作为粪便污染首要地域的龙道河, 起源于温榆河, 向东1400 m后转向东南流入罗马湖, 最终又重新汇入温榆河, 是温榆河的支流之一.从现场观测来看, 龙道河水量小、流动性差, 周围遍布学校及高档别墅小区等建筑物;污水来源较为复杂, 包括生活、工业和农业等分散污水, 同时承担了后沙峪中心及两侧地区的雨水排泄.超出自净能力的污染使龙道河长期处于黑臭水体状态, 微生物污染较为严重.
如上所述, 温榆河干流终点北关闸断面流量的71%来自于清河和坝河的汇入, 而清河和坝河的主要补给水源来自于清河污水处理厂、肖家河污水处理厂、酒仙桥污水处理厂和北小河污水处理厂的退水.由此可知, 清河河口及坝河处微生物污染可能主要来自于污水处理厂中粪源微生物的贡献.如图 2b所示, 晴天条件下, 自肖家河污水处理厂至清河河口采样点处由于清河污水处理厂的汇入, 所有的FIB浓度皆呈现出上升的趋势;而清河污水处理厂至清河河口采样点处FIB浓度皆呈现出下降的趋势, 这可能与下游清河第二再生水厂建立后, 清河流域实现了全线截污有关.
从监测结果来看, 四大污水处理厂采样点处都存在一定程度的污染, 基本呈现出以清河污水处理厂处污染程度最为严重的状态.根据刘国军的研究可知, 由于北京污水处理厂时空分布不均, 造成部分污水处理厂总体处于超负荷运转状态, 如清河污水处理厂等;部分总体不超负荷的污水处理厂也会因时间分布不均在排水高峰时段处于超负荷运转状态, 造成出厂水水质下降(刘国军, 2017).清河污水处理厂是北京城市污水处理厂中规模较大的一座.由表 3可知, 该污水处理厂服务于北京市西北部地区约81.4万的人口, 承担着总计142.98 km2范围内的污水收集与治理任务, 处理能力为55万m3·d-1, 最终出水排入清河.不管是从服务人口、服务面积还是排水水量来看, 清河污水处理厂都远远高于其它3大污水处理厂, 即使严格达标排放其出水限值也在104个·L-1, 这有可能也造就了其目前微生物污染程度较为严重的现状.
| 表 3 四大污水处理厂信息表 Table 3 Basic information of the four major wastewater treatment plants |
水环境中粪便指示微生物的存在表明该水体可能受到粪便污染.但常规FIB如大肠杆菌及肠球菌都属于兼性厌氧型, 粪大肠菌群是好氧及兼性厌氧大肠菌群中的一种, 不论在有氧或无氧环境中都能生长, 其检测结果存在一定的干扰性.溯源FIB, 如拟杆菌属(Bacteroides)是一种正常寄居于人和动物肠道内的专性厌氧杆菌, 为人、猪、牛、羊等哺乳动物粪便中的优势菌群, 并且具有一定的宿主特异性.一旦拟杆菌属被排入环境中后, 只能在无氧的环境中才能生长繁殖, 通过检测水体中不同宿主的拟杆菌生物标记存在情况就可以证明监测点是否存在即时新鲜粪便的污染以及水体遭受的主要粪便污染的来源, 以更具时间和成本效益的方式分配管理和补救措施.因此, 从理论上来说, 拟杆菌相较于粪大肠菌群、大肠杆菌和肠球菌是一种更有效检测粪便污染的手段.
3.3 粪源微生物源解析 3.3.1 宿主来源使用定性PCR方法对温榆河干流、主要来水支流及污水处理厂处水样中的溯源FIB(表 1, 特异性生物标记)进行检测, 人与动物源生物标记检出的阳性率如表 4所示.如表 4与图 3所示, 拟杆菌通用引物在20个样本中都能扩增出目的条带, 拟杆菌检出的阳性率为100%, 说明温榆河中存在普遍的粪便污染.
| 表 4 人与动物源生物标记检出阳性情况 Table 4 Positive rate of human and animal source biomarkers |
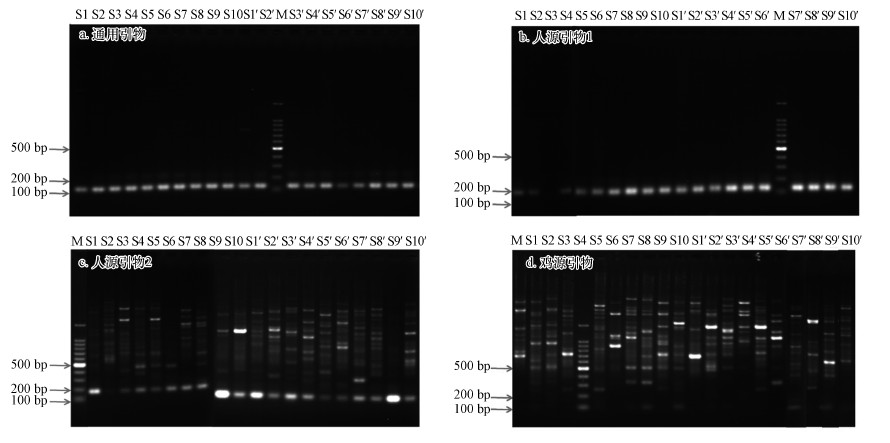 |
| 图 3 人与动物特异性生物标记凝胶电泳 (注:其余动物源特异性引物扩增产物凝胶电泳图无目的条带, 此处省略.) Fig. 3 Gel electropherogram of human and animal specific biomarker |
人源生物标记特异性引物1与2的阳性率分别高达95%与100%, 反刍动物生物标记特异性引物1和2、猪源生物标记特异性引物1和2以及鸡鸭源生物标记特异性引物在20个样本中都未能扩增出目的条带.因拟杆菌在进入环境水体中后, 会呈现出快速衰减的趋势, 鸡源生物标记特异性引物仅在雨前S8和S10样本中能扩增出目的条带, 因此在该点位处可能存在散户养殖随机性的鸡源粪便污染.鸡源与鸡鸭源检出结果的差异性可能是因为这两类目的基因无交叉序列.整体的检测结果说明了温榆河存在普遍的持续性人源粪便污染, 除部分点位鸡源粪便污染之外, 几乎不存在所测的其它动物粪便污染.
根据刘桂中等调研可知, 温榆河干流存在不同程度上由畜禽粪便污染所带来的氨氮及COD污染负荷(刘桂中等, 2015).本研究期间采样点皆处于北京市农业产业布局中禁止及限制养殖区内.2016年, 北京市划定禁养区面积5190.25 km2, 治理、关闭、搬迁禁养区内规模养殖场379家.2017年全市关停并转畜禽养殖场户1900余家, 共清退各类畜禽300余万只(头).
本研究的检测结果也证实了, 诸多防治畜禽粪便污染措施的出台与实施使得北京在畜禽污染防治上取得了显著的效果.当前, 温榆河流域内基本不存在动物粪便所造成的粪源微生物的污染, 温榆河粪便微生物污染来源应主要归因于人体粪便污染.虽然北京市2016年全市粪便处理率高达95.12%, 仍面临着10.46万吨人类粪便直排入水的风险(徐文龙等, 2017).
目前北京拥有17座粪便处理设施, 由于前期布局的不合理, 导致多数粪便消纳站超负荷运转, 如酒仙桥粪便消纳站(负荷率132%)(黄冬等, 2017).而那些将会受到处理的人类粪便在其传输途径中通过管道泄漏、化粪池堵塞或降雨溢流等情况对空气、地表水、地下水及土壤均会造成不同程度的污染.与此同时, 已有研究发现, 尽管北京不同污水处理厂对EC的去除效率可达90%以上, 出水中的浓度依然分布在106~107 copies·L-1之间(易鑫等, 2015).温榆河作为一条以城市污水处理厂退水为主要补给水源的河流, 河流内部普遍性污染严重的理化指标进一步促进了粪便微生物的生长繁殖.
3.3.2 时空分布根据凝胶电泳结果与阳性率结果, 在人源两对引物中选择条带单一明亮且基本无杂带的拟杆菌人源引物1 (qHB)与通用拟杆菌生物标记(qTB)进行qPCR定量.qPCR结果显示, qTB及qHB标准曲线的扩增效率分别为91.5%和93.8%, 回归方程的R2值都为1.溯源FIB中的qTB和qHB分别在1.58×106~4.29×1010 copies·L-1和1.37×106~3.12×1010 copies·L-1之间波动, 该结果与张杨等关于珠三角河网地区粪便污染源解析中的浓度范围基本吻合(张杨等, 2017).
对于溯源FIB来说, 几乎所有采样点处的qTB和qHB皆因降雨呈现出浓度上升的趋势, 最高可达2个数量级的增长.值得注意的是, 清河河口、龙道河、酒仙桥污水处理厂及北关闸采样点处在降雨期间所有指示微生物的浓度皆有所上升(图 2和图 4);其中尤以酒仙桥污水处理厂处污染趋势最为严重, qTB及qHB分别增长了80与148倍.相较于雨前, 雨后导致酒仙桥污水处理厂处拟杆菌浓度急速增长的原因可能如下:①城市降雨径流带来的高负荷面源污染;②降雨为该污水处理厂带来的负荷冲击导致雨污水溢流;③分散污水的随机性排放.
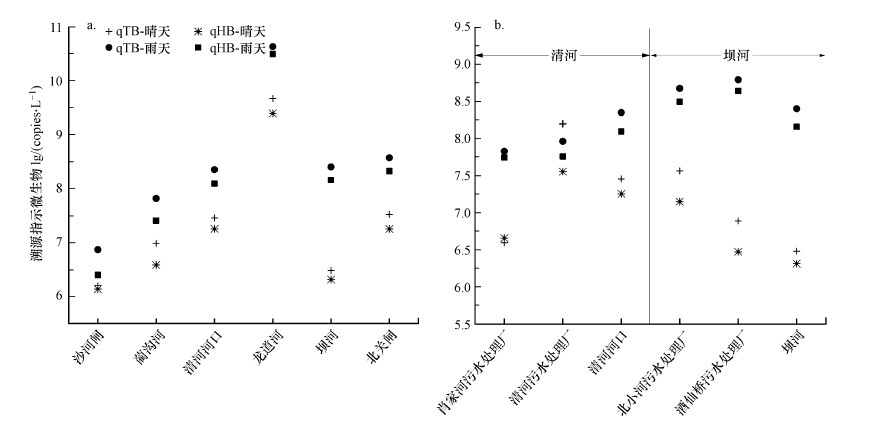 |
| 图 4 各采样点溯源指示微生物时空分布 Fig. 4 Spatial-temporal distribution of source tracking microbial indicators at each sampling point |
与常规FIB分布相似的是, 温榆河干流主要来水支流中的溯源FIB普遍呈现出龙道河>坝河>清河河口>蔺沟河的污染现状(图 2a和图 4a).对比图 2b与图 4b可明显看出, 温榆河支流坝河中常规FIB和溯源FIB之间呈现出不同的分布特征:常规FIB从坝河上游的北小河污水处理厂和酒仙桥污水处理厂采样点处到下游坝河的采样点处呈现出大幅度上升的趋势, 而溯源FIB则显示出快速减少的特征.这可能主要与微生物的自身特性有关, 常规FIB属于好氧或兼性厌氧微生物, 流域内充足的营养元素与不同浓度的溶解氧为其生长繁殖提供了优越的环境(杨丽蓉等, 2011);而溯源FIB拟杆菌是一种专性厌氧微生物, 一旦被排入环境中会呈现出快速衰减的趋势.
总体而言, 由于各大支流及污水处理厂的贡献, 温榆河起点沙河闸水流流至终点北关闸时, 无论晴雨, 所有的指示菌都有大幅度的升高.从指示微生物的浓度水平及样点超标率来看, 拟杆菌与FC为温榆河来水中粪便污染主要的贡献因子.但我国水质标准中当前选用的FC指标仅仅只是停留在数值上的限制, 缺乏流行病学数据的支撑及健康风险的评估, 以建立疾病流行前预测与防控;相较于拟杆菌, 在环境中更易进行生长繁殖且无法追溯粪便宿主的来源, 从而进行针对性的污染防治.
3.4 相关性研究对研究数据进行单样本的K-S检验发现整体数据呈现非正态分布, 以此为基础, 采用Spearman相关性检验分析计算理化指标、培养法FIB指标与qPCR拟杆菌指标之间的相关性(Stachler et al., 2018).从表 5可知, 温榆河溯源指示微生物的浓度与水环境因子之间存在着一定的相关性, 不同天气条件下, 理化指标对溯源指示微生物的影响不一.通过拟杆菌、人源拟杆菌与环境因子的Spearman分析(表 5)可知, 受降雨带来溯源指示微生物的外源输入及理化指标对微生物指标内部生命活动影响的共同作用下, 两种天气下的电导率、COD及氨氮与溯源指示微生物之间呈现相反的结果.总体来看, 在统计学的角度下, 溯源指示微生物的浓度受水环境因子的影响较小, 仅晴天下的pH与拟杆菌/人源拟杆菌之间存在统计学意义上显著的强负相关关系(0.6 < r < 0.79, p<0.05).
| 表 5 溯源指示微生物与水环境因子Spearman相关系数矩阵 Table 5 Spearman correlation coefficient matrix between the concentration of traceability indicator microorganisms and environmental variables |
理想的溯源生物标记不仅应具备在受污染水体中浓度高的特征, 同时应与传统指示微生物在污染区域中具有相似性的衰减规律(Jeanneau et al., 2012; 陈亚楠等, 2015).为探究拟杆菌是否存在可替代常规FIB的空间, 相关性结果表明晴雨天条件下所有的指标之间皆呈现出不同程度的正相关关系(r > 0), 拟杆菌与人源拟杆菌之间存在显著的相关性(r > 0.9, p < 0.01), 说明了温榆河流域来水中近期的粪便污染主要由人类粪便贡献(表 6).如表 6所示, FC与EC、ENT之间存在显著的正相关.FC是卫生细菌领域的用语, 不代表某一个或某一属细菌, 而指的是生长于人和温血动物肠道中的一组肠道细菌, 约占粪便干重的1/3以上, 该菌群细菌可能与大肠杆菌以及肠球菌有一定程度上的交叉关系.已有研究者表明河流中粪大肠菌群、大肠埃希菌和肠球菌之间存在正相关性(张鹏等, 2014; 昝帅君等, 2015).
| 表 6 微生物指标之间的Pearson相关系数矩阵 Table 6 Spearman correlation coefficient matrix between microbial indicators |
张杨等研究利用qPCR方法检测常规FIB与不同宿主来源拟杆菌, 发现两者之间具有显著的相关性(张杨等, 2017).但值得注意的是, 本研究中传统的FIB指标与拟杆菌指标之间不存在统计学意义上的相关(表 6).这有可能是本研究数据样本量较少无法全面反映两类指标之间的关系或培养法与qPCR方法的不同造成数据的差异;抑或是本身不同环境水域中面临的变量因素太多, 各自之间的结果无法进行对比.
Kapoor等的研究发现了与人类相关的拟杆菌标记物与常规FIB呈现出由低至强的相关性, 表明使用肠球菌、大肠杆菌等FIB鉴定人类粪便污染的不确定性(Kapoor et al., 2018).同时, 仅基于拟杆菌进行流域粪源微生物污染现状调查及溯源费用较高.众多研究表明, 可以先通过常规FIB初步判定水域环境中微生物污染程度, 必要时再应用微生物溯源方法确定粪便污染来源, 为河流等不同水环境的针对性治理做出引导(Li et al., 2015; 张杨等, 2017).因此, 本研究建议使用FC结合人源拟杆菌作为受人为活动干扰严重水体粪便污染的指示菌.
4 结论(Conclusions)1) 流域内常规FIB如FC、EC与ENT, 其浓度范围分别介于4×101~4.38×107 CFU·L-1、0~2.2× 107 CFU·L-1和0~5.95 ×105 CFU·L-1之间;溯源FIB如qTB和qHB, 分别在1.58×106~4.29×1010 copies·L-1和1.37×106~3.12×1010 copies·L-1之间波动.
2) 从时空分布来看, 温榆河干流自起点沙河闸至终点北关闸, 随着各大支流汇入后, 所有FIB的污染水平皆得到了大幅度提高, 干流主要来水支流中的微生物普遍呈现出龙道河>坝河>清河河口>蔺沟河的污染现状, 其中清河河口及坝河处微生物污染可能主要来自于污水处理厂中粪源微生物的贡献;降雨径流对粪源微生物含量的时空变化存在非常显著的影响, FIB浓度整体可能因降雨存在不同程度的上升, 最高可达2个数量级的增长;拟杆菌与FC为温榆河来水中粪便污染主要的贡献因子.
3) 流域宿主特异性生物标记仅qTB及qHB检出的阳性率高达95%以上, 除部分点位存在鸡源粪便污染外, 其余动物源拟杆菌皆未检出.由此可知, 北京市一系列防治畜禽粪便污染措施取得了良好效果;但人类粪便仍存在直排或经过污水处理厂处理后间接排放集中污染的现象.
4) FC与EC、ENT之间存在显著的正相关, 但传统的FIB指标与拟杆菌及人源拟杆菌指标之间不存在统计学意义上的相关.建议使用FC结合人源拟杆菌作为受人为活动干扰严重水体粪便污染的指示菌进行流域粪便微生物溯源, 以准确探明粪便微生物的主要地域与宿主来源.
致谢: 在实验和写作过程中, 中国科学院生态环境研究中心的张俊亚博士给予了大力的帮助与指导, 在此表示诚挚的谢意!
北京市地质矿产勘查开发局, 北京市水文地质工程地质大队. 2008. 北京地下水[M]. 北京: 中国大地出版社.
|
北京市统计局, 国家统计局北京调查总队. 2018.北京统计年鉴[Z].北京: 中国统计出版社
|
陈晨, 王曼娜, 王江权, 等. 2017. 基于指示菌的温榆河微生物健康风险评估[J]. 环境科学学报, 37(8): 3177-3184. |
陈磊, 李蕾芳, 郅晓沙, 等. 2019. 北运河粪源微生物分布特征及健康风险评价[J]. 环境科学, 40(2): 633-639. |
陈亚楠, 王亚炜, 魏源送, 等. 2015. 不同功能地表水体中病原微生物指示物的标准比较[J]. 环境科学学报, 35(2): 337-351. |
黄冬, 蒋松竹, 刘秀红, 等. 2017. 我国城市化粪池建设与管理现状及特征研究[J]. 环境卫生工程, 25(6): 84-88. DOI:10.3969/j.issn.1005-8206.2017.06.027 |
Jeanneau L, Solecki O, Wéry N, et al. 2012. Relative decay of fecal indicator bacteria and human-associated markers: a microcosm study simulating wastewater input into seawater and freshwater[J]. Environmental Science & Technology, 46(4): 2375-2382. |
江磊, 朱德军, 陈永灿, 等. 2015. 我国地表水体粪大肠菌群污染现状分析[J]. 水利水电科技进展, 35(3): 11-18. |
Kapoor V, Gupta I, Pasha A B M T, et al. 2018. Real-time quantitative PCR measurements of fecal indicator bacteria and human-associated source tracking markers in a Texas River following Hurricane Harvey[J]. Environmental Science & Technology Letters, 5(6): 322-328. |
Kildare B J, Leutenegger C M, Mcswain B S, et al. 2007. 16S rRNA-based assays for quantitative detection of universal, human-, cow-, and dog-specific fecal Bacteroidales: A Bayesian approach[J]. Water Research, 41(16): 3701-3715. DOI:10.1016/j.watres.2007.06.037 |
Kobayashi A, Sano D, Hatori J, et al. 2013. Chicken- and duck-associated Bacteroides-Prevotella genetic markers for detecting fecal contamination in environmental water[J]. Applied Microbiology and Biotechnology, 97(16): 7427-7437. DOI:10.1007/s00253-012-4469-2 |
Li X, Harwood V J, Nayak B, et al. 2015. A novel microbial source tracking microarray for pathogen detection and fecal source identification in environmental systems[J]. Environmental Science & Technology, 49(12): 7319-7329. |
李小锋, 张楚瑜, 王祖卿. 1990. 武昌东湖生物污染的研究及病毒指示物的初探[J]. 环境科学学报, 10(4): 488-493. |
刘桂中, 李焕利, 孙长虹, 等. 2015. 基于子流域的北运河流域(北京段)畜禽养殖空间布局研究[J]. 环境科学与管理, 40(10): 44-48. DOI:10.3969/j.issn.1673-1212.2015.10.011 |
刘桂中, 孙长虹, 李欣欣, 等. 2015. 北运河流域(北京段)畜禽养殖污染现状及防治对策研究[J]. 环境科学与管理, 40(9): 94-97. DOI:10.3969/j.issn.1673-1212.2015.09.023 |
刘国军. 2017.北京城区污水处理与污水产生量关系及对河道水质影响的研究[D].北京: 中国地质大学(北京). 82 http://cdmd.cnki.com.cn/Article/CDMD-11415-1017129823.htm
|
Mcbride G B, Stott R, Miller W, et al. 2013. Discharge-based QMRA for estimation of public health risks from exposure to stormwater-borne pathogens in recreational waters in the United States[J]. Water Research, 47(14): 5282-5297. DOI:10.1016/j.watres.2013.06.001 |
Mieszkin S, Furet J P, Corthier G, et al. 2009. Estimation of pig fecal contamination in a river catchment by real-time PCR using two pig-specific bacteroidales 16S rRNA genetic markers[J]. Applied and Environmental Microbiology, 75(10): 3045-3054. DOI:10.1128/AEM.02343-08 |
Mieszkin S, Yala J, Joubrel R, et al. 2010. Phylogenetic analysis of Bacteroidales 16S rRNA gene sequences from human and animal effluents and assessment of ruminant faecal pollution by real-time PCR[J]. Journal of applied microbiology, 108(3): 974. DOI:10.1111/j.1365-2672.2009.04499.x |
Okabe S, Okayama N, Savichtcheva O, et al. 2007. Quantification of host-specific Bacteroides-Prevotella 16S rRNA genetic markers for assessment of fecal pollution in freshwater[J]. Applied Microbiology and Biotechnology, 74(4): 890-901. DOI:10.1007/s00253-006-0714-x |
潘涛. 2017.缺水型城市流域水污染物排放总量调控技术研究[D].天津: 天津大学. 177 http://cdmd.cnki.com.cn/Article/CDMD-10056-1018015462.htm
|
Parker J K, Mcintyre D, Noble R T. 2010. Characterizing fecal contamination in stormwater runoff in coastal North Carolina, USA[J]. Water Research, 44(14): 4186-4194. DOI:10.1016/j.watres.2010.05.018 |
Reano D C, Haver D L, Oki L R, et al. 2015. Long-term characterization of residential runoff and assessing potential surrogates of fecal indicator organisms[J]. Water Research, 74: 67-76. DOI:10.1016/j.watres.2015.01.022 |
Siefring S, Varma M, Atikovic E, et al. 2008. Improved real-time PCR assays for the detection of fecal indicator bacteria in surface waters with different instrument and reagent systems[J]. Journal of Water and Health, 6(2): 225-237. DOI:10.2166/wh.2008.022 |
Stachler E, Akyon B, de Carvalho N A, et al. 2018. Correlation of crAssphage qPCR Markers with Culturable and Molecular Indicators of Human Fecal Pollution in an Impacted Urban Watershed[J]. Environmental Science & Technology, 52(13): 7505-7512. |
孙傅, 沙婧, 刘彦华. 2012. 南方某城市地表水体中粪源性污染指示微生物的分布特征研究[J]. 环境科学, 33(11): 3778-3786. |
Villemur R, Imbeau M, Vuong M N, et al. 2015. An environmental survey of surface waters using mitochondrial DNA from human, bovine and porcine origin as fecal source tracking markers[J]. Water Research, 69: 143-153. DOI:10.1016/j.watres.2014.10.063 |
王海鹰, 贾乐华, 吴仁人, 等. 2014. 特异性拟杆菌引物在珠江三角洲的适应性研究[J]. 中国环境科学, 34(8): 2118-2125. |
王江权, 康敉, 郑祥, 等. 2017. 海河流域典型河流粪源性指示微生物的污染特征及其时空分布[J]. 环境科学学报, 37(1): 138-145. |
王显贵, 郭萍, 田云龙, 等. 2013. 利用qPCR定量检测水体中猪源拟杆菌特异性生物标记的研究[J]. 农业环境科学学报, 32(11): 2302-2308. DOI:10.11654/jaes.2013.11.028 |
王亚炜, 杜向群, 郁达伟, 等. 2013. 温榆河氨氮污染控制措施的效果模拟[J]. 环境科学学报, 33(2): 479-486. |
徐文龙, 王敬民. 2017.中国生活垃圾处理行业发展报告: 面向新时代的机遇与挑战[R].西安: 中国城市环境卫生协会, 中国城市建设研究院有限公司.
|
杨博琼, 郑劼. 2015. 北京市畜禽养殖污染防治财政问题的分析[J]. 安徽农业科学, 43(14): 359-360. DOI:10.3969/j.issn.0517-6611.2015.14.127 |
杨丽蓉, 孙然好, 陈利顶. 2011. 流域地表水体污染过程的时空差异及其影响机制分析:以温榆河中上游地区为例[J]. 环境科学, 32(1): 73-79. DOI:10.3969/j.issn.1673-7148.2011.01.013 |
杨柳, 吴忠诚, 韩瑜, 等. 2015. 基于L-THIA模型的温榆河流域非点源污染负荷变化分析[J]. 安全与环境学报, 15(1): 208-213. |
杨勇, 魏源送, 郑祥, 等. 2012. 北京温榆河流域微生物污染调查研究[J]. 环境科学学报, 32(1): 9-18. |
易鑫, 李娟, 黄京, 等. 2015. 北京市4种不同污水处理系统中病原菌变化研究[J]. 环境科学学报, 35(6): 1759-1767. |
于淼, 魏源送, 郑祥, 等. 2012. 温榆河水化学特征演变及其影响因素分析[J]. 环境科学学报, 32(1): 1-8. |
昝帅君, 樊景凤, 明红霞, 等. 2015. 辽河口粪便污染指示菌的时空分布特征[J]. 环境科学学报, 35(11): 3587-3594. |
张鹏, 金敏, 邱志刚, 等. 2014. 天津海河流域冬季微生物污染和水质特征研究[J]. 环境与健康杂志, 31(7): 575-578. |
张杨, 吴仁人, 杨戈, 等. 2018. 西江流域地表水微生物污染定量源解析[J]. 中国环境科学, 38(10): 3889-3896. DOI:10.3969/j.issn.1000-6923.2018.10.036 |
张杨, 吴仁人, 张一敏, 等. 2017. 珠三角河网地区粪便污染源解析[J]. 中国环境科学, 37(9): 3446-3454. DOI:10.3969/j.issn.1000-6923.2017.09.031 |
 2019, Vol. 39
2019, Vol. 39


