亚硝酸盐作为硝化和反硝化过程的中间产物, 经常在污水脱氮除磷工艺中积累, 造成脱氮除磷效果的不稳定, 而且亚硝酸盐对反硝化细菌、硝化细菌和聚磷菌都有一定程度的抑制作用(Weon et al., 2002;王爱杰等, 2005;曾薇等, 2010;宋姬晨等, 2014). Van等(2007)研究发现, 当亚硝酸盐积累到一定程度时, 能够影响微生物的呼吸作用, 进而影响系统的脱氮除磷效率. Glass等(1997)研究表明, 在pH为6时, NO2--N达到30 mg·L-1时会对反硝化过程会产生抑制, NO2--N在0.2 mg·L-1时可对硝化菌产生抑制.已有文献报道, 亚硝酸盐对聚磷菌的好氧吸磷和反硝化吸磷均有抑制作用(Saito et al., 2004;Yoshida et al., 2009), 但由于污泥特性及水质条件的不同, 亚硝酸盐的抑制浓度也不尽相同.Kuba等(1996)认为NO2--N浓度在5~10 mg·L-1时会对聚磷菌产生严重的毒害作用.Hu等(2003)研究结果表明, 当NO2--N达到35 mg·L-1时也没有对除磷产生抑制作用.然而, 近年来在以可溶性淀粉为唯一碳源的缺氧-好氧运行的SBR系统中发现了不同于传统聚磷菌的除磷微生物及除磷现象—产乳酸发酵细菌的缺氧吸磷(张鑫等, 2010;陆林雨等, 2011;柴璐等, 2012;Luo et al., 2017).磷的去除主要依靠产乳酸类发酵细菌通过EMP途径产生乳酸的过程, 其生成的ATP为聚磷酸盐的合成提供了能量(Luo et al., 2018).尽管亚硝酸盐对传统污水生物脱氮除磷功能菌的抑制作用及抑制机理已有一些报道(Lee et al., 2001;刘晖等, 2009;马娟等, 2010;杨莹莹等, 2010;张小玲等, 2015), 但在含大分子淀粉废水的产乳酸发酵细菌为功能菌的缺氧好氧除磷系统中, 亚硝酸盐对产乳酸发酵细菌的影响尚不清楚.基于此, 本文在以可溶性淀粉为唯一碳源、进水含有硝态氮的缺氧-好氧SBR脱氮除磷系统中, 研究投配亚硝态氮对该乳酸发酵系统除磷的影响, 旨在更加深入地认识缺氧好氧生物除磷的机理.
2 试验材料与方法(Materials and methods) 2.1 试验装置与运行条件试验装置为缺氧-好氧交替运行的SBR系统(图 1), 反应器有效容积为8 L, 温度为室内温度(无需严格控制), 进水pH控制在7.0~7.5之间, 初始污泥浓度约为3000 mg·L-1, 污泥龄(SRT)控制在20 d左右.本系统每天运行4个周期, 每周期6 h.系统采用单点瞬时进水方式, 排空比为50%, 缺氧90 min, 好氧220 min, 沉淀40 min, 排水加闲置10 min.进水、搅拌和曝气等过程均由时控开关自动控制, 好氧阶段DO为2~3 mg·L-1.
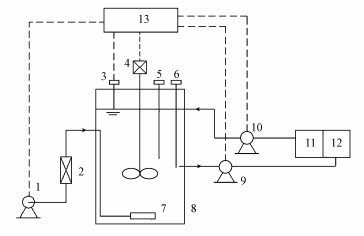 |
| 图 1 SBR系统试验装置示意图 (1.空气泵;2.流量计;3.液位控制器;4.搅拌器;5.ORP/pH测量仪;6.DO测量仪;7.微孔曝气头;8.SBR反应器;9.出水泵;10.进水泵;11.进水箱;12.出水箱;13.可编程控制器(PLC)) Fig. 1 Schematic diagram of SBR |
接种污泥取自西安市第四污水处理厂曝气池的好氧污泥, 直接投放到反应器中进行驯化培养, 供给可溶性淀粉为唯一碳源.试验采用人工废水, 具体见表 1.
| 表 1 人工合成废水组成 Table 1 Composition of synthetic wastewater |
COD、NO3-、NH4+、NO2-、PO43-等常规指标均采用《水和废水监测分析方法》(第四版)中的国标法测定, MLSS和MLVSS采用重量法测定, 乳酸采用对羟基联苯法测定(梁琼等, 2008), 糖原采用蒽酮比色法测定(Oehmen et al., 2005).
高通量的测定是由上海生物工程公司完成.试验采用OMEGA土壤基因组DNA提取试剂盒的方法, 通过16S rDNA中V3~V4区的通用引物341F(5′-CCTACGGGNGGC WGCAG)和805(5′-GACTACHVGGGTATCTAATCC)对提取合格的DNA样品进行PCR扩增.在第二轮扩增中引入Illumina桥式PCR兼容引物, PCR产物的检测采用琼脂糖电泳法.将DNA纯化回收并定量混合后通过Illumina Mi Seq测序平台对处理合格的样品进行测序分析, 对优质序列进行OTU的聚类和注释, 基于此结果做进一步分析.
2.4 试验设计取驯化完成后的污泥进行批次实验, 具体操作为:取1 L的烧杯, 并加入1 L好氧末期的活性污泥混合液, 沉淀后排出500 mL上清液, 并加入500 mL人工模拟废水, 其基质浓度如表 2所示;定时取样, 测定NO2--N、PO43--P及乳酸和糖原的浓度, 以分析不同亚硝酸盐浓度对缺氧吸磷的影响.
| 表 2 批示实验基质成分 Table 2 Composition of synthetic wastewater for batch test |
以缺氧-好氧运行的SBR反应器经过一定时间的驯化作用, 除磷效果较好, 可达80%左右.图 2所示为其典型周期内的物质变化情况.
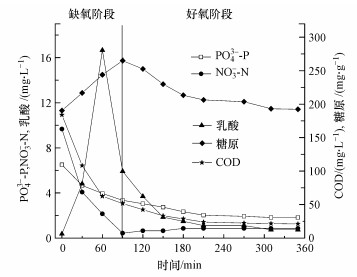 |
| 图 2 SBR系统典型周期内各物质变化情况 Fig. 2 Typical SBR cycle profiles during long-term operation of SBR |
由图 2可知, 缺氧阶段PO43--P的浓度逐渐降低, 由进水时的6.50 mg·L-1降低到3.35 mg·L-1, 同时伴随着糖原的增加和COD的减少, 乳酸的浓度迅速上升到16.66 mg·L-1, 在缺氧段末期又逐渐下降, 推测微生物可能首先将淀粉转化为乳酸, 随后利用乳酸作为碳源进行生长代谢;在好氧阶段, PO43--P的浓度继续降低, 出水PO43--P浓度仅为1.83 mg·L-1, 与此同时, 糖原的含量逐渐降低, 说明糖原分解为聚磷菌进行好氧吸磷提供了能量并作为内碳源供微生物生长, 系统周期内未检测到PHB.说明此条件下的除磷现象不同于传统的除磷机理, 因此, 对本系统内的菌群进行了鉴定, 结果如图 3所示.
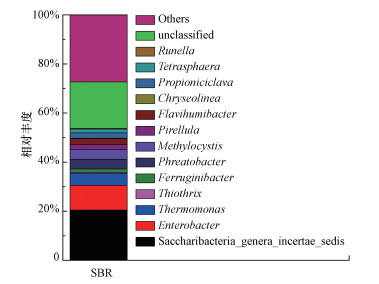 |
| 图 3 SBR系统属水平微生物优势菌种的相对丰度 Fig. 3 Relative abundance of dominant strains at genus level |
由图 3可知, 系统内Saccharibacteria genera incertae sedis和Enterobacter的相对丰度分别为20.48%和10.11%, 占比较大, 属于系统内的优势菌属.通过宏基因组学获得的Saccharibacteria全基因组表明, 其中某些细菌具有专性发酵代谢的特性, 能够发酵葡萄糖和其他糖, 同时产生乳酸(Albertsen et al., 2013; Kantor et al., 2013).Enterobacter作为发酵菌, 可以将葡萄糖发酵成乳酸(Converti et al., 2002), 因此, 在典型周期内有乳酸的生成(图 2).所以推测该SBR系统内缺氧吸磷的关键细菌为产乳酸类发酵型细菌.其除磷过程为:在缺氧初期, 发酵细菌首先将淀粉水解为葡萄糖, 随后葡萄糖进一步被发酵为乳酸, 此时发酵细菌利用产生乳酸时生成的ATP进行聚磷并将葡萄糖以糖原的形式贮存在胞内, 同时此过程生成的乳酸将作为碳源供给其他微生物利用.在缺氧末期, 发酵细菌利用胞内贮存的糖原进行代谢, 通过EMP途径将糖原转化为丙酮酸, 丙酮酸在乳酸脱氢酶的作用下被还原成乳酸, 此过程产生的ATP供发酵细菌聚磷.另一方面, 传统聚磷菌在缺氧阶段利用生成的乳酸合成糖原并完成释磷过程, 但此时的释磷量小于发酵细菌的吸磷量, 因此, 在缺氧阶段表现为吸磷过程.在好氧阶段, 传统聚磷菌利用胞内糖原进行好氧代谢, 通过TCA循环产生的ATP进行吸磷, 完成整个吸磷过程.
3.2 亚硝酸盐对SBR乳酸发酵系统除磷性能的影响进水后不同亚硝酸盐浓度进行的批示实验结果如图 4所示.由图 4a可知, 当初始液相NO2--N浓度分别为2、5和10 mg·L-1时, 亚硝酸盐在好氧末期的浓度分别为3.96、8.79和13.31 mg·L-1, 反硝化作用与硝化作用均不完全.一方面当缺氧区共同存在硝酸盐和亚硝酸盐时, 两种氮氧化物会相互竞争共同的电子供体(有机碳源).但硝酸盐还原酶的生长速率是亚硝酸盐还原酶生长速率的3倍(Turk et al., 1987), 这使硝酸盐反硝化菌的生长更具优势, 造成了亚硝酸盐被还原成氮气的过程受到限制, 进而导致反硝化速率降低, 亚硝酸盐积累.另一方面好氧阶段可能抑制了亚硝酸盐氧化菌(NOB)的活性和生长代谢, 有文献指出, 一定浓度的亚硝酸盐对亚硝酸盐的氧化反应会有一定的抑制作用, 主要抑制剂为游离亚硝酸(FNA), 而NOB对FNA的存在更加敏感(Zhou et al., 2011).
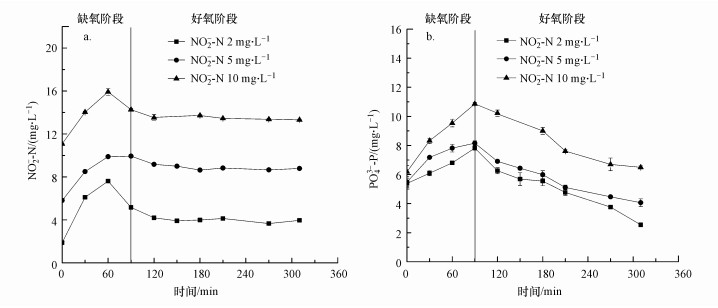 |
| 图 4 进水后亚硝酸浓度分别为2、5、10 mg·L-1时系统NO2--N(a)和PO43--P(b)浓度变化 Fig. 4 Nitrite(a) and phosphorus(b) profiles in nitrite concentration of 2, 5, 10 mg·L-1 respectively |
如图 4b所示, 加入亚硝酸盐后, 缺氧段均表现为释磷现象, 当初始亚硝酸盐浓度为2 mg·L-1时, 出水PO43--P浓度为2.54 mg·L-1, 缺氧阶段的释磷量和释磷速率分别为2.44 mg·L-1和0.532 mg·g-1·h-1(以SS计), 好氧阶段的吸磷量和吸磷速率分别为5.27 mg·L-1和0.462 mg·g-1·h-1(以SS计);当亚硝酸盐浓度为5 mg·L-1时, 出水PO43--P浓度为4.06 mg·L-1, 缺氧阶段的释磷量和释磷速率分别为2.67 mg·L-1和0.584 mg·g-1·h-1, 好氧阶段的吸磷量和吸磷速率分别为4.09 mg·L-1和0.365 mg·g-1·h-1;当进水亚硝酸盐浓度为10 mg·L-1时, 出水PO43--P浓度为6.86 mg·L-1, 缺氧阶段的释磷量和释磷速率分别为4.67 mg·L-1和1.02 mg·g-1·h-1, 好氧阶段的吸磷量和吸磷速率分别为4.00 mg·L-1和0.357 mg·g-1·h-1.由此可见, 随反应初始亚硝酸盐浓度的增大, 缺氧段的释磷量和释磷速率越大, 因此, 对缺氧吸磷的影响越大;在好氧阶段, 亚硝酸盐积累量越高, 好氧吸磷量及吸磷速率越低.乐星星等(2017)认为较高浓度的亚硝酸盐对厌氧释磷有一定的促进作用, 且亚硝酸盐对聚磷菌除磷的影响程度根据进水碳源的不同而产生不同的影响.因此, 在本系统中的缺氧阶段, 亚硝酸盐在促进传统聚磷菌释磷作用的同时也抑制了发酵细菌的吸磷作用, 致使缺氧吸磷量小于缺氧释磷量, 系统表现为缺氧释磷.其他学者对缺氧吸磷过程的研究表明, 亚硝酸盐浓度在4~5 mg·L-1时, 并不影响反硝化吸磷代谢, 而浓度高于8 mg·L-1时, 就严重抑制了反硝化除磷进程, 吸磷代谢完全停止(Kuba et al., 1993; Meinhold et al., 1999).方茜等(2009)认为当NO2--N浓度高于20 mg·L-1时, 未经NO2--N驯化的聚磷菌反硝化吸磷功能受到明显的抑制.Hu等(2003)以厌氧-缺氧条件下稳定运行的SBR系统内的污泥为研究对象, 结果表明, 当NO2--N浓度达35 mg·L-1时也没有对系统除磷产生抑制作用, 反硝化除磷代谢完全停止的抑制浓度大于115 mg·L-1.而在本系统中NO2--N浓度为2 mg·L-1时就对缺氧吸磷产生了显著影响, 表明此系统下的发酵型除磷菌对亚硝酸盐的存在更加敏感.
3.3 亚硝酸盐对系统内除磷菌乳酸和糖原代谢的影响由于此系统中产生乳酸的过程是缺氧吸磷的关键, 为了分析亚硝酸盐抑制生物除磷的机制, 进一步研究了不同亚硝酸盐浓度对发酵菌缺氧期合成乳酸与糖原的影响.从图 5可以看出, 不同的NO2--N浓度对应的乳酸和糖原的合成量明显不同, 当初始NO2--N浓度分别为0、2、5、10 mg·L-1时, 乳酸均在缺氧阶段初期合成且30 min内的最大积累量分别为14.06、3.9、3.12、1.56 mg·L-1.糖原在缺氧阶段合成, 在好氧阶段消耗, 其中, 缺氧阶段的最大积累量依次为235.69、248.85、252.00、272.97 mg·g-1, 在好氧阶段糖原的消耗量分别为35.08、57.01、47.00和33.99 mg·g-1.因此, 随NO2--N浓度的增大, 缺氧段积累的乳酸含量越少, 相反, 糖原的合成量逐渐增大;并且在有亚硝酸盐的情况下, 好氧阶段糖原的消耗量随NO2--N浓度的增大而减少.目前的研究普遍认为NO2-能够与H+结合形成HNO2并透过细胞膜, 降低PAO细胞内的pH值, 进而降低质子驱动力, 导致用于合成聚磷酸盐的ATP降低(Rossetti et al., 2002).而本系统中缺氧吸磷的ATP主要来源于乳酸产生的过程, 乳酸的生成过程主要有两个途径:一是淀粉直接发酵成乳酸, 二是糖原转化成乳酸(Luo et al., 2018).系统中乳酸的合成量随NO2--N浓度的增加而减少, 说明亚硝酸盐对乳酸的生成过程产生了抑制作用, 且NO2--N浓度越大, 抑制作用越明显.当系统中乳酸的合成量减少时, 推测可用于吸磷的ATP合成量会随之减少, 从而导致吸磷量也减少.亚硝酸盐浓度的增加使缺氧阶段糖原的积累量增加, 推测糖原进一步转化为丙酮酸的过程受到抑制, 进而导致这部分ATP的合成受阻, 造成缺氧吸磷量的减少;在好氧阶段, 糖原的消耗量越大, 好氧吸磷量也越大, 说明好氧吸磷的能量来自于糖原的好氧代谢.亚硝酸盐在系统中积累不仅会影响脱氮效率, 还会影响除磷效率, 并随亚硝酸盐浓度的增大影响越明显.
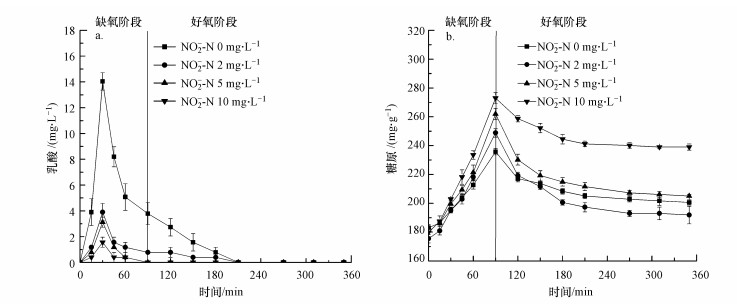 |
| 图 5 NO2--N浓度为2、5、10 mg·L-1时系统内乳酸浓度(a)和糖原含量(b)的变化 Fig. 5 Lactic acid(a) and glycogen(b) profile in nitrite concentration of 2, 5, 10 mg·L-1 respectively |
为了探究亚硝酸盐对系统的长期影响, 将系统中进水NO3--N改为NO2--N, 浓度为20 mg·L-1, 其他运行条件不变.SBR对水中PO43--P和NO2--N的去除结果见图 6a, 周期内各指标变化见图 6b.
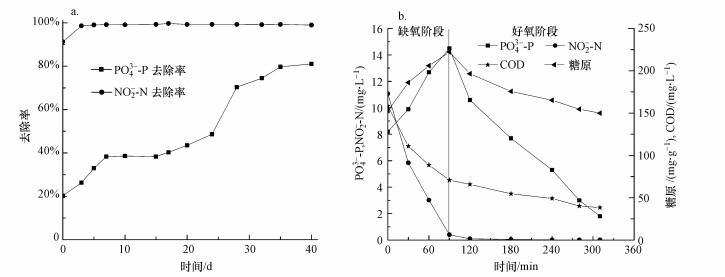 |
| 图 6 改变条件后系统PO43--P、NO2--N的去除率(a)和系统周期COD、NO2--N、糖原、PO43--P的变化(b) Fig. 6 Phosphorus and nitrite(a) and COD, NO2--N, glycogen and phosphorus(b) profiles of typical circle after changing condition |
由图 6a可知, 磷的去除率较低, 这可能是在改变条件的初期, 微生物无法适应环境所致.随系统运行时间的增加, 磷的去除效率也逐渐增加, 在运行40 d左右时, PO43--P的去除率已达到81.11%, NO2--N的去除率维持在99%左右, 表明当进水硝酸盐改为亚硝酸盐时, 系统也能达到良好的除磷效果.但从图 6b可以看出, 系统中磷的去除主要发生在好氧阶段, 并且在缺氧阶段发生了释磷过程, 释磷量和释磷速率分别为6.29 mg·L-1和1.34 mg·g-1·h-1.推测系统内的产乳酸类发酵细菌长期受到亚硝酸盐对其吸磷的抑制作用, 且促进了传统聚磷菌的释磷作用, 随系统运行时间的增加, 导致产乳酸发酵类细菌的衰败及传统聚磷菌的富集, 因此, 系统并未出现与发酵菌类似的缺氧吸磷现象.系统内糖原的含量在缺氧段上升好氧段下降, 且周期内并未检测到PHB, 说明此时系统内的聚磷菌主要以糖原作为内碳源进行生长代谢并为聚磷的合成提供能量.王爱杰等(2005)研究表明, 经长期驯化亚硝酸盐可作为电子受体来进行反硝化除磷, 但只有当NO2--N浓度大于25 mg·L-1时, 才能出现反硝化除磷.刘晖等(2006)的研究结果表明, NO2--N浓度在35 mg·L-1时方可实现缺氧吸磷.与此同时, 碳源类型对于反硝化除磷影响较大, 乙酸盐反硝化除磷系统的除磷效率最佳, 而葡萄糖为碳源时缺氧吸磷效果不明显(吉芳英等, 2010;鲍林林等, 2011).而本系统在缺氧阶段并未发生吸磷现象, 原因可能是进水亚硝酸盐的浓度过低(10 mg·L-1), 容易导致电子受体不足而无法实现反硝化除磷现象, 同时可溶性淀粉作为碳源, 不能被微生物直接利用合成PHB, 由此可见本系统中的聚磷菌无法利用NO2--N作为电子受体进行反硝化吸磷.
4 结论(Conclusions)1) 亚硝酸在系统中积累会影响缺氧吸磷和好氧吸磷速率, 且亚硝酸盐的浓度越高, 缺氧释磷速率越高, 好氧吸磷速率越小, 对缺氧吸磷及好氧吸磷的抑制作用就越明显.
2) 随初始亚硝酸盐浓度的增大, 缺氧期乳酸的浓度随之降低, 相反糖原的含量随之升高.好氧阶段糖原的消耗量增加, 污泥的吸磷量也随之增加.亚硝酸盐对淀粉直接发酵成乳酸的过程及糖原转化为乳酸的过程都有抑制作用.
3) 在长期运行的亚硝酸盐系统中, 系统无法实现以缺氧吸磷为主的除磷现象.
Albertsen M, Hugenholtz P, Skarshewski A, et al. 2013. Genome sequences of rare, uncultured bacteria obtained by differential coverage binning of multiple metagenomes[J]. Nature Biotechnology, 31(6): 533-538. DOI:10.1038/nbt.2579 |
鲍林林, 李相昆, 张杰. 2011. 碳源类型对反硝化除磷系统的影响[J]. 环境工程学报, 5(7): 1567-1571. |
柴璐.2012.AO脱氮系统生物除磷的机理研究[D].西安: 西安建筑科技大学 http://cdmd.cnki.com.cn/Article/CDMD-10703-1018862255.htm
|
Converti A, Perego P. 2002. Use of carbon and energy balances in the study of the anaerobic metabolism of Enterobacter aerogenes at variable starting glucose concentrations[J]. Applied Microbiology and Biotechnology, 59(2/3): 303-309. |
方茜, 张朝升, 张红. 2009. 亚硝酸盐对反硝化聚磷菌除磷性能的影响[J]. 环境工程学报, 3(1): 52-56. |
Glass C, Silverstein J, Oh J. 1997. Inhibition of denitrification in activated sludge by nitrite[J]. Water Environment Resource, 69(6): 1086-1093. DOI:10.2175/106143097X125803 |
Hu J Y, Ong S L, Ng W J, et al. 2003. A new method for characterizing denitrifying phosphorus removal bacteria by using three different types of electron acceptors[J]. Water Research, 37(14): 2463-3471. |
Kantor R S, Wrighton K C, Handley K M, et al. 2013. Small genomes and sparse metabolisms of sediment-associated bacteria from four candidate phyla[J]. Mbio, 4(5): e00708. |
Kuba T, Smolders G J F, Loosrecht M, et al. 1993. Biological phosphorus removal from waste water by anaerobic-anoxic sequencing batch reactor[J]. Water Science and Technology, 27(5/6): 241-252. |
Kuba T, Van Loosdrecht M C M, Heijnen J J. 1996. Phosphorus and nitrogen removal with minimal COD requirement by integration of denitrifying dephosphatation and nitrification in a two-sludge system[J]. Water Resource, 30(7): 1702-1710. |
乐星星, 顾向阳. 2017. 亚硝酸盐对EBPR工艺除磷效率的影响[J]. 南京农业大学学报, 40(2): 266-272. |
梁琼, 鲁明波, 卢正东, 等. 2008. 对羟基联苯法定量测定发酵液中的乳酸[J]. 食品科学, 29(6): 357-360. DOI:10.3321/j.issn:1002-6630.2008.06.078 |
Lee D S, Jeon C O, Park J M. 2001. Biological nitrogen removal with enhanced phosphate uptake in a sequencing batch reactor using single sludge system[J]. Water Research, 35(16): 3968-3976. DOI:10.1016/S0043-1354(01)00132-4 |
刘晖, 孙彦富, 崔英德, 等. 2009. 一株短程反硝化除磷菌的鉴定与生物学利用[J]. 化工学报, 60(7): 1758-1766. DOI:10.3321/j.issn:0438-1157.2009.07.024 |
刘晖, 周康群, 刘开启, 等. 2006. 利用亚硝酸盐的反硝化除磷菌及影响因素[J]. 环境科学与技术, 29(7): 14-16+41+115. DOI:10.3969/j.issn.1003-6504.2006.07.006 |
Luo D, Yuan L, Liu L, et al. 2017. Biological phosphorus removal in anoxic-aerobic sequencing batch reactor with starch as sole carbon source[J]. Water Science and Technology, 75(1/2): 28. |
Luo D, Yuan L, Liu L, et al. 2018. The mechanism of biological phosphorus removal under Anoxic-aerobic alternation condition with starch as sole carbon source and its biochemical pathway[J]. Biochemical Engineering Journal, 132: 90-99. DOI:10.1016/j.bej.2018.01.007 |
陆林雨.2011.缺氧/好氧活性污泥生物除磷机理研究[D].西安: 西安建筑科技大学
|
吉芳英, 杨勇光, 万小军, 等. 2010. 碳源种类对反硝化除磷系统运行状态的影响[J]. 中国给水排水, 26(15): 5-9. |
马娟, 王丽, 彭永臻, 等. 2010. FNA的抑制作用及反硝化过程的交叉影响[J]. 环境科学, 31(4): 1030-1035. |
Meinhold J, Arnold E, Isaacs S. 1999. Effect of nitrite on anoxic phosphate uptake in biological phosphate uptake in biological phosphorus removal activated sludge[J]. Water Research, 33(8): 1871-1883. DOI:10.1016/S0043-1354(98)00411-4 |
Oehmen A, Yuan Z, Blackall L L, et al. 2005. Comparison of acetate and propionate uptake by polyphosphate accumulating organisms and glycogen accumulating organisms[J]. Biotechnology and Bioengineering, 91(2): 162-168. |
Rossetti S, Tomei M C, Levantesi C, et al. 2002. "Microthrix parvicella":a new approach for kinetic and physiological characterization[J]. Water Science Technology, 46(12): 65-72. |
Saito T, Brdjanovic D, Van Loosdrecht M C M. 2004. Effect of nitrite on phosphate uptake by phosphate accumulating organisms[J]. Water Resource, 38(17): 3760-3768. |
宋姬晨, 王淑莹, 杨雄, 等. 2014. 亚硝酸盐对A2O系统脱氮除磷的影响[J]. 中国环境科学, 34(9): 2231-2238. |
Turk O, Mavinic D S. 1987. Benefits of using selective-inhibition to remove nitrogen from highly nitrogenous wastes[J]. Environmental Technology Letters, 8(9): 419-426. |
Van Hulle S, Volcke E, Teruel J L, et al. 2007. Influence of temperature and pH on the kinetics of the Sharon nitritation process[J]. Chemical Technology and Biotechnology, 82(5): 471-480. DOI:10.1002/jctb.1692 |
王爱杰, 吴丽红, 任南琪, 等. 2005. 亚硝酸盐为电子受体反硝化除磷工艺的可行性[J]. 中国环境科学, 25(5): 515-518. DOI:10.3321/j.issn:1000-6923.2005.05.002 |
Weon S Y, Lee C W, Lee S I, et al. 2002. Nitrite inhibition of aerobic growth of Acinetobacter sp[J]. Water Research, 36(18): 4471-4476. DOI:10.1016/S0043-1354(02)00185-9 |
Yoshida Y, Kim Y, Saito T, et al. 2009. Development of the modified activated sludge model describing nitrite inhibition of aerobic phosphate uptake[J]. Water Science and Technology, 59(4): 621-630. DOI:10.2166/wst.2009.024 |
杨莹莹, 曾薇, 刘晶茹, 等. 2010. 亚硝酸盐对污水生物除磷影响的研究进展[J]. 微生物学通报, 37(4): 0586-0593. |
张小玲, 邓扬帆, 冯继贵, 等. 2015. 亚硝酸盐对强化生物除磷系统的影响[J]. 安全与环境学报, 15(2): 204-209. |
张鑫, 袁林江, 陈光秀, 等. 2010. SBR脱氮系统污泥对磷的去除研究[J]. 环境工程学报, 4(5): 1003-1007. |
曾薇, 李磊, 杨莹莹, 等. 2010. 亚硝酸盐积累对A2O工艺生物除磷的影响[J]. 环境科学, 31(9): 2105-2112. |
Zhou Y, Oehmen A, Lim M, et al. 2011. The role of nitrite and free nitrous acid (FNA) in wastewater treatment plants[J]. Water Research, 45(15): 4672-4682. DOI:10.1016/j.watres.2011.06.025 |
 2019, Vol. 39
2019, Vol. 39


