2. 城市水资源与水环境国家重点实验室, 哈尔滨 150090;
3. 黑龙江省科学院微生物研究所, 哈尔滨 150010
2. State Key Laboratory of Urban Water Resources and Water Environment, Harbin 150090;
3. Institute of Microbiology, Heilongjiang Academy of Sciences, Harbin 150010
现代农业的快速发展, 使农业面源污染日趋严重, 水源水氨氮污染普遍存在, 水中过量氨氮不仅增加了氯消毒工艺投氯量, 增大了消毒副产物的生成风险;而且净水厂出水残余氨氮会加剧管网中的硝化作用, 产生对人体健康有害的亚硝酸盐, 诱发人体高铁血红朊症, 因此, 在净水工艺中去除原水中的过量氨氮对于保障供水安全具有重要意义.由于北方冬季水源水温较低(通常低于5 ℃), 传统的生物硝化作用受低温限制导致生物活性降低, 对氨氮的去除效果大幅降低, 甚至出现出水亚硝酸盐积累的现象(张萍萍, 2013), 因此, 有必要探索新途径来解决低温氨氮去除难的问题.
碳源对微生物氮代谢至关重要(王弘宇, 2006), 一方面碳源可以为氮源异化作用提供能量和电子, 同时还可以提供碳骨架参与氮源的合成代谢(Meng et al., 2016).一般来说, 自养硝化菌主要利用二氧化碳为碳源, 通过卡尔文循环为生物生长和代谢提供能量和碳骨架(Kowalchuk et al., 2001).但是一些自养硝化菌依然能够利用一些外源性有机碳源, 如醋酸盐、琥珀酸盐、氨基酸和糖类等进行生长(Zhang et al., 2009).据报道, Nitrosomonas europaea可以利用果糖和丙酮酸盐代替二氧化碳作为唯一碳源进行生长代谢(Hommes et al., 2003).异养硝化菌能够利用有机物获得能量, 其生长速率和对环境的适应均比自养硝化菌强, 因此在水处理领域受到广泛关注.对于异养硝化菌来说, 其生长代谢需要有机碳源作为能源物质, 因此碳源特性是影响其脱氮速率和COD需求至关重要的因素之一(Yang et al., 2012).据报道, Pseudomonas stutzeri D6在利用柠檬酸盐为碳源时总氮的去除率最大, 为80.7%(Yang et al., 2012).总而言之, 不管是异养硝化还是自养硝化微生物的脱氮作用都与其碳源代谢息息相关.研究碳源对脱氮微生物的影响, 对明确该微生物的氮代谢很有意义.同时, 胞外分泌物(EPS)可以调节细胞间的相互作用, 促进细胞与介质表面的粘附, 形成生物膜, 对于微生物的工程化应用至关重要(Li et al., 2011).对于嗜冷菌而言, EPS的组成是影响其低温生长的关键因素之一, 有助于嗜冷菌适应低温环境(Ayala-Del-Río et al., 2010).异养硝化细菌HITLi 7T筛选自松花江, 在2 ℃条件下对氨氮具有较强的去除作用, 经鉴定为不动杆菌属的新菌种, 命名为哈尔滨不动细菌(Acinetobacter harbinensis)并得到国际认可(Li et al., 2014).HITLi 7T的最适生长温度为8~20 ℃(Qin et al., 2016), 通过同步硝化反硝化作用去除氨氮:在氨单加氧酶的作用下将NH4+-N氧化生成NH2OH, NH2OH经羟氨氧化酶氧化生成NO3--N, NO3--N还原生成N2排出(Zhang et al., 2015), 然而关于碳源对该菌低温下氨氮代谢和EPS分泌的影响鲜有报道, 因此, 明确碳源的影响对进一步了解该耐冷异养硝化菌的氮代谢特征以及实现工程化应用具有重要意义.
2 材料与方法(Materials and methods) 2.1 菌种来源及培养基异养硝化细菌(Acinetobacter harbinensis)HITLi 7T从冬季松花江哈尔滨江段分离获得.异养硝化培养基:0.382 g·L-1 NH4Cl、2 g·L-1 CH3COONa、0.2 g·L-1 K2HPO4、0.05 g·L-1 MgSO4、0.12 g·L-1 NaCl、调pH值至7.0~7.4, 在0.11 MPa、121 ℃下灭菌30 min备用.
2.2 菌剂制备用异养硝化培养基在4 ℃培养HITLi 7T, 当OD600值达到1.0以上时, 取2 L培养液在4 ℃、8000 r·min-1转速下离心5 min, 收集菌体并用无菌水洗涤3次后, 加入30 mL无菌水制成悬浮液, 作为种子液, 接种量为100 μL.
2.3 碳源对HITLi 7T低温条件下氨氮去除和EPS分泌的影响用NH4Cl做氮源, 用量0.019 g·L-1, 10种碳源分别为淀粉、蔗糖、乙酸钠、麦芽糖、乳糖、葡萄糖、柠檬酸钠、碳酸钠、甘油和糊精, 用量均为0.2 g·L-1, 其它成分同异养硝化培养基, 每种碳源3个重复, 在4 ℃, 摇床转速为120 r·min-1下培养4 d, 每隔6 h检测氨氮和菌体密度, 并在培养结束时提取ATP和EPS进行分析.
2.4 碳氮比对HITLi 7T低温条件下氨氮去除和EPS分泌的影响以乙酸钠为碳源, 用量0.2 g·L-1, NH4Cl为氮源, 设置6个浓度0.019、0.038、0.057、0.076、0.095、0.114 g·L-1, 对应理论碳氮比分别为40、20、13、10、8、6, 其它成分同异养硝化培养基.每个处理3次重复, 在4 ℃, 摇床转速为120 r·min-1下培养4 d, 每隔6 h检测氨氮和菌体密度, 并在培养结束时提取EPS进行分析.
2.5 分析方法氨氮含量采用纳氏试剂比色法测定;菌体量采用OD600光电比浊法;EPS提取采用醛碱法(Liu et al., 2002);蛋白质浓度测定采用BCA蛋白质检测试剂盒(生工, 上海);多糖含量根据苯酚-硫酸法测定(Nassourou et al., 2017);ATP含量测定采用ATP含量试剂盒(科铭生物, 苏州).
3 结果与分析(Results and discussion) 3.1 碳源对HITLi 7T低温下氨氮去除和EPS分泌的影响 3.1.1 碳源对HITLi 7T低温生长代谢和氨氮去除的影响本实验考察了利用淀粉、蔗糖、乙酸钠、麦芽糖、乳糖、葡萄糖、柠檬酸钠、碳酸钠、甘油和糊精10种不同碳源对HITLi 7T低温下的生长情况, ATP产量以及氨氮降解能力的影响.实验初始氨氮浓度为5.08 mg·L-1, 初始OD600为0.032, 在4 ℃下培养4 d后检测菌液的菌体密度和溶液中剩余氨氮浓度, 并计算平均氨氮去除速率, 结果如图 1a所示.
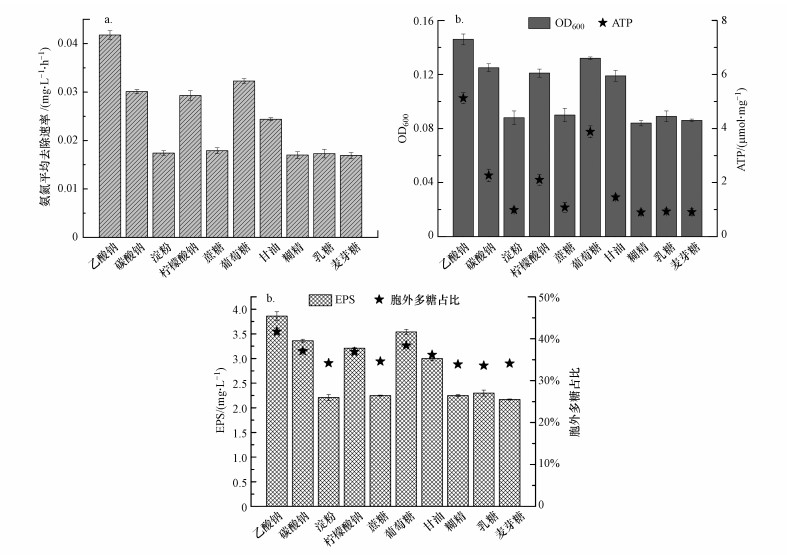 |
| 图 1 不同碳源种类对HITLi 7T低温下氨氮去除(a)、生长和产能(b)和胞外分泌物特性(c)的影响 Fig. 1 Effect of carbon source on the NH4+-N removal(a), bacterial growth and ATP(b) and EPS secretion(c) by HITLi 7T at low temperature |
以乙酸钠为碳源时, HITLi 7T对氨氮的去除速率最高, 为0.042 mg·L-1·h-1.虽然HITLi 7T为异养硝化菌, 但实验结果表明在以无机碳(碳酸钠)为碳源时也能去除水中氨氮, 平均氨氮去除速率为0.030 mg·L-1·h-1, 说明HITLi 7T具有自养硝化的特征.但以碳酸钠为碳源时, 氨氮去除速率低于以乙酸钠为碳源时的氨氮去除速率, 说明对于异养硝化菌HITLi 7T而言, 其最适无机碳源不如最适有机碳源, 以乙酸钠为碳源的异养条件更有利于其对氨氮的代谢.当以淀粉、蔗糖、麦芽糖、乳糖和糊精为碳源时, 氨氮的去除速率接近, 均远小于以乙酸钠为碳源时氨氮的去除速率, 说明HITLi 7T较难利用该5种碳源进行氨氮的去除.蔗糖、麦芽糖、乳糖属于二糖, 淀粉和糊精属于多糖, 它们需要先被微生物水解成单糖等小分子物质才能被微生物所利用, 低温下HITLi 7T分泌水解糖类的胞外酶能力降低, 可能导致该菌对这些碳源的利用能力下降.
10种碳源对HITLi 7T低温生长和能量代谢的影响如图 1b所示.对于异养菌而言, 外部碳源至关重要, 在碳源分解代谢中产生的中间小分子物质, 如柠檬酸、ə-酮戊二酸等是合成细胞脂质、蛋白质的重要前体物质.此外, 碳源分解代谢中产生的ATP是维持异养菌生长代谢, 如氨氮代谢的重要能量来源.由图 1b所知, 适宜于HITLi 7T生长和ATP产生的碳源类型依次为:乙酸钠>葡萄糖>碳酸钠>柠檬酸钠>甘油>淀粉、蔗糖、麦芽糖、乳糖和糊精, 该结论与氨氮去除速率观测到的结果一致.其原因为在本实验中, 氨氮作为HITLi 7T生长代谢的唯一氮源, 去除的氨氮除了通过异化作用转化为气体释放, 还有一部分经过同化作用用于细胞的合成.
氨氮是本实验提供给HITLi 7T利用的唯一氮源, 其代谢途径主要分为两种.一方面, HITLi 7T利用其合成体内的重要组成成分, 维持细胞的生长.在这一过程中, 需要分解碳源提供碳骨架和大量电子和能量.另一方面, HITLi 7T具有异养硝化能力, 氨氮经过一系列酶的作用被其分解成气体释放到空气中, 而在这一过程中碳源的代谢严重影响电子和能量的供给.因此, 无论是通过同化作用还是异化作用, 碳源都与HITLi 7T低温下氨氮的去除息息相关.对于HITLi 7T来说, 乙酸钠更适合其代谢氨氮.
3.1.2 碳源对HITLi 7T低温下EPS分泌的影响EPS作为生物膜的主要成分, 在生物固定化过程中起着重要作用(Vu et al., 2009).研究表明微生物的EPS组成与生长环境有密切关系(Wang et al., 2018).为此, 本实验研究了不同碳源对HITLi 7T EPS分泌的影响, 结果如图 1c所示.
当以乙酸钠为碳源时, 检测到的总EPS量最多, 为3.86 mg·L-1, 这可能是因为乙酸钠为HITLi 7T的最佳碳源, 该组生物量最大, 因而检测到的总EPS量最多.除了EPS量的变化, EPS组成的变化对研究EPS的分泌特性更有意义.如图 1c所示, 当以乙酸钠为碳源时, HITLi 7T分泌的EPS中, 胞外多糖所占比例最高, 为41.7%.胞外多糖通常被认为是EPS中细胞粘附、聚集和内聚的最功能成分(Zhu et al., 2016), 从这一点来看, 以乙酸钠为碳源更有利于HITLi 7T固定在一些载体表面(如活性炭), 从而实现工程化应用.
3.2 碳氮比对HITLi 7T低温下氨氮去除和EPS分泌的影响在3.1节考察的10种碳源中, 乙酸钠更有利于HITLi 7T去除氨氮, 因此本节选用乙酸钠为碳源, 研究了不同碳氮比条件下, HITLi 7T对氨氮去除和EPS分泌的特征.固定乙酸钠浓度为0.2 mg·L-1, 通过调整氨氮浓度改变碳氮比, 使C/N分别为40、20、13、10、8、6.
3.2.1 碳氮比对HITLi 7T低温下生长和氨氮去除的影响表 1为不同碳氮比条件下氨氮的去除量与去除率, 图 2a为不同碳氮比条件下, HITLi 7T在4 ℃培养4 d后菌体的生长和氨氮平均去除速率.由表 1和图 2a可知, HITLi 7T对氨氮的去除速率在低碳氮比情况下, 随着碳氮比的提高而提高, 当碳氮比提高到8时, 氨氮去除率最大为82.6%, 此时氨氮平均去除速率为0.216 mg·L-1, HITLi 7T菌体增长量也最大为0.457.当碳氮比进一步升高20, HITLi7T的平均氨氮去除率和菌体增长量分别仅为最大值的34.2%和51.2%.当碳氮比增加到40时, HITLi 7T的平均氨氮去除率下降至0.036 mg·L-1, 仅为最大值的16.6%, 此时菌体增长量为0.153, 仅为最大值的33.5%.该结果表明高碳氮比对HITLi 7T有显著抑制作用, 这可能是因为HITLi 7T筛选自松花江, 属于贫营养环境, 对高碳氮比环境不耐受.
| 表 1 不同碳氮比条件下氨氮的去除量与去除率 Table 1 NH4+-N removal performance under different C/N |
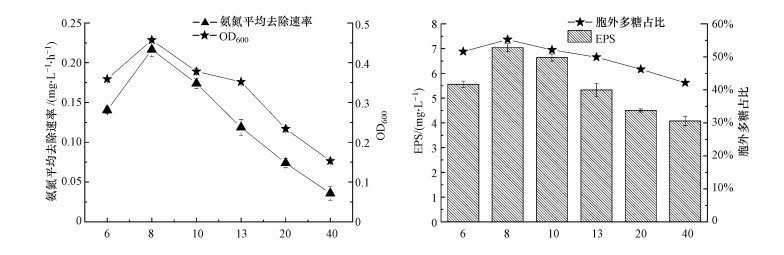 |
| 图 2 不同碳氮比对HITLi 7T低温下生长和氨氮平均去除速率(a)和胞外分泌物的特性影响(b) Fig. 2 Effect of C/N on the growth and average NH4+-N removal rate(a) and EPS secretion(b) of HITLi 7T at low temperature |
3.1.2节研究结果表明, 以乙酸钠为碳源时, HITLi 7T分泌的EPS总量最多, 并且其中的胞外多糖所占百分比量最高.鉴于EPS对于微生物在工程化应用中的重要作用, 本节以乙酸钠为碳源, 考察了不同碳氮比条件下EPS分泌特性, 结果如图 2b所示.
不同碳氮比情况下, HITLi 7T分泌的EPS存在差异.碳氮比为6时, HITLi 7T分泌的总EPS量为5.56 mg·L-1, 当碳氮比提高到8时, HITLi 7T分泌的总EPS量最多, 为7.04 mg·L-1, 其中胞外多糖占比为55.3%.而当碳氮比进一步提高到10时, HITLi 7T分泌的总EPS略有下降为6.64 mg·L-1, 此时, 胞外多糖占比也下降至51.1%.当碳氮比提高至40时, HITLi 7T的EPS分泌受到大大抑制, 此刻总EPS量为4.08 mg·L-1, 仅为最大值的76.3%, 同时胞外多糖的占比也大幅下降, 说明高碳氮比不利于HITLi 7T胞外多糖的分泌.EPS对耐低温菌适应低温环境具有重要意义(Ayala-Del-Río et al., 2010), 同时它能为微生物提供必要的碳源和能量(Yuan et al., 2011).据此, 推测3.2.1节观测到碳氮比为8时的最大生物量与该条件下最大总EPS量密切相关.同时, 考虑到胞外多糖对于微生物固定化的重要作用, 碳氮比8被认为是HITLi 7T的最佳碳氮比, 该条件下HITLi 7T的生长和EPS的分泌都能达到最大, 同时较高的胞外多糖比能够促使其更容易固定, 实现工程化应用.
4 结论(Conclusions)1) 耐低温异养硝化菌HITLi 7T能够利用乙酸钠、葡糖糖、柠檬酸钠和甘油为有机碳源进行异养硝化作用, 乙酸钠为其最佳碳源, 有利于其生长和产能, 此时氨氮平均去除率最大为0.042 mg·L-1·h-1, 分泌的EPS总量最大为3.86 mg·L-1, 胞外多糖占比为41.7%.
2) 耐低温异养硝化菌HITLi 7T能够利用碳酸钠进行自养硝化, 但其效果不如以乙酸钠为碳源时的异养硝化作用.
3) 以乙酸钠为碳源时, HITLi 7T进行异养硝化作用的最佳碳氮比为8, 此时平均氨氮去除速率最大为0.216 mg·L-1·h-1, HITLi 7T菌体生长量最大为0.457, 总EPS量最大为7.04 mg·L-1, 胞外多糖占比为55.3%.
Ayala-Del-Río H L, Chain P S, Grzymski J J, et al. 2010. The genome sequence of psychrobacter arcticus 273-4, a psychroactive siberian permafrost bacterium, reveals mechanisms for adaptation to low-temperature growth[J]. Applied Environmental and Microbiology, 76(7): 2304-2312. DOI:10.1128/AEM.02101-09 |
Hommes N G, Sayavedra-soto L A, Arp D J. 2003. Chemolithoorganotrophic Growth of Nitrosomonas europaea on Fructose[J]. Journal of Bacteriology, 185: 6809-6814. DOI:10.1128/JB.185.23.6809-6814.2003 |
Kowalchuk G. 2001. Ammonia-oxidizing bacteria: a model for molecular microbial ecology[J]. Ann Rev Microbiol, 55: 485-529. DOI:10.1146/annurev.micro.55.1.485 |
Li W, Zhang D, Huang X, et al. 2014. Acinetobacter harbinensis sp. nov. isolated from river water[J]. International Journal of Systematic and Evolutionary Microbiology, 64(Pt 5): 1507-1513. DOI:10.1099/ijs.0.055251-0 |
Liu H, Fang H. 2002. Extraction of extracellular polymeric substances (EPS) of sludges[J]. Journal of Biotechnology, 95(3): 249-256. DOI:10.1016/S0168-1656(02)00025-1 |
Meng L, Li W, Zhang S, et al. 2016. Effects of sucrose amendment on ammonia assimilation during sewage sludge composting[J]. Bioresource Technology: S0960852416300700. |
Nassourou M A, Tchiagam Jean Baptiste Noubissié Y N N, Bell J M. 2017. Diallel analyses of soluble sugar content in cowpea (Vigna unguiculata L.Walp.)[J]. The Crop Journal, 5: 553-559. DOI:10.1016/j.cj.2017.05.005 |
Wen Q, Li W, Zhang D, et al. 2015. Ammonium reduction kinetics in drinking water by newly isolated Acinetobacter sp. HITLi 7 at low temperatures[J]. Desalination & Water Treatment, 57(24): 1-8. |
Vu B, Chen M, Crawford R J, et al. 2009. Bacterial Extracellular Polysaccharides Involved in Biofilm Formation[J]. Molecules, 14(7): 2535-2554. DOI:10.3390/molecules14072535 |
王弘宇, 马放, 苏俊峰, 等. 2007. 不同碳源和碳氮比对一株好氧反硝化细菌脱氮性能的影响[J]. 环境科学学报, 27(6): 968-972. DOI:10.3321/j.issn:0253-2468.2007.06.011 |
Wang B B, Liu X T, Chen J M, et al. 2017. Composition and functional group characterization of extracellular polymeric substances (EPS) in activated sludge: The impacts of polymerization degree of proteinaceous substrates[J]. Water Research: S0043135417309247. |
Yang X, Wang S, Zhou L. 2012. Effect of carbon source, C/N ratio, nitrate and dissolved oxygen concentration on nitrite and ammonium production from denitrification process by Pseudomonas stutzeri D6[J]. Bioresource Technology, 104: 65-72. DOI:10.1016/j.biortech.2011.10.026 |
Yuan S J, Sun M, Sheng G P, et al. 2011. Identification of key constituents and structure of the extracellular polymeric substances excreted by Bacillus megaterium, TF10 for Their Flocculation Capacity[J]. Environmental Science & Technology, 45(3): 1152-1157. |
张萍萍, 花日茂, 徐微, 等. 2013. 生物活性滤池对水中氨氮和亚硝酸盐氮去除效果研究[J]. 安徽农业大学学报, 40(1): 146-149. |
Zhang S M, Li W G, Zhang D Y, et al. 2015. Purification and characterization of a low-temperature ammonia monooxygenase from heterotrophic nitrifier Acinetobacter sp. Y16[J]. Desalination & Water Treatment, 53: 257-262. |
Zhu S, Shen J, Ruan Y, et al. 2016. The effects of different seeding ratios on nitrification performance and biofilm formation in marine recirculating aquaculture system biofilter[J]. Environmental Science and Pollution Research, 23: 14540-14548. DOI:10.1007/s11356-016-6609-1 |
Zhang Y, Love N, Edwards M. 2009. Nitrification in drinking water systems[J]. Critical Reviews in Environmental Science and Technology, 39(3): 153-208. DOI:10.1080/10643380701631739 |
 2019, Vol. 39
2019, Vol. 39


