2. 广东石油化工学院环境工程系, 茂名 525000
2. School of Environmental and Engineering, Guangdong University of Petrochemical Technology, Maoming 525000
目前, 国内外学者对药品与个人护理品(PPCPs)在诸如污水处理厂进出水、污泥、地表水、地下水和土壤等不同环境中的归趋行为、分布和毒性进行了大量研究(Miller et al., 2008; Karnjanapiboonwong et al., 2011; Dai et al., 2014).关于PPCPs降解过程中产生的中间产物或代谢物在环境中的风险是一个研究热点.萘普生(NP)是一种广泛使用的非甾体消炎药, 也是在世界各国的城市污水厂出水中经常被检出的药物之一(Selke et al., 2010).地表水、地下水甚至饮用水中检出的萘普生浓度为ng·L-1~μg·L-1(Grenni et al., 2013; Mohapatra et al., 2016).研究表明, 萘普生不易生物降解(Radke et al., 2010), 光化学降解是其在环境中降解的重要途径, 但其光降解的中间产物对藻类、轮虫和微囊藻类的毒性大于母体化合物(Isidori et al., 2005a).因此, 在研究母体化合物萘普生的光解机理时, 很有必要研究其中间产物或代谢物在光环境下的降解行为.
2-(1-羟乙基)-6-甲氧基萘(NP1)和6-甲氧基-2-乙酰萘(NP2)是萘普生光解的重要中间产物(Boscá et al., 2001)(图 1), 它们在紫外光照下去除率较高(Marotta et al., 2013).研究NP1和NP2在光环境中的进一步降解, 有利于完善萘普生的光降解机理和生态毒理性研究.
 |
| 图 1 NP、NP1和NP2的分子结构 Fig. 1 The molecular structures of NP, NP1 and NP2 |
药物的光降解效率与水中共存组分密切相关.在天然水体中, 以硝酸根(NO3-)、铵根(NH4+)和中间态亚硝酸根(NO2-)形式存在的无机氮对药物光解有重要的影响(Doll et al., 2003; Malouki et al., 2005; Zhang et al., 2011; Chen et al., 2015; Kang et al., 2018).其中, NO3-在自然水环境中普遍存在, 浓度一般为10-5~10-3 mol·L-1(Zuo et al., 2006).而冷佩芳等(2018)在分析环渤海地区河流的硝酸盐污染状态时发现, 亚硝氮和硝酸盐浓度之间没有显著的相关关系, 二者的大致关系为当硝酸盐浓度较高时, 亚硝氮浓度偏低, 反之亦然.NO3-和NO2-能够在自然光照条件下产生羟基自由基(·OH)等活性基团, 从而促进有机物发生氧化反应(Vione et al., 2014).同时, NO2-也能与·OH反应生成更稳定的物种, 从而猝灭·OH.而课题组之前的研究表明, ·OH对NP1和NP2的间接光解有明显影响(Tu et al., 2019).因此, 水体中无机氮的存在可能会通过影响系统中·OH的量而影响包括NP1和NP2在内的有机物的光降解.
依靠现有的实验条件和检测手段, 无法完全呈现化学反应过程, 而基于量子化学理论的计算研究, 可以让科研工作者更加深入地理解反应机理.Zhao等(2016)利用密度泛函理论(DFT)研究了在有氧气和氮氧化物存在下, 由·OH引发的菲在大气中的降解机制.Qu等(2018)通过理论计算研究了·OH的生成及参与光氧化过程的反应机理.Chen等(2018)根据检测到的反应产物推测反应途径, 并计算前线电子密度(FED)、点电荷、wiberg键级(BO)和自旋密度等进一步揭示反应机理.An等(2014)也将DFT理论计算与实验相结合, 研究水溶液中·OH参与的邻苯二甲酸二甲酯降解机理.目前, 将理论计算手段应用于探索环境问题的化学过程和反应机理已经逐渐成熟.
据报道, 水环境中的无机氮对于NP的光解有一定的影响(Avetta et al., 2016), 而其作用机理目前普遍认为是源于无机氮离子和NP之间对于光子的竞争.然而无机氮离子可以在光化学环境中产生多种NOx活性物种, 很明显这些活性物种的存在也极有可能对NP的光化学体系产生影响.此外, 有研究表明(Isidori et al., 2005b)NP的光解产物会对水环境造成持续影响.目前对NP降解的研究比较多, 但对其主要光解产物NP1和NP2的进一步光解研究较少.基于水环境中无机氮对NP、NP1和NP2光解影响的研究对于进一步理解NP在水环境中的光化学行为有积极的意义.因此, 本文通过实验和理论计算相结合的手段考察在紫外光照射下, 水环境中的3种无机氮对NP及其光解产物光降解的影响, 以期为评价NP、NP1和NP2在水体中的环境行为提供参考.
2 实验和计算部分(Experimental and computational methods) 2.1 主要仪器与试剂仪器:SGYIIB.Y1型多功能光化学反应仪(南京斯东柯电气设备有限公司);光源为100、120和500 W的高压汞灯, 主波长为254 nm;pHS-3C型酸度计(上海精密科学仪器有限公司);LC-20AT高效液相色谱仪(日本岛津公司);超纯水系统(Smart2 Pure, 德国TKA);MAPADA紫外可见分光光度计(UV-3200).
试剂:NP、NP1和NP2购于阿法埃莎公司, 纯度>99%;甲醇、甲酸均为色谱纯, 购于上海安谱科学仪器有限公司;硫酸铵、硝酸钠、亚硝酸钠为分析纯试剂, 购于上海国药(集团)化学试剂有限公司.
2.2 试验方法NP、NP1和NP2均易溶于甲醇, 难溶于水, 因此, 将其溶于甲醇制作成储备液备用.用移液枪移取适量的储备液, 通氮气除去其中的甲醇(Gong et al., 2000), 再用超纯水定容为10 μmol·L-1的反应液并超声振荡5 min助溶.取40 mL反应液置入40 mL石英管后放入旋转光化学反应器中.反应液初始pH由浓H2SO4和NaOH调节为7.0, 反应过程中温度控制为25 ℃.根据反应物降解的难易程度, 对NP、NP1和NP2光化学反应体系分别使用100、120和500 W汞灯进行光化学实验(3种灯的光功率强度分别为(6.35±0.05)、(8.45±0.05)、(11.32±0.10) mW·cm-2).并在反应过程中取样, 用0.45 μm的滤膜过滤, 过滤后的样品经高效液相色谱仪分析反应物剩余浓度.研究无机氮对光解反应的影响时, 分别配制含0.50 mmol·L-1的NO2-、NO3-和NH4+的反应液, 方法同上所述.
实验中采用MAPADA紫外可见分光光度计(UV-3200)分别检测了10 μmol·L-1的NP、NP1、NP2及0.5 mmol·L-1的NaNO3、NaNO2、(NH4)2SO4水溶液在200~500 nm波长范围内的吸光度.
2.3 分析方法采用高效液相色谱法(HPLC)检测溶液中NP、NP1和NP2的浓度.色谱条件为:色谱柱ZORBAX Eclipse XDB-C18(2.1 mm×150 mm, 5 μm);流动相为甲醇-0.2%甲酸水溶液(80:20, 体积比);检测器为光电二极管阵列检测器, 检测波长为242 nm, 流速为0.2 mL·min-1, 进样量为4 μL, 柱温为40 ℃.
2.4 计算方法所有的理论计算均在Gaussian 09D.01软件包下完成(Frisch et al., 2009).由于本研究涉及的光化学反应体系为纯有机体系, 因此, 对于反应体系中过渡态和中间体几何结构的优化, 使用的计算方法是对弱相互作用有较好表现的明尼苏达系列泛函中的M06-2X泛函(Zhao et al., 2008), 并添加了色散校正项Grimme′s dispersion-correction D3(Grimme et al., 2010; Grimme et al., 2011).几何结构优化选取的是3-zeta劈裂价键基组6-311+g (d, p)(Andersson et al., 2005), 单点能的计算则使用了精度更高的def2TZVPD基组(Weigend et al., 2005).此外, 溶剂化效应使用IEFPCM模型进行描述(Barone et al., 1997).本研究对优化得到的过渡态和中间体的结构进行了频率分析, 所有的中间体均没有虚频, 过渡态有且仅有一个虚频, 所有结构的能量计算都进行了热力学校正.
3 结果与讨论(Results and discussion) 3.1 无机氮对NP、NP1和NP2光解动力学的影响为了研究3种无机氮离子对NP、NP1和NP2光解体系的影响, 本研究分别对添加NH4+、NO2-、NO3-及纯水环境的NP、NP1、NP2的光化学反应体系进行了光解动力学实验研究.结果显示(图 2), 对于纯水环境的NP光解反应体系, 光解速率常数为0.0283 min-1, 当分别加入0.5 mmol·L-1的NO3-和NO2-后, 反应速率常数减小为0.0209和0.0097 min-1, 对应的半衰期由24.5 min分别降为33.2和71.5 min.此外, 添加了0.5 mmol·L-1 NH4+的NP光解体系的降解速率常数为0.0263 min-1.显然, NO3-和NO2-对于NP的光解反应有一定的抑制作用, 而NH4+对于光解速率的影响很小.对于NP1和NP2的光解体系, NH4+、NO2-、NO3-对其光解的影响与NP的光解呈现出类似的趋势.实验结果表明, 超纯水和分别添加0.5 mmol·L-1的NO3-和NO2-的NP1光解体系的降解速率常数分别为0.0889、0.0374和0.0169 min-1, 对应的半衰期分别为7.8、18.5和41.0 min.而对于NP2光解体系, 纯水、NO3-和NO2-环境下, NP2光解速率常数分别为0.1841、0.1471和0.1292 min-1, 对应的半衰期分别为3.8、4.7和5.4 min.NH4+对于NP1和NP2的光解影响也不明显.由此可见, NO3-和NO2-对于NP、NP1、NP2的光解都会造成不同程度的抑制作用, 并且NO2-的抑制作用要略强于NO3-.而NH4+对于NP、NP1和NP2的光解影响很小.
 |
| 图 2 无机氮对NP(a)、NP1(b)、NP2(c)光解的影响和NP、NP1、NP2及3种无机氮的水溶液的紫外吸收光谱(d) Fig. 2 Kinetics of NP(a), NP1(b), NP2(c) with different forms of nitrogen under UV photodegradation and UV spectra of the aqueous solutions of NP, NP1, NP2 and three different forms of inorganic nitrogen(d) |
光化学降解体系中, 无机氮的引入往往会对有机污染物的降解产生一定影响.究其原因, 一般认为无机氮和特征污染物的吸收光谱发生重叠, 会产生光屏蔽效应, 在光化学反应过程中和特征污染物竞争光子, 进而导致特征污染物的光降解效率降低(赵倩等, 2013).然而, 光化学降解包括直接光解和间接光解.对于直接光解占主导地位的光化学反应体系来说, 具有光屏蔽作用的无机氮的引入会直接导致特征污染物的光解效率降低.而对于间接光解占据主导地位的光化学反应体系, 主导光降解的主要因素是光化学作用产生的各种氧化性强的活性氧物种(Reactive Oxygen Species, ROS).NO3-和NO2-在光的作用下可以分别生成3种ROS(·NO2和·NO及·O-), 同时·O-可以迅速与H+结合形成·OH (式(1)~(3)).此外, NO2-还可以与·OH反应生成·NO2(式(2)~(4))(Vione et al., 2014).由此可见, NO3-和NO2-的引入会诱发·NO2、·NO和·OH之间的竞争机制, 进而对间接光解体系造成影响.
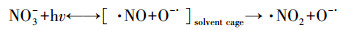
|
(1) |
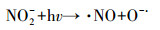
|
(2) |
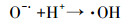
|
(3) |
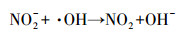
|
(4) |
通过分析3种无机氮、NP、NP1和NP2水溶液的紫外光谱图(图 2d)可知, 含NH4+的水溶液在紫外光范围内基本没有吸收, 含NO3-和NO2-的水溶液在200~230 nm范围内具有很强的吸收, NP、NP1、NP2水溶液的最大吸收峰分别出现在230、228和242 nm处.含NO3-、NO2-的水溶液的吸收光谱与NP、NP1、NP2水溶液的吸收光谱都有明显的部分重叠.由此推测, NO3-、NO2-会同光化学体系内的NP、NP1和NP2竞争光子并对其直接光解产生一定的抑制作用.NH4+在紫外光范围内基本没有吸收, 所以不会通过竞争光子来抑制反应物的光解, 实验结果也证明NH4+几乎不对NP及其产物的光解产生影响.然而NO3-、NO2-参与的NP、NP1、NP2光解体系很可能涉及光屏蔽效应和ROS竞争抑制机制, 本研究利用DFT进一步揭示NO3-、NO2-对NP、NP1、NP2光解的抑制机理.
3.3 NO3-、NO2-对于NP、NP1和NP2光解的作用机理的理论研究 3.3.1 NP、NP1、NP2光降解类型考察有机污染物的S1态和T1态跃迁类型, 可以帮助判断有机污染物的光化学反应是在S1态还是T1态下发生的.一般来说, S1态和T1态之间的能差小于42 kJ·mol-1时, 通过n→π*跃迁形成激发态;S1态与T1态之间的能差大于84 kJ·mol-1时, 通过π→π*跃迁形成激发态.本文分别计算了NP、NP1、NP2的S1态和T1态能差(表 1), 结果显示, NP是通过n→π*跃迁形成激发态且T1态占主要地位, 而NP1和NP2则是通过π→π*跃迁形成激发态.通过考察NP、NP1和NP2的前线轨道(HOMO和LUMO, 图 3)可知, NP的电子跃迁发生在羧基上, 同时有实验表明NP的光解是一个脱羧的过程(Boscá et al., 1990; Marotta et al., 2013), 可确定NP的光解是一个直接光解的过程.而NP1和NP2的电子跃迁发生在萘环上, 其直接开环难度较大, 光降解以间接光解为主.因此, NO3-、NO2-对NP光解抑制作用占主导地位的是由竞争光子造成的光屏蔽效应.NO3-和NO2-对于NP1、NP2光解抑制则是由光化学体系内的ROS竞争引起的.
| 表 1 NP、NP1和NP2的S1态和T1态的能差 Table 1 The energy gap between S1 and T1 for different species |
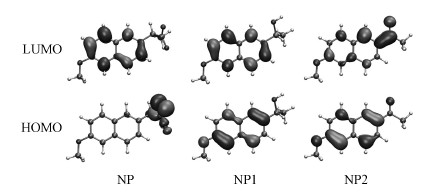 |
| 图 3 NP、NP1和NP2的HOMO和LUMO轨道 Fig. 3 Calculated HOMO-LUMO plots of NP, NP1 and NP2 |
本课题组之前的研究(Tu et al., 2019)发现, 在纯水环境下的NP1和NP2光化学体系中, ·OH对体系的光化学反应的贡献最大.本研究的光化学实验结果表明, NO3-、NO2-的引入会对NP1和NP2的光降解效率产生一定的抑制作用, 推测很可能是因为NO3-和NO2-在光化学体系中产生的·NO2和·NO会与体系中的·OH形成竞争关系, 从而导致NP1和NP2光降解率的变化.根据课题组前期的研究结果(Tu et al., 2019), 在NP1的光解过程中, ROS对于仲碳(C11)上氢的攻击步骤是整个NP1光解反应的决速步, 而对于NP2而言, 最容易受到ROS攻击的位点是萘环上的C2.为了研究NO3-和NO2-对NP1、NP2光解的抑制机理, 本文对光化学体系中3种自由基(·NO2、·NO和·OH)氧化NP1和NP2的间接光解过程进行了深入研究.
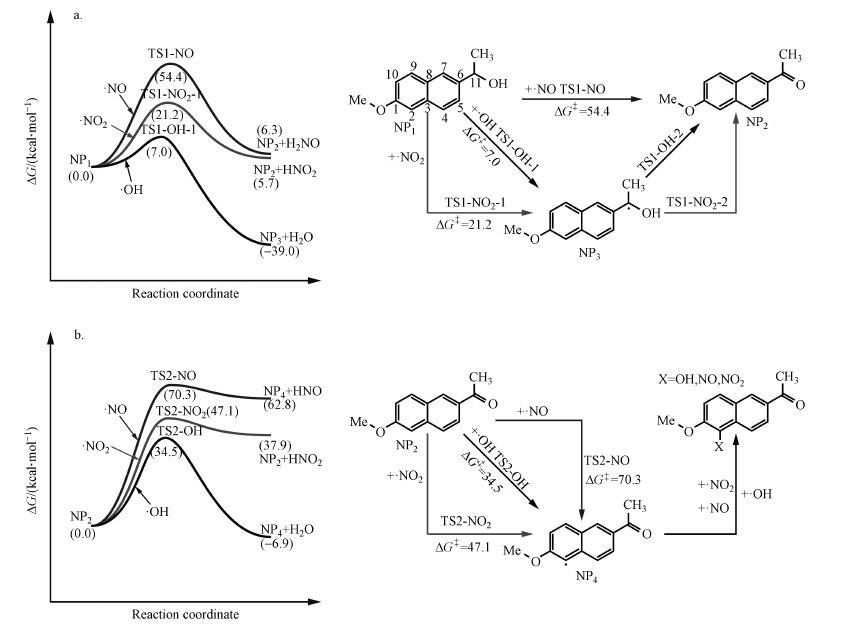
如图 4a所示, ·NO2和·OH对于NP1的夺氢氧化过程包括2个步骤:首先·NO2(或者·OH)攻击NP1的C11导致其脱氢(经过TS1-NO2-1或TS1-OH-1), 形成一个仲碳自由基结构(NP3);然后NP3会继续被另外一个·NO2(或者·OH)攻击, 夺走其羟基上的质子(经过TS1-NO2-2或TS1-OH-2), 最终生成NP2.·NO同样也能将NP1氧化成NP2.不同的是, ·NO会同时对NP1的C11和羟基位置发起攻击, 导致一次脱2个氢, 经过一个基元反应直接生成NP2.对于·NO2和·OH参与的NP1光降解反应而言, 第一步夺氢反应是决速步(Tu et al., 2019), 所以本研究重点考察第一步反应.从研究结果来看, ·OH、·NO2和·NO主导的NP1光降解反应的活化能垒分别为7.0、21.2和54.4 kcal·mol-1.很明显, ·OH主导的NP1光降解过程的反应速度是最快的, 而·NO2和·NO则要慢很多.事实上, 实验结果也证实由于NO3-、NO2-的引入而产生了·NO2和·NO的光化学体系要比纯水体系(·OH占主要地位)的反应速度慢不少.所有的过渡态TS1-OH-1、TS1-NO2-1和TS-NO-1的几何结构及主要参数如图 5所示.
 |
| 图 4 NP1(a)和NP2(b)分别与·OH、·NO2、·NO光化学反应的机理及反应的能垒图 Fig. 4 The reaction mechanisms and the potential energy profiles for photodegradation of NP1 (a) and NP2 (b) with ·OH, ·NO2 and ·NO |
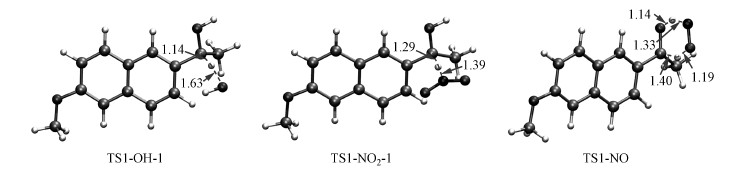 |
| 图 5 NP1分别与·OH、·NO2和·NO反应的过渡态的几何结构及主要参数(单位:Å) Fig. 5 Calculated key structural parameters of transition states for photodegradation of NP1, bond lengths (Å) are shown |
NP2的光化学反应过程主要是C2位的去质子化过程(图 4b), ·OH、·NO2和·NO都可以完成对C2位的攻击, 夺取C2上的质子生成萘环自由基结构(NP4), NP4可以进一步和自由基耦合(无能垒的过程).3种活性物种·OH、·NO2和·NO对NP2光化学反应的活化能垒分别为34.5、47.1和70.3 kcal·mol-1.同样的理论计算的结果也可以很好地解释NO3-、NO2-对NP2光降解体系的抑制作用(添加NO2-的NP2光化学体系光解速率最慢, 添加NO3-体系次之, 纯水体系最快).从过渡态的几何结构分析可知(图 6), C2与H之间的距离TS2-NO是最大的(1.91 Å), 其次是TS2-NO2(1.53 Å), 最小的是TS2-OH(1.23 Å), 说明·NO和·NO2参与反应的过渡态更靠近产物端.此外, NP2的光化学反应的活化能垒要比NP1的大(ΔGNP1-OH‡=7.0 kcal·mol-1, ΔGNP2-OH‡=34.5 kcal·mol-1), 证明NP1的光降解速率要比NP2的快, 这一点与实验得到的结果也是一致的.
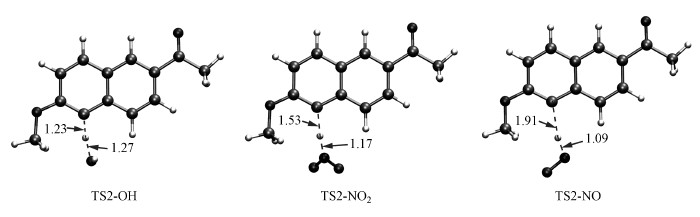 |
| 图 6 NP2分别与·OH、·NO2和·NO反应的过渡态的几何结构及主要参数(单位:Å) Fig. 6 Calculated key structural parameters of transition states for photodegradation of NP2, bond lengths (Å) are shown |
1) NP及其光解产物NP1和NP2在紫外光照条件下的光降解均可以用伪一级反应动力学来模拟.NH4+在紫外光区几乎无吸收, 对NP、NP1和NP2光解的影响也并不明显.NO3-和NO2-的加入则导致光解速率不同程度的下降.NO3-和NO2-对于NP光解的抑制主要是光屏蔽效应主导的, 而NO3-、NO2-对于NP1和NP2光解的抑制作用更多的是由ROS(·NO2、·NO和·OH)之间的竞争性抑制造成的.
2) 通过计算物质的S1态和T1态能差, 发现NP是通过n→π*跃迁形成激发态, 而NP1和NP2则是通过π→π*跃迁形成激发态.通过考察NP、NP1和NP2的前线轨道可知, NP的电子跃迁发生在羧基上.因此, NP的光解是一个脱羧的直接光解过程, 而NP1和NP2的光解则以间接光解为主.
3) 进一步研究·NO2、·NO和·OH氧化NP1和NP2的光化学机理, 可知·OH参与的氧化路径的活化能垒最小(ΔGNP1-OH‡=7.0 kcal·mol-1, ΔGNP2-OH‡=34.5 kcal·mol-1), ·NO2次之(ΔGNP1-NO2‡=21.2 kcal·mol-1, ΔGNP2-NO2‡=47.1 kcal·mol-1), ·NO最大(ΔGNP1-NO‡=54.4 kcal·mol-1, ΔGNP2-NO‡=70.3 kcal·mol-1).活化能垒的差异表明, 光化学反应体系中生成的·NO2和·NO将会导致反应速率下降.这也从反应机理上诠释了NO3-、NO2-的引入对于NP1和NP2光降解将产生抑制作用.
An T, Gao Y, Li G, et al. 2014. Kinetics and mechanism of ·OH mediated degradation of dimethyl phthalate in aqueous solution: Experimental and theoretical studies[J]. Environmental Science & Technology, 48(1): 641-648. |
Andersson M P, Uvdal P. 2005. New scale factors for harmonic vibrational frequencies using the B3LYP Density functional method with the triple-ζ basis set 6-311+G(d, p)[J]. The Journal of Physical Chemistry A, 109(12): 2937-2941. DOI:10.1021/jp045733a |
Avetta P, Fabbri D, Minella M, et al. 2016. Assessing the phototransformation of diclofenac, clofibric acid and naproxen in surface waters:Model predictions and comparison with field data[J]. Water Research, 105: 383-394. DOI:10.1016/j.watres.2016.08.058 |
Barone V, Cossi M, Tomasi J. 1997. A new definition of cavities for the computation of solvation free energies by the polarizable continuum model[J]. The Journal of Chemical Physics, 107(8): 3210-3221. DOI:10.1063/1.474671 |
Boscá F, Marin M L, Miranda M A. 2001. Photoreactivity of the nonsteroidal anti‐inflammatory 2‐arylpropionic Acids with Photosensitizing Side Effects[J]. Photochemistry and Photobiology, 74(5): 637-655. DOI:10.1562/0031-8655(2001)074<0637:POTNAI>2.0.CO;2 |
Boscá F, Miranda M A, Vañó L, et al. 1990. New photodegradation pathways for Naproxen, a phototoxic non-steroidal anti-inflammatory drug[J]. Journal of Photochemistry and Photobiology A:Chemistry, 54(1): 131-134. DOI:10.1016/1010-6030(90)87018-7 |
Chen J, Wu N, Xu X, et al. 2018. Fe(Ⅵ)-mediated single-electron coupling processes for the removal of chlorophene:A combined experimental and computational study[J]. Environmental Science & Technology, 52(21): 12592-12601. |
Chen P, Lv W, Chen Z, et al. 2015. Phototransformation of mefenamic acid induced by nitrite ions in water:mechanism, toxicity, and degradation pathways[J]. Environmental Science and Pollution Research, 22(16): 12585-12596. DOI:10.1007/s11356-015-4537-0 |
Dai G, Huang J, Chen W, et al. 2014. Major Pharmaceuticals and Personal Care Products (PPCPs) in wastewater treatment plant and receiving water in Beijing, China, and associated ecological risks[J]. Bulletin of Environmental Contamination and Toxicology, 92(6): 655-661. DOI:10.1007/s00128-014-1247-0 |
Doll T E, Frimmel F H. 2003. Fate of pharmaceuticals-photodegradation by simulated solar UV-light[J]. Chemosphere, 52(10): 1757-1769. DOI:10.1016/S0045-6535(03)00446-6 |
Frisch M J, Trucks G W, Schlegel H B, et al.2009.Gaussian 09 D.01[CP].Gaussian, Inc.: Wallingford, CT
|
Gong Y K, Miyamoto T, Nakashima K, et al. 2000. Photoinduced electron transfer from 3-(9-Anthracene)propyltrimethyl ammonium bromide and pyrene to methyl viologen on the surface of polystyrene latex particles[J]. The Journal of Physical Chemistry B, 104(24): 5772-5778. DOI:10.1021/jp993898r |
Grenni P, Patrolecco L, Ademollo N, et al. 2013. Degradation of Gemfibrozil and Naproxen in a river water ecosystem[J]. Microchemical Journal, 107: 158-164. DOI:10.1016/j.microc.2012.06.008 |
Grimme S, Antony J, Ehrlich S, et al. 2010. A consistent and accurate ab initio parametrization of density functional dispersion correction (DFT-D) for the 94 elements H-Pu[J]. The Journal of Chemical Physics, 132(15): 154104. DOI:10.1063/1.3382344 |
Grimme S, Ehrlich S, Goerigk L. 2011. Effect of the damping function in dispersion corrected density functional theory[J]. Journal of Computational Chemistry, 32(7): 1456-1465. DOI:10.1002/jcc.21759 |
Isidori M, Lavorgna M, Nardelli A, et al. 2005a. Ecotoxicity of naproxen and its phototransformation products[J]. Science of The Total Environment, 348(1): 93-101. |
Isidori M, Lavorgna M, Nardelli A, et al. 2005b. Ecotoxicity of naproxen and its phototransformation products[J]. Science of the Total Environment, 348(1/3): 93-101. |
Kang Y M, Kim M K, Zoh K D. 2018. Effect of nitrate, carbonate/bicarbonate, humic acid, and H2O2 on the kinetics and degradation mechanism of Bisphenol-A during UV photolysis[J]. Chemosphere, 204: 148-155. DOI:10.1016/j.chemosphere.2018.04.015 |
Karnjanapiboonwong A, Suski J G, Shah A A, et al. 2011. Occurrence of PPCPs at a wastewater treatment plant and in soil and groundwater at a land application site[J]. Water, Air, & Soil Pollution, 216(1): 257-273. |
冷佩芳, 李发东, 古丛珂, 等. 2018. 基于集成分析的环渤海地区河流硝酸盐污染解析[J]. 环境科学学报, 38(4): 1537-1548. |
Malouki M A, Lavédrine B, Richard C. 2005. Phototransformation of methabenthiazuron in the presence of nitrate and nitrite ions[J]. Chemosphere, 60(11): 1523-1529. DOI:10.1016/j.chemosphere.2005.02.080 |
Marotta R, Spasiano D, Di Somma I, et al. 2013. Photodegradation of naproxen and its photoproducts in aqueous solution at 254 nm:A kinetic investigation[J]. Water Research, 47(1): 373-383. DOI:10.1016/j.watres.2012.10.016 |
Miller T R, Heidler J, Chillrud S N, et al. 2008. Fate of triclosan and evidence for reductive dechlorination of triclocarban in estuarine sediments[J]. Environmental Science & Technology, 42(12): 4570-4576. |
Mohapatra S, Huang C H, Mukherji S, et al. 2016. Occurrence and fate of pharmaceuticals in WWTPs in India and comparison with a similar study in the United States[J]. Chemosphere, 159: 526-535. DOI:10.1016/j.chemosphere.2016.06.047 |
Qu R, Li C, Liu J, et al. 2018. Hydroxyl radical based photocatalytic degradation of halogenated organic contaminants and paraffin on silica gel[J]. Environmental Science & Technology, 52(13): 7220-7229. |
Radke M, Ulrich H, Wurm C, et al. 2010. Dynamics and attenuation of acidic pharmaceuticals along a river stretch[J]. Environmental Science & Technology, 44(8): 2968-2974. |
Selke S, Scheurell M, Shah M R, et al. 2010. Identification and enantioselective gas chromatographic mass-spectrometric separation of O-desmethylnaproxen, the main metabolite of the drug naproxen, as a new environmental contaminant[J]. Journal of Chromatography A, 1217(3): 419-423. DOI:10.1016/j.chroma.2009.11.095 |
Tu N, Liu Y, Li R, et al. 2019. Experimental and theoretical investigation on photodegradation mechanisms of naproxen and its photoproducts[J]. Chemosphere, 227: 142-150. DOI:10.1016/j.chemosphere.2019.04.055 |
Vione D, Minella M, Maurino V, et al. 2014. Indirect photochemistry in sunlit surface waters:Photoinduced production of reactive transient species[J]. Chemistry-A European Journal, 20(34): 10590-10606. DOI:10.1002/chem.201400413 |
Weigend F, Ahlrichs R. 2005. Balanced basis sets of split valence, triple zeta valence and quadruple zeta valence quality for H to Rn:Design and assessment of accuracy[J]. Physical Chemistry Chemical Physics, 7(18): 3297-3305. DOI:10.1039/b508541a |
Zhang N, Liu G, Liu H, et al. 2011. Diclofenac photodegradation under simulated sunlight:Effect of different forms of nitrogen and Kinetics[J]. Journal of Hazardous Materials, 192(1): 411-418. |
Zhao N, Zhang Q, Wang W. 2016. Atmospheric oxidation of phenanthrene initiated by OH radicals in the presence of O2 and NOx—A theoretical study[J]. Science of the Total Environment, 563-564: 1008-1015. DOI:10.1016/j.scitotenv.2016.01.089 |
赵倩, 陈超, 封莉, 等. 2013. 不同形态无机氮对水中微量药物安替比林光降解效能影响[J]. 环境科学, 34(7): 2665-2669. |
Zhao Y, Truhlar D G. 2008. The M06 suite of density functionals for main group thermochemistry, thermochemical kinetics, noncovalent interactions, excited states, and transition elements:two new functionals and systematic testing of four M06-class functionals and 12 other functionals[J]. Theoretical Chemistry Accounts, 120(1): 215-241. |
Zuo Y, Li X, Wang W, et al. 2006. Catastrophe model and its experimental verification of static loading rock system under impact load[J]. Journal of Central South University of Technology, 13(3): 281-285. DOI:10.1007/s11771-006-0124-3 |
 2019, Vol. 39
2019, Vol. 39


