微生物胞外聚合物作为金属离子的“载体”(Bhatnagar et al., 2017), 在生物处理和生物修复中起到关键作用(Seviour et al., 2019), 它对金属离子的络合影响其形态、流动性、生物利用度和生物修复的效率(Tourney et al., 2014; Decho et al., 2017).尤其是对于不会发生微生物或化学降解的重金属离子, 微生物胞外聚合物的存在对于重金属离子的迁移、转化和归宿具有重要影响.由于微生物胞外聚合物广泛分布于水体系和土壤中, 因而了解它对重金属迁移的影响可以帮助评估重金属的生态风险, 并且有助于微生物胞外聚合物对污染土壤和水体系的生物处理和生物修复的应用.
地衣芽孢杆菌(Bacillus lichenformis)是一种常见的土壤微生物, 可生产γ-谷氨酸(γ-PGA)胞外聚合物.该胞外聚合物也可由其他芽孢杆菌属细菌产生, 如枯草芽孢杆菌、巨大芽孢杆菌、短小芽孢杆菌、莫氏芽孢杆菌、解淀粉芽孢杆菌和炭疽芽孢杆菌等(Bajaj et al., 2011; Ogunleye et al., 2015; Sirisansaneeyakul et al., 2017).γ-PGA分子的侧链中含有羧基, 可与阳离子结合.γ-PGA因其在水处理中去除重金属的潜在应用而具有特殊的研究意义(Xu et al., 2015; Sakamoto et al., 2016).
γ-PGA与金属离子的结合性能最早由Mclean等(1990a; 1992b)研究, 研究结果发现Cu2+、Al3+、Cr3+和Fe3+有促进γ-PGA絮凝的作用, 而Na+、Mg2+、Ca2+、Mn2+和Ni2+却不能, 认为不同金属离子与γ-PGA的结合性能受到γ-PGA自身及离子的物化性质影响.Yao等(2007)发现在pH为3~6时, γ-PGA吸附重金属Cr3+、Cu2+、Ni2+的量随着pH的增加而增大, 且吸附量Q(Cr3+) >Q(Cu2+) > Q(Ni2+).He等(2000)利用衰减全反射-傅里叶变换红外光谱(ATR-FTIR)研究了γ-PGA与U(Ⅵ)的相互作用, 认为在不同条件下聚合物构型的变化可能影响暴露的表面官能团的数量和性质, 而表面官能团是结合金属的位点, 从而导致γ-PGA与U(Ⅵ)在不同条件下结合性能的差异.γ-PGA自身的构型主要有α-螺旋结构、β-折叠和无规线团3种(He et al., 2000).然而这种由于阳离子自身的物化性质(离子特异性)和γ-PGA自身分子构型变化对γ-PGA吸附金属离子产生的影响, 却未在γ-PGA与金属离子之间的相互作用研究中被深入解析.
因为Pb2+是一种重要的有害重金属并且能够有效地对γ-PGA絮凝, 而常见的二价金属阳离子Ca2+和Mg2+对γ-PGA无絮凝作用.因此, 本研究的目的是利用圆二色谱(CD)获得γ-PGA结合重金属离子Pb2+前后的二级结构变化, 并与常见二价金属离子Ca2+和Mg2+比较, 同时结合Zeta电势、吸附量、红外光谱等技术, 深入解析γ-PGA与金属离子相互作用时的离子特异性机理, 以期为微生物胞外聚合物对金属离子的迁移、转化和归宿产生的重要影响提供参考.
2 材料与方法(Materials and methods) 2.1 γ-PGA的纯化本实验所用的γ-PGA购买自广东迪美生物技术有限公司, 为地衣芽孢杆菌(B. licheniformis)ATCC 9945A发酵生产.将所购的γ-PGA(5% w/w)溶液用载有分子截留量为10 kDa聚醚砜超滤膜的装置(Millipore公司, 美国)浓缩, 再加入5~6倍体积的去离子水稀释, 反复浓缩和稀释至少10次, 以去除离子和小分子物质.随后对获得的γ-PGA浓缩液用0.22 μm亲水性PTFE过滤膜过滤并冻干.获得的γ-PGA固体保存在干燥器中.
2.2 γ-PGA的表征γ-PGA样品水解后, 通过薄层色谱分析法(TLC)确认水解液中只含有谷氨酸, 同时利用比色法测定水解液中的谷氨酸含量(Wang et al., 2017).γ-PGA水解液中的金属含量使用电感耦合等离子体质谱仪(ICP-MS, 7700X, Agilent Inc., 美国)分析.γ-PGA的分子量使用配有Waters UltrahydrogelTM Linear柱和示差折光检测器的凝胶渗透色谱(LC-20A, Shimadzu, 日本)测定.凝胶渗透色谱实验条件为:流动相为0.01 mol·L-1柠檬酸-柠檬酸钠缓冲液(pH 5.0), 流速为0.5 mL·min-1, 柱温35 ℃, 进样体积为10.0 μL, 运行时间为30 min.使用单分散的一系列PEO标准品(American Polymer Standards Co., Mp范围为83600~1001000)进行分子量标定.
2.3 圆二色谱(CD)测试CD实验采用Chirascan光谱仪(Applied Photophysics Co., 英国), 使用1 cm石英比色皿, 采集波长为190~260 nm.γ-PGA溶液的浓度为10 mg·L-1, 使用微量HCl和NaOH调节pH.由于NaCl会对CD信号产生影响, 故使用NaF调节溶液离子强度.CD光谱利用软件CDNN 2.1(GeraldBöhm, Martin-Luther-UniversitätHalle-Wittenberg, 德国)进行分析, 以获得γ-PGA二级结构中α-螺旋、β-折叠、β-转角和无规线团的含量.
2.4 伏安极谱滴定伏安极谱法可有效地区分溶液中游离和结合金属离子的含量(d′Abzac et al., 2010; Yin et al., 2013).溶液状态下的γ-PGA/Pb2+结合量使用797VA Computrace(Metrohm, 瑞士)极谱法测量, 工作电极为静态滴汞电极, 参比电极为Ag/AgCl, 对电极为Pt, 仪器参数列于表 1.
| 表 1 伏安极谱法参数 Table 1 Voltammetric parameters used for polarographic measurements |
用于伏安极谱法测定的溶液含有10 mg·L-1 γ-PGA和10 mmol·L-1 NaNO3支持电解质.溶液的初始体积为20 mL, 搅拌溶液并通过加入微量的NaOH或HNO3溶液调节至所需的pH, 测量温度为25 ℃.在通氮气5 min后对初始γ-PGA溶液进行空白扫描, 之后每次滴加25或50 μL 7.7 mmol·L-1 Pb(NO3)2并调节pH, 通氮气5 min后测量.γ-PGA/Pb2+结合量可通过滴定曲线获得.
2.5 Zeta电势测定Zeta电势采用美国Nano Brook Omni多角度粒度及高灵敏度Zeta电位分析仪分析.为了获得足够的信号, Zeta电势测定时γ-PGA的浓度为1 g·L-1, 离子强度为10 mmol·L-1 NaCl, 氯化钙或氯化镁的浓度与γ-PGA谷氨酸结构单元的比例为1:2(由于γ-PGA与金属离子的作用基团为侧链上的羧基, 所以将γ-PGA的量归一化为γ-PGA谷氨酸结构单元的量, 一个谷氨酸结构单元含一个羧基).pH用HCl和NaOH调节, 溶液测试前使用0.45 μm亲水性PTFE针式过滤器过滤.样品测定温度为25 ℃, 每个样品平行检测3次, 每次扫描至少10次, 测定结果使用Zeta电势质量报告进行评估, 确保正确性.
2.6 傅里叶红外光谱(FTIR)分析γ-PGA、γ-PGA/CaCl2和γ-PGA/MgCl2为溶液状态, 故采用衰减全反射(ATR)FTIR进行分析.为了在红外光谱中获得足够的信号, γ-PGA的浓度为40 mmol·L-1谷氨酸结构单元, CaCl2或MgCl2的浓度为20、40和80 mmol·L-1.溶液pH用0.1 mol·L-1 NaOH调节至6.5, 检测器为RT-DLaTG(Bruker公司, 德国), 光谱仪为Tensor Ⅱ FTIR(Bruker公司, 德国), 使用水平衰减全反射(ATR)附件(PIKE Technologies, 德国)测量1 mL液体样品, 采集波数范围为4000~400 cm-1, 以4 cm-1分辨率进行16次扫描.通过从样品光谱中减去去离子水的光谱获得最终的ATR-FTIR光谱.
在pH 5.0的γ-PGA溶液(1 mmol·L-1谷氨酸结构单元)中加入1 mmol·L-1 PbCl2后迅速出现沉淀, 将沉淀物用0.45 μm的滤膜过滤并用去离子水洗涤以去除残留的离子, 冻干后直接与FTIR级KBr粉末混合进行测试.为了比较, 使用0.1 mol·L-1 HCl或NaOH调节γ-PGA溶液(10 mmol·L-1谷氨酸结构单元)至pH3.0、5.0和7.0, 冻干并进行FTIR测试.所有样品均在Tensor Ⅱ FTIR仪器(Bruker公司, 德国)上测试.
3 结果和讨论(Results and discussion) 3.1 γ-PGA表征通过TLC分析确认γ-PGA水解液中只含有谷氨酸, 比色法测得谷氨酸含量为(7.00±0.21) mmol·g-1.γ-PGA中的主要金属离子为Na, 含量为(24.41±0.27) mg·g-1, 占2.44%.另外含有微量Mg和K, 其含量分别为(0.23±0.001) mg·g-1和(0.78±0.02) mg·g-1.其余金属离子, 包括Pb、Cu、Ni、Cd、Cr、Al、Zn和Ba, 在γ-PGA中未被检测出或可忽略不计(< 0.02 mg·g-1).基于谷氨酸和金属离子含量结果, γ-PGA样品主要以γ-PGA酸(γ-PGA-H, 5.94 mmol·g-1)形式存在, 一小部分γ-PGA以钠盐(γ-PGA-Na, 1.06 mmol·g-1)形式存在.γ-PGA的纯度测定为93%, 分子量(Mw)为2.59×105 g·moL-1.
3.2 pH和离子强度对γ-PGA二级结构的影响图 1显示的是不同pH(0 mmol·L-1 NaF)和不同离子强度(pH 5.0)条件下典型的CD谱图.而利用CD光谱软件CDNN 2.1获得的γ-PGA二级结构中α-螺旋、β-折叠、β-转角和无规线团的含量则如图 2所示.γ-PGA的pKa为4.86(Wang et al., 2017), 图 2a中的插图说明了pH对γ-PGA中γ-PGA-H组分含量的影响, 即pH为3.0时, γ-PGA主要以γ-PGA-H形式存在, 当pH从3.0增加到7.0时, γ-PGA-H电离形成阴离子γ-PGA-形式.随着pH从3.0上升到6.7, γ-PGA二级结构中的α-螺旋含量下降, 且其下降趋势与γ-PGA-H含量随pH上升而下降的趋势一致.同时, γ-PGA二级结构中的β-转角含量略微下降, β-折叠和无规线团结构含量上升.与pH相比, 离子强度在0~50 mmol·L-1的范围内对γ-PGA的二级结构影响不大.
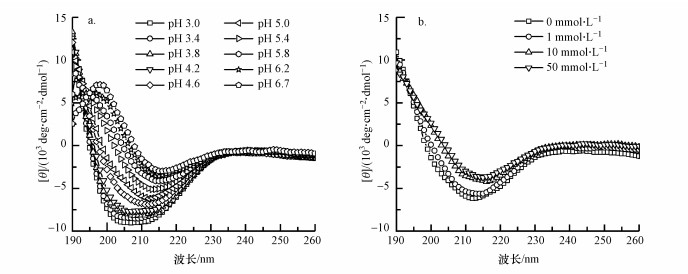 |
| 图 1 不同pH时10 mg·L-1 γ-PGA(0 mmol·L-1 NaF)的CD光谱(a)和pH为5.0时不同离子强度(0、1、10、50 mmol·L-1 NaF)下10 mg·L-1 γ-PGA的CD光谱(b) Fig. 1 Typical CD spectroscopy of 10 mg·L-1 γ-PGA at different pH values (0 mmol·L-1 NaF) (a) and typical CD spectroscopy of 10 mg·L-1 γ-PGA at different ionic strength values (pH 5.0) (b) |
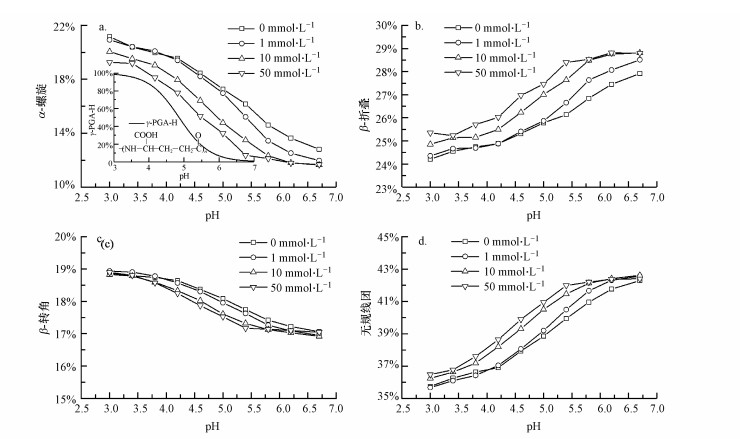 |
| 图 2 pH和离子强度(0、1、10、50 mmol·L-1 NaF)对10 mg·L-1 γ-PGA的α-螺旋(a)、β-折叠(b)、β-转角(c)和无规线团(d)结构的影响 ((a)中的插图为γ-PGA中γ-PGA-H组分含量随pH的变化) Fig. 2 Effects of pH and ionic strength (0, 1, 10, 50 mmol·L-1 NaF) on the α-helix (a), β-sheet (b), β-turn (c) and random coil (d) structures of 10 mg·L-1 γ-PGA (the inset in (a) represents the effect of pH on the γ-PGA-H fraction) |
γ-PGA的二级结构受分子内作用力的影响(Wang et al., 2017).在酸性条件下, γ-PGA结构通过分子内氢键稳定.分子内氢键有两种, 一种在γ-PGA分子骨架中的CO和NH之间, 另一种在侧链羧基氧和骨架NH之间(Zanuy et al., 1998).理论模型表明, 在酰胺基团第i个CO和酰胺基团第i+3个NH之间形成的19元环氢键是最稳定的构象.而侧链羧基氧和骨架NH之间形成的氢键是左旋螺旋相对高稳定性的原因(Zanuy et al., 1998).
γ-PGA分子在较高pH条件下采用的结构可归因于两个因素.首先, γ-PGA分子侧链上的羧基由于去质子化不能保持侧链和骨架之间的氢键.其次, 随着pH上升, 不断增加的带负电的羧基基团具有更强的静电排斥力, 使其向更加无规的结构转变.原子力显微镜(AFM)图像显示, 由于分子内氢键断裂和静电斥力增加, 酸性条件下的γ-PGA-H由棒状变为碱性条件下球状的γ-PGA-Na(Wang et al., 2017).其他研究者也观察到类似的结果:Agresti等(2008)观察到溶液pH从7.2降低到3.0时, γ-PGA的构型从无规线团变为α-螺旋;地衣芽孢杆菌的γ-PGA在低pH下呈现螺旋构型并在较高pH下β-折叠的构型占主导(He et al., 2000).与pH对γ-PGA构型的显著影响不同, 在0、1、10、50 mmol·L-1 NaF条件下, 离子强度对γ-PGA构型几乎没有影响.这可能是由于强的分子内氢键阻碍了钠离子取代γ-PGA侧链羧基上的氢离子.
3.3 Ca2+、Mg2+和Pb2+对γ-PGA二级结构的影响图 3为相同浓度的Ca2+、Mg2+和Pb2+在不同pH条件下对γ-PGA二级结构的影响, Ca2+、Mg2+和Pb2+浓度与γ-PGA谷氨酸结构单元的比例均为1:2.如图所示, Ca2+和Mg2+的加入对γ-PGA二级结构并无影响, 而Pb2+的加入则对γ-PGA二级结构产生了显著影响.在未加入二价离子时, pH为3.0时γ-PGA的二级结构由20.1%α-螺旋、24.9%β-折叠、18.8%β-转角和36.3%无规线团组成.随着pH增加至6.7, α-螺旋从20.1%减少到11.7%, β-折叠和无规线团分别从24.9%和36.3%增加到28.8%和42.6%, β-转角的含量从18.8%略微下降到16.9%.加入Pb2+后, pH为3.0时γ-PGA的二级结构由17.0%α-螺旋、26.5%β-折叠、18.6%β-转角和37.9%无规线团组成.随着pH增加至6.7, α-螺旋的含量减少至5.2%, β-折叠和无规线团的含量分别增加至35.2%和44.0%, β-转角的含量从18.8%略微下降到15.5%.Pb2+的加入, 不仅使γ-PGA的二级结构在pH的影响下变化更显著, 更使得γ-PGA的二级结构变化在较低pH时便已达到, 即在pH约为γ-PGA的pKa(4.86)时, γ-PGA的二级结构变化开始变得稳定.
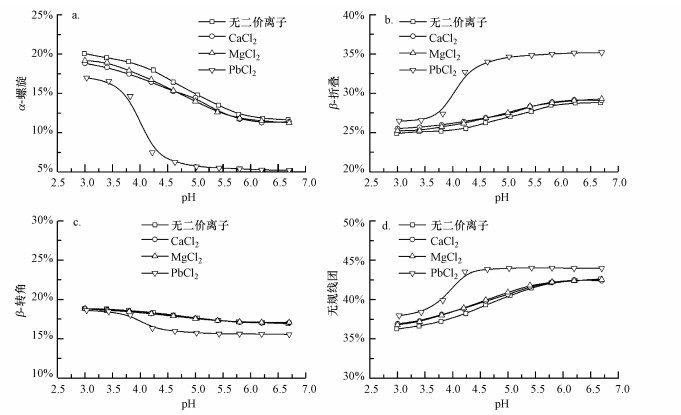 |
| 图 3 不同二价离子(Ca2+、Mg2+和Pb2+)对10 mg·L-1 γ-PGA的α-螺旋(a)、β-折叠(b)、β-转角(c)和无规线团(d)结构的影响 (离子强度为10 mmol·L-1 NaF, Ca2+、Mg2+和Pb2+浓度与γ-PGA谷氨酸结构单元的摩尔比例均为1:2) Fig. 3 Effect of different divalent ion (Ca2+, Mg2+ and Pb2+) on the α-helix (a), β-sheet (b), β-turn (c) and random coil (d) structures of 10 mg·L-1 γ-PGA (All experiments were conducted with 10 mg·L-1 γ-PGA in 10 mmol·L-1 NaF; The values of Ca2+:glutamate, Mg2+:glutamate and Pb2+:glutamate molar ratios were the same, 1:2) |
阳离子对γ-PGA结构的影响取决于离子的性质, 如尺寸、电荷密度、水合能力和电负性等(Bostrom et al., 2001).在Ca2+、Mg2+和Pb2+这3种离子中, 只有Pb2+具有改变γ-PGA二级结构的能力.从表 2中可以看出, 这种差异可能与以下原因有关:首先Pb2+具有较高的电负性以吸引COO-基团(Siao et al., 2009);其次Pb2+自身的有效离子半径更大, 且能与更多的H2O配位, 由于空间位阻效应, 这种较大的水合离子可能会破坏骨架中CO和NH之间的氢键.
| 表 2 Pb、Ca和Mg的电负性、离子电荷、有效离子半径和第一水合层的水分子数 Table 2 Electronegativity values, ion charge, effective ionic radii and coordination H2O number in first hydration shell of the Pb, Ca and Mg |
Mclean等研究了γ-PGA与Ca2+、Mg2+的结合特性(Mclean et al., 1990).pH为5.2时, 当Ca2+或Mg2+与谷氨酸结构单元比例为1:2时, Ca2+或Mg2+能够使γ-PGA吸附饱和, Ca2+或Mg2+的结合量相似, 均测定为约2.0 mmol ·g-1(γ-PGA干重).图 4所示为γ-PGA、γ-PGA/Ca2+、γ-PGA/Mg2+(Ca2+和Mg2+浓度与γ-PGA谷氨酸结构单元的比例均为1:2)的Zeta电势.在pH 3.0时, 由于γ-PGA未电离, Zeta电势值为(-3.06 ± 0.90) mV, 随着pH上升, γ-PGA侧链上的羧基解离, Zeta电势值逐渐下降, pH为6.7时为(-8.90 ± 1.39) mV.在加入Ca2+或Mg2+后, 由于γ-PGA吸附了Ca2+或Mg2+, Zeta电势值随着pH的上升而下降的速度变缓, 在pH为6.7时γ-PGA/Ca2+和γ-PGA/Mg2+的Zeta电势值分别为(-5.14 ± 0.39) mV和(-6.91 ± 1.07)mV.结合CD光谱的结果可发现, 虽然Ca2+或Mg2+能够与γ-PGA结合, 但结合的Ca2+或Mg2+却不会改变γ-PGA分子的二级结构.
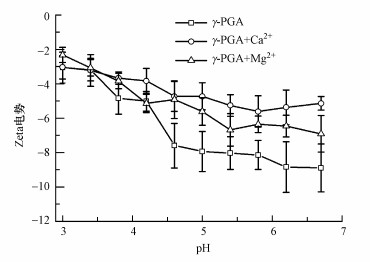 |
| 图 4 γ-PGA、γ-PGA/Ca2+、γ-PGA/Mg2+(1 g·L-1 γ-PGA, Ca2+和Mg2+浓度与γ-PGA谷氨酸结构单元的摩尔比例均为1:2)的Zeta电势 Fig. 4 Zeta potentials of γ-PGA、γ-PGA/Ca2+ and γ-PGA/Mg2+ (1 g·L-1 γ-PGA, the values of Ca2+:glutamate and Mg2+:glutamate molar ratios were the same, 1:2) |
图 5所示为Pb2+浓度对γ-PGA/Pb2+络合物二级结构的影响, 因为有一部分Pb2+并未结合到γ-PGA上, 因此图 6显示的则是对应的相同Pb2+浓度下结合到γ-PGA(干重)上的Pb2+的量.从图 5可知, γ-PGA/Pb2+络合物的二级结构与γ-PGA的二级结构有显著差异.当加入Pb2+时, α-螺旋和β-转角含量降低, β-折叠和无规卷曲含量增加.如前所述, α-螺旋通过分子内氢键稳定, γ-PGA在pH为3.0处为酸形式(γ-PGA-H).在pH 3.0下, 没有COO-使Pb2+络合.随着pH的增加, COOH基团的电离使COO-可用于Pb2+络合.此外, 由于在较高pH下从棒状到球状的结构演变使得γ-PGA的分子构型变得更为松散(Wang et al., 2017), 使得Pb2+更易进入分子链, 降低了Pb2+进入γ-PGA的空间阻力.
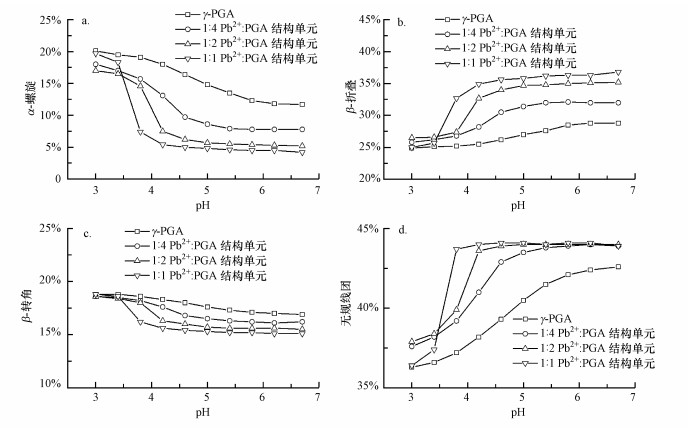 |
| 图 5 不同铅离子浓度对10 mg·L-1 γ-PGA的α-螺旋(a)、β-折叠(b)、β-转角(c)和无规线团(d)结构的影响 (10 mmol·L-1 NaF离子强度, Pb2+:谷氨酸结构单元摩尔比分别为1:4、1:2和1:1) Fig. 5 Effects of Pb2+ concentrations on the α-helix (a), β-sheet (b), β-turn (c) and random coil (d) structures of complexed Pb2+ with γ-PGA (All experiments were conducted with 10 mg·L-1 γ-PGA in 10 mmol·L-1 NaF. The values of Pb2+:glutamate molar ratios were 1:4, 1:2 and 1:1, respectively) |
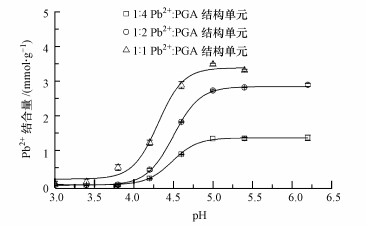 |
| 图 6 不同铅离子浓度下γ-PGA结合Pb2+的量 (10 mg·L-1 γ-PGA, 10 mmol·L-1 NaCl离子强度, Pb2+:谷氨酸结构单元摩尔比分别为1:4、1:2和1:1) Fig. 6 The amount of complexed Pb2+ with γ-PGA at different Pb2+ concentrations (10 mg·L-1 γ-PGA, 10 mmol·L-1 NaCl, the values of Pb2+:glutamate molar ratios were 1:4, 1:2 and 1:1, respectively) |
随着pH从3.0增加到6.7, Pb2+与γ-PGA的络合改变了γ-PGA分子的二级结构.如前所述, γ-PGA分子内存在着两种分子内氢键稳定酸性条件下的γ-PGA结构.随着pH增加, 由于羧酸基团的去质子化, 侧链羧基氧和骨架NH之间的分子内氢键被破坏.然而, 骨架中CO和NH之间的氢键可能仍然稳定.因此, 当pH从3.0增加到6.7时, γ-PGA的α-螺旋含量从20.1%降低到11.7%.加入1:1(Pb2+:谷氨酸结构单元)的Pb2+后, 由于空间位阻效应, 与羧基络合的大粒径水合Pb2+可能进一步破坏骨架中CO和NH之间的氢键.因此, 随着pH值从3.0增加到4.2, Pb2+与γ-PGA的络合作用已使γ-PGA的α-螺旋含量从19.7%迅速降低至5.4%.
值得注意的是, 当pH高于5.0(接近pKa值4.86)和Pb2+:谷氨酸结构单元摩尔比率为1:2和1:1时, Pb2+与γ-PGA络合的二级结构相似且几乎与pH值无关.而此时, 从图 6可知, 相同情况下的Pb2+吸附到γ-PGA的量不同.因此, 在Pb2+吸附量逐渐增加的过程中, 参与改变γ-PGA构型的Pb2+将逐渐达到饱和, 其余吸附的Pb2+并不影响γ-PGA的构型.
Ho等(2006)发现, γ-PGA的Na+、Ca2+和Mg2+盐溶解性很好.本研究发现, pH 5.0时, 在10 mg·L-1 γ-PGA的浓度下, Ca2+和Mg2+的浓度即使达到75 mmol·L-1, γ-PGA溶液仍未出现絮凝, 而Pb2+浓度超过78 μmol·L-1时, γ-PGA即被絮凝.从以上对γ-PGA与Ca2+、Mg2+和Pb2+结合以及二级结构的变化来看, γ-PGA对Ca2+、Mg2+和Pb2+絮凝性能, 可能与其二级结构的改变密切相关.
3.4 红外光谱金属离子与γ-PGA的羧基以不同的方式络合, 会影响其对称性, 键合强度和键角(He et al., 2000).因此, FTIR光谱用于鉴定γ-PGA羧基基团与金属离子络合前后的振动模式的频率差异.如图 7a所示, pH为3.0时γ-PGA中1728 cm-1附近的峰在pH 5.0和7.0下逐渐消失.这是由于1728 cm-1附近的峰为COOH中的C=O伸缩振动, 随着COOH的去质子化, COO-中的C=O位移至约1595 cm-1(不对称伸缩振动)和1403 cm-1(对称伸缩振动)(Garcia-Alvarez et al., 2005).在pH为5.0和7.0时, 1595 cm-1处的峰强度甚至与酰胺Ⅰ(1643 cm-1)和酰胺Ⅱ(1548 cm-1)重叠.在与Pb2+络合后, COO-的不对称伸缩振动位移至约1550 cm-1, 与酰胺Ⅱ带重叠.这表明Pb2+与γ-PGA的COO-强烈结合并显著改变羧基基团的振动模式.
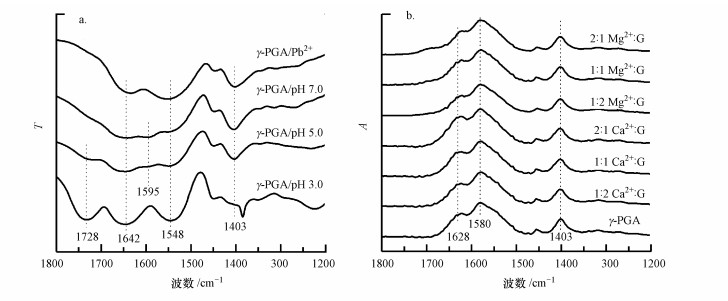 |
| 图 7 γ-PGA/Pb2+、pH 3.0、5.0和7.0时γ-PGA的红外光谱(a)和不同Ca2+:谷氨酸结构单元摩尔比(Ca2+:G)和Mg2+:谷氨酸结构单元摩尔比(Mg2+:G)时γ-PGA/Ca2+和γ-PGA/Mg2+的ATR-FTIR谱图(b) Fig. 7 FTIR spectra of γ-PGA/Pb2+ complexation, γ-PGA at pH 3.0, 5.0 and 7.0 (a) and ATR-FTIR spectra of γ-PGA/Ca2+ and γ-PGA/Mg2+ mixture at varying Ca2+:glutamate and Mg2+:glutamate molar ratios (b) |
图 7b显示了pH为6.5时不同n(Ca2+):n(γ-PGA谷氨酸单体结构)和n(Mg2+):n(γ-PGA谷氨酸单体结构)条件下γ-PGA/Ca2+和γ-PGA/Mg2+的红外光谱.1580 cm-1和1403 cm-1分别对应于γ-PGA中COO-的不对称伸缩振动和对称伸缩振动.在n(Ca2+):n(γ-PGA谷氨酸单体结构)和n(Mg2+):n(γ-PGA谷氨酸单体结构)范围从0.5变化到2时, 这两个红外吸收峰并没有变化, 这与CD光谱的结果一致, 表明Ca2+和Mg2+的络合并没有改变γ-PGA的分子结构.
4 结论(Conclusions)1) pH对γ-PGA的二级结构具有显著影响, 而离子强度(0~50 mmol·L-1)对γ-PGA的二级结构影响不大.
2) Ca2+和Mg2+虽然能够与γ-PGA结合, 会影响γ-PGA的Zeta电势, 但并不影响γ-PGA侧链上羧基的振动模式, 也不影响γ-PGA的二级结构.
3) Pb2+能够与γ-PGA的COO-强烈结合并显著改变羧基基团的振动模式, 同时显著影响γ-PGA的二级结构.Pb2+的加入不仅会破坏侧链和骨架之间的氢键, 还可能破坏骨架中CO和NH之间的氢键.在Pb2+吸附量逐渐增加的过程中, 参与改变γ-PGA构型的Pb2+将逐渐达到饱和, 其余吸附的Pb2+并不影响γ-PGA的构型.
4) Ca2+、Mg2+和Pb2+对γ-PGA二级结构的不同影响取决于离子自身的性质, 即离子特异性, 一是Pb2+具有较高的电负性以吸引COO-基团, 二是Pb2+自身的有效离子半径更大, 且能与更多的H2O配位, 由于空间位阻效应, 这种较大的水合离子可能会破坏骨架中CO和NH之间的氢键.
Adrian S M, Mallet G, Vasilescu D, et al. 2005. Hydration of Mg++: a quantum DFT and ab initio HF study[J]. Journal of Molecular Structure-Theochem, 728(1/3): 231-242. |
Agresti C, Tu Z G, Ng C. 2008. Specific interactions between diphenhydramine and alpha-helical poly(glutamic acid) - a new ion-pairing complex for taste masking and pH-controlled diphenhydramine release[J]. European Journal of Pharmaceutics and Biopharmaceutics, 70(1): 226-233. DOI:10.1016/j.ejpb.2008.04.004 |
Bajaj I, Singhal R. 2011. Poly (glutamic acid) - an emerging biopolymer of commercial interest[J]. Bioresource Technology, 102(10): 5551-5561. DOI:10.1016/j.biortech.2011.02.047 |
Bhatnagar A, Sillanpaa M. 2017. Removal of natural organic matter (NOM) and its constituents from water by adsorption - A review[J]. Chemosphere, 166: 497-510. DOI:10.1016/j.chemosphere.2016.09.098 |
Bhattacharjee A, Hofer T S, Pribil A B, et al. 2009. Revisiting the hydration of Pb(Ⅱ): A QMCF MD approach[J]. Journal of Physical Chemistry B, 113(39): 13007-13013. DOI:10.1021/jp905848x |
Bostrom M, Williams D R M, Ninham B W. 2001. Specific ion effects: why DLVO theory fails for biology and colloid systems[J]. Physical Review Letters, 87(16): 168103. DOI:10.1103/PhysRevLett.87.168103 |
Carl D R, Moision R M, Armentrout P B. 2007. Binding energies for the inner hydration shells of Ca2+: An experimental and theoretical investigation of Ca2+(H2O)(x) complexes (x=5~9)[J]. International Journal of Mass Spectrometry, 265(2/3): 308-325. |
d′Abzac P, Bordas F, van Hullebusch E, et al. 2010. Effects of extraction procedures on metal binding properties of extracellular polymeric substances (EPS) from anaerobic granular sludges[J]. Colloids and Surfaces B-Biointerfaces, 80(2): 161-168. DOI:10.1016/j.colsurfb.2010.05.043 |
Decho A W, Gutierrez T. 2017. Microbial extracellular polymeric substances (EPSs) in ocean systems[J]. Frontiers in Microbiology, 8: 922. DOI:10.3389/fmicb.2017.00922 |
Garcia A M, Alvarez J, Alla A, et al. 2005. Comb-like ionic complexes of cationic surfactants with bacterial poly(gamma-glutamic acid) of racemic composition[J]. Macromolecular Bioscience, 5(1): 30-38. DOI:10.1002/mabi.200400146 |
He L M, Neu M P, Vanderberg L A. 2000. Bacillus lichenformis gamma-glutamyl exopolymer: physicochemical characterization and U(Ⅵ) interaction[J]. Environmental Science & Technology, 34(9): 1694-1701. |
Mclean R J C, Beauchemin D, Beveridge T J. 1992. Influence of oxidation-state on iron-binding by Bacillus licheniformis capsule[J]. Applied and Environmental Microbiology, 58(1): 405-408. |
Mclean R J C, Beauchemin D, Clapham L, et al. 1990. Metal-binding characteristics of the gamma-glutamyl capsular polymer of Bacillus licheniformis ATCC 9945[J]. Applied and Environmental Microbiology, 56(12): 3671-3677. |
Ogunleye A, Bhat A, Irorere V U, et al. 2015. Poly-gamma-glutamic acid: production, properties and applications[J]. Microbiology-Sgm, 161: 1-17. |
Sakamoto S, Kawase Y. 2016. Adsorption capacities of poly-gamma-glutamic acid and its sodium salt for cesium removal from radioactive wastewaters[J]. Journal of Environmental Radioactivity, 165: 151-158. DOI:10.1016/j.jenvrad.2016.10.004 |
Seviour T, Derlon N, Dueholm M S, et al. 2019. Extracellular polymeric substances of biofilms: suffering from an identity crisis[J]. Water Research, 151: 1-7. DOI:10.1016/j.watres.2018.11.020 |
Siao F Y, Lu J F, Wang J S, et al. 2009. In vitro binding of heavy metals by an edible biopolymer poly(gamma-glutamic acid)[J]. Journal of Agricultural and Food Chemistry, 57(2): 777-784. DOI:10.1021/jf803006r |
Sirisansaneeyakul S, Cao M F, Kongklom N, et al. 2017. Microbial production of poly-gamma-glutamic acid[J]. World Journal of Microbiology & Biotechnology, 33(9): 173. |
Speight J G. 2005. Lange′s handbook of chemistry[M]. 16th ed. McGraw-Hill, New York, NY.
|
Tourney J, Ngwenya B T. 2014. The role of bacterial extracellular polymeric substances in geomicrobiology[J]. Chemical Geology, 386: 115-132. DOI:10.1016/j.chemgeo.2014.08.011 |
Wang L L, Chen J T, Wang L F, et al. 2017. Conformations and molecular interactions of poly-gamma-glutamic acid as a soluble microbial product in aqueous solutions[J]. Scientific Reports, 7: 12787. DOI:10.1038/s41598-017-13152-2 |
Xu S, Wang Z, Gao Y, et al. 2015. Adsorption of rare earths(Ⅲ) using an efficient sodium alginate hydrogel cross-linked with poly-gamma-glutamate[J]. Plos One, 10(5): e0124826. DOI:10.1371/journal.pone.0124826 |
Yao J, Xu H, Wang J, et al. 2007. Removal of Cr(Ⅲ), Ni(Ⅱ) and Cu(Ⅱ) by poly(gamma-glutamic acid) from Bacillus subtilis NX-2[J]. Journal of Biomaterials Science-Polymer Edition, 18(2): 193-204. DOI:10.1163/156856207779116702 |
Yin Y R, Hu Y Y, Xiong F. 2013. Biosorption properties of Cd(Ⅱ), Pb(Ⅱ), and Cu(Ⅱ) of extracellular polymeric substances (EPS) extracted from Aspergillus fumigatus and determined by polarographic method[J]. Environmental Monitoring and Assessment, 185(8): 6713-6718. DOI:10.1007/s10661-013-3059-9 |
Zanuy D, Aleman C, Munoz G S. 1998. On the helical conformation of un-ionized poly(gamma-D-glutamic acid)[J]. International Journal of Biological Macromolecules, 23(3): 175-184. |
 2019, Vol. 39
2019, Vol. 39


