2. 北京师范大学水科学研究院, 北京 100875;
3. 中国环境监测总站, 北京 100012
2. College of Water Sciences, Beijing Normal University, Beijing 100875;
3. China National Environmental Monitoring Centre, Beijing 100012
环境污染可以改变河流的生物群落组成、生物多样性和生态功能(Dudgeon et al., 2010), 是影响流域生态系统健康的主要威胁.着生硅藻是一种世界范围内广泛分布的着生藻类(Taylor et al., 2007), 它们对水环境因子非常敏感, 对环境变化特别是有机污染和富营养化反应迅速(Venkatachalapathy et al., 2015), 已广泛应用于河流生态系统健康的监测与评估(Rimet, 2012; Lavoie et al., 2014).研究表明, 与蓝绿藻相比, 着生硅藻能够更快地反映环境变化(Kelly et al., 2008, Schneider et al., 2012), 更适合作为水生态健康评价的生物指标(Fetscher et al., 2014).国外学者对比了着生硅藻、大型无脊椎动物等水生生物的指示作用, 结果表明着生硅藻群落具有更高的结构差异(Soininen and Könönen, 2004), 对水化学变化更敏感(Feio et al., 2009), 与河流富营养化的相关性更强(Hering et al., 2006, Justus et al., 2010), 而且着生硅藻是固定的, 能够更可靠地表明污染梯度(Beyene et al., 2009), 因此具有更好的指示作用.
利用硅藻进行河流水质评价的方法较多, 包括生物多样性指数、硅藻指数、完整性指数等.近年来, 国内关于着生硅藻群落结构及硅藻水质评价的相关研究逐渐增多, 有学者调查了太子河(殷旭旺等, 2012)、东江(邓培雁等, 2012)、渭河(殷旭旺等, 2013)、浑太河(张莉等, 2017)等流域的着生硅藻群落结构, 并研究了水环境因子对硅藻群落结构的影响.也有学者使用着生硅藻指数等方法, 评价了渭河(刘麟菲等, 2016)、梧桐河(薛浩等, 2018)等流域的水生态环境质量, 以上研究均表明, 在我国广泛应用着生硅藻群落进行生物监测与评价是可行的.
近年来, 倭肯河流域生活污水和城镇工业废水的排放量不断增加, 农业面源污染也未得到有效治理, 导致倭肯河水质逐渐恶化(王天亮, 2015).在倭肯河流域进行水环境监测和水生生物调查, 将有助于该流域的水资源保护工作, 有利于流域内经济社会协调发展, 具有重要意义.本研究调查了倭肯河着生硅藻群落和环境因子, 综合运用聚类分析、Mcnaughton优势度分析、Spearman相关分析、除趋势对应分析(detrended correspondence analysis, DCA)和典范对应分析(canonical correspondence analysis, CCA)等分析方法, 研究了倭肯河流域丰水期着生硅藻群落结构差异, 优势种以及生态型变化, 探讨了水环境因子对倭肯河流域着生硅藻群落的影响, 以期为我国着生硅藻的河流水环境质量监测与评价工作提供基础数据与研究案例.
2 研究方法(Research methods) 2.1 研究区概况与点位设置倭肯河发源于完达山脉阿尔哈山, 是松花江右岸较大支流.倭肯河全长450 km, 流域总面积11015 km2, 是七台河市、勃利县、桦南县、依兰县等地的主要工农业水源.本研究共设置19个采样点(图 1), 于2018年8月对倭肯河干流及其主要支流如七虎力河、八虎力河等进行了采样调查.
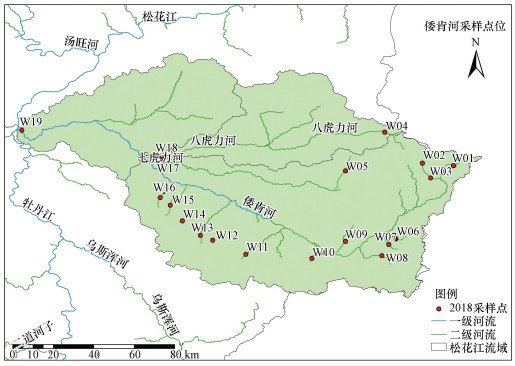 |
| 图 1 倭肯河采样点分布 Fig. 1 Sampling sites in Woken River |
在采样点河流上下游100 m范围内, 依据河流生境(流速、水深和透明度)的不同, 挑选3个石块(石块上表面积 < 200 cm2), 用底面直径2.8 cm塑料盖划定取样范围, 用硬毛刷刮取该范围内着生藻, 用纯净水冲刷至不锈钢托盘中, 加5%甲醛溶液固定后转移到广口塑料瓶中保存, 作为着生藻类的定量样品.对于没有石头的点位, 刷取枯枝、落叶等基质的着生藻类样品(薛浩等, 2018).
样品运回实验室, 静置沉淀48 h后, 取0.1 mL均匀样品于400倍显微镜(OLMPUS BX51)下进行种类鉴定和细胞计数(刘奕伶等, 2015).取部分样品进行酸化处理(浓硝酸和浓硫酸), 并制成硅藻封片, 在1000倍光学显微镜(OLMPUS BX51)下进行鉴定计数, 每张封片观察到的硅藻细胞个数不少于400个(Xue et al., 2019).400倍视野下样品鉴定到属, 1000倍视野下硅藻样品鉴定到种.
2.3 水质、水文和生境指标测定水温(T)、电导率(Cond)、溶解氧(DO)和pH使用便携式水质分析仪(YSI Professional Plus, Yellow Springs, OH, USA)现场测定.各采样点位同步采集河水样品, 预处理后带回实验室, 测定化学需氧量(CODCr)、高锰酸盐指数(CODMn)、氨氮(NH3-N)、硝氮(NO3-N)、总氮(TN)和总磷(TP), 水样采集、预处理、保存以及测定参照《水和废水监测分析方法(第四版)》(国家环境保护总局, 2002);按照《栖息地评价指标与评价标准》(郑丙辉等, 2007), 现场打分, 获取底质得分(Bott)和生境得分(QHEI).
2.4 数据分析根据着生硅藻多度数据计算各采样点香农多样性指数和Pielou均匀度指数, 对着生硅藻物种多度数据进行弦转化后计算欧氏距离矩阵, 使用Ward最小方差法对所有采样点位进行聚类分析.
本文采用Mcnaughton优势度指数来判定优势种的组成, 选取Mcnaughton优势度指数(Y)>0.02的藻类为优势种.公式如下所示.
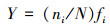
|
(1) |
式中, ni为第i种藻类的细胞总数;N为所有藻类的总细胞数;ni/N为第i种藻类的细胞数占所有藻类总细胞数的比值;fi为第i种藻类在样点中出现的频率.
对生境质量数据和水环境理化数据, 进行Spearman相关分析, 相关性较强的两个水环境理化因子仅保留其一.对着生硅藻相对多度数据进行DCA, 如果DCA排序前4个轴中最大值超过4, 选择单峰模型排序更合适;如果是小于3, 则选择线性模型更好;如果DCA排序前4个轴中最大值在3和4之间, 两种模型均可使用.CCA分析过程中, 每个变量的贡献程度通过计算方差膨胀因子(variance inflation factor, VIF)判断, VIF值超过10则可能存在共线问题.进行Spearman相关分析和CCA时, 除pH以外的所有水体理化数据和着生藻类相对多度数据均进行数据转换(log10(x+1))(薛浩等, 2018).以上分析均通过R 3.5.2完成, 聚类分析、PCA、DCA、CCA通过“vegan”程序包实现, 聚类最佳分类数确定通过“factoextra”程序包实现, VIF通过“car”程序包计算.
3 结果与分析(Results and analysis) 3.1 着生硅藻群落结构分析倭肯河共鉴定出着生藻类5门57属107种(属)6变种, 其中硅藻门33属83种6变种, 绿藻门16属, 蓝藻门5属, 裸藻门2属, 隐藻门1属.硅藻群落中, 舟形藻属(Navicula)、菱形藻属(Nitzschia)和异极藻属(Gomphonema)鉴定出的分类单元最多, 分别为22种、15种和7种.19个采样点位中, W16点位样品采集效果最差, 仅鉴定出着生硅藻2种, 且生物量较其他点位严重偏低, 不再参与后续分析.倭肯河各点位着生硅藻平均物种数为19种, 不同采样点位之间物种数量差异较大;W09点位物种丰富度最高, 共鉴定出着生硅藻28种;W06点位物种丰富度最低, 共鉴定出着生硅藻6种.
倭肯河丰水期香农多样性指数平均得分2.58, Pielou均匀度指数平均得分0.63, 着生硅藻多样性与均匀度状况均一般.其中W18点位香农多样性指数3.88, 得分最高;W01点位香农多样性指数1.63, 得分最低, 该点位物种数量较少且Navicula atomus var. permitis在该点位相对丰度大于60%.W15点位Pielou均匀度指数0.92, 得分最高;W14点位Pielou均匀度指数0.40, 得分最低, 导致W14点位均匀度过低的主要原因是Gomphonema pumilum在该点位相对丰度接近80%.
使用Ward最小方差法对所有采样点位进行聚类分析, 聚类分析结果见图 2.根据聚类结果, 组1包含6个点位, 组2包含4个点位, 组3包含8个点位.
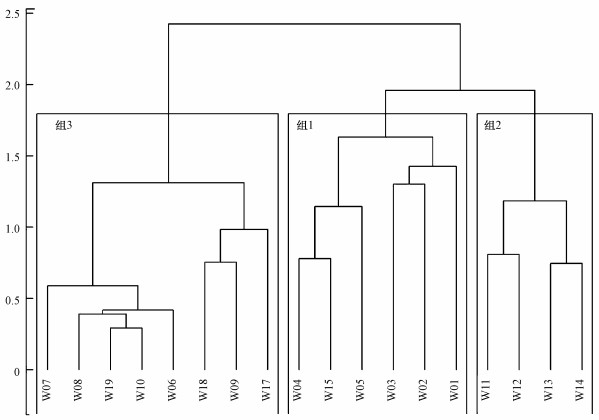 |
| 图 2 3组分类的聚类树状图 Fig. 2 Dendrogram with boxes around the three selected groups |
选取Mcnaughton优势度指数(Y)>0.02为优势种, 倭肯河全流域以及各分组的优势种和优势度结果见表 1, 其中各硅藻代码参照BDI指数(Coste et al., 2009).结果表明, Nitzschia palea为倭肯河着生硅藻绝对优势种, 其在全流域优势度为0.23;N. palea在组3的优势度最高, 达到了0.40.
| 表 1 倭肯河着生硅藻优势种 Table 1 Dominant species of benthic diatom in Woken River |
对不同分组的着生硅藻生物多样性进行了分析, 结果表明(表 2), 从组1到组3, 4个物种多样性参数平均值均呈现先升高后降低的趋势.
| 表 2 各分组着生硅藻多样性 Table 2 Benthic diatom diversities in different groups |
图 3展示了倭肯河全流域及3个分组的着生硅藻优势种在BDI指数(Coste et al., 2009)划分的7类水质(CL1-CL7)中出现的概率, 水质等级越低代表水质越差.其中, RES代表该组所有优势种在7类水质中出现的平均概率.倭肯河全流域优势种在CL1水质条件下出现的平均概率最高, 约25%.倭肯河着生硅藻优势种在CL1~CL3 3类水质条件下出现的平均概率约60%, 说明该流域着生硅藻优势种清洁度较低.
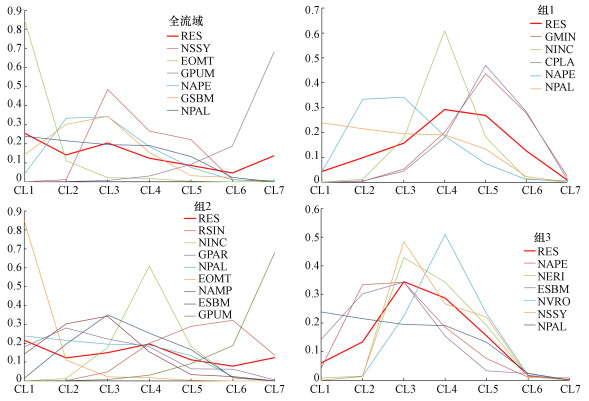 |
| 图 3 倭肯河全流域及各分组优势种在不同水质类别中出现概率 Fig. 3 Dominant species probability of occurance of dominant species for water quality class |
3个分组中, 组1优势种清洁度最高, 在CL5及更高水质条件下出现的平均概率约40%;其次是组2, 在CL5及更高水质条件下出现的平均概率约30%;组3优势种清洁度最低, 在CL5及更高水质条件下出现的平均概率不足20%, 在CL3及更低水质条件下出现的平均概率约50%.
根据荷兰淡水硅藻生态指示值清单(Van Dam et al., 1994), 分析了所有采样点位硅藻群落需氧量、腐殖度和营养状况3种生态型所占比例, 计算了各分组不同生态型的平均占比情况.结果表明(表 3), 从组1到组3, 极度需氧型和中度需氧型硅藻比例明显降低, 低度需氧型硅藻比例明显升高;组1各需氧型硅藻分布较为均匀, 组2和组3低度需氧型硅藻比例较高.从组1到组3, 中度腐生型硅藻比例呈下降趋势, 高度腐生型硅藻比例呈上升趋势, 其中组1硅藻主要为β-中度腐生型, 组2硅藻主要为α中腐-高度腐生型, 组3硅藻主要为高度腐生型.倭肯河流域寡营养型和中营养型硅藻比例较少, 尤其是组3, 寡营养型和中营养型硅藻比例不足3%;从组1到组3, 中营养型和富营养型硅藻比例逐渐下降, 极度富营养型硅藻比例逐渐上升;组1和组2硅藻主要为富营养型, 组3硅藻主要为富营养型和极度富营养型.
| 表 3 各分组着生硅藻生态型及环境因子(均值) Table 3 Ecological types of benthic diatom and environmental factors in different groups |
对倭肯河12项环境因子执行Spearman相关分析, 相关性较强(r≥0.75, p < 0.001)的两个指标仅保留一个.结果表明(表 4), TP同时与NO3-N和DO显著相关, NO3-N同时与TN和Cond显著相关, 且NO3-N与TN相关性很强, QHEI同时和Bott、NH3-N两项环境因子显著相关, 剔除TP、NO3-N和QHEI.CODMn和CODCr显著相关且相关性很强, CODMn更适合用于地表水水质监测, 因此仅保留CODMn参与后续分析.综上, 保留TN、Cond、T、pH、DO、Bott、NH3-N和CODMn共8项环境因子进行后续分析.
| 表 4 12个环境因子的Spearman相关系数 Table 4 Spearman correlation coefficient of 12 environmental factors |
根据DCA分析, DCA排序前4轴中最大值为3.72, 大于3, 选择CCA分析环境因子、硅藻群落及采样点位间的关系.8个环境因子VIF计算结果表明, T和Cond两个变量的VIF值为12.14, 存在共线性问题, Cond与TN相关性较高且均可代表倭肯河营养状况, 所以剔除Cond进行后续分析.剩余7个环境因子VIF计算结果显示, 变量间VIF最大值为5.2, 不存在明显的共线关系.
样方与环境因子CCA排序图(图 4a)体现了环境因子和采样点位沿第一、第二排序轴的变化梯度.沿第一排序轴从左往右, NH3-N、CODMn、Bott和DO浓度逐渐升高, TN和T逐渐降低, pH沿第二排序轴从下到上逐渐升高.排序图结果表明, 3个分组间存在较为明显的环境差异.组1大部分点位位于排序图右侧, 说明组1各点位DO、Bott、NH3-N和CODMn均较高, TN浓度较低.组2所有点位均位于排序图上方, 且与pH夹角较小, 说明影响组2硅藻群落结构的主要环境因子为pH.组3所有采样点位均位于排序图左下方, 与TN相关性较高且正相关, 与DO相关性较高但负相关.
 |
| 图 4 CCA分析排序图(a.样方-环境因子, b.物种-环境因子) Fig. 4 Ordination diagram of CCA(a. sites-environmental factors, b.species-environmental factors) |
物种与环境因子CCA排序图(图 4b)体现了水质、生境和倭肯河流域常见硅藻物种(出现频次大于5的物种)沿第一、第二排序轴的变化梯度, 其中各硅藻代码参照法国BDI指数(Coste et al., 2009).沿第一排序轴从左往右, NH3-N、CODMn、Bott和DO浓度逐渐降低, TN和T逐渐升高, pH沿第二排序轴从下到上逐渐升高.
4 讨论(Discussion) 4.1 着生硅藻群落结构差异倭肯河丰水期着生硅藻群落结构从上游到下游变化较为明显, 上游接近源头区域部分点位生境和水质较好, 其余点位生境破坏严重, 水体呈现富营养化趋势, TN超标严重.这是因为倭肯河是七台河市、勃利县、桦南县、依兰县等地的主要工农业水源, 沿途农业面源污染强度较大.倭肯河各点位着生硅藻平均物种数19种, 物种丰富度较好, 但各采样点位物种数量分布不均匀, 个别点位物种数量较少, 如W06点位仅鉴定出着生硅藻6种.
根据硅藻群落聚类分析结果(图 2), 倭肯河19个采样点位可分为3组.从组1到组3, 生境质量呈现下降的趋势, 物种丰富度、属丰富度、香农多样性指数与Pielou均匀度指数均呈现先上升后下降的趋势.大量研究表明, 在群落演替的过程中, 物种多样性会随外界干扰强度的增加先上升后下降(Clauson-Kaas et al., 2017, Simoes et al., 2013, Espinar, 2010), 即驼峰效应(hump-shaped eff ect).由此也可以推断, 组3受到的外界干扰强度过大, 已经引起硅藻群落的不良反应.
4.2 着生硅藻优势种清洁度及组间差异Nitzschia palea等6个物种为倭肯河丰水期着生硅藻优势种, 根据BDI指数(Coste et al., 2009), 倭肯河流域优势种除Gomphonema pumilum外均为污染耐受种, 主要分布在CL4及更差的水质等级中(图 2).其中N. palea在除W16以外的18个采样点位中均有出现, 优势度最高, 是倭肯河流域的绝对优势种.研究表明, N. palea广泛分布于世界各地(Bere, 2016), 主要生活在TP浓度较高(Oeding et al., 2017)、农业活动影响较大(Lavoie et al., 2006)的区域, 被认为是富营养指示种(Besse-Lototskaya et al., 2011).根据Muscio(2002)建立的美国硅藻耐污指数(Pollution Tolerance Index, PTI), N. palea为耐污种, 耐污值为1(最低分为1).在澳大利亚河流硅藻指数(Diatom Species Index for Australian Rivers, DSIAR)(Chessman et al., 2007)物种清单中, Eolimna subminuscula和Eolimna minima耐污值得分均较低, 也是耐污能力较强的物种.国外学者研究表明, Navicula atomus(Kawecka et al., 1993)和Navicula atomus var. permitis(Sabater et al., 2009)都是富营养水域的优势种.邓培雁等(2015)在东江流域研究结果表明, Navicula schroeteri var. symmetrica具有较高的TP最适值.综上所述, 除Gomphonema pumilum外倭肯河丰水期着生硅藻优势种均为污染耐受性较高的富营养指示种.
根据BDI指数(Coste et al., 2009), 组1优势种清洁度最高, 在CL5及更高水质条件下出现的平均概率约40%.组1优势度最大的物种为Gomphonema minutum, G. minutum和Cocconeis placentula在PTI指数中耐污值3(最高分为4), 为相对清洁种, 其余3个优势种均为耐污种.组2优势种清洁度较组1偏低, 在CL5及更高水质条件下出现的平均概率约30%.组2优势种除G. pumilum和Reimeria sinuata外, 均为耐污种.组3优势种清洁度最低, 在CL5及更高水质条件下出现的平均概率不足20%, 该组所有优势种均为耐污种, 其中N. palea在该组优势度达到了0.40, 为绝对优势种, 说明该组水体富营养化已相当严重.各组清洁度变化也表明, 由组1到组3, 水生态健康状况逐渐变差, 与4.1节结论一致.
4.3 环境因子对硅藻生态型比例的影响从组1到组3, 极度需氧型和中度需氧型硅藻比例明显降低, 低度需氧型硅藻比例明显升高.样方与环境因子CCA排序图(图 4a)可以看出, 组3点位全部位于排序图左下角, DO浓度为3组最低;物种与环境因子CCA排序图(图 4b)可以看出, 除Eolimna subminuscula外, 组3其余5个优势种均位于排序图右下角, 与DO负相关.从组1到组3, α中度腐生型和高度腐生型硅藻物种比例明显升高, 尤其是组3, 约65%硅藻为α中度腐生型和高度腐生型, 这可能是组3 DO浓度太低导致的.组1中营养型硅藻物种比例为3组中最高, 这也说明组1在3组中富营养化程度最低.组3极度富营养型硅藻指数达到了43.36%, 远超其余2组, 富营养型和极度富营养型物种比例接近80%, 说明组3富营养化状况已到了相当严重的程度.
4.4 环境因子对硅藻群落结构的影响样方与环境因子CCA排序图结果与硅藻群落聚类分析结果基本吻合, 组1的6个点位中, W01~W05点位地理条件较为相近, 均位于山地丘陵区, 其他点位主要位于平原区, 相似的地形、地质、土壤、潜在自然植被等因素可能导致W01~W05之间生物群落相似度较高(Tang et al., 2016), 因此聚类分析过程中W01点位与W02~W04点位被划分为一组.但是样品采集过程中发现, W01点位附近已被开垦为农场, 农业面源污染严重, W01点位DO浓度明显低于组1中其他点位.此外, W01点位N. atomus var. permitis的相对丰度达到了61.81%, 说明该点位富营养化程度也相当严重, 因此CCA排序图上, W01点位和组3点位距离更近.
组2中4个采样点(W11~W14)均位于倭肯河南侧支流, 且地理位置较近.环境因子分析结果(表 3)表明, 组2水质最好, 但生境质量比组1差, 这可能是导致组2着生硅藻清洁度低于组1的主要原因.根据CCA排序图结果(图 4a), 组2的4个采样点均位于排序图正上方, 且相互之间距离较近.组2所有点位和pH之间夹角较小, 相关性较高且正相关, 说明pH是组2硅藻群落结构的主要影响因子.其他环境因子组2各点位夹角较大, 有些近乎垂直, 说明其他环境因子对组2影响较小.
组3采样点位主要分为两部分, W6~W10位于七台河市境内, W17~W19位于倭肯河下游.环境因子分析结果(表 3)表明, 组3水质及生境质量均为3组中最差.W6~W10所在区域农场较多, 农业种植活动强度较大, 这可能是导致这5个点位环境质量差的主要原因.W17~W19分别位于倭肯河两个最大的支流下游及倭肯河干流下游, 沿途农业面源污染及城镇污水排放可能是导致这3个点位环境质量差的主要原因.根据CCA排序图结果(图 4a), 组3所有点位均位于排序图左下方且距离较近, 与TN之间夹角较小, 说明组3个点位与TN相关性较高且正相关;组3多数点位和DO之间夹角接近180°, 相关性较高且负相关, 说明TN和DO是组3硅藻群落结构的主要影响因子.
物种与环境因子CCA排序图结果表明, Eolimna subminuscula、Gyrosigma scalproides和Navicula trivialis 3个物种与pH相关性最强且正相关, 说明在倭肯河流域, 这3个物种偏好生活在pH较高的河段.根据Van Dam(1994)的研究成果, 这3种硅藻均为偏碱性物种(alkaliphilous或alkaliphilic), 或许可以作为倭肯河的碱性指示种.Reimeria sinuata与Bott相关性极强且正相关, 与DO相关性也很高, 说明R. sinuata偏好生活在生境较好、溶氧较高的河段.国外硅藻耐污值研究结果(Muscio, 2002, Chessman et al., 2007, Gómez et al., 2001)均表明, R. sinuata清洁度较高.Gomphonema minutum和Ulnaria ulna与氨氮显著正相关, 与CODMn相关性也较高, 根据Van Dam(1994)的研究成果, 这两种硅藻分别为β-中污指示种和α-中污指示种.与TN正相关的物种数量最多, 如N. palea和Navicula erifuga等富营养水体指示物种, 说明倭肯河流域水体富营养化状况严重.
5 结论(Conclusions)1) 倭肯河丰水期共鉴定出着生硅藻33属83种6变种, 各点位平均物种数19种, 不同采样点位之间生物多样性差异较大.倭肯河水生态环境质量状况较差, 着生硅藻主要由Nitzschia palea等富营养指示种构成, 其中N. palea优势度0.23, 为倭肯河丰水期绝对优势种.
2) 根据着生硅藻群落结构聚类分析, 倭肯河19个采样点位可分为3组.从组1到组3, 物种清洁度逐渐降低, 低度需氧型、中腐-高度腐生型和极度富营养型硅藻比例逐渐升高, 清洁点位主要集中在河流源头区域.
3) 影响倭肯河着生硅藻群落结构变化的主要水环境因子包括TN、DO和pH, 着生硅藻群落可以有效的指示倭肯河水体富营养化状况和腐生状况.
Bere T. 2016. Challenges of diatom-based biological monitoring and assessment of streams in developing countries[J]. Environmental Science and Pollution Research, 23(6): 5477-5486. DOI:10.1007/s11356-015-5790-y |
Besse-Lototskaya A, Verdonschot P, Coste M, et al. 2011. Evaluation of European diatom trophic indices[J]. Ecological Indicators, 11(2): 456-467. DOI:10.1016/j.ecolind.2010.06.017 |
Beyene A, Addis T, Kifle D, et al. 2009. Comparative study of diatoms and macroinvertebrates as indicators of severe water pollution:Case study of the Kebena and Akaki rivers in Addis Ababa, Ethiopia[J]. Ecological Indicators, 9(2): 381-392. DOI:10.1016/j.ecolind.2008.05.001 |
Chessman B C, BatE N, Gell P A, et al. 2007. A diatom species index for bioassessment of Australian rivers[J]. Marine and Freshwater Research, 58(6): 542-557. DOI:10.1071/MF06220 |
Clauson-Kaas S, Richardson K, Rahbek C, et al. 2017. Species-specific environmental preferences associated with a hump-shaped diversity/temperature relationship across tropical marine fish assemblages[J]. Journal of Biogeography, 44(10): 2343-2353. DOI:10.1111/jbi.13044 |
Coste M, Boutry S, Tison-Rosebery J, et al. 2009. Improvements of the biological diatom index (BDI):Description and efficiency of the new version (BDI-2006)[J]. Ecological Indicators, 9(4): 621-650. DOI:10.1016/j.ecolind.2008.06.003 |
Dudgeon D, Arthington A H, Gessner M O, et al. 2010. Freshwater biodiversity:importance, threats, status and conservation challenges[J]. Biological Reviews, 81(2): 163-182. |
邓培雁, 雷远达, 刘威, 等. 2012. 七项河流附着硅藻指数在东江的适用性评估[J]. 生态学报, 32(16): 5014-5024. |
邓培雁, 张婉, 王旭涛, 等. 2015. 水质对东江流域附生硅藻群落的影响[J]. 生态学报, 35(6): 1852-1861. |
Espinar J L. 2010. Sample size and the detection of a hump-shaped relationship between biomass and species richness in Mediterranean wetlands[J]. Journal of Vegetation Science, 17(2): 227-232. DOI:10.1111/j.1654-1103.2006.tb02441.x |
Feio M J, Almeida S F P, Craveiro S C, et al. 2009. A comparison between biotic indices and predictive models in stream water quality assessment based on benthic diatom communities[J]. Ecological Indicators, 9(3): 497-507. DOI:10.1016/j.ecolind.2008.07.001 |
Fetscher A E, Stancheva R, Kociolek J P, et al. 2014. Development and comparison of stream indices of biotic integrity using diatoms vs. a combination[J]. Journal of Applied Phycology, 26(1): 433-450. DOI:10.1007/s10811-013-0088-2 |
Gómez N, Licursi M. 2001. The Pampean diatom index (IDP) for assessment of rivers and streams in Argentina[J]. Aquatic Ecology, 35(2): 173-181. DOI:10.1023/A:1011415209445 |
国家环境保护总局. 2002. 水和废水监测分析方法[M]. 第4版. 北京: 中国环境科学出版社.
|
Hering D, Johnson R K, Kramm S, et al. 2006. Assessment of European streams with diatoms, macrophytes, macroinvertebrates and fish:A comparative metric-based analysis of organism response to stress[J]. Freshwater Biology, 51(9): 1757-1785. DOI:10.1111/j.1365-2427.2006.01610.x |
Justus B G, Petersen J C, Femmer S R, et al. 2010. A comparison of algal, macroinvertebrate, and fish assemblage indices for assessing low-level nutrient enrichment in wadeable Ozark streams[J]. Ecological Indicators, 10(3): 627-638. DOI:10.1016/j.ecolind.2009.10.007 |
Kawecka B, Olech M. 1993. Diatom communities in the Vanishing and Ornithologist Creek, King George Island, South Shetlands, Antarctica[J]. Hydrobiologia, 269-270(1): 327-333. DOI:10.1007/BF00028031 |
Kelly M G, King L, Jones R I, et al. 2008. Validation of diatoms as proxies for phytobenthos when assessing ecological status in lakes[J]. Hydrobiologia, 610(1): 125-129. DOI:10.1007/s10750-008-9427-8 |
Lavoie I, Campeau S, Grenier M, et al. 2006. A diatom-based index for the biological assessment of eastern Canadian rivers:an application of correspondence analysis (CA)[J]. Canadian Journal of Fisheries and Aquatic Sciences, 63(8): 1793-1811. DOI:10.1139/f06-084 |
Lavoie I, Campeau S, Zugic-Drakulic N, et al. 2014. Using diatoms to monitor stream biological integrity in Eastern Canada:an overview of 10 years of index development and ongoing challenges[J]. Science of the Total Environment, 475: 187-200. DOI:10.1016/j.scitotenv.2013.04.092 |
刘麟菲, 徐宗学, 殷旭旺, 等. 2016. 应用硅藻指数评价渭河流域水生态健康状况[J]. 北京师范大学学报(自然科学版), 52(3): 317-321. |
刘奕伶, 葛继稳, 李艳元, 等. 2015. 古夫河着生藻类优势种体积与水质因子的相关性研究[J]. 中国环境科学, 35(7): 2182-2191. DOI:10.3969/j.issn.1000-6923.2015.07.044 |
Muscio C. 2002. The diatom pollution tolerance index: assigning tolerance values[R]. City of Austin: Watershed Protection and Development Review Department, Environmental Resource Management, 1-17
|
Oeding S, Taffs K H. 2017. Developing a regional diatom index for assessment and monitoring of freshwater streams in sub-tropical Australia[J]. Ecological Indicators, 80: 135-146. DOI:10.1016/j.ecolind.2017.05.009 |
Rimet F. 2012. Recent views on river pollution and diatoms[J]. Hydrobiologia, 683(1): 1-24. DOI:10.1007/s10750-011-0949-0 |
Sabater S, Muñoz I, Feio M J, et al. 2009. Chapter 4-The Iberian Rivers[M]//K. Tockner, U. Uehlinger, C. T. Robinson, Rivers of Europe. Academic Press; London.
|
Schneider S C, Lawniczak A E, Picińska-Faltynowicz J, et al. 2012. Do macrophytes, diatoms and non-diatom benthic algae give redundant information? Results from a case study in Poland[J]. Limnologica, 42(3): 204-211. DOI:10.1016/j.limno.2011.12.001 |
Simoes N R, Colares M A M, Lansac-Tôha F A, et al. 2013. Zooplankton species richness-productivity relationship:Confronting monotonic positive and hump-shaped models from a local perspective[J]. Austral Ecology, 38(8): 952-958. DOI:10.1111/aec.12038 |
Soininen J, Könönen K. 2004. Comparative study of monitoring South-Finnish rivers and streams using macroinvertebrate and benthic diatom community structure[J]. Aquatic Ecology, 38(1): 63-75. |
Tang T, Stevenson R J, Infante D M. 2016. Accounting for regional variation in both natural environment and human disturbance to improve performance of multimetric indices of lotic benthic diatoms[J]. Science of the Total Environment, 568: 1124-1134. DOI:10.1016/j.scitotenv.2016.03.060 |
Taylor J C, Prygiel J, Vosloo A, et al. 2007. Can diatom-based pollution indices be used for biomonitoring in South Africa? A case study of the Crocodile West and Marico water management area[J]. Hydrobiologia, 592(1): 455-464. DOI:10.1007/s10750-007-0788-1 |
Dam H V, Mertens A, Sinkeldam J. 1994. A coded checklist and ecological indicator values of freshwater diatoms from the Netherlands[J]. Netherlands Journal of Aquatic Ecology, 28(1): 117-133. DOI:10.1007/BF02334251 |
Venkatachalapathy R, Karthikeyan P. 2015. Application of diatom-based indices for monitoring environmental quality of riverine ecosystems: a review[M]. Ramkumar M, Kumaraswamy K, Mohanraj R. Environmental Management of River Basin Ecosystems. Cham; Springer International Publishing, 10.1007/978-3-319-13425-3(chapter 28): 593-619
|
王天亮. 2015.倭肯河流域水资源保护研究[D].哈尔滨: 黑龙江大学
|
Xue H, Zheng B, Meng F, et al. 2019. Assessment of aquatic ecosystem health of the Wutong River based on benthic diatoms[J]. Water, 11(4): 727-745. DOI:10.3390/w11040727 |
薛浩, 郑丙辉, 孟凡生, 等. 2018. 基于着生硅藻指数的梧桐河水生态健康评价[J]. 生态毒理学报, 13(4): 83-90. |
殷旭旺, 渠晓东, 李庆南, 等. 2012. 基于着生藻类的太子河流域水生态系统健康评价[J]. 生态学报, 32(6): 1677-1691. |
殷旭旺, 徐宗学, 鄢娜, 等. 2013. 渭河流域河流着生藻类的群落结构与生物完整性研究[J]. 环境科学学报, 33(2): 518-527. |
张莉, 林佳宁, 张远, 等. 2017. 浑太河不同水生态区营养盐对底栖硅藻的影响及阈值[J]. 环境科学, 38(11): 4570-4579. |
郑丙辉, 张远, 李英博. 2007. 辽河流域河流栖息地评价指标与评价方法研究[J]. 环境科学学报, 27(6): 928-936. DOI:10.3321/j.issn:0253-2468.2007.06.006 |
 2019, Vol. 39
2019, Vol. 39


