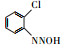
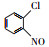
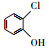
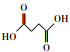
氯代硝基苯是一类含氯含硝基芳香烃化合物, 广泛用于化工、医药、农药等行业, 是生产杀虫剂、除草剂、染料、药品及橡胶等产品的重要中间体(李明堂等, 2010;Wang et al., 2011;Zhu et al., 2014).由于苯环上的氯和硝基官能团的亲电子性, 使氯代硝基苯类化合物具有稳定的化学结构(Zhu et al., 2012;Chen et al., 2017), 导致这类化合物极易在底泥和土壤中积累, 并通过食物链积累进而影响人类的健康, 因此美国环保署(EPA), 欧盟环境署(EEA)均将氯代硝基苯列为优先控制污染物(Xu et al., 2017).
目前含氯代硝基苯类化合物废水的处理主要有两类方法:一类是氧化还原法, 众多研究者(廖娣劼等, 2012;陈宜菲等, 2007;Li et al., 2014)利用自制的纳米零价铁, 还原处理废水或土壤中的氯代硝基苯, 在弱酸性条件下, 反应2 h后氯代硝基苯的降解率达到99%以上;李炳智等(2008)采用臭氧氧化处理含氯代硝基苯废水, 50 min内臭氧氧化法可完全去除废水中200 mg · L-1的氯硝基苯.采用氧化还原法降解氯硝基苯具有较高的降解效率, 但处理成本普遍较高.另一类生物法是利用微生物的新陈代谢功能将氯代硝基苯氧化或还原降解, 但氯代硝基苯在好氧条件下难以氧化降解, 在厌氧或缺氧的条件下, 苯环上的硝基(氯)取代基易被亲核攻击发生硝基还原及脱氯反应(Chun et al., 2013).但低降解速率、较差的系统运行稳定性限制了传统厌氧方法在氯代硝基苯降解的实际应用.生物电化学系统(BES)是利用电极与微生物间的电子传递作用, 强化微生物代谢, 促进污染物去除的技术(高凯拓等, 2016;蒋沁芮等, 2018).Xu等(2016)采用MES-UASB耦合体系降解P-CNB废水, 在水力停留时间为36 h, 中性条件下, 外加电压为1.5 V, P-CNB的降解率达99.6%.Chen等(2017)研究在持续外加电压和间歇外加电压条件下, BES-UASB反应器对2, 4-二氯硝基苯的去除效果, 发现在两种外加电压模式下, 2, 4-二氯硝基苯的去除效果相似, 间歇外加电压模式极大地降低了反应能耗.目前, BES以其处理效果好、经济成本低、污泥产量少成为难降解废水处理研究的趋势(何伟华等, 2017;张一帆等, 2017), 但迄今为止, 氯代硝基苯的UBES降解机理与途径仍不够明确.对比其他研究者, 本实验UBES采用底部进水, 顶部出水, 构成循环处理系统, 在系统中, 阴极水平置于电解槽底部厌氧污泥中, 阳极水平置于上覆水中, 形成底部污泥厌氧, 上部水体缺氧的实验体系.污染物质将在阴极被还原, 在阳极被氧化, 从而增大污染物质的降解效率, 并采用IC和HPLC-MS等分析有机物的降解可能路径与机理.
本实验通过搭建UBES进行2-CNB降解特性研究.重点研究了UBES降解2-CNB废水的特性, 分析2-CNB厌氧还原转化过程, 以及外加电压, 污染物初始浓度等因素对2-CNB的降解特性, 并分析和探讨了2-CNB降解的可能途径, 为上流式生物电化学系统降解2-CNB提供理论和方法支撑.
2 材料与方法(Materials and methods) 2.1 实验试剂本实验所用材料2-CNB为分析纯(上海科丰化学试剂有限公司);甲醇为色谱纯(西陇化工股份有限公司);葡萄糖、尿素、磷酸氢二钾均为分析纯, 购自天津市福晨化学试剂厂.
实验装置由蠕动泵(BT100-2J)、电解槽(10 cm×10 cm×15 cm)、稳压直流电源(MS305D)构成.采用石墨片(6 cm×6 cm)作为阴极, 连接电源负极, 水平固定于电解槽底部污泥中;采用钌铱板作(6 cm×6 cm)为阳极, 连接电源正极, 水平固定于电解槽上覆水中;利用蠕动泵, 使得电解槽形成底部进水顶部出水的循环系统.自制上流式生物电化学系统实验装置如图 1所示.
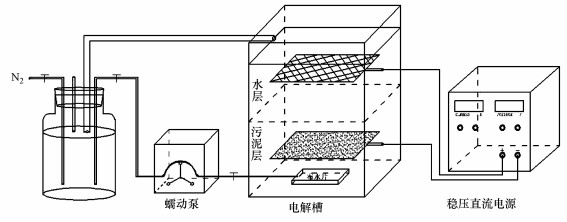 |
| 图 1 实验装置图 Fig. 1 Schematic diagram of experimental setup |
污泥驯化在1000 mL聚乙烯瓶内进行, 接种污泥取自南昌市朝阳污水处理厂回流污泥, 开始驯化时实验配水中2-CNB的浓度为5 mg · L-1, 以5、10、20、30 mg · L-1为驯化浓度梯度, 每个浓度驯化4~5 d, 每个浓度重复驯化两次, 厌氧污泥梯度浓度驯化稳定后MLSS为8 g · L-1.将驯化完成的厌氧污泥移入UBES电解槽, 并加入20 mg · L-1的2-CNB溶液, 在0.5 V条件下继续驯化, 取样测量水样中2-CNB的浓度, 当2-CNB去除率稳定达到90%以上, 工作电极电流输出稳定时, 即认为UBES成功启动.按图 1所示搭建实验装置, 根据实验条件向电解槽内依次加磷酸盐缓冲液(PBS)200 mL、驯化好的厌氧污泥500 mL及配置好的目标污染物溶液, 使电解槽内溶液体积在蠕动泵作用下维持1 L, 水力停留时间为4 h, 完成UBES的启动.改变实验条件下进行生物电化学处理, 处理时间为30 h, 在反应的不同时间分别取出水样, 经5000 r · min-1离心10 min后进行分析测试.
实验过程采用3组平行实验进行样品检测, 用标准方差分析检测数据的误差棒s, 其具体公式见式(1):
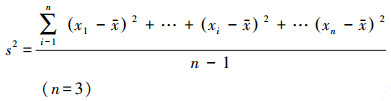
|
(1) |
采用配备有Agilent ZORBAX SB-C18柱(不锈钢150 mm×4.6 mm)和紫外检测器的高效液相色谱仪(HPLC, Agilent 1200)测定2-CNB的浓度.使用甲醇/0.1%磷酸(60 : 40 v/v)的溶液作为流动相.流动相经过滤和超声处理, 去除溶解气体, 流速为1.23 mL · min-1, 压力为10.7 MPa, 柱温为303 K, 紫外检测波长为260 nm.使用试剂等级标准来校准HPLC, 将20 μL的等分试样手动注入HPLC以测定2-CNB的浓度.降解效率(DE)计算公式见式(2).
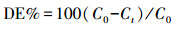
|
(2) |
式中:C0为2-CNB的初始浓度(mg · L-1);C为t时刻系统中2-CNB的浓度(mg · L-1).
2.3.2 高效液相色谱-质谱联用(HPLC-MS)分析采用配有ESI源的HPLC/MS/MS(Agilent6538Q-TOF系统)对2-CNB降解的中间产物进行鉴定.HPLC/MS/MS中的HPLC测试条件为:流动相采用甲醇: 0.1%甲酸=70 : 30, 流速设定为0.2 mL · min-1.记录质量范围为50~500 m/z的负离子和正离子模式下的全量程质谱图.
2.3.3 离子色谱分析(IC)采用离子色谱仪(Dionex ICS-2500)分析降解后水样, 在阴离子交换柱(离子包AS 18, 2 mm×250 mm)上, 用电导检测器(ECD)测量Cl-、NO2-和NO3-离子浓度.将20 μL的脂肪酶注入IC内, 流动相为1.7 mmol · L-1NaHCO3溶液和1.8 mmol · L-1Na2CO3溶液, 流速为0.25 mL · min-1.分析水样中的离子产生情况, 来探讨2-CNB的可能降解机理.
3 结果与讨论(Results and discussion) 3.1 外加电压的影响在2-CNB初始浓度为20 mg · L-1, 初始pH=7, 电解时间t=30 h, 极板间距d=5 cm条件下, 改变外加电压大小, 研究外加电压对2-CNB降解速率的影响, 结果如图 2所示.
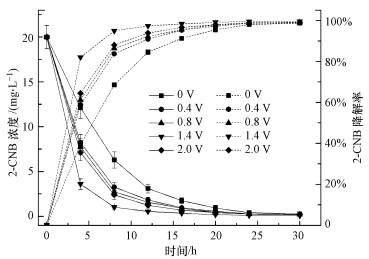 |
| 图 2 不同电压下2-CNB的去除效果(实线代表浓度,虚线代表降解率,下同) Fig. 2 Removal effect of 2-CNB under different external voltage |
从图 2可以看出, 随着降解时间的增加, 2-CNB的降解率逐渐提高.在不同的电压下反应30 h, 2-CNB的降解率均达到98%以上.系统反应30 h, 当外加电压为0.0、0.4、0.8、1.4、2.0 V时, 2-CNB的降解率分别为98.72%、98.82%、99.05%、99.61%、99.13%, 当外加电压从0提高到1.4 V时, 2-CNB的降解效率随电压的升高而加快, 继续升高外加电压, 增强效果不明显.分析原因为:当外加电压从0 V上升至1.4 V时, 一方面外加电压提高生物体活性, 对生物体酶活性、新陈代谢及细胞膜通透性产生影响(Chen et al., 2017);另一方面极板间电势差增大, 阴极产生极少量氢气作为电活性微生物的电子供体, 提高了阴极还原效率(Jiang et al., 2016), 降解速率逐渐增加;当电压从1.4 V上升至2.0 V时, 电极副反应加剧, 导致过多的氢气小气泡附着在阴极表面, 阻碍电子的传递, 影响阴极还原反应, 使2-CNB降解速率下降.
3.2 2-CNB初始浓度的影响固定系统初始电压为1.4 V, pH=7, 电解时间t=30 h, 极板间距d=5 cm条件下, 改变2-CNB的初始浓度浓度, 研究底物初始浓度对2-CNB降解的影响.
从图 3可以看出, UBES对2-CNB的降解速率在前4 h最大, 然后逐渐减小, 因为随着反应进行, 系统中营养物质和底物逐渐被消耗, 微生物增长速率减小, 导致后期降解速率缓慢, 符合Monod方程动力学降解规律.在反应前期, 2-CNB初始浓度从10 mg · L-1增加到20 mg · L-1, 降解速率明显增大, 因为2-CNB初始浓度增大, 使系统中微生物的比增长速率增大, 因而提高了2-CNB的降解速率;当2-CNB初始浓度从20 mg · L-1增加到30 mg · L-1时, 2-CNB的降解速率反而降低, 这是因为高浓度2-CNB抑制微生物的活性, 使微生物增殖受抑制, 降解速率减小.由此说明, 底物浓度对于UBES降解2-CNB有着一定的影响, 底物浓度越大, 降解速率相对较快, 但浓度超过某一阈值后, 微生物的活性将受到抑制, 进而影响降解效果.
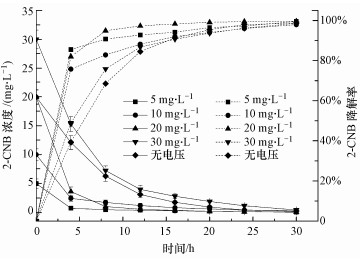 |
| 图 3 不同底物初始浓度下2-CNB的去除效果 Fig. 3 Removal effect of 2-CNB under different initial concentration |
为进一步了解2-CNB的降解情况, 对降解过程可能生成的中间产物做高效液相色谱分析结果如图 4所示.由图可知, 原样色谱图中保留时间3.1 min为2-CNB的特征峰, 其色谱峰高和峰面积随反应时间不断变小, 即表明随着反应的进行, 2-CNB不断被降解, 反应30 h, 2-CNB基本被完全降解;降解过程中的色谱图还出现多种峰, 说明降解过程生成了多种降解中间产物, 部分中间产物的峰高和峰面积随反应的进行也有减小的趋势, 说明随着反应的进行部分中间产物也在被降解, 达到反应终点时, 色谱图中依旧含有峰型较多, 这说明在降解过程中产生的中间产物不能完全被降解.
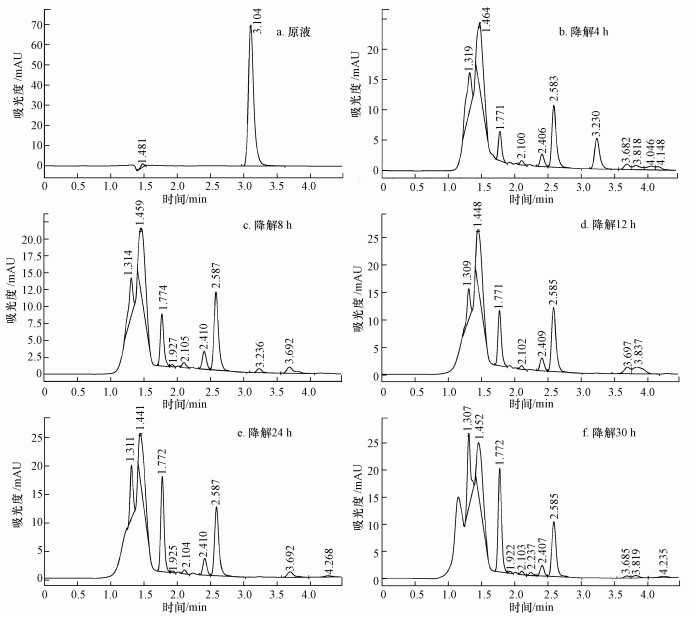 |
| 图 4 UBES降解2-CNB高效液相图 Fig. 4 HPLC spectra of 2-CNB degradation in UBES |
将20 mg · L-1的2-CNB原样及UBES最佳处理条件下反应24 h的样品采用IC对其进行测定分析, 分析结果如图 5所示.
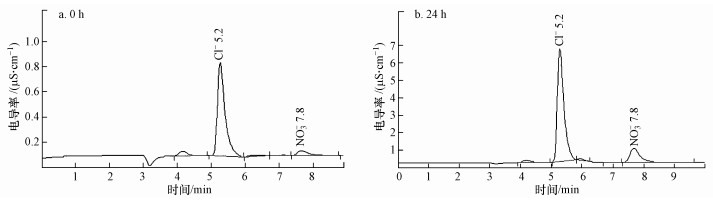 |
| 图 5 2-CNB生物电化学降解产物IC扫描图 Fig. 5 The IC spectra of 2-CNB and its degradation intermediates during UBES degradation |
图 5中依次为2-CNB在UBES中降解0、24 h时的离子色谱扫描图, 由图可以看出分别在5.2 min左右扫出Cl-1, 在7.8 min左右扫出NO3-.从峰高可以明显看出两种离子浓度显著增大, 通过工作站标准曲线自动换算出各离子浓度见表 1.
| 表 1 UBES降解2-CNB阴离子浓度变化 Table 1 The variation in anion concentrations with time during UBES degradation of 2-CNB |
从表 1可以看到, Cl-和NO3-的浓度随时间的增加而增大, Cl-浓度从2.24 mg · L-1增大到5.52 mg · L-1, NO3-浓度从1.03 mg · L-1增大到2.21 mg · L-1, 这说明在UBES中, 2-CNB发生了还原脱氯和脱硝基过程, 且还原脱氯效果较好, 前24 h内还原脱氯已达最佳水平, 2-CNB中的N元素只有部分转化为NO3-, 还有一部分可能存在于中间产物.
3.3.3 高效液相色谱-质谱联用(HPLC-MS)分析为了探究2-CNB在UBES降解过程中可能出现的中间产物, 对初始浓度为20 mg · L-1, 外加电压为1.4 V, 降解时间为20 h的水样, 采用HPLC/MS/MS进行定性分析, 检测降解过程中所生成的中间产物, 根据分析结果, 推测出UBES降解2-CNB的机理.降解中间产物质谱图如图 6所示.
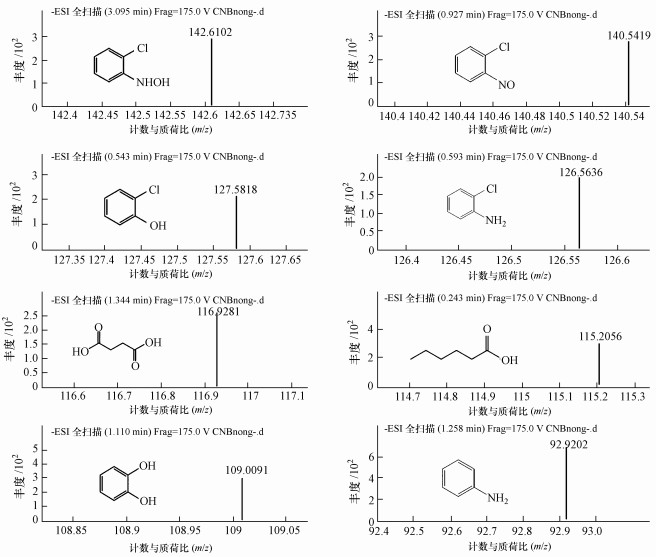 |
| 图 6 UBES降解2-CNB质谱图 Fig. 6 The HPLC-MS spectra of 2-CNB degradation in UBES |
根据质谱分析结果, 对比谱库标准物质, 推测出UBES降解2-CNB的过程中可能产生的中间产物如表 1所示.中间产物可能有苯胺、2-氯亚硝基苯、2-氯羟基苯胺、2-氯苯胺、正己酸、2-氯苯酚、苯二酚、丁二酸等中间产物.由此推测系统中可能存在两条降解途径:①厌氧微生物的引入, 电极反应的过电位被降低, 阴极电子传递速率加快, 强化阴极还原反应.厌氧微生物通过一系列的电子传递体系将电子传递给2-CNB及其中间产物(2-氯亚硝基苯、2-氯羟基苯胺、2-氯苯胺), 生成苯胺, 部分苯胺发生脱氨基, 并在阳极区域被氧化开环裂解生成正己酸, 正己酸最终发生矿化生成CO2.2-CNB生物转化成苯胺这一结论与前期报道的结果一致(陈浩毅, 2009;李海翔等, 2012;Jiang et al., 2016);②随着外加电压的逐渐增大, 在外加电场的作用下阳极直接产生少量具有强氧化活性的羟基自由基(· OH), 系统内存在的· OH攻击2-CNB中的硝基与氯生成少量的苯二酚, 然后开环裂解生成丁二酸, 最后矿化生成CO2.推断可能的降解途径如图 7所示.
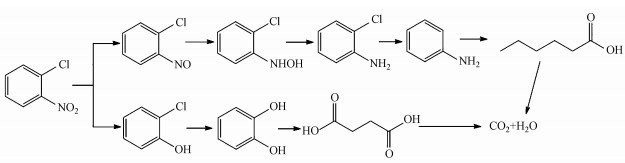 |
| 图 7 UBES降解2-CNB的可能途径 Fig. 7 Possible degradation pathway of 2-CNB in UBES |
| 表 2 2-CNB降解中间产物的高效液相质谱分析结果 Table 2 HPLC-MS analysis results of 2-CNB degradation intermediate products |
1) 相比传统的厌氧污泥处理体系, UBES对2-CNB的降解效果有明显增强.
2) 在UBES中, 外加电压和底物浓度对2-CNB的降解影响较大, 中性条件下, 当外加电压为1.4 V, 极板间距5 cm, 初始浓度为20 mg · L-1的2-CNB降解30 h后, 降解效果最好, 2-CNB的降解率达到99.61%.
3) 2-CNB降解24 h的降解产物通过IC进行阴离子测定, 24 h后产生了Cl- 4.28 mg · L-1, NO3- 1.18 mg · L-1, 2-CNB中Cl基本转化为Cl-1, N少量转化为NO3-.
4) UBES降解2-CNB过程通过HPLC/MS/MS检测得到8种物质为苯胺、2-氯亚硝基苯、2-氯羟基苯胺、2-氯苯胺、正己酸、2-氯苯酚、苯二酚、丁二酸等中间产物, 推断可能的降解途径为2-CNB还原降解成2-氯亚硝基苯、2-氯羟基苯胺、2-氯苯胺, 然后, 2-氯苯胺脱除氯取代基进一步降解生成苯胺, 最后裂解开环为链烃类有机物正己酸;推测可能的第二条降解途径为2-CNB降解成氯苯酚、苯二酚, 再降解为链烃类有机物丁二酸.链状烃因结构中不再含有苯环其降解难度远低于2-CNB, 极大提高了可降解性.
Chun C L, Payne R B, Sowers K R, et al. 2013. Electrical stimulation of microbial PCB degradation in sediment[J]. Water Research, 47(1): 141–152.
DOI:10.1016/j.watres.2012.09.038
|
Chen H, Gao X, Wang C, et al. 2017. Efficient 2, 4-dichloronitrobenzene removal in the coupled BES-UASB reactor:Effect of external voltage mode[J]. Bioresource Technology, 241: 879.
DOI:10.1016/j.biortech.2017.06.010
|
陈宜菲, 陈少瑾. 2007. 利用零价铁还原土壤中硝基苯类化合物的研究[J]. 环境科学学报, 2007, 27(2): 241–246.
DOI:10.3321/j.issn:0253-2468.2007.02.011 |
程浩毅.2009.利用生物电化学系统(BES)去除废水中硝基苯的可行性研究[D].哈尔滨: 哈尔滨工业大学
http://cdmd.cnki.com.cn/article/cdmd-10213-2010027793.htm |
高凯拓, 华立锋, 陶丽杰, 等. 2016. 微生物电解池原理及其在废水处理中的研究进展[J]. 能源环境保护, 2016, 30(4): 1–4.
DOI:10.3969/j.issn.1006-8759.2016.04.001 |
何伟华, 刘佳, 王海曼, 等. 2017. 微生物电化学污水处理技术的优势与挑战[J]. 电化学, 2017, 23(3): 283–296.
|
Jiang X, Shen J, Yan H, et al. 2016. Efficient nitro reduction and dechlorination of 2, 4-dinitrochlorobenzene through the integration of bioelectrochemical system into upflow anaerobic sludge blanket:A comprehensive study[J]. Water Research, 88: 257–265.
|
蒋沁芮, 杨暖, 吴亭亭, 等. 2018. 生物电化学脱氮技术研究进展[J]. 应用与环境生物学报, 2018, 24(2): 1–13.
|
Li B, Zhu J. 2014. Removal of p-chloronitrobenzene from groundwater:Effectiveness and degradation mechanism of a heterogeneous nanoparticulate zero-valent iron (NZVI)-induced Fenton process[J]. Chemical Engineering Journal, 255(7): 225–232.
|
李炳智, 徐向阳, 朱亮. 2008. 氯代硝基苯类废水臭氧化动力学和机理[J]. 化工学报, 2008, 59(8): 2111–2120.
DOI:10.3321/j.issn:0438-1157.2008.08.035 |
李海翔, 徐晓茵, 梁郡, 等. 2012. 氢基质自养微生物还原降解水中对氯硝基苯的研究[J]. 环境科学学报, 2012, 32(10): 2394–2401.
|
李明堂, 徐镜波, 卢振兰, 等. 2010. 两株细菌对邻氯硝基苯的协同降解[J]. 环境科学学报, 2010, 30(6): 1138–1143.
|
廖娣劼, 杨琦, 李俊錡. 2012. 零价铁降解4-氯硝基苯动力学研究[J]. 环境科学, 2012, 33(2): 469–475.
|
Wang A J, Cheng H Y, Liang B, et al. 2011. Efficient reduction of nitrobenzene to aniline with a biocatalyzed cathode[J]. Environmental Science & Technology, 45(23): 10186–10193.
|
Xu X, Shao J, Li M, et al. 2016. Reductive Transformation of p-chloronitrobenzene in the upflow anaerobic sludge blanket reactor coupled with microbial electrolysis cell:performance and microbial community[J]. Bioresource Technology, 218: 1037.
DOI:10.1016/j.biortech.2016.07.037
|
Zhu L, Gao K, Qi J, et al. 2014. Enhanced reductive transformation of p-chloronitrobenzene in a novel bioelectrode-UASB coupled system[J]. Bioresource Technology, 167(3): 303–309.
|
Zhu L, Lin H Z, Qi J Q, et al. 2012. Effect of H2 on reductive transformation of p-ClNB in a combined ZVI-anaerobic sludge system[J]. Water Research, 46(19): 6291–6299.
DOI:10.1016/j.watres.2012.08.029
|
张一帆, 王爱杰, 程浩毅. 2017. 生物电化学系统在废水脱氮中的应用研究进展[J]. 水处理技术, 2017, 43(10): 54–59.
|
 2019, Vol. 39
2019, Vol. 39