2. 农业部西北植物营养与农业环境重点实验室, 杨陵 712100;
3. 中国烟草总公司郑州烟草研究院, 郑州 450001
2. Key Lab of Plant Nutrition and the Agri-environment in Northwest China, Ministry of Agriculture, Yangling 712100;
3. China Tobacco Corporation Zhengzhou Tobacco Research Institute, Zhengzhou 450001
中国是小麦和烟草种植大国, 每年都会产生大量的烟草和小麦秸秆, 秸秆焚烧会造成一定的环境问题(Qu et al., 2012), 而烟杆直接还田可能引发土传病害(何玉亭等, 2016).如何实现农业废弃物秸秆资源的有效利用是目前我们面临的主要问题.生物炭是生物质材料如作物秸秆和果木枝条等在高温(< 700 ℃)无氧条件下热解得到的一类固态物质(张玉洁等, 2017;Lehmann et al., 2006), 其丰富的孔隙结构不仅为微生物生长繁殖提供良好的场所, 巨大的比表面积和表面能还可通过吸附和保持土壤水分减少养分流失(刘玉学等, 2014), 从而改善土壤养分和结构状况, 促进作物生长和产量提升(Oguntunde et al., 2008).因此, 将秸秆炭化为生物炭后还田改土是一种有效的农业废弃物秸秆资源利用方式(Min et al., 2013).
福建烟区是我国三大优质烟产区之一, 烟草种植面积约为6×104~7×104 hm2(Min et al., 2013), 土壤类型主要以红壤性水稻土为主, 由于长期连作和单一施用化肥等问题, 导致植烟土壤养分严重失调, 烟草产量和品质不佳(Oguntunde et al., 2008;武小净等, 2013).生物炭作为一种土壤改良剂在烟田中的应用中已有报道.王丽渊等(2014)发现, 施用小麦炭会抑制砂壤土上烤烟前期生长.但Niu等(2015)研究发现, 花生壳炭和稻壳炭施用于山地黄棕壤后均可促进烤烟前期生长.可见, 不同来源的生物炭施用于不同类型的土壤对烤烟生长的影响有差异, 因制备生物炭的原材料组成(纤维素、木质素和水分)不同, 所以相同热解温度下这些组分的热解程度也会存在较大差异(Lehmann et al., 2009).物料类型是决定生物炭特性和组分的重要因素之一(李明等, 2015), 不同类型的生物炭对土壤微生物群落结构的影响也不尽相同.李明等(2015)的室内培养试验结果表明, 水稻秸秆炭比玉米秸秆炭对土壤微生物群落结构的影响更为显著, 乌英嘎等(2014)的田间试验表明, 施用花生壳炭导致潮土细菌多样性下降, 而木材炭对粉砂壤土土壤细菌多样性短期内无影响(Rutigliano et al., 2014).而Zhang等(2016)的田间试验结果显示, 施用稻杆生物炭提高了烤烟成熟期根际土壤细菌多样性, 但对真菌多样性无显著影响, Chen等(2013)发现小麦秸秆炭施用导致水稻土细菌丰富度提高, 但真菌丰富度显著下降, Hu等(2014)研究发现, 短期施用生物炭降低了红壤氧化土中真菌多样性.可见, 土壤类型和生物炭在土壤体系中的作用时间都可能影响其对土壤微生物群落结构的改变.土壤酶是根际微生态系统的重要组成部分, 土壤酶活性可一定程度反映土壤微生物活性及养分循环状况(Nannipieri et al., 2012).有研究者认为, 生物炭主要通过影响理化性质等间接途径来影响微生物群落结构(Muhammad et al., 2014;姚钦, 2017).目前的研究多集中于生物炭施用对土壤理化性质和微生物群落结构的影响及其二者之间的关系(何玉亭等, 2016;Lehmann, 2009;Zhang et al., 2016), 而关于小麦秸秆炭和烟秆炭对烤烟前期施用效果的深入研究未见报道.本研究选用烟草和小麦两种作物秸秆于350~550 ℃高温无氧制备得到两种生物炭材料, 以水稻土为供试土壤, 通过盆栽试验, 研究不同材料制备的生物炭对烤烟前期生长、土壤理化性质和微生物群落结构的影响, 以期为植烟土壤改良和秸秆生物炭在烟田的合理施用提供理论参考.
2 材料与方法(Materials and methods) 2.1 试验材料试验于2016年在西北农林科技大学(34°16′ 56.24″N, 108°4′ 27.95″E)旱棚(日光温室)中进行.以烤烟K326为试验品种, 用漂浮育苗的方式育苗, 待育苗完成后选取长势一致的烟苗移栽至高25 cm、口径36 cm的花盆, 每盆移栽1颗.盆栽用土为福建烟区0~10 cm土层的水稻土, 经风干过筛(2 mm), 每盆装土+生物炭(过2 mm筛)10 kg.供试生物炭分别为小麦秸秆和烟杆在350~550 ℃厌氧热解后的产物, 烟杆炭由淮安华电环保机械制造有限公司提供, 小麦秸秆炭购买于河南三利新能源有限公司, 供试土壤和生物炭的基本理化性质如表 1所示.
| 表 1 土壤和生物炭的基本性质 Table 1 Basic properties of soil and biochar |
试验设3个处理, 分别为对照(无添加, CK), 添加0.1%(质量分数)的小麦秸秆炭(WB)和烟秆炭(TB), 每个处理3次重复, 随机排列, 在烟苗移栽前将肥料(每盆按2 g纯氮量施N : P2O5 : K2O=1 : 1.5 : 3的复合肥)、生物炭和土充分混合均匀后装盆.烟苗移栽后采样之前保持水分为土壤相对含水量的60%, 试验期间根据水分蒸发情况每1~2 d补充1次水分.
2.3 样品采集及分析方法分别在烟苗移栽后的还苗期(第15 d)和团棵期(第45 d)测定烟草的农艺性状指标(株高、叶片数、叶长和叶宽), 之后将整个植株连根挖出, 用抖根法取根际土壤, 将所取土样分为两份, 一份放入冷藏箱运回实验室储存于-80 ℃冰箱, 除去杂根等后用于土壤DNA提取, 另一份风干过筛后用于理化性质分析.将烟株地上部和根分开, 洗净后装入信封, 105 ℃杀青15 min, 60 ℃烘干后称重.
农艺性状指标用卷尺测定, 叶面积=叶长×叶宽×叶面积指数(0.6345)(Zhang et al., 2016), 土壤理化性质的测定参照鲍士旦(2000)的方法.脱氢酶采用TTC还原法, 蔗糖酶活性采用3, 5-二硝基水杨酸比色法, 脲酶活性采用靛酚蓝比色法测定, 具体试验步骤参照关松荫(1986)的方法.
将根际土壤样品送至北京诺禾致源科技股份有限公司采用MiSeq平台进行微生物16S和18S扩增子高通量测序.采用MPBIO公司的土壤DNA快速提取试剂盒(Fast DNATM SPIN Kit for Soil)提取土壤微生物基因组DNA, 使用Nano Drop 2000微量分光光度计测定提取液中DNA的浓度和质量.试验在iCycler IQ 5定量PCR仪(Bio-Rad, Hercules, CA, USA)上进行, 采用引物对F515(5′-GTG CCA GCM GCC GCG GTA A-3′)和R806(5′-GGA CTA CHV GGG TWT CTA AT-3′)扩增16S rRNA基因的V4区.扩增程序:95 ℃ 10 min, 40×(95 ℃ 15 s, 53 ℃ 30 s, 70 ℃ 60 s).采用引物对ITS1F(5′-ACT TGG TCA TTT AGA GGA AGT AA-3′)和ITS2(5′-BGC TGC GTT CTT CAT CGA TGC-3′)扩增18S rRNA基因的ITS-1区域, 扩增程序:95 ℃ 10 min, 29×(95 ℃ 15 s, 50 ℃ 30 s, 70 ℃ 60 s).PCR反应体系如下:采用20 μL的体系, 10 μL扩增酶混合物(Applied Biological Materials Inc., Richmond, BC, Canada), 8 μL无菌水, 10 nmol·L-1正反向引物各0.5 μL, DNA模板1 μL.试验设置不加模板的对照.利用Pico green和荧光分光光度计方法定量文库, 并使用安捷伦对PCR富集片段进行质量控制, 多样品DNA文库均一化至10 nmol·L-1后等体积混合, 之后于Illumina MiSeq平台进行文库构建和测序.采用标准的TruSeq DNA文库制备实验流程, 测序结果采用滑动窗口法对双端的FASTQ序列做质量过滤, 然后利用FLASH软件进行阅读和拼接.利用Qiime(version 1.7.0, http://qiime.org)在97%的相似水平下对有效序列进行OTU的聚类, 运用mothur软件(version 1.31.2, http://www.mothur.org/)中uchime的方法去除嵌合体序列, 得到OTU代表序列, 并用该软件中的summary. single命令对菌群的α多样性指数(Chao1、Shannon和Simpson指数)进行计算, 利用统计学方法, 观测样品在不同门水平上的群落结构.
2.4 数据处理试验数据均取3次重复的平均值, 采用Microsoft excel 2013和JMP10.0(SAS Institute, USA, 2011)统计软件处理数据, 用Duncan′s法检验差异显著性(p < 0.05).
3 结果与分析(Results and analysis) 3.1 生物炭施用对土壤理化性质及酶活性的影响由表 2可知, 小麦秸秆炭和烟秆炭施用对土壤容重、pH、有机碳、全氮、全磷、有效磷和有效钾含量没有显著影响, 但显著影响了土壤硝、铵态氮含量.与CK处理相比, WB和TB处理硝态氮含量分别降低64.7%和47.6%, TB处理铵态氮含量增加37.5%.
| 表 2 烟草根际土壤理化性质 Table 2 Physical and chemical properties in the rhizosphere soil of tobacco |
小麦秸秆炭和烟杆炭施用影响了土壤脱氢酶的活性, 而对土壤脲酶和蔗糖酶的活性没有显著影响.对于WB和TB处理, 与CK处理相比, 土壤脱氢酶活性分别显著降低了56.4%和48.7%(表 3).
| 表 3 烟草根际土壤酶活性 Table 3 Enzyme activities in the rhizosphere soil of tobacco |
由表 4可知, 与CK处理相比, WB和TB两处理细菌的OTUs数分别显著降低20.6%和18.0%, Chao1丰富度指数分别显著减小21.2%和23.7%, Shannon指数显著降低10.3%和10.0%, Simpson指数显著降低0.7%和0.9%, 但两生物炭处理之间并无显著差异.与CK处理相比, WB和TB两处理中真菌的OTUs数分别显著减小53.8%和77.4%, Chao1丰富度指数分别显著减小49.4%和72.0%, Shannon指数显著降低29.2%和50.6%, TB处理的Simpson指数显著降低20.8%, 而WB处理的Simpson指数没有显著变化.这说明添加不同类型的生物炭均可以显著降低植烟土壤中细菌和真菌的物种丰富度.
| 表 4 根际土壤细菌和真菌多样性指数分析 Table 4 Analysis of bacterial and fungal diversity indexes in the rhizosphere soil of tobacco |
根据物种注释结果, 选取每个处理在门水平上最大丰度排名前10的物种, 生成物种相对丰度柱形累加图(图 1).由图可知各处理中丰度最高的菌门是蛋白菌门, 其次是放线菌门、厚壁菌门、酸杆菌门、芽单胞菌门、拟杆菌门、疣微菌门、蓝细菌门、Saccharibacteria和浮霉菌门.其中放线菌门、疣微菌门和Saccharibacteria的相对丰度变化显著.与CK处理相比, WB处理中放线菌门的丰度提高69.5%, 疣微菌门的丰度降低37.6%;TB处理中疣微菌门的丰度降低40.9%, Saccharibacteria的丰度提高129.7%.
 |
| 图 1 根际土壤细菌主要菌群丰度 (图柱上标不同小写字母表示处理间差异显著(p < 0.05), 下图同) Fig. 1 Abundance of main bacteria in rhizosphere soil |
由图 2可知, 各处理中丰度最高的真菌是子囊菌门, 其次是担子菌门、接合菌门、壶菌门和球囊菌门.其中接合菌门和子囊菌门相对丰度变化显著.与CK处理相比, WB处理接合菌门的丰度降低87.5%, TB处理子囊菌门的丰度提高133.8%, 接合菌门的丰度降低92.9%.
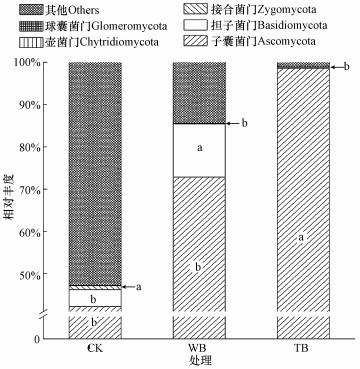 |
| 图 2 根际土壤真菌主要菌群丰度 Fig. 2 Abundance of main fungi in rhizosphere soil |
Unweighted unifrac可以检测样品间变化的存在, 而Weighted unifrac可以更进一步定量的检测样品间不同谱系上发生的变异.图 3表示不同处理之间细菌的物种结构多样性和组成多样性.可知, 就物种结构多样性而言, CK、WB和TB 3个处理细菌群落两两之间均存在较大差异, 其中CK和TB之间的群落差异最大.而就物种结构组成多样性而言, 3个处理之间并没有显著性的差异.这说明烟杆生物质炭处理对植烟根际土壤细菌群落结构的影响大于小麦生物炭处理.
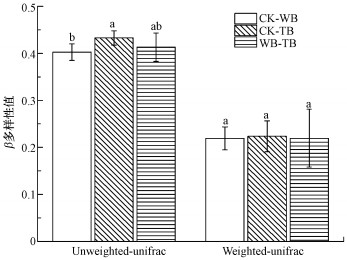 |
| 图 3 根际土壤细菌群落结构β多样性 Fig. 3 β diversity of fungal community structure in the rhizosphere soil |
图 4表示不同处理之间真菌的物种结构多样性和组成多样性.可知, 不论是物种结构多样性还是物种结构组成多样性, CK、WB和TB 3个处理真菌群落两两之间均存在较大的差异, 其中CK和TB之间的物种结构多样性差异最大.这说明烟杆炭处理对烟草根际真菌群落结构的影响更大.而就物种结构组成多样性而言, CK和WB和TB处理之间均产生了较大的差异, 而WB和TB处理之间差异较小.
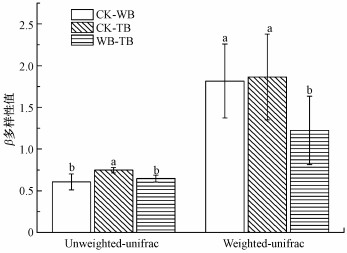 |
| 图 4 根际土壤真菌群落结构β多样性 Fig. 4 β diversity of fungal community structure in the rhizosphere soil |
与CK处理相比, 小麦秸秆炭和烟秆炭施用影响了烟草还苗期和团棵期的农艺性状(表 5).对于WB和TB处理, 烟草还苗期株高分别较对照显著增加97.2%和119.4%.对于WB处理, 烟草团颗期的叶片数、株高、最大叶面积、地上部干重和根干重分别较对照增加79.1%、222.7%、126.4%、439.6%和866.7%.对于TB处理, 烟草团颗期的叶片数、株高、最大叶面积、地上部干重和根干重分别较对照显著增加83.6%、257.6%、156.5%、469.2%、833.3%.可以看出, 施用两种生物炭后烤烟农艺性状明显改善.
| 表 5 烟株农艺性状及干重 Table 5 Tobacco agronomic traits and dry weight |
本研究由于生物炭用量较低(0.1%), 两种生物炭施用均未显著影响土壤容重、pH、有机碳、全氮、全磷、有效磷和有效钾, 但与CK处理相比, 小麦秸秆炭和烟杆炭处理土壤硝态氮含量分别显著降低64.7%和47.6%, TB处理铵态氮含量显著增加37.5%, 与Lu等(2015)的研究结果一致, 生物炭有利于土壤中氮的保存.可能是因为生物炭的吸附作用减少了铵与硝化细菌的接触, 减少硝化作用损失(Lu et al., 2015).两种生物炭施用均导致土壤脱氢酶活性降低, 但对脲酶活性没有显著影响, 与Wu等(2013)的研究结果一致.可能是一方面, 生物炭通过氢键和阳离子交换作用吸附了酶分子, 导致结构改变并减少酶的活动位点;另外, 酶促反应的底物可能被生物炭吸附, 降低了底物对酶的有效性(Luo et al., 2016).但脲酶活性变化与生物炭的来源和用量有关, Yang等(2016)研究发现, 与不施生物炭处理相比, 添加5%的稻秆炭后土壤脲酶活性显著提高100%以上, 而用量为1%的稻秆炭处理土壤脲酶活性并无显著变化.姚钦(2017)的研究发现添加高量(8%)玉米秸秆炭对土壤脲酶活性的提升效果显著, 而Oleszczuk等(2014)的研究结果表明, 用量为30 t·hm-2生物炭土壤脱氢酶和脲酶活性升高, 而用量为40 t·hm-2时降低这两种酶活性, Xu等(2018)研究发现, 添加1%的酒糟生物炭提高脲酶和蔗糖酶活性, 而用量为2%的处理会导致酶活性降低.而生物炭特殊的吸附性能增加了其在土壤体系中与酶作用的复杂性, 因此有关作用机理还有待进一步探讨.
4.2 两种生物炭添加对土壤微生物群落结构的影响本研究结果表明, 添加小麦秸秆炭和烟杆炭显著降低植烟土壤中细菌的物种丰富度和多样性(表 4), 这与Khodadad等(2011)的研究结果一致, 生物炭施用在为某些类群的细菌生长提供有利条件的同时也抑制了一部分细菌的生长和繁殖, 导致群落多样性指数减小.小麦秸秆炭处理提高了放线菌门的丰度(图 1), 这与顾美英等(2016)的研究结果一致.放线菌分泌的胞外酶可参与复杂芳香物质的降解过程, 因此生物炭施入会促进放线菌的生长(雷海迪等, 2016).但是小麦秸秆炭和烟杆炭处理显著降低疣微菌门的丰度(图 1).一方面, 生物炭释放出的乙烯可能抑制疣微菌门的活性(乌英嗄等, 2014);另外, 疣微菌门不属于异养活性低但腐殖化能力强的细菌, 因此芳香族化合物(生物炭)施用反而导致其丰度降低(田小平等, 2017).这与王成己等(2017)研究结果不同, 烟杆生物炭施用提高红壤性水稻土(pH 5.45)烤烟旺长期根际土壤疣微菌门的丰度, 而放线菌门的丰度并无显著变化.这可能与烟草生长时期有关.
另外, 小麦秸秆炭和烟杆炭施用显著降低植烟土壤真菌的物种丰富度和多样性(表 4), 这与Hu等(2014)的研究结果一致.生物炭自身的营养物质可能对微生物生长产生影响(姚钦, 2017), 在促进优势菌群如子囊菌门生长的同时, 抑制了部分真菌生长, 减少杂菌比例, 从而导致真菌多样性降低.生物炭中的有机物质能够作为部分真菌代谢的基质(Chen et al., 2013), 促进优势菌群的生长, 这与我们观察到的烟杆炭处理子囊菌门的丰度显著升高结果一致.真菌中的子囊菌门与木质素的分解有关, 而接合菌门被认为是蔗糖和纤维素的分解者(Jin, 2010).李发虎等(2017)的研究结果表明, 用量为20~60 t·hm-2的玉米秸秆炭处理可显著增加砂壤土上黄瓜结果期土壤真菌中子囊菌门和接合菌门丰度, 与本研究结果不一致.这可能与生物炭的类型有关.
4.3 两种生物炭添加对烤烟生长的影响本研究结果表明, 烟杆炭和小麦秸秆炭均能有效促进烤烟前期生长, 这与Niu等(2015)的研究结果一致, 施用不同类型生物炭(花生壳炭、小麦秸秆炭和稻壳炭)均能促进烤烟前期生长, 与生物炭改善土壤结构、增加土壤养分含量有关(Xu et al., 2013).但本研究中, 在低量(0.1%)施用生物炭的情况下, 生物炭对烤烟生长的促进作用主要可能与影响土壤硝化作用、微生物整体的氧化还原能力和土壤细菌和真菌优势群落分布有关.而万海涛(2014)的研究表明花生壳炭施用于壤质潮土(pH 7.48)后会抑制烟株前期生长, 王丽渊等(2014)也有类似的结论.这可能与土壤类型、生物炭的来源和性质不同有关.Zhang等(2016)在山地黄棕壤(pH 6.9)上施用秸秆炭, 结果发现, 适宜用量(0.2%~1%)的生物炭处理可促进烤烟前期生长, 而高量(5%)的生物炭处理会抑制烤烟生长.刘卉等(2016)研究表明, 施炭量为3000~3750 kg·hm-2时有利于烤烟生长, 而施炭量为4500 kg·hm-2时烤烟生长发育速度低于未施炭处理, 高用量的高C/N比外源炭施用, 导致土壤中矿质态氮的微生物固定, 从而影响烤烟的生长.
5 结论(Conclusion)添加两种生物炭显著降低烤烟生长前期植烟土壤脱氢酶活性和硝态氮含量及细菌和真菌多样性和丰富度指数, 细菌优势种群中, 小麦秸秆炭处理放线菌门丰度升高, 疣微菌门丰度降低, 烟杆炭处理Saccharibacteria丰度升高, 疣微菌门丰度降低.真菌优势种群中, 小麦秸秆炭处理接合菌门丰度降低, 烟杆炭处理子囊菌门丰度升高, 接合菌门丰度降低.从β多样性结果, 就物种结构多样性而言, 烟杆炭对土壤微生物群落结构的影响大于小麦秸秆炭.但是生物炭施用促进烤烟前期生长, 且需进一步开展生物炭对烤烟整个生育期生长的影响机制和规律研究.
鲍士旦. 2000. 土壤农化分析[M]. 北京: 中国农业出版社.
|
Chen J, Liu X, Zheng J, et al. 2013. Biochar soil amendment increased bacterial but decreased fungal gene abundance with shifts in community structure in a slightly acid rice paddy from Southwest China[J]. Applied Soil Ecology, 71: 33–44.
DOI:10.1016/j.apsoil.2013.05.003
|
顾美英, 唐光木, 刘洪亮, 等. 2016. 施用棉秆炭对新疆连作棉花根际土壤微生物群落结构和功能的影响[J]. 应用生态学报, 2016, 27(1): 173–181.
|
关松荫. 1986. 土壤酶及其研究法[M]. 北京: 农业出版社.
|
何玉亭, 王昌全, 沈杰, 等. 2016. 两种生物质炭对红壤团聚体结构稳定性和微生物群落的影响[J]. 中国农业科学, 2016, 49(12): 2333–2342.
DOI:10.3864/j.issn.0578-1752.2016.12.009 |
Hu L, Cao L, Zhang R. 2014. Bacterial and fungal taxon changes in soil microbial community composition induced by short-term biochar amendment in red oxidized loam soil[J]. World Journal of Microbiology & Biotechnology, 30(3): 1085–1092.
|
Jin H.2010.Characterization of microbial life colonizing biochar and biochar-amended soils[D].Ithaca: Cornell University
|
Khodadad C L M, Zimmerman A R, Green S J, et al. 2011. Taxa-specific changes in soil microbial community composition induced by pyrogenic carbon amendments[J]. Soil Biology & Biochemistry, 43(2): 385–392.
|
Lehmann J, Gaunt J, Rondon M. 2006. Biochar sequestration in terrestrial ecosystems-a review[J]. Mitigation and Adaptation Strategies for Global Change, 11(2): 403–427.
DOI:10.1007/s11027-005-9006-5
|
Lehmann J. 2009. Biochar for environmental management:an introduction[J]. Biochar for Environmental Management Science & Technology, 25(1): 15801–15811.
|
雷海迪, 尹云锋, 刘岩, 等. 2016. 杉木凋落物及其生物炭对土壤微生物群落结构的影响[J]. 土壤学报, 2016, 53(3): 790–799.
|
李明, 李忠佩, 刘明, 等. 2015. 不同秸秆生物炭对红壤性水稻土养分及微生物群落结构的影响[J]. 中国农业科学, 2015, 48(7): 1361–1369.
|
李发虎, 李明, 刘金泉, 等. 2017. 生物炭对温室黄瓜根际土壤真菌丰度和根系生长的影响[J]. 农业机械学报, 2017, 48(4): 265–270.
|
刘卉, 周清明, 黎娟, 等. 2016. 生物炭施用量对土壤改良及烤烟生长的影响[J]. 核农学报, 2016, 30(7): 1411–1419.
|
刘玉学, 吕豪豪, 石岩, 等. 2014. 生物质炭对土壤养分淋溶的影响及潜在机理研究进展[J]. 应用生态学报, 2014, 26(1): 304–310.
|
Lu H, Lashari M S, Liu X, et al. 2015. Changes in soil microbial community structure and enzyme activity with amendment of biochar-manure compost and pyroligneous solution in a saline soil from Central China[J]. European Journal of Soil Biology, 70: 67–76.
DOI:10.1016/j.ejsobi.2015.07.005
|
Luo X, Chen L, Zheng H, et al. 2016. Biochar addition reduced net N mineralization of a coastal wetland soil in the Yellow River Delta, China[J]. Geoderma, 282: 120–128.
DOI:10.1016/j.geoderma.2016.07.015
|
Min H, Liu Y, Qin H, et al. 2013. Quantifying the effect of biochar amendment on soil quality and crop productivity in Chinese rice paddies[J]. Field Crops Research, 154(3): 172–177.
|
Muhammad N, Dai Z, Xiao K, et al. 2014. Changes in microbial community structure due to biochars generated from different feedstocks and their relationships with soil chemical properties[J]. Geoderma, 226.
|
Nannipieri P, Giagnoni L, Renella G, et al. 2012. Soil enzymology:classical and molecular approaches[J]. Biology and Fertility of Soils, 48(7): 743–762.
DOI:10.1007/s00374-012-0723-0
|
Niu Y D, Niu Z J, Li J F, et al. 2015. Effects of different biochar dosages and types on growth, yield and output value of flue-cured tobacco in Hanzhong Area[J]. Agricultural Science & Technology, 16(11): 2476–2480.
|
Oguntunde P G, Abiodun B J, Ajayi A E. 2008. Effects of charcoal production on soil physical properties in ghana[J]. Joumal of Plant Nutrient and soil Science, 171(4): 591–596.
DOI:10.1002/(ISSN)1522-2624
|
Oleszczuk P, Jośko I, Futa B, et al. 2014. Effect of pesticides on microorganisms, enzymatic activity and plant in biochar-amended soil[J]. Geoderma, 214-215: 10–18.
DOI:10.1016/j.geoderma.2013.10.010
|
Qu C, Li B, Wu H, et al. 2012. Controlling air pollution from straw burning in china calls for efficient recycling[J]. Environmental Science & Technology, 46(15): 7934–7936.
|
Rutigliano F A, Romano M, Marzaioli R, et al. 2014. Effect of biochar addition on soil microbial community in a wheat crop[J]. European Journal of Soil Biology, 60(2): 9–15.
|
田小平, 王磊, 王菡, 等. 2017. 秸秆与秸秆生物炭还田对土壤微生物群落结构的影响[J]. 工业微生物, 2017, 47(6): 1–6.
DOI:10.3969/j.issn.1001-6678.2017.06.001 |
万海涛.2014.烤烟发育和产量品质及植烟土壤理化性状对生物炭的响应研究[D].郑州: 河南农业大学
http: //cdmd.cnki.com.cn/Article/CDMD-10466-1014420671.htm |
王成己, 陈庆荣, 陈曦, 等. 2017. 烟秆生物质炭对烟草根际土壤养分及细菌群落的影响[J]. 中国烟草科学, 2017, 38(1): 42–47.
|
王丽渊, 刘国顺, 王林虹, 等. 2014. 生物质炭对烤烟干物质积累量及根际土壤理化性质的影响[J]. 华北农学报, 2014, 29(1): 140–144.
|
Wu F, Jia Z, Wang S, et al. 2013. Contrasting effects of wheat straw and its biochar on greenhouse gas emissions and enzyme activities in a Chernozemic soil[J]. Biology & Fertility of Soils, 49(5): 555–565.
|
乌英嗄, 张贵龙, 赖欣, 等. 2014. 生物炭施用对华北潮土土壤细菌多样性的影响[J]. 农业环境科学学报, 2014, 33(5): 965–971.
|
武小净, 李德成, 胡锋, 等. 2013. 福建典型烟区土壤、灌溉水和肥料中重金属含量调查[J]. 土壤, 2013, 45(2): 246–249.
|
Xu G, Wei L L, Sun J N, et al. 2013. What is more important for enhancing nutrient bioavailability with biochar application into a sandy soil:direct or indirect mechanism?[J]. Ecological Engineering, 52(2): 119–124.
|
Xu M, Zhu Q, Wu J, et al. 2018. Grey relational analysis for evaluating the effects of different rates of wine lees-derived biochar application on a plant-soil system with multi-metal contamination[J]. Environmental Science & Pollution Research, 25(7): 6990–7001.
|
Yang X, Liu J, Mcgrouther K, et al. 2016. Effect of biochar on the extractability of heavy metals (Cd, Cu, Pb, and Zn) and enzyme activity in soil[J]. Environmental Science & Pollution Research, 23(2): 974–984.
|
姚钦.2017.生物炭施用对东北黑土土壤理化性质和微生物多样性的影响[D].长春: 中国科学院大学(中国科学院东北地理与农业生态研究所)
http: //cdmd.cnki.com.cn/Article/CDMD-80062-1017930187.htm |
Zhang C, Lin Y, Tian X, et al. 2016. Tobacco bacterial wilt suppression with biochar soil addition associates to improved soil physiochemical properties and increased rhizosphere bacteria abundance[J]. Applied Soil Ecology, 112: 90–96.
|
Zhang J X, Zhang Z F, Shen G M, et al. 2016. Growth performance, nutrient absorption of tobacco and soil fertility after straw biochar application[J]. International Journal of Agriculture & Biology, 18(5): 983–989.
|
张玉洁, 吴婷, 赵娟, 等. 2017. 生物炭添加对秸秆还田土壤细菌群落结构和多样性影响[J]. 环境科学学报, 2017, 37(2): 712–720.
|
 2019, Vol. 39
2019, Vol. 39


