农药三氟羧草醚(Acifluorfen, AF)是以天然产物莎草茵为前体化合物研发的二苯醚类除草剂(陈世国等, 2015), 具有生物活性谱广、对哺乳动物毒性低、高效等特性, 可除去农业和居住地的杂草, 主要应用于大豆、花生、水稻等作物中阔叶杂草的防治(曹学仁, 2010).AF主要通过抑制植物细胞线粒体电子传导, 干扰细胞呼吸系统和能量产生系统, 阻碍细胞分裂活动使杂草死亡(Duk et al., 1983; 秦恩昊等, 2016);也能够被光照和光合作用电子传递链激活, 有效诱导脂质过氧化和叶绿素漂白, 通过破坏叶绿体膜影响光合作用而发挥除杂草效力(Gillham et al., 2010).AF在土壤中的半衰期可达59 d, 在水中能稳定存在28 d而不被降解(Kamrin, 1997);此外, 除草剂乳氟禾草灵在环境中的降解产物为AF(Rodriguez, 2014), 这些无疑会增加生物体暴露的机会.因此, 食物、饮水和住宅接触等多种暴露方式使得AF显现出对人类和生态环境潜在的威胁(Kamrin, 1997), 其生物安全性也逐渐引起人们的关注.
美国环保局(EPA)对AF的致癌可能性评估结果为:AF低剂量时不大可能对人类产生致癌性, 但高剂量时可能产生致癌性(王以燕等, 2009).毒理学实验表明, AF对大鼠经口途径的半致死量(Median Lethal Dose, LD50)为1370 mg·kg-1(Gooch et al., 2017).高剂量AF具有生殖毒性, 可能存在致畸效应但未显现出致突变, 对眼和皮肤有刺激性, 会影响肝、肾、心等器官的质量和功能(Kamrin, 1997).有研究报道, AF能显著造成小鼠肝脏和肾脏的氧化损伤(杜俊停等, 2017), 更重要的是, Kuwata等(2016)发现AF会引起肝细胞坏死和炎症, 并引起再生变化, 继而诱发肝癌.故AF的生物安全性不容忽视, 且有报告指出其发育神经毒性未见报道且亟待确定(United States Environmental Protection Agency, 2003).此外, AF可作为原卟啉原氧化酶的抑制剂而影响动植物机体的生命活动(Matringe et al., 1992; Corrigall et al., 1994).原卟啉原氧化酶广泛存在于动物、植物、微生物的线粒体中, 参与合成叶绿素和血红素的共同通路, 其作用是将对光不敏感的原卟啉原IX氧化成光敏感的原卟啉IX(秦晓红, 2013).原卟啉原氧化酶活性受到抑制, 会引起混合型卟啉症, 出现意识障碍等神经系统症状(秦晓红, 2013).基于这些证据推测AF可能对人类或动物的学习记忆有一定的影响.基于此, 本研究通过Morris水迷宫实验从行为学上测定不同浓度AF暴露对小鼠学习和记忆的影响, 并进一步检测受试小鼠脑组织中氧化损伤和与学习记忆相关指标的变化, 以期探索AF的神经毒性, 为AF的毒理学研究提供实验依据.
2 材料与方法(Materials and methods) 2.1 实验材料、试剂与仪器实验材料三氟羧草醚(纯度92%)购于上海将来生化试剂公司.主要实验试剂包括2′, 7′-二氯荧光黄双乙酸盐(DCFH-DA)、2-硫代巴比妥酸(TBA)、三氯乙酸(TCA), 均为分析纯, 购自国药集团化学试剂有限公司;微量还原型谷胱甘肽(GSH)试剂盒购自南京建成生物工程研究所, 小鼠磷酸化cAMP反应元件结合蛋白(pCREB) ELISA试剂盒、小鼠脑源性神经营养因子(BDNF) ELISA试剂盒均购自上海源叶生物公司.主要仪器包括FLx800荧光酶标仪(美国Bio-Tek仪器有限公司)、DNM-9602全波长酶标仪(北京普朗新技术有限公司).
2.2 实验动物与染毒方案30只无特定病原体(SPF)级昆明种纯系雄性小鼠购于湖北省实验动物中心(合格证号:42010200000844, 许可证号SYXK(鄂)2011-0012), 体重20~22 g, 4周龄左右.实验环境无致病微生物, 环境温度为20~25 ℃, 湿度为55%~70%, 12 h光照和黑暗循环进行, 每天自由进食和饮水.
小鼠随机分成5组:1个生理盐水对照组及4个AF暴露组, 暴露浓度分别为0.13、1.3、13和130 mg·kg-1·d-1(组别表示为对照组、0.13 AF、1.3 AF、13 AF和130 AF).AF用0.9%生理盐水配制成浓度分别为0.013、0.13、1.3和13 mg·mL-1的溶液.小鼠适应实验环境1周, 开始实验时各组小鼠每天定点灌胃染毒1次, 连续染毒14 d.
2.3 实验方法 2.3.1 Morris水迷宫实验参照文献(Vorhees et al., 2006; 路雨等, 2018)中的方法进行Morris水迷宫实验, 由Smart 3.0软件收集数据.染毒第6~12 d为定向航行实验;第13 d只染毒, 作为小鼠遗忘期;第14 d进行空间探索实验以检测小鼠的记忆能力.
2.3.2 小鼠脑组织匀浆的制备第15 d采用心脏取血法处死小鼠, 立即将小鼠脑组织用冰的PBS缓冲液(pH=7.5)洗去组织上的血块, 吸水纸吸干, 在玻璃匀浆器中加入PBS研磨脑组织制成10%匀浆, 在4 ℃、12000 r·min-1下离心12 min, 收集上清液, 于-80 ℃冰箱中冷冻保存.
2.3.3 海马区H&E切片及病理分析取小鼠脑组织固定于4%的多聚甲醛中, 24 h后经常规脱水和石蜡包埋等处理后, 切成薄片, 经H&E染色制成永久装片, 用显微镜观察其病理变化并拍照.
2.3.4 氧化应激指标的测定采用DFC荧光法进行活性氧(Reactive Oxygen Species, ROS)含量的测定, 具体操作为:用PBS将脑组织匀浆液稀释20倍, 取稀释后的脑匀浆和浓度为0.2 μmol·L-1的DCFH-DA荧光染料各100 μL混匀, 37 ℃下避光孵育15 min, 采用FLx800荧光酶标仪在480 nm激发光和520 nm发射光下测其荧光强度.参照文献(路雨等, 2018)方法测定丙二醛(Malonaldehyde, MDA)含量.按照GSH试剂盒说明书的操作测定脑组织中还原型谷胱甘肽(Glutathione, GSH)的含量.
2.3.5 与学习记忆相关指标的测定小鼠脑组织中磷酸化cAMP反应元件结合蛋白(pCREB)和脑源性神经营养因子(BDNF)的含量测定依据酶联免疫吸附法(ELISA)说明书的操作步骤进行.
2.3.6 统计分析结果以平均值±标准差(Mean±SD)表示, 用GraphPad Prism 5.0分析实验数据并生成统计图.水迷宫定向航行实验数据采用重复测量的方差分析, 其他数据采用单因素方差分析做多组间均数比较, 并用Tukey Test做两两比较.将p<0.05视为差异显著, p<0.01视为差异极显著.
3 结果(Results) 3.1 AF在行为学上对小鼠学习记忆能力的影响AF对小鼠学习记忆能力的影响如图 1所示.由图 1a和1b可知, 随着小鼠定向航行实验训练天数的增加, 小鼠的逃避潜伏期整体呈下降的趋势;随着AF染毒剂量的增加, 小鼠的逃避潜伏期增加且出现剂量效应关系, 13和130 mg·kg-1·d-1 AF组的逃避潜伏期显著高于对照组(p<0.05).图 1c所示为小鼠空间探索实验中目标象限游泳时间的表现,与对照组相比, 130 mg·kg-1·d-1 AF组目标象限游泳时间变短且差异具有统计学意义(p<0.05).从图 1d可以看出, 对照组小鼠的运动轨迹较有规律性, 多集中在原平台所在象限, 而130 mg·kg-1·d-1 AF组小鼠目的性不强, 运动轨迹与对照组比较相对分散.
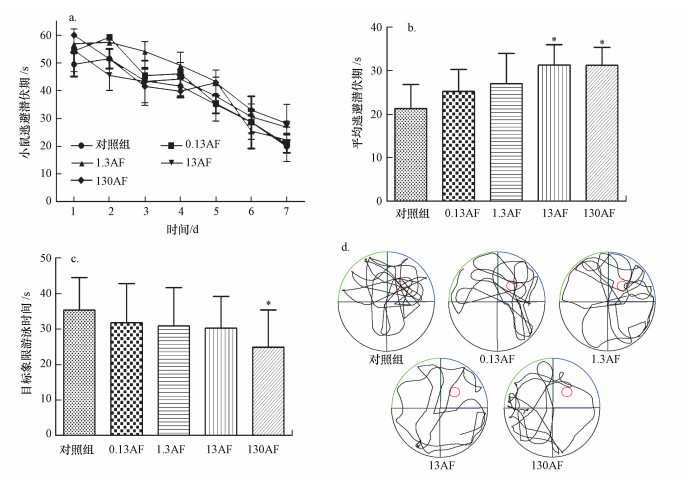 |
| 图 1 AF暴露后小鼠行为学的变化(a.逃避潜伏期随时间的变化;b.不同三氟羧草醚染毒组逃避潜伏期;c.空间探索实验小鼠在目标象限游泳时间;d.空间探索实验小鼠运动轨迹;*p<0.05, 与对照组相比) Fig. 1 Behavioral effects of aciflurofen on mice |
图 2所示为小鼠经AF染毒后脑海马组织病理改变的结果.由图 2可知, 经H&E染色, 对照组小鼠海马CA1区脑细胞排列整齐, 分布较集中, 细胞所在层面较光滑;而随着染毒剂量的增加, 海马CA1区细胞排列变得不规则, 13和130 mg·kg-1·d-1 AF组海马CA1区细胞分布相对分散且不均匀.
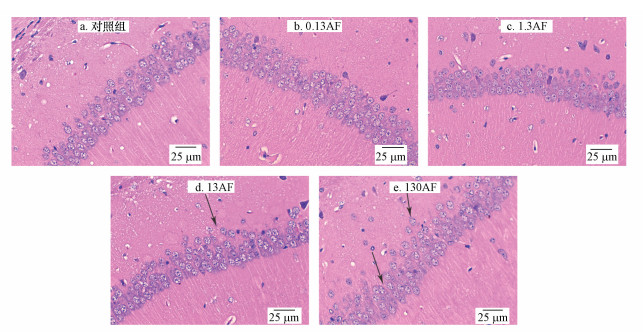 |
| 图 2 小鼠海马H&E病理切片观察(×400) Fig. 2 Observation of H&E staining of hippocampus tissue in brain tissue (×400) |
图 3所示为AF对小鼠脑组织氧化应激水平的影响.ROS含量(以其荧光强度表征)随着AF暴露剂量的增多而显示出剂量效应关系(图 3a), 13和130 mg·kg-1·d-1 AF组ROS水平均显著高于对照组(p<0.05).GSH含量随着AF浓度的增多逐渐呈现出下降趋势(图 3b), 与对照组相比, 13和130 mg·kg-1·d-1 AF组中GSH含量显著降低(p<0.05).如图 3c所示, AF染毒组小鼠脑组织中MDA含量随染毒剂量的增加而升高, 130 mg·kg-1·d-1 AF组MDA含量与对照组相比差异显著(p<0.05).
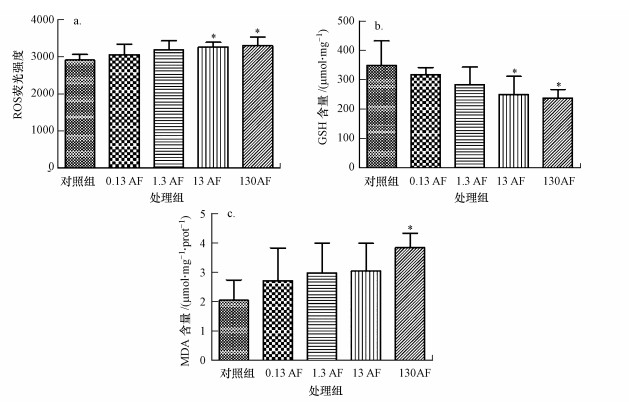 |
| 图 3 AF染毒对小鼠脑组织氧化应激水平的影响(a.ROS荧光强度;b.GSH含量;c.MDA含量;*p<0.05, 与对照组相比) Fig. 3 The levels of oxidative stress after acifluorfen exposure |
为了进一步评估农药AF对小鼠学习记忆能力的影响, 本研究还检测了与学习记忆相关蛋白pCREB和BDNF的含量(图 4).由图 4a可知, 随着AF暴露剂量的增加, AF染毒组小鼠脑组织中pCREB的含量逐渐减少, 与对照组相比, 13 mg·kg-1·d-1 AF组小鼠脑组织中pCREB含量显著降低(p<0.05), 130 mg·kg-1·d-1 AF组小鼠脑组织中pCREB含量极显著降低(p<0.01).由图 4b可知, 小鼠脑组织中BDNF的表达情况随着AF浓度的增加呈下降趋势, 13 mg·kg-1·d-1 AF组小鼠脑组织中BDNF表达水平显著低于对照组(p<0.05), 130 mg·kg-1·d-1 AF组小鼠脑组织中BDNF含量与对照组之间有极显著性差异(p<0.01).
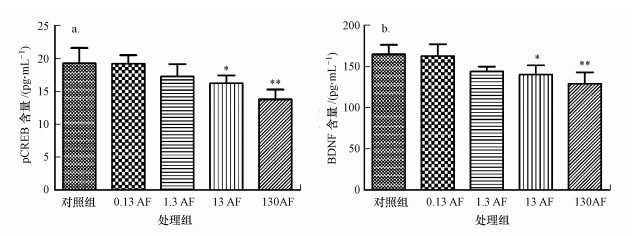 |
| 图 4 AF染毒对各组小鼠pCREB和BDNF含量的影响(a. pCREB含量;b. BDNF含量;*p<0.05, **p<0.01, 与对照组相比) Fig. 4 The pCREB and BDNF content in different groups |
《食品安全国家标准食品中农药最大残留限量GB2763—2016》中指出, AF每日允许摄入量(Acceptable Daily Intake, ADI)为0.013 mg·kg-1·bw-1 (中华人民共和国国家卫生和计划生育委员会等, 2016).为此, 本研究中以10倍ADI为最低剂量, 依次设置0.13、1.3、13和130 mg·kg-1·d-1 4个染毒剂量组和1个生理盐水对照组, 以探究AF对小鼠学习记忆能力的影响.2011年《Illinois State Water Survey》刊登的一篇指南(Gillespie et al., 2011)中指出, 土壤中三氟羧草醚半衰期为14~60 d不等, 综合考虑到实验室的人力、物力等的情况, 本研究选择每天染毒一次, 连续染毒14 d的方案以更好地模拟真实暴露水平.
Morris水迷宫实验设置简单、误差小、参数多、评估较客观, 已被广泛用于对啮齿类动物的空间学习和参考记忆能力的检测, 也是研究海马回路的关键技术(Vorhees et al., 2006).海马在学习记忆过程中具有关键作用, 其病理改变与小鼠的行为学变化有密切联系(陈业文等, 2018), 因此, 实验对小鼠海马组织进行病理学观察.实验结果显示, 定向航行实验和空间探索实验中, 高剂量AF暴露组(130 mg·kg-1·d-1)小鼠的逃避潜伏期、在目标象限游泳时间均与对照组有显著性差异, 且运动轨迹无规律性, 表明小鼠经AF暴露后在行为学上可显现出学习记忆能力的下降.H&E病理切片结果显示, 13和130 mg·kg-1·d-1 AF组小鼠海马组织受损.Mei等(2016)研究表明, 3 mg·m-3甲醛会损伤小鼠海马组织, 显著降低小鼠的学习和记忆能力, 与本实验一定浓度的三氟羧草醚造成小鼠海马细胞发生病理改变、学习记忆能力下降的结果一致, 说明三氟羧草醚暴露会损伤小鼠的学习记忆能力.因此, 小鼠海马组织受损可能是AF暴露所致的小鼠学习记忆能力下降的原因之一.
活性氧(ROS)是机体正常代谢的副产物, 主要来自线粒体呼吸链、烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶和未偶联的一氧化氮合酶(NOS)(Sugamura et al., 2011).谷胱甘肽(GSH)是内源性抗氧化剂, 作为谷胱甘肽过氧化物酶的共底物发挥清除ROS的作用(Bilzer et al., 1999).当ROS的产生和清除失衡时发生氧化应激, 过量产生的ROS会攻击DNA、脂质和蛋白质等大分子而对它们产生不利影响(Sesti et al., 2010), 进而不同程度地损伤组织和细胞.常见的脂质过氧化产物——丙二醛(MDA)是氧化应激可靠的标志物, 有研究发现, MDA结合蛋白与MDA结合后可有效保护机体免受氧化应激和炎症(Weismann et al., 2011).中枢神经系统由于需氧量高、经典抗氧化物及相关酶浓度低、不饱和脂肪酸含量多等特点而易发生氧化损伤(Sayre et al., 2008), 越来越多的证据表明氧化应激与神经退行性疾病有关(Radak et al., 2011).先前有研究报道, AF会诱导ROS和MDA的产生, 并降低GSH的含量, 引起氧化应激(杜俊停等, 2017).Min等(2014)的研究结果中增塑剂邻苯二甲酸丁基苄酯会诱导氧化应激的发生, 造成学习记忆障碍, 与本实验中三氟羧草醚暴露引起ROS、GSH、MDA等氧化损伤标志物含量改变, 从而影响学习记忆能力的结果一致, 说明学习记忆能力的下降与氧化应激的发生有关.本研究中, 130 mg·kg-1·d-1的AF能显著增加ROS和MDA的水平, 且明显减少GSH的含量, 表明AF诱导小鼠脑组织发生氧化损伤, 其可能是造成海马组织受损和学习记忆能力减退的原因.
pCREB和BDNF是目前学习记忆研究涉及到的两个关注度比较高的蛋白.CREB是一种关键的及早基因, 与突触可塑性和长期记忆密切相关, 其Ser133磷酸化而活化为pCREB以应对多种信号通路(Mayr et al., 2001).其中, BDNF是pCREB的一个下游靶基因, 其可能通过调控NMDA受体和非NMDA受体的功能, 以及控制胞外分泌所需蛋白的表达来影响学习和记忆, 也可能参与丝裂原相关蛋白激酶和磷脂酰肌醇3-激酶信号通路的激活而在BDNF依赖的学习和记忆形成过程中发挥作用(Yamada et al., 2002).Caccamo等(2013)发现, 阿尔兹海默症模型小鼠中pCREB和BDNF含量比非转基因小鼠低, 但用CREB结合蛋白(CBP)激活CREB信号通路后, 阿尔兹海默症模型小鼠pCREB和BDNF的表达恢复到非转基因小鼠水平, 学习和记忆障碍得到改善.本研究中, AF组pCREB和BDNF含量显著低于对照组, 与研究(Li et al., 2017)表明的CREB-BDNF级联的下调与学习记忆能力受损有关的结果相符.另外, CREB和BDNF都能调控抗凋亡信号通路起到神经保护作用, 其中, CREB还能刺激抗氧化基因的表达来对抗ROS介导的细胞毒性(Sakamoto et al., 2011; Cunha et al., 2010).因此, 本研究结果提示, AF组低水平的pCREB使得神经保护能力弱, 可能无法对抗过量产生的ROS造成的毒性, 有助于氧化应激发生, 进而损伤小鼠海马组织, 引起学习记忆能力的下降.
5 结论(Conclusions)本研究表明, 一定剂量的AF (13和130 mg·kg-1·d-1)通过灌胃的方式会对小鼠的学习和记忆能力产生不利影响, 损伤小鼠脑组织的功能和结构, 造成一定的神经毒性.出现的氧化损伤和CREB-BDNF通路的级联下调可能是导致AF神经毒性的机制之一.但关于AF诱导的氧化应激和CREB-BDNF通路的下调是否存在因果关系还有待深入研究以证明.
Bilzer M, Paumgartner G, Gerbes A L. 1999. Glutathione protects the rat liver against reperfusion injury after hypothermic preservation[J]. Gastroenterology, 117(1): 200–210.
DOI:10.1016/S0016-5085(99)70568-8
|
Caccamo A, Oddo S. 2013. CBP gene transfer increases BDNF levels and ameliorates learning and memory deficits in a mouse model of Alzheimer's disease[J]. Alzheimers & Dementia, 9(4): 22687–22692.
|
曹学仁. 2010. 美国开始审查更多农药登记申请[J]. 农药市场信息, 2010(9): 40.
|
陈世国, 强胜. 2015. 生物除草剂研究与开发的现状及未来的发展趋势[J]. 中国生物防治学报, 2015, 31(5): 770–779.
|
陈业文, 梁冯, 程龙, 等. 2018. 邻苯二甲酸二异壬酯单独暴露及与褪黑素联合作用对小鼠脑组织损伤研究[J]. 环境科学学报, 2018, 38(5): 2066–2073.
|
Corrigall A V, Hift R J, Adams P A, et al. 1994. Inhibition of mammalian protoporphyrinogen oxidase by acifluorfen[J]. Biochemistry & Molecular Biology International, 34(6): 1283–1298.
|
Cunha C, Brambilla R, Thomas K L. 2010. A simple role for BDNF in learning and memory?[J]. Frontiers in Molecular Neuroscience, 3(1): 1–14.
|
Duk S O, Vaughna K C, Meeusen R L. 1983. Mitochondrial involvement in the mode of action of acifluorfen[J]. Pesticide Biochemistry & Physiology, 21(3): 368–376.
|
杜俊停, 李潇潇, 宋静, 等. 2017. 农药三氟羧草醚对小鼠肝脏和肾脏氧化损伤的研究[J]. 化学与生物工程, 2017, 34(9): 29–34.
DOI:10.3969/j.issn.1672-5425.2017.09.006 |
Gillespie W, Czapar G, Hager A.2011.Pesticide fate in the environment: A guide for field inspectors[R].Contract Report 2011-07.Champaign, Illinois: Illinois State Water Survey, Institute of Natural Resource Sustainability, and University of Illinois at Urbana-ChampaignIllinois State Water Survey.4
.Pesticide fate in the environment: A guide for field inspector |
Gillespie W, Czapar G, Hager A. 2011. Pesticide fate in the environment:A guide for field inspectors[J]. Illinois State Water Survey.
|
Gillham D J, Dodge A D. 2010. Studies into the action of the diphenyl ether herbicides acifluorfen and oxyfluorfen. Part Ⅰ:Activation by light and oxygen in leaf tissue[J]. Pest Management Science, 19(1): 19–24.
|
Gooch A, Sizochenko N, Rasulev B, et al. 2017. In vivo toxicity of nitroaromatics:A comprehensive quantitative structure-activity relationship study[J]. Environmental Toxicology & Chemistry, 36(8): 2227–2233.
|
Kamrin M A. 1997. Pesticide Profiles:Toxicity, Environmental Impact, and Fate[M]. New York: Lewis Publishers: 455–457.
|
Kuwata K, Inoue K, Ichimura R, et al. 2016. Involvement of mouse constitutive androstane receptor in acifluorfen-induced liver injury and subsequent tumor development[J]. Toxicological Sciences An Official Journal of the Society of Toxicology, 151(2): 271–285.
DOI:10.1093/toxsci/kfw040
|
Li X, Guo C, Li Y, et al. 2017. Ketamine administered pregnant rats impair learning and memory in offspring via the CREB pathway[J]. Oncotarget, 8(20): 32433–32449.
|
Liu X, Zhang Y, Li J, et al. 2014. Cognitive deficits and decreased locomotor activity induced by single-walled carbon nanotubes and neuroprotective effects of ascorbic acid[J]. International Journal of Nanomedicine, 9(1): 823–839.
|
路雨, 李瑶, 胡赢丹, 等. 2018. 邻苯二甲酸二异癸酯对小鼠学习记忆的影响[J]. 中国环境科学, 2018, 38(1): 361–368.
DOI:10.3969/j.issn.1000-6923.2018.01.040 |
Matringe M, Camadro J M, Block M A, et al. 1992. Localization within chloroplasts of protoporphyrinogen oxidase, the target enzyme for diphenylether-like herbicides[J]. Journal of Biological Chemistry, 267(7): 4646–4651.
|
Mayr B, Montminy M. 2001. Transcriptional regulation by the phosphorylation-dependent factor CREB[J]. Nat Rev Mol Cell Biol, 2(8): 599–609.
|
Mei Y, Duan C, Li X, et al. 2016. Reduction of endogenous melatonin accelerates cognitive decline in mice in a simulated occupational formaldehyde exposure environment[J]. International Journal of Environmental Research & Public Health, 13(3): 258.
|
Min A, Liu F, Yang X, et al. 2014. Benzyl butyl phthalate exposure impairs learning and memory and attenuates neurotransmission and CREB phosphorylation in mice[J]. Food & Chemical Toxicology, 71(8): 81–89.
|
秦恩昊, 赵利利. 2016. 三氟羧草醚全球市场发展概况解析[J]. 农化市场十日讯, 2016(31): 34–36.
|
秦晓红.2013.人源原卟啉原氧化酶结构与功能的研究[D].天津: 南开大学.7-12
http://cdmd.cnki.com.cn/Article/CDMD-10055-1014171552.htm |
Radak Z, Zhao Z, Goto S, et al. 2011. Age-associated neurodegeneration and oxidative damage to lipids, proteins and DNA[J]. Molecular Aspects of Medicine, 32(4/6): 305–315.
|
Rodriguez Y R.2014. Acifluorfen, Sodium Salt//Philip Wexler.Encyclopedia of Toxicology(Third Edition)[M]. Salt Lake, USA: Academic Press.59-62
|
Sakamoto K, Karelina K, Obrietan K. 2011. CREB:a multifaceted regulator of neuronal plasticity and protection[J]. Journal of Neurochemistry, 116(1): 1–9.
DOI:10.1111/jnc.2010.116.issue-1
|
Sayre L M, Perry G, Smith M A. 2008. Oxidative stress and neurotoxicity[J]. Chemical Research in Toxicology, 21(1): 172–188.
|
Sesti F, Liu S, Cai S Q. 2010. Oxidation of potassium channels by ROS:a general mechanism of aging and neurodegeneration?[J]. Trends in Cell Biology, 20(1): 45–51.
DOI:10.1016/j.tcb.2009.09.008
|
Sugamura K, Jr J F K. 2011. Reactive oxygen species in cardiovascular disease[J]. Free Radical Biology & Medicine, 51(5): 978–992.
|
United States Environmental Protection Agency (US EPA).2003.R.E.D.FACTS Sodium Acifluorfen (Blazer®)[R].EPA-738-F-04-001.Washington D.C.: US EPA.1-6
|
Vorhees C V, Williams M T. 2006. Morris water maze:procedures for assessing spatial and related forms of learning and memory[J]. Nature Protocols, 1(2): 848–858.
DOI:10.1038/nprot.2006.116
|
王以燕, 许建宁, 胡洁. 2009. 美国EPA对农药致癌可能性的评估[J]. 农药, 2009, 48(6): 462–466.
DOI:10.3969/j.issn.1006-0413.2009.06.028 |
Weismann D, Hartvigsen K, Lauer N, et al. 2011. Complement factor H binds malondialdehyde epitopes and protects from oxidative stress[J]. Nature, 478(7367): 76–81.
DOI:10.1038/nature10449
|
Yamada K, Mizuno M, Nabeshima T. 2002. Role for brain-derived neurotrophic factor in learning and memory[J]. Life Sciences, 70(7): 735–744.
DOI:10.1016/S0024-3205(01)01461-8
|
中华人民共和国国家卫生和计划生育委员会, 中华人民共和国农业部, 国家食品药品监督管理总局.2016.GB2763-2016食品安全国家标准食品中农药最大残留限量[S].北京: 中国标准出版社
|
 2019, Vol. 39
2019, Vol. 39


