湿地是世界三大生态系统之一, 对养分(碳、氮、磷)的保持与循环具有重要作用(Moreau et al., 2013).大气沉降、农业肥料使用、工业废水排放等导致大量重金属流入湿地生态系统, 对土壤及水体造成了严重污染(Zhang et al., 2016; Machado et al., 2016).铬(Cr)被认为是毒性最强的重金属之一, 其在自然环境中主要以Cr(VI)、Cr(III)的形式存在, 其中, Cr(VI)具有更强的可溶性、生物毒性与迁移性, 能通过食物链和生物放大作用于人体积聚, 引发神经系统、胃肠道慢性病变与肾功能障碍(Farmer, 1991; Pan et al., 2012; Liao et al., 2014).因此, 针对Cr污染治理已成为环境修复重要任务之一.
目前, 固化/稳定化(Valipour et al., 2016; 吴玉俊等, 2016)、化学淋洗(Qiao et al., 2017)、电动修复(Probstein et al., 1993)等物理-化学技术已被广泛应用于重金属污染土壤的修复.然而这些技术不同程度的存在高成本、会改变土壤原有理化性质、易产生二次污染(Polti et al., 2011; Jing et al., 2007)等问题, 使业界更关注具有环境友好优势的土壤微生物燃料电池(S-MFC)技术.诸多研究发现, 将植物引入S-MFC系统, 对其环境修复性能及产电效能均有促进作用.Yan等(2015)在芘、苯并芘污染土壤中引入菖蒲构建植物微生物燃料电池(Plant Microbial Fuel Cells, P-MFC), 发现与S-MFC相比, 污染物去除率至少分别提高了30%、20%.Lu等(2015)仅以美人蕉根系分泌物为电子供体构建P-MFC, 获得的最大功率密度为105 mW · m-2, 并指出在低电导率溶液存在的贫瘠环境中构建P-MFC是可行的.Cr(VI)氧化还原电位较高, 通过接受阳极微生物氧化分解有机物产生的电子后于阴极还原为Cr(III)并产生电能, 是一种在Cr(VI)污染土壤修复中有着良好潜力的方式.目前, 国内外有关P-MFC的研究多集中于通过阴阳极改性、减小系统内阻以获得更高电能输出(Schneider et al., 2016), 或将该技术应用于有机废水处理(Fang et al., 2016), 而利用其修复土壤重金属污染的研究较少.P-MFC阳极表面生物膜是P-MFC的重要组成部分之一, 而物种多样性、丰度会影响微生物群落功能、活性及稳定性, 最终影响系统产电与重金属去除性能(Hodgson et al., 2016).目前并未有对以污染土壤构建的P-MFC中阳极功能微生物群落组成的研究, 深入进行这方面的分析有利于系统快速启动与性能的提高.
基于此, 本研究应用P-MFC修复Cr(VI)污染湿地土壤, 考察沼生植物(香蒲)的种植对系统产电与Cr(VI)去除性能的影响, 并改变系统初始Cr(VI)浓度, 探讨不同暴露浓度下Cr(VI)的去除效率.同时, 通过16S rDNA测序技术分析不同浓度胁迫对阳极微生物群落结构的影响, 揭示P-MFC污染去除与产电机理.以期为重金属污染湿地土壤的原位、异位修复提供参考.
2 材料与方法(Materials and methods) 2.1 实验土样和土样染毒试供土样为江苏省武进区滆湖湿地公园根层(0~20 cm)土壤, 剔除植物根系、石子等杂物, 自然风干, 研磨, 过2 mm不锈钢筛网后于室温储存备用.土样理化性质为:pH=7.12, 有机碳5.81 g·kg-1, 总氮1.46 g·kg-1, 总磷0.43 g·kg-1, 速效磷6.11 g·kg-1, 速效钾0.13 g·kg-1.
以人工添加方式进行染毒, 对香蒲耐受能力进行预实验, 确定香蒲对Cr(VI)的耐受浓度为800 mg·kg-1.按照不同Cr(VI)浓度梯度(200、400、600、800 mg · kg-1)投加K2Cr2O7溶液, 于通风橱内老化30 d(含水率60%).
2.2 实验装置构建采用单室结构(图 1)的系统构型, 系统底部铺石墨颗粒(直径3~5 mm, 比表面积500~900 m2 · g-1), 13 cm × 13 cm的正方形石墨毡置于其中作为阳极.染毒土壤(3 kg, 干重)转移至阳极上方, 土壤层高度为12 cm, 以保证植物根系位于阳极附近.为避免湿地水体中重金属离子及有机物对系统运行的影响, 将去离子水作为实验用水, 添加去离子水至土层表面上方.系统阴极为10 cm×10 cm的正方形石墨毡, 置于水层表面, 使其与氧气充分接触.阴、阳两极对称放置, 用铜导线连接, 外接1000 Ω电阻.石墨毡先后置于H2SO4(0.5 mol·L-1)、蒸馏水、NaOH(0.5 mol·L-1)中各超声15 min, 用蒸馏水冲洗至中性后, 放入50 ℃烘箱烘干.
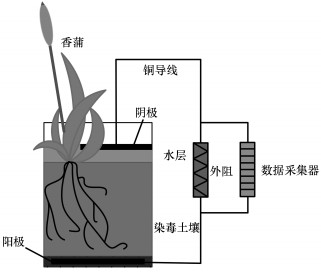 |
| 图 1 P-MFC系统结构示意图 Fig. 1 Configuration diagram of the plant-microbial fuel cell |
选择香蒲(Typha latifolia L.)为试供植物, 购自江苏省宿迁植物园.香蒲是一种分布广泛、对重金属具有较强吸收与富集能力的水生植物, 具有生物量大、生长迅速等特点, 能够适应恶劣的生长环境(Ye et al., 2010; Lyubenova et al., 2013), 在污染土壤、水体修复方面具有巨大的潜力.于去离子水中驯化10 d后, 选择长势良好、形态相近的香蒲(植株长(35±2) cm, 鲜重(13±0.5) g)植入不同处理条件的P-MFC中, 每箱定植6株.
设置12个实验组, 不同Cr(VI)浓度(200、400、600、800 mg · kg-1)暴露的P-MFC系统分别编号为CP1、CP2、CP3、CP4, 并设置无植物闭路对照组(CS1~CS4)和植物种植开路对照组(OP1~OP4), 每个处理3个重复, 保持室温在(25±2) ℃, 实验期内定期补充去离子水, 平衡自然条件下水分蒸发.
2.3 测定与计算数据采集器(安捷伦34970A, 美国)连于P-MFC外电阻两端, 每30 min记录系统电压.更换5~105 Ω大小不等(105、5000、4500、4000、2000、1500、1000、700、500、200、100、50、20、10 Ω)的电阻, 检测8组系统输出电压, 绘制极化曲线.根据式(1)、(2)计算电流密度与功率密度.
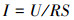
|
(1) |
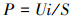
|
(2) |
式中,I为电流密度(A·m-2), P为功率密度(mW·m-2), U为系统输出电压(V), R为电阻(Ω), i为电流(A), S为阳极有效工作面积(m2).
实验周期结束后, 将土样风干, 研磨, 过2 mm筛, 然后取适量进行检测分析.土壤基本理化性质参照《土壤农化分析》所述方法进行测定.土样于60 ℃恒温干燥箱中烘干至恒重, 根据EPA 3060A所述方法, 用Na2CO3(0.28 mol · L-1)与NaOH(0.5 mol · L-1)碱消解, 转移消解液至容量瓶, 定容后采用二苯碳酰二肼分管光度法测定土壤Cr(VI)含量.土样经HNO3-HF-HClO3消解后采用火焰原子吸收光谱法测定总Cr含量. Cr(III)含量为总Cr与Cr(VI)含量的差值.根据式(3)计算土壤Cr(VI)去除率η.

|
(3) |
式中, A、B分别为土壤初始Cr(VI)含量与修复后Cr(VI)含量(mg · kg-1).
香蒲收获后, 分开地上部与地下部, 105 ℃杀青, 烘干至恒重并称量.经HNO3-HClO3消解后采用火焰原子吸收光谱法测定香蒲各部分Cr累积量.
2.4 高通量测序与分析实验周期结束后, 通过16S rDNA测序技术分析阳极微生物群落结构.采用MOBIO PowerSoil®DNA Isolation Kit, 根据DNA提取试剂盒所述步骤对阳极微生物DNA进行提取.用1%琼脂糖凝胶电泳检测DNA的完整性、纯度和浓度, 最后于-20 ℃保存备用.
PCR扩增引物为细菌通用引物:515F(5′-GTGCCAGCMGCCGCGGTAA-3′)与806R(5′-GGACTACHVGGGTWTCTAAT-3′), 扩增区为16S rDNA V4高变区.PCR反应体系:2×Premix Taq 25 μL, 正、反向引物(10 mmol · L-1)各1 μL, 20 ng · μL-1 DNA 3 μL, 补ddH2O至50 μL. PCR反应条件:94 ℃预变性5 min; 90 ℃变性30 s, 52 ℃复性30 s, 72 ℃延伸30 s, 共30个循环; 最后在72 ℃延伸1 min.使用EZNA Gel Extraction Kit对PCR产物纯化回收.建立文库, 采用Illumina Hiseq2500平台进行高通量测序.
测序结果质控后得到PE reads.根据PE reads之间的overlap关系, 设置最小overlap长度为10 bp, 最大错配比率为0.1, 将成对reads拼成一条序列, 获得原始拼接序列.利用Mothur软件质控过滤后获得有效拼接片段.在97%相似性下, 通过Usearch软件将序列聚类为操作分类单元(OTU).利用QIIME软件计算分析α-多样性, 根据分类学, 在不同水平下(门、纲、属)统计群落组成.
3 结果与讨论(Results and discussion) 3.1 系统输出电压实验周期为香蒲最适宜生长时间5—9月, 共100 d.实验期内CP与CS对照组输出电压、功率密度和极化曲线在不同Cr(VI)浓度暴露下有显著区别(图 2).与对照组相比, P-MFC能更快地到达系统稳定期, 200、400 mg · kg-1 Cr(VI)暴露浓度下P-MFC系统均于20 d后达到稳定水平;启动时间在600、800 mg · kg-1 Cr(VI)暴露浓度下差异较大, CP3、CP4分别为第28、33 d,CS3、CS4分别延长至第38、50 d.相同Cr(VI)浓度下, 香蒲的种植能明显提高P-MFC输出电压, 最大可达到对照组的1.6倍, 最大功率密度为对照组的3倍.对照组60 d后电压呈下降趋势, 可能是由于电活性微生物降解了大部分可被利用的溶解性有机物, 转化为其它化合物释放电子用于系统产电.
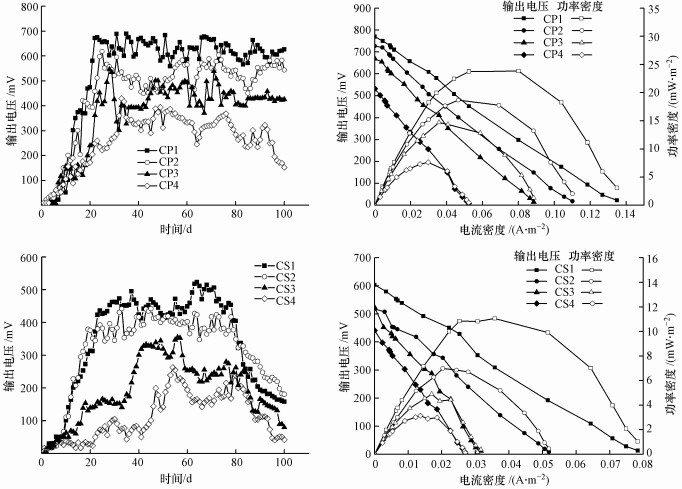 |
| 图 2 不同实验条件系统输出电压与极化曲线 Fig. 2 Voltage output and polarization curve of system under different conditions |
可见, 植物种植能在一定程度上提高P-MFC产电性能, 延长产电周期.这是由于植物根系巨大的比表面积为微生物提供了良好的生长环境, 促进了根际环境微生物的多样性与活性, 进而提高了电极电化学反应速率(Timmers et al., 2012); 同时, 植物根系分泌物(糖类、氨基酸、有机酸等)能被微生物氧化分解, 作为电子供体(Liu et al., 2013).De等(2008)研究发现, 水稻种植可使S-MFC功率密度提高7~9倍, 与本实验结论一致.
随着初始Cr(VI)浓度的升高, P-MFC达到稳定期的时间变长, 且稳定期内输出电压呈减小趋势.CP1~CP4的最大输出电压分别为690、618、546、430 mV, CP1的功率密度最大, 当电流密度为0.080 A·m-2时达到最大值23.834 mW·m-2, 分别为CP2~CP4的1.28~3.13倍.CS1~CS4的最大输出电压分别为523、442、354、262 mV, CS1的功率密度最大, 当电流密度为0.036 A·m-2时达到最大值11.058 mW·m-2, 分别为CS2~CS4的1.58~3.52倍.
当土壤Cr(VI)含量较高时, 一方面由于重金属具有较强的生物毒性, 使阳极微生物生长繁殖和活性受到抑制, 需要更长的时间适应污染环境, 因此, P-MFC具有更长的产电延滞期, 且输出电压降低(Fang et al., 2015; Wang et al., 2017); 另一方面, Cr(VI)作为强氧化剂, 会对植物组织造成氧化应激, 在Cr持续暴露下, 植物抗氧化酶水平降低, O2 · -与H2O2含量增加, 进而严重损害根尖细胞活性, 影响到植物根系有机物的分泌(Zeng et al., 2014).
电池内阻是系统运行过程中电流通过时受到的阻力, 也是影响燃料电池产电的关键因素(杨芳等, 2011).本研究通过极化曲线线性拟合估算不同处理条件下的系统内阻,发现P-MFC内阻(180~1100 Ω)低于对照组(250~2100 Ω), 推测植物引入增加了土壤中碳源含量, 使阳极微生物生物量增加, 进而降低了系统内阻.Timmers等(2013)研究指出, 系统内阻增大是由于底物耗尽, 以及电流产生过程中电化学活性生物膜、阳极和阴极之间传质阻力增加.土壤Cr(VI)含量分别为200、400、600、800 mg · kg-1时, P-MFC系统内阻分别为337、390、441、589 Ω, 对照组的系统内阻分别为455、589、935、945 Ω.内阻升高, 增加了质子由阳极迁移至阴极的阻力, 降低了系统电流密度和功率密度(Timmers et al., 2012).污染浓度改变会引起P-MFC内阻的变化, 这是影响系统性能的原因之一.阳极深度、尺寸和阴阳极相对位置是P-MFC设计时需要考虑的因素(Nitisoravut et al., 2017), 合理的系统构型能有效降低内阻, 而对其进行深入研究分析并改进, 有利于提高香蒲P-MFC产电性能.
3.2 土壤污染去除实验周期结束后, 取上层、中层、下层(每层高4 cm)土壤进行检测分析, 土壤初始Cr(VI)含量分别为200、800 mg · kg-1时, P-MFC和对照组中Cr(VI)、Cr(III)分布及Cr(VI)去除率如表 1所示.闭合回路条件下CP、CS组Cr(VI)含量呈下层>中层>上层的分布规律, 上层土壤Cr(III)含量大于中层与下层土壤, OP组不同价态Cr在土壤层并无明显分布规律. Cr(VI)在土壤中通常以阴离子团形式(如CrO42-、HCrO4-、Cr2O72-)存在, 因此, 在电场力作用下CP、CS中部分Cr(VI)向系统阳极移动并累积, 部分则通过阴极还原作用变为毒性较弱的Cr(III), 于阴极附近土壤沉积.研究指出,S-MFC中存在微弱的电场能驱动污染土壤进行电动修复(Habibul et al, 2016).经修复, 初始Cr(VI)含量为200、800 mg · kg-1时, P-MFC中Cr(VI)的去除率分别为33.01%、20.87%, 高剂量污染暴露下Cr(VI)去除率降低.CS组未种植香蒲, 阳极附近的电化学活性微生物可通过氧化分解土壤中原有的可被利用的有机物产生电子形成电流, 该系统启动慢、电压低、电化学还原反应弱, 土壤Cr(VI)去除率分别降低至18.55%、11.66%;开路条件下OP组无阴极电化学还原, 污染土壤修复主要通过植物富集, 以及微生物与有机物的直接还原, Cr(VI)去除率最低, 分别为10.17%、3.66%.
| 表 1 P-MFC和对照组Cr(VI)、Cr(III)分布及Cr(VI)去除率 Table 1 Distribution of Cr(VI)、Cr(III) and the removal efficiency in P-MFC and control group |
200、800 mg · kg-1 Cr(VI)暴露下, CP、OP组香蒲各部分Cr积累量如表 2所示.随Cr(VI)暴露浓度的增大, CP组单株香蒲对系统Cr的去除率由0.31%降低至0.06%, OP组由0.25%降低至0.05%.100 d后, CP、OP组Cr的去除率分别约为0.36%~1.86%、0.3%~1.5%.Cr被香蒲吸收并转运至其各部分, 地下部Cr累积量显著高于地上部.CP组香蒲单株Cr含量略高于OP组, 一定程度上表明P-MFC对香蒲吸收富集Cr具有促进作用, 可能由于Cr(VI)在系统中还原为Cr(III), 更有利于香蒲吸收(Augustynowicz et al., 2010).
| 表 2 香蒲Cr积累量与分布情况 Table 2 Cr concentration and distribution in Typha latifolia L. under Cr(VI) exposure |
香蒲P-MFC系统中, Cr(VI)可通过植物吸收富集, 以及阴极电化学还原和微生物还原作用去除.综上可知, 电化学还原作用是本研究土壤Cr(VI)去除的主要机制, 微生物与还原性有机物对Cr(VI)的直接还原作用在各实验组均存在, 约占3.5%~9.5%, 仅有2%的Cr通过植物吸收在各部分富集.推测植物为电化学活性微生物提供了更丰富的代谢底物, 强化了电化学还原作用; 此外, 植物根系分泌物能酸化土壤, 促进重金属离子的迁移(Ali et al, 2013).随着阳极有机物氧化降解, Cr(VI)在阴极还原为Cr(III), 并富集在阴极附近, 还原过程如下:
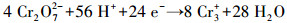
|
(4) |
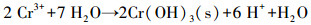
|
(5) |
可以发现, 阴极接受电子数量会影响Cr(VI)的还原, 更多的电子转移能促进Cr(VI)离子向阴极迁移, 集中在阴极表面.当前, 环境能源问题日趋严重, 与传统土壤污染修复方式相比, P-MFC无需消耗能源, 可在原位修复污染环境的同时产生电能, 其环境友好的优点使其具有极大的推广价值.而系统内阻升高导致的电子转移数量与速率降低是Cr(VI)去除率降低的原因之一.此外, 土壤和植物根系分泌物中存在的硝酸盐、有机物等营养物质直接用于反硝化过程而不是系统产电过程; 植物根系通过泌氧作用产生氧气, 在一定程度上消耗了电活性微生物代谢产生的电子, 这些都将降低系统污染物的去除性能(Helder et al., 2012).
3.3 微生物群落结构分析通过16S rDNA高通量测序对实验周期结束后CP1、CP4、CS1、CS4阳极微生物群落多样性进行检测, 在97%相似度水平下Alpha多样性检测结果见表 3.CP1、CP4、CS1、CS4检测获得的OUT数分别为3090、2332、1902、1251.Chao1指数用来衡量群落丰度, Shannon与Simpson指数可在衡量群落丰度的同时, 进一步揭示物种丰度和均匀度.4个样品的Chao1、Shannon、Simpson指数均表现出相同趋势:CP1>CP4>CS1>CS4, 表明阳极微生物群落丰度、多样性随香蒲种植与Cr(VI)暴露浓度减小而增大.这与Chodak等(2013)的研究结果一致, 该研究发现, 高浓度重金属暴露下, 土壤微生物群落结构变化明显, Chao1与Shannon指数降低.重金属污染对群落结构的影响表现为:对重金属较敏感的物种受到抑制, 同时耐受性较强的物种的活性得到提高.He等(2016)研究报道, 土壤微生物多样性随Cr(VI)浓度升高而降低, 本实验结果也有相同的变化趋势.
| 表 3 不同处理条件阳极微生物群落的Alpha多样性 Table 3 Alpha diversity of anode microbial community under different conditions |
对CP1、CP4、CS1、CS4阳极微生物群落中电活性和Cr还原微生物进行识别, 结果见图 3.各样品微生物门类如图 3a所示, 测序读数主要属于6个门类.其中, 变形菌门(Proteobacteria)均为4个样本中相对丰度最高的门类, 占44.9%~63.9%, 其它相对丰度较高的还有拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi), 这与多数对P-MFC、S-MFC阳极微生物群落结构的报道相似(Lu et al., 2015; Xun et al., 2016).Proteobacteria微生物能够为电子受体提供电子, 是MFC中的优势类群, 当土壤Cr(VI)含量较低且种植香蒲时, CP1中Proteobacteria的相对丰度最高(63.9%), 超过CP4、CS1、CS4(3.4%、9.1%、19.0%), 是其输出电压高于其它实验组的重要因素之一. Bacteroidetes为次优势类群, 4个样本的相对丰度分别为11.4%、14.0%、10.3%和18.9%.Acidobacteria多存在于贫瘠的环境, 其相对丰度与土壤营养物质含量呈负相关(Naether et al., 2012).本研究CS1、CS4中Acidobacteria的相对丰度分别为10.3%、15.4%, 高于CP1(4.4%)、CP4(5.4%), 香蒲能通过根系分泌有机物为微生物提供更多的代谢底物, 增加土壤养分.Firmicutes中存在大量纤维素降解微生物, 能够将坏死的根系水解成脂肪酸等小分子化合物, 为电活性微生物提供可直接利用的基质, 在促进系统产电上起到一定作用, 且这类微生物具有能够抵御恶劣生长环境的孢子(Xie et al., 2014).本研究中Firmicutes呈现出与Acidobacteria相似的规律, 在CP4中有最高的相对丰度(10.3%), 其余实验组为4.1%~8.3%. Chloroflexi在CP1、CP4中的相对丰度分别为4.3%、4.0%, CS1、CS4中分别为0.2%、0.4%, 说明Cr(VI)浓度改变对其相对丰度影响不显著, 种植香蒲可提高其占比.以上结果表明, 由于微生物对环境的适应能力不同, 当土壤污染浓度改变与植物种植时, 阳极微生物群落结构发生相应变化, 最终导致系统产电性能与污染去除率的差异.
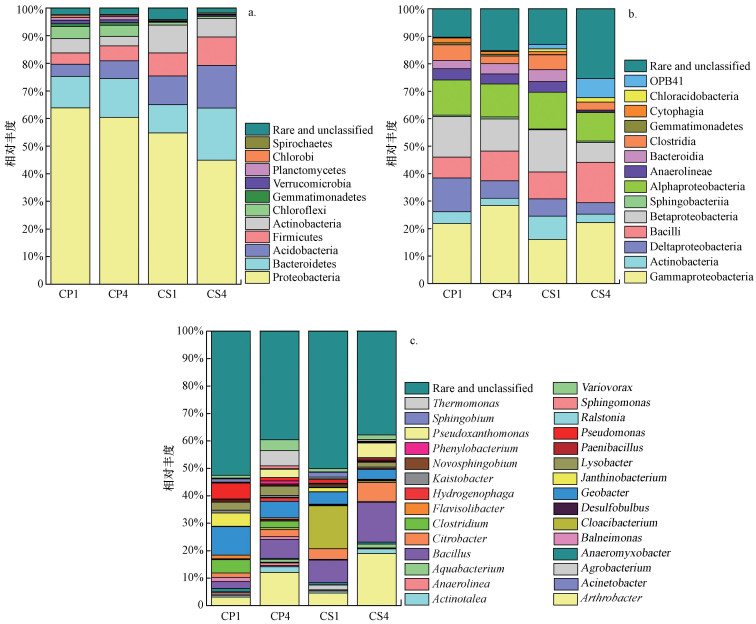 |
| 图 3 阳极微生物群落在门(a)、纲(b)、属(c)水平的分布情况 Fig. 3 The distributions of anode microbial community at phylum(a), class(b) and genus(c) level |
纲水平微生物群落结构如图 3b所示, 样本中共检测出占比最高的纲14类.4个样本中Gammaproteobacteria是Proteobacteria中丰度最大的类群, 在CP1、CP4、CS1、CS4中分别占21.8%、28.4%、16.0%、22.2%, 这与前人研究有所不同, 如Lu等(2015)以美人蕉构建的P-MFC阳极微生物群落中Deltaproteobacteria具有最高的相对丰度, 该课题组之前在水稻P-MFC系统中也有相同的发现.Wang等(2017)应用S-MFC修复阿特拉津污染土壤的研究中, 阳极群落占比最高的同样为Deltaproteobacteria, Deltaproteobacteria中的Geobacter能在MFC大量富集, 是最主要的电化学活性微生物之一, 且具有较高比例. He等(2016)在39 mg · kg-1 Cr(VI)土壤样品中检测出Gammaproteobacteria占比最高为36.1%, 并鉴定出能高效还原Cr(VI)的微生物Marinobacter spp..本研究4个样本中可能存在的较多Cr(VI)还原微生物属于Gammaproteobacteria, 而Deltaproteobacteria在CP1中相对丰度最高(12.3%), 其余实验组中在4%~6%左右. Betaproteobacteria是各实验组的次优势群落, 占比分别为14.8%、11.7%、15.3%、7.3%, 该类的大部分微生物能够氧化氨, 同时参与污染物的降解, 并且对Cr(VI)具有较强的耐受性(Branco et al., 2005).此外, Alphaproteobacteria也有较高的比例, 在4个实验组中未发现明显差异, 香蒲种植与Cr(VI)浓度改变对其群落影响不显著.
属水平的微生物群落结构如图 3c所示.地杆菌属(Geobacter)是MFC中最常见的电活性微生物之一, 其在群落中的占比往往会影响系统输出电压.研究发现, 低浓度Cr(VI)暴露及引入香蒲的系统中Geobacter相对丰度最大(10.4%), CP4、CS1、CS4中依次减小至6.0%、4.4%、3.6%.高通量测序还检测出柠檬酸杆菌属(Citrobacter, 1.6%~6.9%)、梭菌属(Clostridium, 0.2%~4.8%)、脱硫球茎菌属(Desulfobulbus, 0.1%~0.6%)、假单胞菌属(Pseudomonas, 0.5%~5.7%)等这些已被报道为电活性微生物的类群.Desulfobulbus、Clostridium能够氧化分解丙酸盐、乳酸盐、硫化物提供电子或将纤维素水解为小分子脂肪酸供电活性微生物使用. Pseudomonas是MFC中常见的电化学微生物, 在阳极形成生物膜并进行产电, 同时分泌氧化还原介体(吩嗪)加速电子由细胞表面至阳极的传递(Yu et al., 2015).不同实验条件下, 土壤中可利用碳源含量的改变及对土壤环境的适应能力导致其在群落中的相对丰度也产生不同程度的变化.革兰氏阴性菌不动细菌属(Acinetobacter)属于Gammaproteobacteria, 能适应重金属和需氧污染物暴露环境, 有研究利用Acinetobacter sp.还原1100 mg · L-1 Cr(VI)废水, 发现Acinetobacter sp.表现出良好的耐受性与还原效果(Pradhan et al., 2017).高浓度Cr(VI)处理下, CP4、CS4中Acinetobacter微生物的相对丰度分别增加至12.1%、19.0%, 并参与了土壤Cr(VI)的还原.芽孢杆菌属(Bacillus sp.)在土壤中分布广泛, 同样被认为对Cr(VI)具有较强的耐受性和还原能力.有研究从铁矿区分离出8种能在500 mg · kg-1 Cr(VI)培养基上生长的微生物, 并鉴定为Bacillus sp.(Cheng et al., 2009).本研究800 mg · kg-1 Cr(VI)实验组群落中Bacillus的相对丰度高于200 mg · kg-1实验组, CP1、CP4、CS1、CS4中相对丰度分别为2.5%、6.8%、8.2%、14.4%, 表明800 mg · kg-1 Cr(VI)胁迫对Bacillus的生长繁殖具有一定的促进作用.本研究在P-MFC和对照组中发现Cr(VI)还原微生物占比较高, 表明微生物还原作用在Cr(VI)去除上起到一定作用.
P-MFC中香蒲根系分泌物为阳极微生物(电活性、发酵、Cr(VI)还原微生物)提供更丰富的基质, 根系分泌物随Cr(VI)浓度的改变而变化, 进而影响微生物代谢.后期研究将对不同污染浓度胁迫下香蒲代谢组学进行分析, 讨论P-MFC运行过程中的反应机理, 以此为基础进一步提高系统性能.
4 结论(Conclusions)1) 香蒲种植和初始Cr(VI)暴露浓度会显著影响P-MFC输出电压与功率密度, 高浓度Cr(VI)对阳极微生物与植物具有抑制毒害作用, 可增加系统内阻, 进而降低系统产电性能.
2) 种植香蒲能强化P-MFC系统去除Cr(VI)的性能, Cr(VI)去除率最高为33.01%, 随着Cr(VI)浓度的升高, 去除率降低.经修复, 约90%的Cr(VI)通过P-MFC电化学还原作用去除, 以Cr(III)形式在阴极附近沉积, 2%的Cr(VI)被香蒲吸收富集在植物各组分, 8%的Cr(VI)由Cr(VI)还原微生物直接去除.
3) 香蒲种植与低Cr(VI)暴露浓度处理的阳极微生物群落结构多样性较丰富, 微生物对环境不同的适应能力使得不同实验条件下群落结构发生明显改变.研究发现, 系统中存在多种Cr还原微生物与耐Cr能力较强的电化学活性微生物, 影响系统产电与Cr(VI)去除性能.
Ali H, Khan E, Sajad M A. 2013. Phytoremediation of heavy metals-concepts and applications[J]. Chemosphere, 91(7): 869–881.
DOI:10.1016/j.chemosphere.2013.01.075
|
Augustynowicz J, Grosicki M, Hanus-Fajerska E, et al. 2010. Chromium(VI) bioremediation by aquatic macrophyte Callitriche cophocarpa, Sendtn[J]. Chemosphere, 79(11): 1077–1083.
DOI:10.1016/j.chemosphere.2010.03.019
|
Cheng G J, Li X H. 2009. Bioreduction of chromium (VI) by Bacillus sp.isolated from soils of iron mineral area[J]. European Journal of Soil Biology, 45(5): 483–487.
|
Chodak M, Gołębiewski M, Morawskapłoskonka J, et al. 2013. Diversity of microorganisms from forest soils differently polluted with heavy metals[J]. Applied Soil Ecology, 64(3): 7–14.
|
De S L, Van d B L, Dang H S, et al. 2008. Microbial fuel cells generating electricity from rhizodeposits of rice plants[J]. Environmental Science & Technology, 42(8): 3053–3058.
|
Fang Z, Song H L, Ning C, et al. 2015. Electricity production from Azo dye wastewater using a microbial fuel cell coupled constructed wetland operating under different operating conditions[J]. Biosensors and Bioelectronics, 68(68): 135–141.
|
Fang Z, Song H, Yu R, et al. 2016. A microbial fuel cell-coupled constructed wetland promotes degradation of azo dye decolorization products[J]. Ecological Engineering, 94: 455–463.
DOI:10.1016/j.ecoleng.2016.06.020
|
Farmer J G. 1991. The perturbation of historical pollution records in aquatic sediments[J]. Environmental Geochemistry and Health, 13(2): 76–83.
DOI:10.1007/BF01734298
|
Habibul N, Hu Y, Sheng G P. 2016. Microbial fuel cell driving electrokinetic remediation of toxic metal contaminated soils[J]. Journal of Hazardous Materials, 318: 9–14.
DOI:10.1016/j.jhazmat.2016.06.041
|
He Z, Hu Y, Yin Z, et al. 2016. Microbial diversity of chromium-contaminated soils and characterization of six chromium-removing bacteria[J]. Environmental Management, 57(6): 1319–1328.
DOI:10.1007/s00267-016-0675-5
|
Helder M, Strik D P B T B, Hamelers H V M, et al. 2012. New plant-growth medium for increased power output of the plant-microbial fuel cell[J]. Bioresource Technology, 104(1): 417–423.
|
Hodgson D M, Smith A, Dahale S, et al. 2016. Segregation of the anodic microbial communities in a microbial fuel cell cascade[J]. Frontiers in Microbiology, 7(103).
DOI:10.3389/fmicb.2016.00699
|
Jing Y D, He Z L, Yang X E. 2007. Role of soil rhizobacteria in phytoremediation of heavy metal contaminated soils[J]. Journal of Zhejiang University-Science B(Biomedicine & Biotechnology), 8(3): 192–207.
|
Liao Y, Min X, Yang Z, et al. 2014. Physicochemical and biological quality of soil in hexavalent chromium-contaminated soils as affected by chemical and microbial remediation[J]. Environmental Science and Pollution Research, 21(1): 379–388.
DOI:10.1007/s11356-013-1919-z
|
Liu S, Song H, Li X, et al. 2013. Power generation enhancement by utilizing plant photosynthate in microbial fuel cell coupled constructed wetland system[J]. International Journal of Photoenergy, 2013(2): 15158–15166.
|
Lu L, Xing D, Ren Z J. 2015. Microbial community structure accompanied with electricity production in a constructed wetland plant microbial fuel cell[J]. Bioresource Technology, 195: 115–121.
DOI:10.1016/j.biortech.2015.05.098
|
Lyubenova L, Pongrac P, Vogel-Mikuš K, et al. 2013. The fate of arsenic, cadmium and lead in Typha latifolia:A case study on the applicability of micro-PIXE in plant ionomics[J]. Journal of Hazardous Materials, 248-249(1): 371–378.
|
Machado A A D S, Spencer K, Kloas W, et al. 2016. Metal fate and effects in estuaries:A review and conceptual model for better understanding of toxicity[J]. Science of the Total Environment, 541: 268–281.
DOI:10.1016/j.scitotenv.2015.09.045
|
Moreau J W, Fournelle J H, Banfield J F. 2013. Quantifying heavy metals sequestration by sulfate-reducing bacteria in an acid mine drainage-contaminated natural wetland[J]. Frontiers in Microbiology, 49(3): 43–42.
|
Naether A, Foesel B U, Naegele V, et al. 2012. Environmental factors affect acidobacterial communities below the subgroup level in grassland and forest soils[J]. Applied š Environmental Microbiology, 78(20): 7398–7406.
DOI:10.1128/AEM.01325-12
|
Nitisoravut R, Regmi R. 2017. Plant microbial fuel cells:A promising biosystems engineering[J]. Renewable and Sustainable Energy Reviews, 76: 81–89.
DOI:10.1016/j.rser.2017.03.064
|
Pan K, Wang W X. 2012. Trace metal contamination in estuarine and coastal environments in China[J]. Science of the Total Environment, 421-422(3): 3–16.
|
Polti M A, Atjián M C, Amoroso M J, et al. 2011. Soil chromium bioremediation:Synergic activity of actinobacteria and plants[J]. International Biodeterioration & Biodegradation, 65(8): 1175–1181.
|
Pradhan D, Sukla L B, Sawyer M, et al. 2017. Recent bioreduction of hexavalent chromium in wastewater treatment:A review[J]. Journal of Industrial and Engineering Chemistry, 55: 1–20.
DOI:10.1016/j.jiec.2017.06.040
|
Probstein R F, Hicks R E. 1993. Removal of contaminants from soils by electric fields[J]. Science, 260(5107): 498–503.
DOI:10.1126/science.260.5107.498
|
Qiao J, Sun H, Luo X, et al. 2017. EDTA-assisted leaching of Pb and Cd from contaminated soil[J]. Chemosphere, 167: 422–428.
DOI:10.1016/j.chemosphere.2016.10.034
|
Branco R, Chung A P, Veríssimo A, et al. 2010. Impact of chromium-contaminated wastewaters on the microbial community of a river[J]. Fems Microbiology Ecology, 54(1): 35–46.
|
Schneider K, Thorne R J, Cameron P J. 2016. An investigation of anode and cathode materials in photomicrobial fuel cells[J]. Philosophical Transaction of the Royal Society A-mathematical Physical and Engineering Sciences, 374(2061).
DOI:10.1098/rsta.2015.0080
|
Timmers R A, Rothballer M, Strik D P, et al. 2012. Microbial community structure elucidates performance of Glyceria maxima plant microbial fuel cell[J]. Applied Microbiology & Biotechnology, 94(2): 537–548.
|
Timmers R A, Strik D P B T B, Hamelers H V M, et al. 2012. Characterization of the internal resistance of a plant microbial fuel cell[J]. Electrochimica Acta, 72(6): 165–171.
|
Timmers R A, Strik D P B T B, Hamelers H V M, et al. 2013. Electricity generation by a novel design tubular plant microbial fuel cell[J]. Biomass and Bioenergy, 51(51): 60–67.
|
Valipour M, Shahbazi K, Khanmirzaei A. 2016. Chemical immobilization of lead, cadmium, copper, and nickel in contaminated soils by phosphate amendments[J]. CLEAN-Soil, Air, Water, 44(5): 572–578.
DOI:10.1002/clen.v44.5
|
Wang H, Li L, Cao X, et al. 2017. Enhanced degradation of atrazine by soil microbial fuel cells and analysis of bacterial community structure[J]. Water Air & Soil Pollution, 228(8): 308–317.
|
吴玉俊, 周航, 杨文弢, 等. 2016. 组配改良剂对污染稻田中Pb、Cd、Cu和Zn钝化效果持续性比较[J]. 环境科学, 2016, 37(7): 2791–2798.
|
Xie Z, Wang Z, Wang Q, et al. 2014. An anaerobic dynamic membrane bioreactor (AnDMBR) for landfill leachate treatment:performance and microbial community identification[J]. Bioresource Technology, 161(3): 29–39.
|
Xun X, Zhao Q, Wu M, et al. 2016. Biodegradation of organic matter and anodic microbial communities analysis in sediment microbial fuel cells with/without Fe(Ⅲ) oxide addition[J]. Bioresource Technology, 225: 402–408.
|
Yan Z, Jiang H, Cai H, et al. 2015. Complex interactions between the macrophyte Acorus calamus and microbial fuel cells during pyrene and Benzo[a]Pyrene degradation in sediments[J]. Scientific Reports, 5(75): 10709–10719.
|
杨芳, 李兆华, 肖本益. 2011. 微生物燃料电池内阻及其影响因素分析[J]. 微生物学通报, 2011, 38(7): 1098–1105.
|
Ye Z H, Ajm B, Wong M H, et al. 2010. Zinc, lead and cadmium tolerance, uptake and accumulation by Typha latifolia[J]. New Phytologist, 136(3): 469–480.
|
Yu J, Park Y, Kim B, et al. 2015. Power densities and microbial communities of brewery wastewater-fed microbial fuel cells according to the initial substrates[J]. Bioprocess and Biosystems Engineering, 38(1): 85–92.
DOI:10.1007/s00449-014-1246-x
|
Zeng F, Wu X, Qiu B, et al. 2014. Physiological and proteomic alterations in rice (Oryza sativa L.) seedlings under hexavalent chromium stress[J]. Planta, 240(2): 291–308.
DOI:10.1007/s00425-014-2077-3
|
Zhang C, Nie S, Liang J, et al. 2016. Effects of heavy metals and soil physicochemical properties on wetland soil microbial biomass and bacterial community structure[J]. Science of the Total Environment, 557/558: 785–790.
DOI:10.1016/j.scitotenv.2016.01.170
|
 2019, Vol. 39
2019, Vol. 39


