硒是人体必须的微量元素, 与人体健康密切相关(Fernández-Martínze et al., 2009; Ju et al., 2017).当人体对硒的日摄取量不足40 μg时, 可导致糖尿病、癌症、心血管等疾病, 也可引起免疫系统缺陷和抗氧化机能降低;当人体对硒的日摄取量高于400 μg时, 则可导致脱发、指甲变脆、肝增大等硒中毒症状(Fernández-Martínze et al., 2009; Winkel et al., 2011; Schiavon et al., 2017).水是硒的迁移转化和人体摄取的重要载体, 硒在水体中的含量是水环境质量的重要指标.水体中硒的主要来源包括采矿、冶金、电子等工业废水及农业废水的排放, 富硒地区土壤中的硒也可在风化、淋溶和生物等作用下向水环境中迁移, 导致水体中硒含量过高并造成水体硒污染(Holmes et al., 2016).世界卫生组织(WHO)和美国环境保护署(EPA)规定饮用水中硒的含量上限分别为40 μg·L-1和50 μg·L-1 (Holmes et al., 2016), 而我国规定地表水Ⅲ类水体的硒含量上限为10 μg·L-1(中华人民共和国生态环境部, 2002).可见, 我国对地表水中硒含量的要求非常严格.降低水体硒含量的方法有生物法、共沉淀法、离子交换法、膜分离、吸附法等, 其中, 吸附法因具有去除效率高、再生简单、无二次污染物等优点而被广泛研究和应用(Santos et al., 2015; Holmes et al., 2016).
近年来, 金属有机骨架材料(MOFs)因具有巨大的比表面积、丰富的孔隙结构和表面活性位点(Lewis、Brønsted酸碱和有机官能团等)及结构可调和可扩展性强等优点而备受研究者的关注(Schröder, 2010).MOFs作为一种功能性多孔材料, 可为分子的传质等输运过程提供便利, 极大地提高材料的空间利用率.MOFs表面丰富的Lewis酸位点可为无机含氧酸根阴离子提供理想的配位吸附位点(Howarth et al., 2015; 王锐等, 2018a), Brønsted碱位点则是重金属等阳离子的交换吸附位点(Rahimi et al., 2016), 质子化后的Brønsted碱位点也是含氧酸根阴离子的良好吸附位点(王锐等, 2018a), 而富电子的苯环结构和其他官能团则是有机污染物的有效吸附位点(Jun et al., 2015).因此, MOFs被广泛用于环境污染物的吸附研究(Kumar et al., 2017; Li et al., 2018).研究表明, UN-1000和MIL-100(Fe)对Se(Ⅳ)的最大吸附容量分别可达95 mg·g-1和117 mg·g-1(以Se计)(Howarth et al., 2015; 王锐等, 2018b), 远大于传统吸附材料对Se(Ⅳ)的吸附容量(Santos et al., 2015; Holmes et al., 2016).可见, MOFs是一类对Se(Ⅳ)具有高吸附容量的新型吸附材料.
MIL-100(Fe)对Se(Ⅳ)的吸附机制包括配位吸附、阴离子交换、氢键、静电作用等多种物理/化学作用(王锐等, 2018a);而磷酸盐(Pi)、硫酸盐、碳酸盐等多种无机含氧酸根阴离子也可与MOFs发生多种物理/化学吸附作用, 尤其是Pi与金属氧化物、石墨烯、MOFs等多种吸附材料都有较高的吸附亲和力(Zhao et al., 2001; Khare et al., 2007; Constantino et al., 2017; Kumar et al., 2017; Ajmal et al., 2018).并且Pi普遍存在于水环境中, 自然水体包括饮用水中磷的含量往往远大于Se(Ⅳ).我国地表水Ⅲ类水体的磷含量上限分别为50 μg·L-1(湖、库水体)和200 μg·L-1(非湖、库水体), 分别是Se(Ⅳ)上限值的5倍和20倍(国家环境保护总局, 2002).因此, 天然水体中磷的存在对各种吸附材料吸附Se(Ⅳ)产生的影响不可忽视.研究显示, 尽管UN-1000、MIL-100(Fe)等MOFs都是Se(Ⅳ)的高效吸附材料, 但这些研究均是在没有其它无机含氧酸根阴离子共存条件下开展的, 相应的结果与有Pi共存时MOFs对Se(Ⅳ)的吸附性能差异较大, 不能真实地反映MOFs对水体中Se(Ⅳ)的去除性能.基于以上研究的不足, 本研究通过制备MOF-Fe材料, 并在含有Pi的条件下开展MOF-Fe对Se(Ⅳ)的吸附研究, 着重探讨水体中Pi共存时对MOF-Fe吸附Se(Ⅳ)的影响.
2 材料与方法(Materials and methods) 2.1 实验材料所用的试剂均为分析纯级, 超纯水由纯水机(HK-UP-11-20, 浩康科技, 成都)制备.根据文献(王锐等, 2018a)的方法制备MOF-Fe样品, 主要步骤如下:按Fe3+:BTC(均苯三甲酸):水= 1:0.66:280(物质的量), 取4.05 g FeCl3·6H2O溶于75 mL超纯水中, 再加入2.10 g BTC, 转入水热合成反应釜中, 在150 ℃下合成24 h;然后自然冷却至室温, 用超纯水洗涤并用无水乙醇浸泡沉淀, 最后在60 ℃下烘干, 研磨.
MOF-Fe样品的粉末X-射线衍射(XRD)分析及其结果见文献(王锐等, 2018a).MOF-Fe样品的XRD主要衍射峰与文献(Song et al., 2014; Guesh et al., 2017)中MIL-100(Fe)的XRD主要衍射峰一致, 没有出现杂峰, 这表明本研究使用的MOF-Fe具有MIL-100(Fe)的晶体结构, 且纯度较高、结晶度良好.
2.2 吸附实验 2.2.1 等温吸附以0.01 mol·L-1的NaCl溶液作为离子强度调节剂, 配制20 mmol·L-1和2 mmol·L-1的Na2SeO3溶液(Se(Ⅳ))及相同浓度的Na3PO4溶液(Pi);然后用微量的NaOH和HCl溶液将5种溶液的pH调节至5.0.用pH为5.0的0.01 mol·L-1 NaCl溶液配制6 g·L-1的MOF-Fe悬浮液, 并超声处理10 min.
MOF-Fe对Se(Ⅳ)的吸附实验分为两种体系:不加Pi的体系(Pi/Se=0)和加Pi的体系(Pi/Se=1).Pi/Se=0体系中, 依次加入不同浓度和体积的Se(Ⅳ)溶液, 然后加入5 mL MOF-Fe悬浮液, 再用0.01 mol·L-1的NaCl溶液定容至30 mL;使吸附体系中Se(Ⅳ)的初始浓度为0~5.06 mmol·L-1, MOF-Fe悬浮液的浓度为1 g·L-1.Pi/Se=1体系中, 依次加入与Pi/Se=0体系相同浓度和体积的Se(Ⅳ), 然后加入与Se(Ⅳ)相同浓度和体积的Pi溶液, 再加入5 mL MOF-Fe悬浮液, 最后用0.01 mol·L-1的NaCl溶液定容至30 mL;使Pi/Se=1体系中Pi与Se(Ⅳ)的初始物质的量浓度比为1:1.最后在温度为25 ℃、转速为250 r·min-1的恒温摇床(QYC-200, 上海新苗)中振荡12 h.吸附结束后, 在10000 r·min-1条件下离心10 min得到上清液, 用氢化物发生-原子荧光分光光度计(AFS-8330, 北京吉天)检测吸附后Se(Ⅳ)的平衡浓度.根据吸附前后Se(Ⅳ)的浓度差和MOF-Fe悬浮液的浓度计算MOF-Fe对Se(Ⅳ)的平衡吸附量.本研究中除了动力学吸附实验无法做平行以外, 其他所有的吸附实验均做3次平行, 结果取平均值.
2.2.2 动力学吸附以0.01 mol·L-1的NaCl溶液为离子强度调节剂, 配制2 mmol·L-1和4 mmol·L-1的Se(Ⅳ)溶液及4 mmol·L-1的Pi溶液, 并用微量的NaOH和HCl溶液依次将各溶液的pH调节至5.0.用pH为5.0的NaCl溶液配制2份30 mL 3 g·L-1的MOF-Fe悬浮液, 超声处理10 min, 将2份MOF-Fe悬浮液分为Pi/Se=0和1两种体系.在25 ℃恒温条件下, Pi/Se=0体系中, 向剧烈搅拌状态下的MOF-Fe悬浮液中快速加入60 mL 2 mmol·L-1的Se(Ⅳ)并开始计时;Pi/Se=1体系中, 将30 mL 4 mmol·L-1 Se(Ⅳ)溶液和30 mL 4 mmol·L-1 Pi溶液均匀混合, 再快速加入到剧烈搅拌状态下的MOF-Fe悬浮液中并开始计时.分别在吸附时间为0.5、1、2、5、10、20、40、80、160和300 min时取两种体系中悬浮液各3~5 mL, 用0.22 μm针头过滤器快速过滤得到上清液, 检测上清液中Se(Ⅳ)的浓度, 并计算平衡吸附量.
2.2.3 热力学吸附取若干50 mL离心管, 向Pi/Se=0体系中依次加入pH=5.0的0.01 mol·L-1 NaCl溶液、20 mmol·L-1 Se(Ⅳ)溶液和6 g·L-1 MOF-Fe悬浮液各23、2和5 mL, 向Pi/Se=1体系中依次加入pH为5.0的0.01 mol·L-1 NaCl溶液、20 mmol·L-1 Se(Ⅳ)和Pi溶液及6 g·L-1 MOF-Fe悬浮液各21、2、2和5 mL.两种吸附体系中, Se(Ⅳ)的初始浓度为1.27 mmol·L-1, MOF-Fe的浓度为1 g·L-1;Pi/Se=1体系中, Pi的初始浓度也为1.27 mmol·L-1.在设定的温度(15、25和35 ℃)和250 r·min-1的条件下振荡12 h, 其余步骤参照等温吸附实验.Pi/Se=1体系的上清液中Pi的浓度采用钼锑抗分光光度法测定, 根据吸附前后Pi的浓度差和MOF-Fe悬浮液的浓度计算MOF-Fe对Pi的平衡吸附量.
2.2.4 pH对吸附的影响取若干50 mL离心管, 向Pi/Se=0体系中依次加入设定pH(4.0、5.0、6.0、7.0和8.0)的0.01 mol·L-1 NaCl溶液、20 mmol·L-1 Se(Ⅳ)溶液和6 g·L-1 MOF-Fe悬浮液各23、2和5 mL, 向P/Se=1体系中依次加入设定pH的0.01 mol·L-1 NaCl溶液、20 mmol·L-1 Se(Ⅳ)和Pi溶液及6 g·L-1 MOF-Fe悬浮液各21、2、2和5 mL.两种吸附体系中, Se(Ⅳ)的初始浓度为1.27 mmol·L-1, MOF-Fe的浓度为1 g·L-1;Pi/Se=1体系中, Pi的初始浓度也为1.27 mmol·L-1.在25 ℃和250 r·min-1的条件下振荡12 h, 其余步骤参照等温吸附实验.
2.2.5 Pi的浓度对吸附的影响取若干50 mL离心管, 依次加入2 mL、pH=5.0的20 mmol·L-1 Se(Ⅳ)后, 再加入不同体积pH=5.0的20 mmol·L-1 Pi溶液和5 mL 6 g·L-1 MOF-Fe悬浮液, 最后补加pH为5.0的0.01 mol·L-1 NaCl溶液至30 mL.吸附体系中Se(Ⅳ)的初始浓度1.27 mmol·L-1, MOF-Fe的浓度为1 g·L-1, Pi浓度由0 mmol·L-1增大至6.51 mmol·L-1.在25 ℃和250 r·min-1的条件下振荡12 h, 其余步骤参照等温吸附实验.
3 结果与讨论(Results and discussion) 3.1 等温吸附图 1为MOF-Fe对Se(Ⅳ)的等温吸附曲线.由图 1可知, 在Pi/Se=0的体系中, Se(Ⅳ)的平衡浓度(Ce)为0~4.04 mmol·L-1时, MOF-Fe对Se(Ⅳ)的平衡吸附量(Qe)随着平衡浓度的升高而显著增大.在Pi/Se=1的体系中, 当Ce < 1.62 mmol·L-1时, Qe随着Ce升高而明显增大;当Ce>1.62 mmol·L-1时, Qe随着Ce升高而缓慢变化至趋于饱和.当Se(Ⅳ)的平衡浓度相同时, Pi/Se=1体系中MOF-Fe对Se(Ⅳ)的平衡吸附量明显低于Pi/Se=0体系中相应的平衡吸附量.
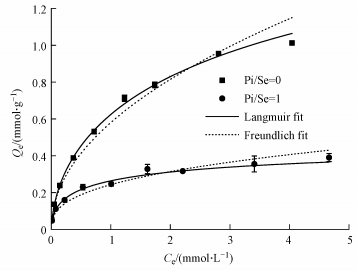 |
| 图 1 MOF-Fe对Se(Ⅳ)的等温吸附曲线 (图中误差棒为3次平行实验结果的标准差) Fig. 1 Adsorption isothermal curves of selenite on MOF-Fe |
选用Langmuir和Freundlich两种等温吸附模型对两种体系中的等温吸附数据进行拟合.Langmuir和Freundlich模型的非线性表达式(Freundlich, 1906; Langmuir, 1918)分别见式(1)和(2).
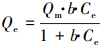
|
(1) |
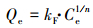
|
(2) |
式中, Qe为吸附剂对吸附质的平衡吸附量(mmol·g-1);Ce为吸附体系中吸附质的平衡浓度(mmol·L-1);Langmuir模型中Qm为吸附剂对吸附质的最大吸附容量(mmol·g-1);b为与吸附亲和力及结合能有关的常数(L·mmol-1);Freundlich模型中kF为与吸附容量相关的常数(mmol1-(1/n)·L1/n·g-1);n为与吸附强度相关的常数.
MOF-Fe吸附Se(Ⅳ)的等温吸附模型拟合参数列于表 1.在Pi/Se=0的体系中, Langmuir和Freundlich模型对MOF-Fe吸附Se(Ⅳ)的等温吸附数据的拟合度(R2)分别为0.9863和0.9855, 这表明Langmuir和Freundlich模型均可描述MOF-Fe对Se(Ⅳ)的吸附.根据文献(牛鹏举等, 2016; Tran et al., 2017), Langmuir模型适合描述单层均匀位点吸附, 而Freundlich模型适合描述多层异质性吸附.因此, 在Pi/Se=0体系中, MOF-Fe对Se(Ⅳ)的吸附可认为是单层/多层吸附的综合结果.在Pi/Se=1体系中, Freundlich模型对MOF-Fe吸附Se(Ⅳ)的等温吸附数据的拟合度(R2)明显高于Langmuir模型对相应吸附数据的拟合度, 这说明Pi/Se=1体系中MOF-Fe对Se(Ⅳ)的吸附更适合用多层异质性吸附模型描述.可见, 向MOF-Fe吸附Se(Ⅳ)的体系中加入等物质的量浓度的Pi以后, 增加了MOF-Fe对Se(Ⅳ)的异质性吸附.
| 表 1 MOF-Fe对Se(Ⅳ)的等温吸附模型拟合参数 Table 1 Fitting parameters of the adsorption isothermals for selenite on MOF-Fe |
比较Pi/Se=0和1两种体系可知, 向吸附Se(Ⅳ)的体系中加入等物质的量浓度的Pi时, 导致MOF-Fe对Se(Ⅳ)的Langmuir最大吸附容量(Qm)降低了68%, 而吸附亲和力(b)升高了2.43倍.可见, 加入Pi导致MOF-Fe对Se(Ⅳ)的Qm显著降低, 但却增大了MOF-Fe与Se(Ⅳ)之间的吸附亲和力.
Pi/Se=0和1两种体系中, MOF-Fe对Se(Ⅳ)的Freundlich吸附容量常数kF分别为0.60 0.25 mmol1-(1/n)·L1/n·g-1, 这与两种体系中Qm的大小关系一致.两种体系中MOF-Fe吸附Se(Ⅳ)的拟合参数n分别为2.387和3.378.根据文献(Tran et al., 2017), Freundlich等温吸附模型中的参数n既能反映吸附剂的异质性, 也可指示吸附剂对吸附质的吸附强度.可见, 向MOF-Fe吸附Se(Ⅳ)的体系中加入等物质的量浓度的Pi以后, MOF-Fe的表面异质性及对Se(Ⅳ)的吸附强度都明显增加, 这与MOF-Fe对Se(Ⅳ)的吸附模型分析结果一致.
3.2 动力学吸附图 2为MOF-Fe对Se(Ⅳ)的吸附动力学数据(图 2a)及其线性拟合图(图 2b~2d).图 2a显示, 在Pi/Se=0的体系中, 当吸附时间(t)小于80 min时, MOF-Fe对Se(Ⅳ)的吸附量(Qt)随着时间的增加而迅速增大;当吸附时间为80~160 min时, 吸附量缓慢增大并趋于稳定.在Pi/Se=1的体系中, 当吸附时间增大至40 min时, MOF-Fe对Se(Ⅳ)的吸附即可达到平衡.当t < 20 min时, Pi/Se=1体系中MOF-Fe对Se(Ⅳ)的吸附量大于相同吸附时间下Pi/Se=0体系中的吸附量;当t>20 min时, Pi/Se=0体系中MOF-Fe对Se(Ⅳ)的吸附量继续明显增大, 致使其吸附量超过Pi/Se=1体系中的吸附量.
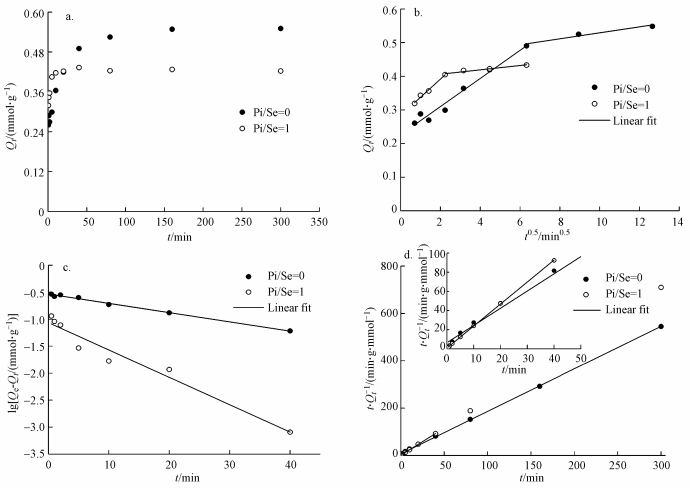 |
| 图 2 MOF-Fe对Se(Ⅳ)的吸附动力学数据及其线性拟合 (a.吸附动力学数据散点图, b. Weber-Morris方程线性拟合图, c.一级动力学方程线性拟合图, d.二级动力学方程线性拟合图) Fig. 2 Adsorption kinetics data and linear fitting for selenite on MOF-Fe |
选用Weber-Morris方程、一级动力学和二级动力学方程对两种吸附体系中的动力学数据进行线性拟合, 3种方程的表达式(Lagergren, 1898; Weber et al., 1963; Blanchard et al., 1984)分别见式(3)、(4)和(5).
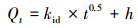
|
(3) |
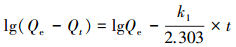
|
(4) |
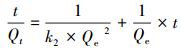
|
(5) |
式中, Qt为吸附剂在时间t时对吸附质的吸附量(mmol·g-1);t为吸附时间(min);kid为颗粒内扩散速率常数(mmol·g-1·min-0.5);h为与液膜相关的常数(mmol·g-1);Qe为吸附剂对吸附质的平衡吸附量(mmol·g-1);k1为一级动力学吸附速率常数(min-1);k2为二级动力学吸附速率常数(g·mmol-1·min-1).
3种模型对MOF-Fe吸附Se(Ⅳ)的线性拟合分别见图 2b~2d, 拟合参数列于表 2.图 2b显示, 在Pi/Se=0和1的体系中, MOF-Fe对Se(Ⅳ)的吸附达到平衡以前, Qt对t0.5作图均可拟合得到两段不过原点的线性区间.根据文献(Walter, 1984; Tran et al., 2017), 内扩散模型拟合直线为多段线且不经过原点, 说明液膜扩散和颗粒内扩散为吸附速率的主要控制过程.因此, 在Pi/Se=0和1体系中, 液膜扩散和颗粒内扩散是MOF-Fe吸附Se(Ⅳ)的主要速率控制因子.MOF-Fe吸附Se(Ⅳ)的动力学方程的拟合结果(表 2)表明, 在Pi/Se=0和1的体系中, MOF-Fe吸附Se(Ⅳ)的动力学过程更适合用二级动力学方程描述, 这说明两种体系中MOF-Fe对Se(Ⅳ)的吸附均主要为化学吸附机制(Liu et al., 2018).二级动力学方程拟合结果中, 两种体系的Qe分别为0.56 mmol·g-1和0.43 mmol·g-1, 与实验结果高度相符;Pi/Se=1体系中的k2是Pi/Se=0体系中k2的12.58倍, 表明在等物质的量浓度的Pi共存体系中, MOF-Fe对Se(Ⅳ)的吸附速率得到了极大的提高.
| 表 2 MOF-Fe对Se(Ⅳ)的动力学吸附数据的拟合参数 Table 2 Fitting parameters of adsorption kinetics data for selenite on MOF-Fe |
图 3为MOF-Fe对Se(Ⅳ)和Pi的吸附热力学数据(图 3a)及热力学方程的线性拟合图(图 3b).在15~35 ℃范围内, Pi/Se=0和1体系中MOF-Fe对Se(Ⅳ)的平衡吸附量Qe均呈现随着温度升高而降低的趋势, 其中, Pi/Se=0体系中Qe的降低量仅为5%, 而Pi/Se=1体系中Qe的降低量达26%.此外, 在Pi/Se=1体系中, MOF-Fe对Pi的Qe随着温度的升高而明显升高.
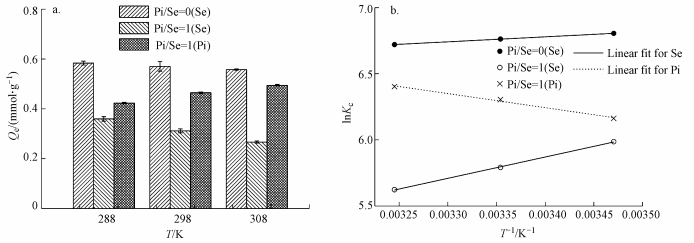 |
| 图 3 MOF-Fe对Se(Ⅳ)和Pi的热力学吸附数据(a)及线性拟合图(b) (图中Pi/Se=0(Se)表示Pi/Se=0体系中MOF-Fe对Se(Ⅳ)的吸附, Pi/Se=1(Se)表示Pi/Se=1体系中MOF-Fe对Se(Ⅳ)的吸附, Pi/Se=1(Pi)表示Pi/Se=1体系中MOF-Fe对Pi的吸附) Fig. 3 Adsorption thermodynamics data and linear fitting curves for selenite and phosphate on MOF-Fe |
采用吉布斯自由能变、修正后的吸附体系分布系数及van′t Hoff等热力学方程(Milonjić, 2007; Tran et al., 2016; 2017)对实验数据进行拟合, 3种热力学方程分别见式(6)、(7)和(8).
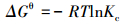
|
(6) |
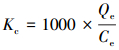
|
(7) |
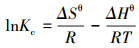
|
(8) |
式中, Kc为无量纲的分布系数;R为理想状态气体常数(8.314 J·mol-1·K-1);T为吸附体系的温度(K);ΔGθ、ΔHθ和ΔSθ分别为吸附的标准自由能变(kJ·mol-1)、焓变(kJ·mol-1)和熵变(J·mol-1·K-1);Qe为吸附剂对吸附质的平衡吸附量(mmol·g-1);Ce为吸附体系中吸附质的平衡浓度(mmol·L-1).
拟合的热力学参数列于表 3.根据ΔGθ的正负可判断吸附是自发/非自发过程, ΔHθ的正负可判断吸附是吸热/放热过程, ΔSθ的正负可判断吸附剂界面处吸附质无序度的增大/减小(牛鹏举等, 2016; Lim et al., 2017; Guo et al., 2017).当吸附温度分别为15、25和35 ℃时, Pi/Se=0和1体系中MOF-Fe吸附Se(Ⅳ)的ΔGθ均为负值, 且ΔGθ随着温度的升高而降低.这说明MOF-Fe对Se(Ⅳ)的吸附均属于自发过程, 且升高温度有利于提高MOF-Fe对Se(Ⅳ)的吸附自发性.两种体系中的ΔHθ均为负值而ΔSθ均为正值, 这表明两种体系中MOF-Fe对Se(Ⅳ)的吸附均是放热过程, 且吸附导致MOF-Fe界面处Se(Ⅳ)的无序度增大.
| 表 3 MOF-Fe对Se(Ⅳ)和Pi的吸附热力学拟合参数 Table 3 Fitting parameters of adsorption thermodynamics for selenite and phosphate on MOF-Fe |
根据文献(Freitas et al., 2007), 当吸附体系中ΔGθ < 0时, ΔGθ随着温度升高而降低, 意味着升高吸附体系的温度可以促进吸附质在吸附剂表面的吸附过程.与Pi/Se=0体系相比, 在Pi/Se=1体系中MOF-Fe吸附Se(Ⅳ)的自由能变ΔGθ随着温度升高的变化程度减小, 这表明向MOF-Fe吸附Se(Ⅳ)的体系中加入等物质的量浓度的Pi以后导致MOF-Fe对Se(Ⅳ)的吸附过程受温度的影响降低.根据文献(Krishna et al., 2000), 吸附焓变ΔHθ数值的增大说明吸附质与吸附剂之间的相互作用增强.在Pi/Se=0和1的体系中, ΔHθ数值分别为3.13和13.40, 这说明Pi/Se=1体系中MOF-Fe与Se(Ⅳ)之间的相互作用更强.尽管在Pi/Se=0和1的体系中, MOF-Fe对Se(Ⅳ)的吸附均导致MOF-Fe界面处Se(Ⅳ)的无序度增大.然而, 与Pi/Se=0体系相比, Pi/Se=1体系中MOF-Fe吸附Se(Ⅳ)以后, 其界面处Se(Ⅳ)的无序度增大程度较小.两种体系中MOF-Fe对Se(Ⅳ)的吸附热力学参数变化表明, 吸附体系中Pi共存时导致MOF-Fe对Se(Ⅳ)的吸附作用中化学吸附作用的贡献增强.
Pi/Se=1体系中MOF-Fe吸附Pi的热力学参数显示, 当温度由15 ℃升高至35 ℃时, MOF-Fe吸附Pi的ΔGθ由-14.76 kJ·mol-1降低至-16.40 kJ·mol-1, 而ΔHθ和ΔSθ分别为8.86 kJ·mol-1和82.05 J·mol-1·K-1.这说明在Pi/Se=1体系中, MOF-Fe对Pi的吸附为自发吸热且无序度增大的过程, 升高温度有利于MOF-Fe对Pi的吸附.因此, 随着温度的升高, MOF-Fe对Pi的Qe增大, 并导致吸附在MOF-Fe上的Se(Ⅳ)的Qe因Pi的竞争性增强而发生更大程度的降低, 表现为MOF-Fe对Se(Ⅳ)的Qe因Pi的竞争而增强了对温度的敏感性.
3.4 pH对吸附的影响图 4为不同pH条件下MOF-Fe对Se(Ⅳ)的平衡吸附量.由图可知, 在Pi/Se=0的体系中, 当pH由4.0升高至8.0时, MOF-Fe对Se(Ⅳ)的平衡吸附量Qe由0.58 mmol·g-1降低至0.54 mmol·g-1, 变化程度仅为7%.在Pi/Se=1的体系中, 随着pH的升高, Qe由0.30 mmol·g-1降低至0.19 mmol·g-1, 变化程度达到37%.可见, 向MOF-Fe吸附Se(Ⅳ)的体系中加入等物质的量的Pi以后, MOF-Fe对Se(Ⅳ)的Qe受pH影响的敏感性显著增强.
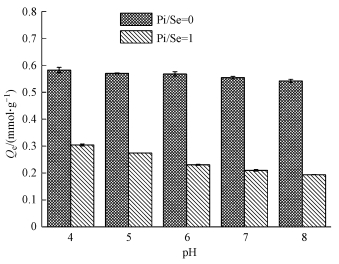 |
| 图 4 不同pH条件下MOF-Fe对Se(Ⅳ)的吸附量 Fig. 4 The amount of selenite adsorbed on MOF-Fe at different pH |
吸附体系的pH显著影响着Se(Ⅳ)和Pi在吸附剂表面的吸附性能及机制, 其主要原因在于吸附体系的pH可以改变吸附剂和吸附质的质子化程度, 进而影响吸附剂的表面电荷和活性位点性质及吸附质的形态.根据文献(王锐等, 2018a), MOF-Fe的电荷零点(pHZPC)小于4, 其表面具有与水分子配位的Fe位点和Fe-OH位点.降低体系的pH可导致配位水分子和Fe-OH因质子化而活化并形成MOF-Fe的活性Fe位点;相反, 升高体系的pH则不利于MOF-Fe中活性Fe位点的活化和形成.此外, Se(Ⅳ)和Pi在不同的pH条件下可以发生不同程度的质子化, 相应的电离平衡见式(9)~(13).根据式(9)~(13)绘制Se(Ⅳ)和Pi的pH-形态分布图(图 5).
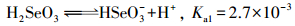
|
(9) |
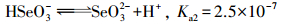
|
(10) |
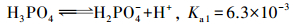
|
(11) |
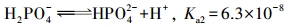
|
(12) |
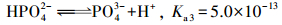
|
(13) |
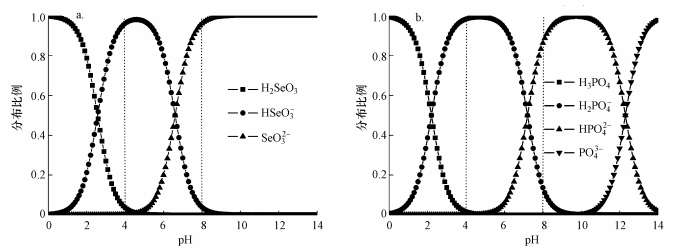 |
| 图 5 不同pH条件下Se(Ⅳ)(a)和Pi(b)的形态分布 Fig. 5 Distributions of forms for selenite(a) and phosphate(b) at the different pH values |
当体系的pH从4升高到8时, Se(Ⅳ)的主要形态由HSeO3-变为SeO32-, Pi的主要形态由H2PO4-变为HPO42-;此外, MOF-Fe表面的负电荷量也逐渐升高(王锐等, 2018a).可见, 体系pH的升高可导致MOF-Fe与Se(Ⅳ)之间的静电排斥作用增大, 因此, Qe呈降低的趋势.与Pi/Se=0体系相比, Pi/Se=1体系中MOF-Fe对Se(Ⅳ)的Qe随着pH升高而降低的趋势更明显.其原因可能包括:①在pH为4~8范围内, 相同pH条件下, [HPO42-]/[H2PO4-]低于[SeO32-]/[HSeO3-], 因此, Pi的负电荷量低于Se(Ⅳ)的负电荷量;升高pH导致MOF-Fe对Pi的吸附影响较小而对Se(Ⅳ)的影响较大, 因而增强了Pi对Se(Ⅳ)在MOF-Fe上的吸附竞争力.②升高pH后, H2PO4-向HPO42-转化, 导致Pi与MOF-Fe形成的吸附复合物由单齿单核结构转向双齿单核结构(Arai et al., 2001);与单齿单核结构相比, 双齿单核结构的吸附复合物占据的MOF-Fe活性吸附位点更多.
3.5 Pi浓度对MOF-Fe吸附Se(Ⅳ)的影响在不同Pi浓度条件下, MOF-Fe对Se(Ⅳ)的平衡吸附量见图 6.Se(Ⅳ)初始浓度为1.27 mmol·L-1时, 当Pi初始浓度由0 mmol·L-1增大到6.51 mmol·L-1, MOF-Fe对Se(Ⅳ)的平衡吸附量Qe快速降低, 并且Qe的降低程度随着Pi浓度的增大而逐渐减缓, 最终趋向于一个恒定值, 这说明Pi与Se(Ⅳ)之间尽管存在竞争性吸附关系, 但Pi却无法完全取代MOF-Fe对Se(Ⅳ)的吸附.
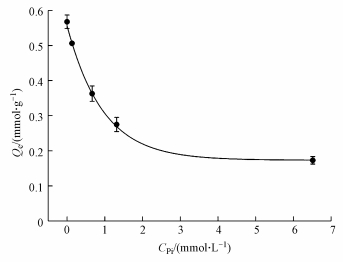 |
| 图 6 不同Pi浓度条件下MOF-Fe对Se(Ⅳ)的平衡吸附量 Fig. 6 The amount of selenite adsorbed on MOF-Fe at Pi with different concentration |
现针对Pi共存条件下MOF-Fe对Se(Ⅳ)的吸附做以下假设:①MOF-Fe对Se(Ⅳ)的吸附分为可逆吸附和不可逆吸附两类;②MOF-Fe对Se(Ⅳ)的可逆吸附可被Pi竞争性取代, MOF-Fe对Se(Ⅳ)的不可逆吸附无法被Pi取代;③Pi竞争性取代MOF-Fe对Se(Ⅳ)的可逆吸附量与Pi的初始浓度相关.由于吸附剂对离子性吸附质的可逆吸附与氢键、静电吸引、分子间的作用力及热运动密切相关, 刘洪国等(2016)研究的吸附剂固/液界面扩散双电层模型指出, 双电层中的电荷离子服从玻尔兹曼分布;而静电力等分子间作用力也服从玻尔兹曼能量分布定律.此外, 分子热运动同样遵循玻尔兹曼分布规律.因此, 根据上述假设及玻尔兹曼分布, 本研究自建指数模型对图 6中Qe与CPi的变化趋势进行拟合, 模型方程见式(14).
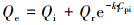
|
(14) |
式中, Qe为MOF-Fe对Se(Ⅳ)的平衡吸附量(mmol·g-1);Qi为MOF-Fe对Se(Ⅳ)的不可逆平衡吸附量(mmol·g-1);Qr为MOF-Fe对Se(Ⅳ)的可逆平衡吸附量(mmol·g-1);kr为Pi对Se(Ⅳ)的竞争性因子, 其大小与MOF-Fe对Pi和Se(Ⅳ)的吸附亲和力有关;CPi为体系中Pi的初始浓度(mmol·L-1).
MOF-Fe吸附Se(Ⅳ)的Qe与Pi浓度的拟合曲线见图 6.拟合结果中R2为0.9983, 可见指数模型(式(14))与实验结果吻合度较高.这表明可以用指数模型(式(14))对不同Pi浓度下MOF-Fe吸附Se(Ⅳ)的Qe进行拟合.拟合得到的Qi和Qr分别为0.17 mmol·g-1和0.39 mmol·g-1, 即MOF-Fe对Se(Ⅳ)的不可逆平衡吸附量和可逆平衡吸附量的比例为3:7.此外, 式(14)的拟合结果显示, 在MOF-Fe吸附Se(Ⅳ)的体系中, Pi对Se(Ⅳ)在MOF-Fe上吸附的竞争性因子kr为1.06.根据文献(Sposito, 2008), 常见无机含氧阴离子酸根的活性顺序为:NO3- < SO42-≈SeO42- < CO32- < SeO32-≈PO43-, 这说明Pi对MOF-Fe的吸附亲和力可能略高于Se(Ⅳ)对MOF-Fe的吸附亲和力, 即Pi与Se(Ⅳ)在MOF-Fe上的吸附亲和力的比值可能为略高于1的常数.因此, 式(14)中的吸附竞争因子kr的数值可表示为Pi与Se(Ⅳ)对MOF-Fe吸附剂的亲和力的比值.
4 结论(Conclusions)本文研究了Pi/Se=0和1两种体系中MOF-Fe对Se(Ⅳ)的吸附特性, 结果表明, 与Pi/Se=0体系相比, Pi/Se=1体系中MOF-Fe对Se(Ⅳ)的等温吸附数据更适合用Frenudlich模型拟合, Langmuir模型拟合的最大吸附容量降低了68%, 而吸附亲和力和吸附异质性都明显增强;Pi/Se=1体系中MOF-Fe对Se(Ⅳ)的平衡吸附时间明显缩短, 其二级动力学吸附速率常数显著增大.可见, Pi的共存降低了MOF-Fe对Se(Ⅳ)的平衡吸附容量, 却增大了其吸附速率.在Pi/Se=0和1两种体系中, MOF-Fe对Se(Ⅳ)的吸附过程都服从二级动力学方程, 吸附反应的速率控制步骤都为液膜扩散和内扩散过程.吸附温度从15 ℃升高至35 ℃时, 两种体系中MOF-Fe对Se(Ⅳ)的平衡吸附量都有所减少, 其中, Pi/Se=1体系中的平衡吸附量受温度影响更大, 表明升高温度增强了Pi对Se(Ⅳ)在MOF-Fe上的竞争吸附作用.两种体系中吸附反应的ΔGθ和ΔHθ都为负值, ΔSθ都为正值, 说明MOF-Fe对Se(Ⅳ)的吸附都为自发放热吸附, 吸附作用使固-液界面的无序度增大.与Pi/Se=0体系相比, Pi/Se=1体系中吸附反应的ΔGθ有所升高, 而ΔHθ和ΔSθ均显著降低, 说明Pi共存时导致了MOF-Fe对Se(Ⅳ)的化学吸附贡献增强.当pH从4.0升高至8.0时, Pi/Se=0和1体系中MOF-Fe对Se(Ⅳ)的平衡吸附量都有所降低, 其中, Pi/Se=1体系中的平衡吸附量降低程度更大, 表明升高pH也增强了Pi对样品吸附Se(Ⅳ)的抑制效应.Pi/Se=1体系中, 随着Pi的浓度增大, MOF-Fe对Se(Ⅳ)的平衡吸附量呈指数模型降低;MOF-Fe对Se(Ⅳ)的吸附作用可分为可逆和不可逆吸附, 二者对总的平衡吸附量的贡献比例约为7:3, 且可逆吸附受Pi的竞争作用而明显降低, 而不可逆吸附则不受共存Pi的影响.
Ajmal Z, Muhmood A, Usman M, et al. 2018. Phosphate removal from aqueous solution using iron oxides:adsorption, desorption and regeneration characteristics[J]. Journal of Colloid and Interface Science, 528: 145–155.
DOI:10.1016/j.jcis.2018.05.084
|
Arai Y, Sparks D L. 2001. ATR-FTIR spectroscopic investigation on phosphate adsorption mechanisms at the ferrihydrite-water interface[J]. Journal of Colloid and Interface Science, 241(2): 317–326.
DOI:10.1006/jcis.2001.7773
|
Blanchard G, Maunaye M, Martin G. 1984. Removal of heavy metals from waters by means of natural zeolites[J]. Water Research, 18(12): 1501–1507.
DOI:10.1016/0043-1354(84)90124-6
|
Constantino L V, Quirino J N, Monteiro A M, et al. 2017. Sorption-desorption of selenite and selenate on Mg-Al layered double hydroxide in competition with nitrate, sulfate and phosphate[J]. Chemosphere, 181: 627–634.
DOI:10.1016/j.chemosphere.2017.04.071
|
Fernández-Martínze A, Charlet L. 2009. Selenium environmental cycling and bioavailability:a structural chemist point of view[J]. Reviews in Environmental Science and Bio/Technology, 8(1): 81–110.
|
Freitas A F, Mendes M F, Coelho G L V. 2007. Thermodynamic study of fatty acids adsorption on different adsorbents[J]. The Journal of Chemical Thermodynamics, 39(7): 1027–1037.
DOI:10.1016/j.jct.2006.12.016
|
Freundlich H M F. 1906. Uber die adsorption in lasungen[J]. Journal of Physical Chemistry, 57: 385–470.
|
Guesh K, Caiuby C A D, Mayoral Á, et al. 2017. Sustainable preparation of MIL-100(Fe) and its photocatalytic behavior in the degradation of methyl orange in water[J]. Crystal Growth & Design, 17(4): 1806–1813.
|
Guo X, Feng Y R, Ma L, et al. 2017. Phosphoryl functionalized mesoporous silica for uranium adsorption[J]. Applied Surface Science, 402: 53–60.
DOI:10.1016/j.apsusc.2017.01.050
|
国家环境保护总局.2002.GB 3838-2002地表水环境质量标准[S].北京: 国家质量监督检验检疫总局
|
Holmes A B, Gu F X. 2016. Emerging nanomaterials for the application of selenium removal for wastewater treatment[J]. Environmental Science-Nano, 3(5): 982–996.
DOI:10.1039/C6EN00144K
|
Howarth A J, Katz M J, Wang T C, et al. 2015. High efficiency adsorption and removal of selenate and selenite from water using metal-organic frameworks[J]. Journal of the American Chemical Society, 137(23): 7488–7484.
DOI:10.1021/jacs.5b03904
|
Ju W, Li X, Li Z, et al. 2017. The effect of selenium supplementation on coronary heart disease:A systematic review and meta-analysis of randomized controlled trials[J]. Journal of Trace elements in Medicine and Biology, 44: 8–16.
DOI:10.1016/j.jtemb.2017.04.009
|
Jun J W, Tong M M, Jung B K, et al. 2015. Effect of central metal ions of analogous metal-organic frameworks on adsorption of organoarsenic compounds from water:Plausible mechanism of adsorption and water Purification[J]. Chemistry-A European Journal, 21(1): 347–354.
|
Khare N, Martin J D, Hesterberg D. 2007. Phosphate bonding configuration on ferrihydrite based on molecular orbital calculations and XANES fingerprinting[J]. Geochimica et Cosmochimica Acta, 71(18): 4405–4415.
DOI:10.1016/j.gca.2007.07.008
|
Krishna B S, Murty D S R, Jai Prakash B S. 2000. Thermodynamics of chromium(Ⅵ) anionic species sorption onto surfactant-modified montmorillonite clay[J]. Journal of Colloid and Interface Science, 229(1): 230–236.
DOI:10.1006/jcis.2000.7015
|
Kumar P, Pournara A, Kim K H, et al. 2017. Metal-organic frameworks:Challenges and opportunities for ion-exchange/sorption applications[J]. Progress in Materials Science, 86: 25–74.
DOI:10.1016/j.pmatsci.2017.01.002
|
Lagergren S. 1898. About the theory of so-called adsorption of soluble substances[J]. Kungliga Svenska Vetenskapsakademies Handlingar, 24(4): 1–39.
|
Langmuir I. 1918. The adsorption of gases on plane surfaces of glass, mica and platinum[J]. Journal of the American Chemical Society, 40(9): 1361–1403.
DOI:10.1021/ja02242a004
|
Li J, Wang X X, Zhao G X, et al. 2018. Metai-organic framework-based materials:Superior adsorbents for the capture of toxic and radioactive metal ions[J]. Chemical Society Reviews, 47(7): 2322–2356.
DOI:10.1039/C7CS00543A
|
Lim Y S, Kim K H. 2017. Isotherm, kinetic and thermodynamic studies on the adsorption of 13-dehydroxybaccatin Ⅲ from Taxus chinensis onto Sylopute[J]. The Journal of Chemical Thermodynamics, 115: 261–268.
DOI:10.1016/j.jct.2017.08.009
|
Liu G H, Zhang Z H, Yan C, et al. 2018. Adsorption of estrone with few-layered boron nitride nanosheets:Kinetics, thermodynamics and mechanism[J]. Chemosphere, 207: 534–542.
DOI:10.1016/j.chemosphere.2018.05.129
|
刘洪国, 孙德军, 郝京诚. 2016. 新编胶体与界面化学[M]. 北京: 化学工业出版社.
|
Schröder M. 2010. Functional Metal-Organic Frameworks:Gas Storage, Separation and Catalysis[M]. Berlin Heidelberg: Springer-Verlag.
|
Milonjić S K. 2007. A consideration of the correct calculation of thermodynamic parameters of adsorption[J]. Journal of the Serbian Chemical Society, 72(12): 1363–1367.
DOI:10.2298/JSC0712363M
|
牛鹏举, 魏世勇, 方敦, 等. 2016. 高岭石、针铁矿及其二元体对胡敏酸的吸附特性[J]. 环境科学, 2016, 37(6): 2220–2228.
|
Rahimi E, Mohaghegh N. 2016. Removal of toxic metal ions from sungun acid rock drainage using mordenite zeolite, graphene nanosheets, and a novel metal-organic framework[J]. Mine Water and the Environment, 35(1): 18–28.
DOI:10.1007/s10230-015-0327-7
|
Santos S, Ungureanu G, Boaventura R, et al. 2015. Selenium contaminated waters:An overview of analytical methods, treatment options and recent advances in sorption methods[J]. Science of the Total Environment, 521-522: 246–260.
DOI:10.1016/j.scitotenv.2015.03.107
|
Schiavon M, Ertani A, Parrasia S, et al. 2017. Selenium accumulation and metabolism in algae[J]. Aquatic Toxicology, 189: 1–8.
DOI:10.1016/j.aquatox.2017.05.011
|
Song G Q, Wang Z Q, Wang L, et al. 2014. Preparation of MOF(Fe) and its catalytic activity for oxygen reduction reaction in an alkaline electrolyte[J]. Chinese Journal of Catalysis, 35(2): 185–195.
|
Sposito G. 2008. The Chemistry of Soils(2nh ed)[M]. New York: Oxiford University Press.
|
Tran H N, You S J, Chao H P. 2016. Thermodynamic parameters of cadmium adsorption onto orange peel calculated from various methods:A comparison study[J]. Journal of Environmental Chemical Engineering, 4(3): 2671–268.
DOI:10.1016/j.jece.2016.05.009
|
Tran H N, You S J, Hosseini-Bandegharaei A, et al. 2017. Mistakes and inconsistencies regarding adsorption of contaminants from aqueous solutions:A critical review[J]. Water Research, 120: 88–116.
DOI:10.1016/j.watres.2017.04.014
|
Walter W J. 1984. Evolution of a Technology[J]. Journal of Environmental Engineering, 110(5): 899–917.
DOI:10.1061/(ASCE)0733-9372(1984)110:5(899)
|
王锐, 许海娟, 魏世勇, 等. 2018a. MOF-Fe吸附Se(Ⅳ)的特性与机制研究[J]. 环境科学学报, 2018a, 38(8): 3127–3137.
|
王锐, 龚勇, 许海娟, 等. 2018b. 不同调节剂制备MOF-Fe的性质及对Se(Ⅳ)的吸附性能[J]. 无机化学学报, 2018b, 34(5): 906–916.
|
Weber W J, Morris J C. 1963. Kinetics of adsorption on carbon from solution[J]. Journal of the Sanitary Engineering Division, 89: 31–60.
|
Winkel L H, Johnson C A, Lenz M, et al. 2011. Environmental selenium research:from microscopic processes to global understanding[J]. Environmental Science & Technology, 46(2): 571–579.
|
Zhao H S, Robert S. 2001. Competitive adsorption of phosphate and arsenate on goethite[J]. Environmental Science & Technology, 35(24): 4753–4757.
|
 2019, Vol. 39
2019, Vol. 39


