2. 永清环保股份有限公司上海分公司, 上海 200051
2. Branch of Shanghai, Yonker Environmental Protection Co., Ltd, Shanghai 200051
土壤稳定化技术因具有处理速度快、费用较低、易于操作实施等特点而被广泛用于重金属污染土壤修复.浸出毒性测试是目前用于土壤重金属稳定化处理效果评估的主要测试方法, 常用测试方法包括美国TCLP测试及我国的HJ/T 299—2007、HJ/T 300-200等方法(卢聪等, 2013).然而, 单一浸出测试评估难以满足稳定化处理后土壤多样化用途的要求(张琢等, 2015).稳定化修复改变了重金属在土壤中的赋存形态, 但并没有减少重金属在土壤中的总量(Lee et al., 2009), 浸出毒性测试只是反映了在模拟条件下重金属浸出量的变化, 不能准确反映土壤处理后重金属生物有效性与毒性特征, 因此, 难以有效指导土壤的安全性评估与资源化利用.
蚯蚓作为土壤环境指示生物的研究, 起源于20世纪40~50年代, 因其与土壤接触密切, 在生态系统的食物链中担负着物质传递的重要功能, 且对土壤中外源性污染物非常敏感(高岩等, 2005), 所以赤子爱胜蚓(Eisenia fetida)毒理试验被广泛用于土壤生态环境监测和生物毒性评价, 并形成了相关的国际标准化测试方法(ISO, 1993;1998;OECD, 1984;2004), 并在生态安全风险中监测被广泛使用(邱江平, 1999).采用蚯蚓监测土壤污染, 可以为整个土壤动物体系提供相对安全的污染浓度阈值.
本研究选择某电镀厂铬(Cr)污染土壤, 利用多硫化钙(Calcium Polysulfide, CPS)进行稳定化处理, 然后以赤子爱胜蚓作为指示生物, 研究赤子爱胜蚓暴露于CPS稳定化处理的Cr污染土壤中的致死效应、回避率、皮肤损伤及总Cr在其体内的富集等情况, 以期为稳定化处理后土壤的安全性评估与资源化利用提供科学依据.
2 材料与方法(Materials and methods) 2.1 实验材料和仪器Cr污染土壤采自福州市某电镀厂, 土壤中Cr(Ⅵ)含量为1587 mg·kg-1, 总Cr含量为1876 mg·kg-1.干净土壤采自无污染的福州市土壤.本研究以投加稳定化药剂CPS与土壤中Cr(Ⅵ)的物质的量比分别为0、1、1.5、3、4和5的土壤为样品, 分别将500 g稳定化处理的土壤装入高11 cm、直径18 cm的干净塑料盆中用于后续暴毒实验(Coller-Myburgh et al., 2014).
赤子爱胜蚓购于上海市金山区枫泾镇特种蚓场.赤子爱胜蚓在实验前放入干净的土壤中, 定期投加腐熟的牛粪, 于(20 ± 2) ℃的温室条件下自然光照(12 h光照和12 h黑暗为一个循环)驯化培养28 d左右.暴露实验中所使用的赤子爱胜蚓均具有明显生殖环带,大小保持一致, 体重为(0.61±0.14) g.
实验所用试剂:CH3CH2OH、H2SO4、HF、HCl等均购于上海泰坦科技有限公司, 为优级纯(GR);CPS购于连云港兰星工业技术有限公司, 主要成分为CaS5(质量分数29%).
主要实验设备:冷冻干燥仪(FD-10-50, 北京博弈康实验仪器有限公司), 微波消解仪(ETHOS ONE-41, 意大利Milestone有限公司), 原子吸收光谱仪AAS(Nov AA400, Analytik Jena AG), 真空扫描式电子显微镜(JSM-6360LV, 日本JEOL公司).
2.2 土壤理化性质pH值测定参照NY/T 1377—2007, 阳离子交换量(CEC)测定参照EPA Method 9081, 土壤粒径分布参照ASTM D422.
2.3 急性致死毒性实验急性致死毒性实验参照OECD 207, 蚯蚓暴露前放入铺有湿润滤纸的培养皿中清肠24 h, 用0.9%的生理盐水冲洗蚯蚓表面并用滤纸擦干.将20条蚯蚓分别放入维持相对湿度的CPS稳定化处理的Cr污染土壤和加入相同剂量梯度稳定化药剂CPS的干净土壤中暴毒, 分别于第1、3、5和7 d测定其致死率, 认为对机械刺激无反应的蚯蚓为死亡.每组设置4个平行.
2.4 蚯蚓回避实验蚯蚓回避行为实验采用国际标准化组织ISO 2007推荐的二室法.选用20 cm×10 cm×7 cm的透明塑料盒, 中间插入一块挡板, 一边分别放入500 g的实验土壤, 另一边放入等量未经污染的干净土壤.取出挡板, 于中线放入10条蚯蚓, 用纱布固定封口保证蚯蚓的正常呼吸并防止其逃逸.培养48 h后将挡板插回原位, 以蚯蚓头部指向位置为准, 分别计数两边土壤中蚯蚓的数目.每组设置10个平行.蚯蚓的回避率计算公式如下所示:
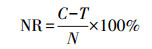
|
(1) |
式中, NR为蚯蚓净回避率;C为对照组土壤中蚯蚓的条数;T为实验组中蚯蚓的条数;N为加入蚯蚓的总条数.
2.5 皮肤损伤蚯蚓暴毒3 d后取出清肠24 h, 用0.9%的生理盐水清洗干净后置于铺有湿润滤纸的培养皿中.在每个培养皿中滴加4%的戊二醛溶液固定30 min, 之后用1 mL的PBS缓冲液清洗干净, 再分别用50%、70%、90%和100%的乙醇溶液进行逐步脱水, 中间每次间隔10 min.之后加入乙酸异戊酯置换10 min, 在真空干燥箱中干燥后喷金, 用真空扫描式电子显微镜观察拍照(谢显传, 2010).
2.6 蚯蚓体内重金属富集于暴毒第5 d取出活体蚯蚓样品, 清肠24 h后冷冻干燥、研磨.分别称取0.2 g蚯蚓样品, 加入HNO3:HCl:HF(9:3:3, 体积比)并放入微波消解仪中消解蚯蚓样品(Yirsaw et al., 2016).消解结束后取出转移至聚乙烯坩埚中, 于180 ℃的电热板上加热赶酸, 至坩埚内仅有少量液体后冷却, 用1%的HNO3清洗后通过0.22 μm的滤膜过滤, 用AAS检测分析样品中总Cr含量.每组设置4个平行.
2.7 数据处理方法本研究中的实验数据均取实验结果的平均值±标准误差, 利用Origin 8.1和Excel 2013软件对实验所得数据进行处理和制图, SPSS软件进行显著性差异分析, 采用Duncan进行多重比较, 不同字母表示差异显著, p < 0.05.
3 结果与分析(Results and analysis) 3.1 Cr污染土壤稳定化处理和稳定化药剂CPS对赤子爱胜蚓的致死率赤子爱胜蚓在稳定化处理的Cr污染土壤中的致死情况如图 1a所示.未经稳定化处理的Cr污染土壤中, 蚯蚓在暴露1 d时的致死率为21.7%.经不同剂量CPS稳定化处理后, 在暴毒阶段初期, CPS投加比分别为1、1.5和3的Cr污染土壤中蚯蚓的致死率显著低于未经稳定化处理的Cr污染土壤(p < 0.05), 但在CPS投加比分别为4和5的Cr污染土壤中蚯蚓的致死率达到了100%, 表明高浓度稳定化药剂CPS对蚯蚓有明显的毒性作用.在7 d的暴毒期结束后, 供试土壤中蚯蚓全部死亡, 这可能是由于蚯蚓接触土壤中的重金属Cr及与稳定化药剂CPS的联合毒性作用所致.本研究中污染土壤的Cr(Ⅵ)含量为1587 mg·kg-1, 总Cr含量为1876 mg·kg-1, 其含量分别远远大于文献所报道的Cr(Ⅵ)和Cr(Ⅲ)对赤子爱胜蚓的半数致死剂量222~257 mg·kg-1和1656~1902 mg·kg-1 (Sivakumar et al., 2005).稳定化处理技术是通过稳定化药剂CPS将土壤中的Cr(Ⅵ)还原为Cr(Ⅲ), 即便修复效率高可以将Cr(Ⅵ)全部还原, 然而由于污染土壤中Cr(Ⅲ)含量高达1876 mg·kg-1, 对蚯蚓仍然具有较强的生物毒性.稳定化修复技术适用于一定含量范围的重金属污染土壤, 高含量重金属污染土壤稳定化后对蚯蚓仍有明显的生物毒性.
 |
| 图 1 不同投加量稳定化药剂CPS处理Cr污染土壤对赤子爱胜蚓的致死率(a.Cr污染土壤稳定化处理对赤子爱胜蚓死亡率的影响, b.稳定化药剂CPS胁迫下赤子爱胜蚓的死亡率) Fig. 1 Mortality of Eisenia fetida exposed to soils selected from polluted and non-polluted areas all added with various molar rations of CPS (a.Eisenia fetida are exposed to polluted soils stabilized by different dosage of CPS, b. Eisenia fetida are exposed to non-polluted soils which added the same dosage of the CPS as the polluted soil) |
未污染土壤中投加与稳定化处理Cr污染土壤中相同剂量的CPS对赤子爱胜蚓的致死情况如图 1b所示.实验结果显示, 蚯蚓在未投加稳定化药剂CPS的土壤中无致死现象出现, 在投加稳定化药剂CPS的其他实验组中出现致死现象, 在暴毒第7 d时, CPS投加量与稳定化处理Cr污染土壤中稳定化药剂投加比为5相同时的致死率达到100%, 随着稳定化药剂CPS投加量的增加, 蚯蚓的致死率逐渐升高, 且蚯蚓的致死效应随着暴露时间的增加而增强.因此, 若投加过量的CPS, 会对蚯蚓造成更大的毒性效应.
尽管选用CPS作为稳定化药剂处理供试土壤可满足我国国家浸出标准要求(卢鑫等, 2017), 且CPS修复后的土壤在不同场景下具有一定的长期稳定性(刘馥雯等, 2018).然而, 稳定化修复后的土壤对蚯蚓仍然具有一定的生物毒性.稳定化药剂CPS与土壤中Cr(Ⅵ)反应生成氢氧化铬和硫单质(Chrysochoou et al., 2010), 这两种反应产物对蚯蚓具有一定的毒性作用.另外, CPS属于一种农药, 过量的CPS可能在潮湿的条件下与土壤中其他物质发生反应, 产生硫化氢气体, 刺激蚯蚓的皮肤及呼吸系统.因此, 在稳定化修复过程中, 稳定化药剂与土壤中重金属作用生成的副产物也应引起关注, 稳定化药剂CPS的投加量必须控制在合适的范围内, 否则修复后会增加对土壤生物的毒性作用.
3.2 Cr污染土壤稳定化处理对赤子爱胜蚓形态变化的影响赤子爱胜蚓在稳定化处理的Cr污染土壤中的形态变化如图 2所示.暴露的蚯蚓表现出不同程度的受损症状, 在暴露实验初期, 蚯蚓出现了卷曲和黄色体液渗出.随着暴露时间的增加, 蚯蚓出现了其他的中毒症状, 生殖环带肿大和在蚯蚓躯体后端出现断尾、尾部串珠的情况.稳定化处理的Cr污染土壤对蚯蚓形态的影响记录共7 d, 在实验结束时, 多数蚯蚓死亡在供试土壤表层并发生身体变粘、自溶的现象, 推测是蚯蚓通过过度分泌粘液引起运动迟缓和掘穴能力减弱, 随后蚯蚓由于自身的能量短缺将自己的组织转化为供能体.Nusair等(2017)研究表明, 蚯蚓暴露在PCDD/Fs下48 h后其机体本身会出现自溶现象, 这是由于蚯蚓本身代谢分解使其能量储备完全消耗而导致自溶的现象.在本研究中, 没有Cr污染的对照组土壤中生存的蚯蚓无上述现象发生, 并且具有良好的掘穴能力.表明Cr污染土壤经过稳定化处理后蚯蚓具有肉眼可见的中毒症状, 可见稳定化修复后的土壤对蚯蚓仍然具有较强的毒性作用.
 |
| 图 2 Cr污染土壤稳定化处理对赤子爱胜蚓形态的影响(a.正常, b.卷曲, c.黄色体液渗出, d.断尾、尾部串珠状, e.生殖环带肿大, f.身体变粘、自溶) Fig. 2 Morphology of Eisenia fetida exposed to soils stabilized with CPS (a.normal earthworm, b.curly earthworm, c.extrusion of coelomic fluid resulting in earthworm bloody lesions, d.disappearances of metameric segmentation appeared at the posterior end of the exposed earthworm, e.constriction and swelling started appearing in the anterior regions of the exposed earthworms, f.earthworm autolysis of its own tissue) |
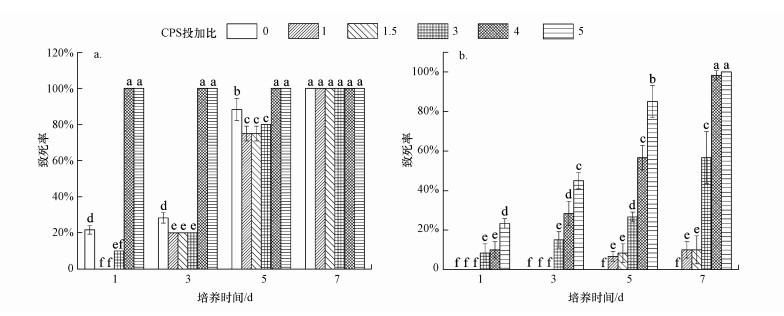
赤子爱胜蚓在稳定化处理的Cr污染土壤中的回避率(NR)如图 3所示.在未经稳定化处理的Cr污染土壤、稳定化药剂CPS投加比分别为4和5的实验土壤中, 蚯蚓的回避率均达到100%且无误差出现.稳定化药剂CPS投加比分别为1、1.5和3的实验土壤中, 经过48 h的暴露, 蚯蚓的回避率分别为93.3%、90.0%和83.3%, 均高于80%.当回避率NR值高于80%时, 表明蚯蚓对污染物具有明显的回避效应, 此场景不适合蚯蚓的生存(Udovic et al., 2010).有研究表明, 土壤理化性质会对回避率的结果造成影响, 土壤在中性条件下最适合蚯蚓的生存(Amorim et al., 2008).在本研究中, 供试土壤的pH范围在5~10之间(表 1), 稳定化药剂CPS投加比分别为1、1.5和3时, pH分别为6.41、7.40和7.90, 最接近中性条件, 而投加比分别为4和5时, pH分别为8.93和9.90, 修复后土壤pH增高也可能影响蚯蚓的回避选择.
 |
| 图 3 Cr污染土壤稳定化处理对赤子爱胜蚓回避率的影响 Fig. 3 Avoidance responses of Eisenia fetida exposed to soils stabilized with CPS |
| 表 1 Cr污染土壤稳定化处理后土壤的理化性质 Table 1 Selected pedological properties in soil stabilized with CPS |
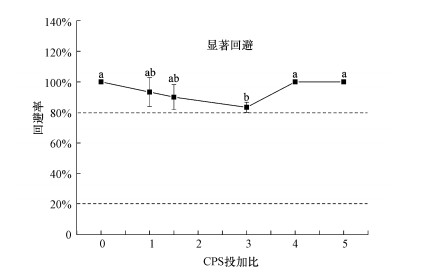
赤子爱胜蚓在稳定化处理第3 d的Cr污染土壤中的皮肤扫描电镜结果如图 4所示.图 4a为对照组中正常蚯蚓的皮肤情况, 皮肤表面光滑紧凑的组织良好且无裂痕.但在稳定化处理的Cr污染土壤中, 蚯蚓皮肤表面受到了不同程度的损害(图 4c~4h), 皮肤表面出现不规则的褶皱和裂纹、异常组织增生、角质层变厚、刚毛断裂及脱水等现象.未经稳定化处理的Cr污染土壤中蚯蚓的皮肤损伤(图 4b)比稳定化修复后Cr污染土壤中生存的蚯蚓更为严重.Zhang等(2016)研究表明, 蚯蚓体壁外侧的角质层具有一定的保护功能, 接触到污染物后会启动机体自身对外界污染物的防御机制自动增厚.外源污染物会对蚯蚓皮肤造成损伤, 进而会影响其呼吸和运动行为, 导致蚯蚓机体的活动能力减弱和其他功能缺失, 使其丧失掘穴能力.这也从另外一方面证实了蚯蚓死亡于土壤表面的原因.
 |
| 图 4 Cr污染土壤稳定化处理第3 d时赤子爱胜蚓皮肤扫描电镜的变化(a.对照组, 100×;b.铬污染土壤稳定化处理前, 1000×;c~h:铬污染土壤稳定化处理后(c. CPS投加比为1, 1000×;d. CPS投加比为1.5, 1000×;e.CPS投加比为3, 100×;f. CPS投加比为4, 100×;g.CPS投加比为5, 1500×;h. CPS投加比为5, 400×) Fig. 4 Skin examination of Eisenia fetida exposed to soils stabilized with CPS on 3rd day (a. represented the control, 100×; b. represented the damage of Eisenia fetida in the non-remediated soils, 1000×; c~h represented the damage of Eisenia fetida in the soil remediated by the molar ration of CPS (c. CPS to Cr(Ⅵ) was 1, 1000×; d. CPS to Cr(Ⅵ) was 1.5, 1000×; e. CPS to Cr(Ⅵ) was 3, 100×; f. CPS to Cr(Ⅵ) was 4, 100×; g. CPS to Cr(Ⅵ) was 5, 1500×; h. CPS to Cr(Ⅵ) was 5, 400×) |
由于Cr污染土壤及稳定化处理土壤中总Cr含量均很高, 在很短的时间内对蚯蚓的皮肤产生损害作用, 认为污染物会通过蚯蚓的皮肤扩散吸收.一般来说, 蚯蚓对污染物的富集是通过真皮扩散及主动摄食吸收的过程, Vijver等(2003)对蚯蚓进行了封口实验, 在蚯蚓暴毒第6 d时发现, 未被封口的蚯蚓与被封口的蚯蚓对重金属(Cd、Cu和Pb)的富集量基本相同, 表明重金属主要通过蚯蚓的皮肤途径富集.本研究中蚯蚓皮肤损伤严重是由于蚯蚓通过皮肤进行污染物质的代谢.且有研究表明, 高浓度的重金属Pb会损害细胞膜, 穿透蚯蚓的皮肤组织, 进而加速污染物的渗透过程(Zhang et al., 2014).重金属Cr对生物细胞具有较强的穿透性, 可被碳酸盐、硫酸盐或磷酸盐载体转运入细胞, 破坏生物细胞的结构, 使得生物发生组织破坏、机体损伤, 进而加速污染物的扩散.
3.5 赤子爱胜蚓体内总Cr的富集Cr污染土壤稳定化处理后蚯蚓暴露第5 d时其体内总Cr含量如图 5所示.结果显示, 暴露5 d后, 未经稳定化处理的蚯蚓体内总Cr含量高达91.94 mg·kg-1, 投加稳定化药剂CPS会显著影响蚯蚓体内总Cr的富集(p > 0.05), 稳定化药剂CPS投加比分别为1、1.5和3时, 蚯蚓体内总Cr含量分别为33.9、27.7和20.9 mg·kg-1.稳定化药剂CPS可有效降低重金属Cr的生物有效性, 减少总Cr在蚯蚓体内的赋存.Tica等(2013)研究显示, 稳定剂可有效减少土壤中重金属的可移动态形式.Cr污染土壤经CPS稳定化处理后其可交换态含量显著降低.在未经稳定化处理的Cr污染土壤中可交换态Cr占比为4.38%, 经过CPS稳定化处理后, 当稳定化药剂投加比由0.75增加到5时, 可交换态Cr保持在0.3%左右(卢鑫等, 2017).
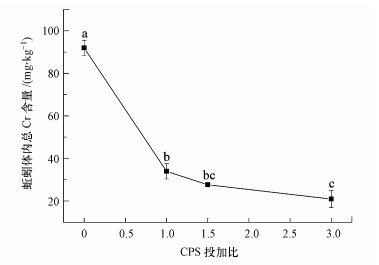 |
| 图 5 Cr污染土壤稳定化处理后赤子爱胜蚓暴露第5 d体内总Cr含量 Fig. 5 The accumulation of total Cr in Eisenia fetida on the 5th day |
1) 高剂量铬污染土壤利用CPS进行稳定化处理后仍具有显著的生物毒性.对于CPS与土壤中Cr(Ⅵ)投加比为3的土壤, 处理后土壤的浸出毒性虽满足浸出标准, 但对蚯蚓的7 d致死效应和回避率分别高达100%和83.3%, 在暴毒第5 d时蚯蚓体内总Cr含量为20.9 mg·kg-1.
2) 稳定化药剂CPS对蚯蚓具有一定的生物毒性, 蚯蚓的致死效应随着CPS投加量的增加而增大, 处理后土壤对赤子爱胜蚓的毒性效应增加, 在稳定化处理时应控制合理的药剂投加量.
3) 赤子爱胜蚓的致死率和外部形态变化是评估CPS稳定化处理Cr污染土壤的生物毒性的敏感指标, 可用于快速评估稳定化处理土壤的安全性与生态毒性.
Amorim M J, Novais S, Römbke J, et al. 2008. Avoidance test with Enchytraeus albidus (Enchytraeidae):Effects of different exposure time and soil properties[J]. Environmental Pollution, 155(1): 112–116.
DOI:10.1016/j.envpol.2007.10.028
|
Chrysochoou M, Ferreira D R, Johnston C P. 2010. Calcium polysulfide treatment of Cr(Ⅵ)-contaminated soil[J]. Journal of Hazardous Materials, 179(1): 650–657.
|
Coller-Myburgh C V, Rensburg L V, Maboeta M. 2014. Utilizing earthworm and microbial assays to assess the ecotoxicity of chromium mine wastes[J]. Applied Soil Ecology, 83: 258–265.
DOI:10.1016/j.apsoil.2013.09.004
|
高岩, 骆永明. 2005. 蚯蚓对土壤污染的指示作用及其强化修复的潜力[J]. 土壤学报, 2005, 42(1): 140–148.
DOI:10.3321/j.issn:0564-3929.2005.01.022 |
刘馥雯, 罗启仕, 卢鑫, 等. 2018. 多硫化钙对铬污染土壤处理效果的长期稳定性研究[J]. 环境科学学报, 2018, 38(5): 1999–2007.
|
卢聪, 李青青, 罗启仕, 等. 2013. 场地土壤中有效态砷的稳定化处理及机理研究[J]. 中国环境科学, 2013, 33(2): 298–304.
DOI:10.3969/j.issn.1000-6923.2013.02.016 |
卢鑫, 罗启仕, 刘馥雯, 等. 2017. 硫化物对电镀厂铬污染土壤的稳定化效果及其机理研究[J]. 环境科学学报, 2017, 37(6): 2315–2321.
|
Lee S H, Lee J S, Choi Y J, et al. 2009. In situ stabilization of cadmium-, lead-, and zinc-contaminated soil using various amendments[J]. Chemosphere, 77(8): 1069–1075.
DOI:10.1016/j.chemosphere.2009.08.056
|
Nusair S D, Zarour Y S A, Altarifi A A. 2017. Effects of dibenzo-p-dioxins/dibenzofurans on acetylcholinesterase activity and histopathology of the body wall of Earthworm Eisenia andrei:a potential biomarker for ecotoxicity monitoring[J]. Water Air and Soil Pollution, 228(7): 266.
DOI:10.1007/s11270-017-3448-8
|
邱江平. 1999. 蚯蚓及其在环境保护上的应用Ⅰ.蚯蚓及其在自然生态系统中的作用[J]. 上海农学院学报, 1999, 17(3): 227–232.
|
Sivakumar S, Subbhuraam C V. 2005. Toxicity of chromium(Ⅲ) and chromium(Ⅵ) to the earthworm Eisenia fetida[J]. Ecotoxicology and Environmental Safety, 62(1): 93–98.
DOI:10.1016/j.ecoenv.2004.08.006
|
Tica D, Udovic M, Lestan D. 2013. Long-term efficiency of soil stabilization with apatite and Slovakite:The impact of two earthworm species (Lumbricus terrestris, and Dendrobaena veneta) on lead bioaccessibility and soil functioning[J]. Chemosphere, 91(1): 1–6.
DOI:10.1016/j.chemosphere.2012.11.011
|
Udovic M, Lestan D. 2010. Eisenia fetida avoidance behavior as a tool for assessing the efficiency of remediation of Pb, Zn and Cd polluted soil[J]. Environmental Pollution, 158(8): 2766–2772.
DOI:10.1016/j.envpol.2010.04.015
|
Vijver M G, Vink J P M, Miermans C J H, et al. 2003. Oral sealing using glue:a new method to distinguish between intestinal and dermal uptake of metals in earthworms[J]. Soil Biology and Biochemistry, 35(1): 125–132.
DOI:10.1016/S0038-0717(02)00245-6
|
谢显传.2010.土壤中十溴联苯醚(BDE-209)对赤子爱胜蚓(Eisenia fetida)和黑麦草(Lolium perenne)的生物有效性及其生物毒性效应[D].南京: 南京大学
http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2371461 |
Yirsaw B D, Mayilswami S, Megharaj M, et al. 2016. Effect of zero valent iron nanoparticles to Eisenia fetida in three soil types[J]. Environmental Science and Pollution Research, 23(10): 9822–9831.
DOI:10.1007/s11356-016-6193-4
|
Zhang W, Chen L, Liu K, et al. 2014. Bioaccumulation of decabromodiphenyl ether (BDE209) in earthworms in the presence of lead (Pb)[J]. Chemosphere, 106(2): 57–64.
|
Zhang W, Liang J, Li J, et al. 2016. Diverse impacts of a step and repeated BDE209-Pb exposures on accumulation and metabolism of BDE209 in earthworms[J]. Chemosphere, 159: 235–243.
DOI:10.1016/j.chemosphere.2016.06.009
|
张琢, 李发生, 王梅, 等. 2015. 基于用途和风险的重金属污染土壤稳定化修复后评估体系探讨[J]. 环境工程技术学报, 2015, 5(6): 509–518.
DOI:10.3969/j.issn.1674-991X.2015.06.080 |
 2019, Vol. 39
2019, Vol. 39


