纳米材料是指在三维空间中至少有一维处于1~100 nm, 并由它们作为基本单元构成的材料(Burklew et al., 2012).随着纳米技术的快速发展, 纳米材料的应用越来越广泛, 目前已被广泛应用于化妆品、生物医学、催化剂、服装、食品、陶瓷、光学、化学、农业、制造、国防等领域, 其独特的物理和化学性质归因于其粒度、分布、化学成分、表面积、表面化学性质和表面电荷等(Hood et al., 2004; Oberdörster et al., 2005b; Xia et al., 2006; Ravichandran, 2010).然而, 纳米材料在广泛应用的同时, 对人类健康和环境也造成了潜在的危害.
纳米氧化铝(nAl2O3)作为一种新型材料, 化学稳定性较好, 是众多行业中不可缺少的材料, 需求量也逐年增长.然而其潜在危害也逐渐受到人们的关注, 国际癌症研究机构(International Agency for Research on Cancer, IARC)、美国国家毒理学计划(National Toxicology Program, NPT)和其他机构将氧化铝纤维(俗称陶瓷纤维)列为人类可能的致癌物(2B级)(Kerkwijk et al., 1999; Li et al., 2007; Siemiatycki et al., 2005).纳米氧化铝的暴露易使工厂工人及相关研究人员暴露于纳米颗粒浓度高的空气中, 并通过细胞膜以被动扩散的方式被人体吸收, 从而产生一定的危害.且相关实验研究表明, 纳米氧化铝暴露可导致机体产生多种毒性效应, 包括神经毒性、免疫毒性、生殖毒性、基因毒性等(Li et al., 2009; Xing et al., 2015; Shah et al., 2015; 李欢等, 2015; 丁勇等, 2015; Zhang et al., 2017).
吸入是纳米材料主要的暴露途径, 大多数研究表明, 吸入有毒金属和金属氧化物纳米材料会导致肺癌(Donaldson et al., 2004; Oberdörster et al., 2005a; Borm et al., 2006; Sikkeland et al., 2016).而吸入的主要实验暴露途径为鼻腔内滴注和气道内滴注(非暴露式吸入方式), 且气道滴注为模拟吸入方式较为高效且耗时较少的实验暴露方案(Krondahl et al., 2002).马继轩等(2014)采用一次性气道滴注纳米氧化铝悬液, 发现nAl2O3可对肺组织结构造成损伤, 且会引起肺组织产生炎症反应.然而, 有关模拟吸入暴露不同浓度nAl2O3, 探究其对各脏器毒性作用的研究目前尚未见报道.因此, 本研究选择3种不同浓度的nAl2O3悬液, 对雄性Balb/小鼠进行每天气道滴注, 以及抗氧化剂维生素E的灌胃, 持续21 d后, 通过测定各组小鼠肺部、脾脏、肝脏、肾脏中活性氧(ROS)、还原型谷胱甘肽(GSH)的含量, 探究nAl2O3颗粒经气道滴注对小鼠各脏器的毒性作用.同时, 通过肺部的病理学观察和细胞数目的统计, 探究nAl2O3经气道滴注对小鼠肺部炎症反应的影响作用, 从而为纳米材料的安全性应用及其潜在危害的预防提供科学依据.
2 材料与方法(Materials and methods) 2.1 实验材料 2.1.1 实验动物SPF(Specific Pathogen Free)级雄性Balb/c小鼠(5~6周龄, (18±2) g), 购于湖北省疾病预防控制中心, 饲养于华中师范大学生命科学学院SPF级实验动物中心.饲养环境为标准的屏障环境, 温度设定为20~25 ℃, 相对湿度维持在50%~70%, 光暗循环周期为12 h.
2.1.2 主要实验试剂纳米氧化铝(nAl2O3, 粒径 < 50 nm, 美国Sigma-Aldrich公司)、维生素E(Vitanin E, >99%, Sigma T4389)、丙酮(acetone, 分析纯, 国药集团化学试剂有限公司)、三氯乙酸(Trichloroacetic Acid, TCA, 分析纯, 国药集团化学试剂有限公司)、2′, 7′-二氯荧光黄双乙酸盐(2′, 7′- Dichloro-dihydrofluorescein diacetate, DCFH-DA, 99.9%, Sigma)、无水乙醚(Anhydrous Ether, >99%, 分析纯, 国药集团化学试剂有限公司)、微量还原型谷胱甘肽测试盒(Glutathione, GSH, 南京建成生物工程研究所)、Folin-酚蛋白定量试剂盒(北京鼎国昌盛生物技术有限责任公司).
2.1.3 主要实验仪器FLx800荧光酶标仪(美国Bio-Tek公司)、DNM-9602酶标分析仪(北京普朗新技术有限公司)、电子分析天平(上海民桥精密科学仪器有限公司)、MSI涡旋仪(IKA公司)、5415R低温冷冻离心机(德国Eppendorf公司)、全自动细胞计数仪(MTN-21, Matenu)、JN-32OODT超声仪(宁波江南仪器厂)、电热恒温鼓风干燥箱(上海索普仪器有限公司)、ML-902定时恒温磁力搅拌器(上海浦江分析仪器厂制造)、-80 ℃超低温冰箱等.
2.1.4 主要实验溶液纳米氧化铝(nAl2O3)悬液:1 g nAl2O3粉末溶解于40 mL生理盐水中配置成0.025 mg·μL-1的nAl2O3悬液母液, 磁力搅拌3 h左右, 然后进行梯度稀释成0.0025、0.00025 mg·μL-1的nAl2O3悬液, 分别超声1 h, 直至均匀.
维生素E(Vit E):0.5 g维生素E溶解于100 mL生理盐水中配置成5 mg·mL-1的溶液, 超声仪超声30 min, 现配现用.
2.2 实验方法 2.2.1 nAl2O3的暴露方案Balb/c小鼠适应性饲养5 d后, 随机分为6组, 每组8只.A组:对照组(生理盐水组); B组:50 mg·kg-1·d-1 Vit E组; C组:0.5 mg·kg-1·d-1 nAl2O3组(nAl2O3 0.5);D组:5 mg·kg-1·d-1 nAl2O3组(nAl2O3 5);E组:50 mg·kg-1·d-1 nAl2O3组(nAl2O3 50);F组:nAl2O3 50+Vit E组.以染毒实验开始的第1天记作第1 d, 采用气道滴注, 连续21 d, 隔天滴注, 染毒剂量分别为0.5、5、50 mg·kg-1·d-1 (按体重算).染毒剂量依据nAl2O3的毒性研究实验确定(Li et al., 2009; 李欢等, 2015; 丁勇等, 2015).维生素E采用连续灌胃处理, 共21 d.滴注前使用乙醚对小鼠进行麻醉, 每只小鼠nAl2O3的滴注体积量(μL)与小鼠体重(g)的比值为2:1.
2.2.2 小鼠肺泡灌洗液中炎症细胞的计数肺泡灌洗液(Bronchoalveolar Lavage Fluid, BALF)的制备采用体全肺灌洗法.小鼠深度麻醉后, 剥离气管, 气管插管, 结扎固定气管, 将1.8 mL生理盐水推入小鼠肺部, 回吸液体即为肺泡灌洗液, 体积在1.2~1.4 mL之间, 离心后, 取细胞沉淀重悬于0.5 mL生理盐水, 用于细胞计数.
2.2.3 小鼠肺、脾、肝、肾组织匀浆的制备颈椎脱臼法处死小鼠, 取小鼠肺、脾、肝、肾组织, 漂洗干净, 去水分, 加入PBS后研磨, 制备成10%的组织匀浆液, 离心, 取上清, 分装, 冷冻于-80 ℃冰箱中储存备用.
2.2.4 小鼠肺、脾、肝、肾组织中ROS、GSH的测定ROS含量的测定采用二氯荧光黄(dichlorofluorescein, DCF)荧光法(Wu et al., 2013).具体操作为:取稀释后的染料和组织匀浆各100 μL, 混匀, 37 ℃下孵育10 min, 测量其在480 nm激发光、520 nm发射光下的荧光强度.
GSH含量的测定采用微量还原型谷胱甘肽测定试剂盒进行, 具体方法参照说明书.
2.2.5 小鼠肺组织病理学的检测肺组织切片制备过程:取肺组织, 漂洗干净后, 固定过夜, 脱水, 透明, 包埋, 切片, 粘片, 脱蜡, 然后进行H&E(Hematoxylin and Eosin)染色、MT(Masson′s Trchrome)染色, 再脱水, 透明和封片, 最后在显微镜下观察、采集图片.
2.2.6 统计学分析实验数据的分析与处理均使用SPSS 13.0软件和GraphPad Prism 5.0软件, 采用单因素方差分析(One-way ANOVA), 并采用Tukey-检验(Multiple Comparisons)对实验数据进行组间均值差异显著性比较.显著水平定为p < 0.05, 实验数据用平均值±标准差来表示.
3 结果(Results) 3.1 nAl2O3的表征分析电镜扫描图片显示(图 1), nAl2O3颗粒材料聚集成絮团状, 颗粒粒径大小(< 50 nm)与药品标签上的一致, 说明药品无异常, 可以用于实验.颗粒外形为非尖锐型, 因此, 气管滴注nAl2O3对小鼠肺部产生的物理损伤无显著影响.
 |
| 图 1 nAl2O3的电镜扫描图片 Fig. 1 Scanning electron microscope image of nAl2O3 |
小鼠体重的检测结果如图 2所示, 小鼠的初始体重为(22±2) g, 染毒21 d后, 各组小鼠的体重均出现不同程度的增加.实验期间, 对照组小鼠体重逐渐增加, 且体重增量为初始体重的17.25%;0.5、5和50 mg·kg-1·d-1 nAl2O3暴露组中小鼠体重增长较为缓慢, 体重增量为初始体重的4.99%~9.22%, 表明nAl2O3的暴露对于小鼠的正常生长有影响, 且剂量为5和50 mg·kg-1·d-1的nAl2O3对小鼠的体重增长影响较为严重.
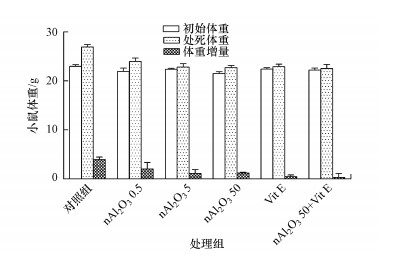 |
| 图 2 小鼠体重变化 Fig. 2 Changes of body weight in mice |
脏体比又称脏器系数, 是动物某脏器的质量与其体重的比值.由图 3可知, nAl2O3暴露对小鼠肺部和脾脏脏体比造成了不同的影响.与对照组相比, nAl2O3处理组中肺体比均极显著增加(p < 0.01), nAl2O3 50处理组中脾体比显著增加(p < 0.05), nAl2O3 0.5和nAl2O3 5处理组中脾体比均有增加趋势, 但差异不显著(p > 0.05).与nAl2O3 50组相比, nAl2O3 50+Vit E组中肺体比和脾体比均有下降趋势, 但无统计学意义(p > 0.05).由此可知, 气道滴注nAl2O3后, 小鼠的肺部和脾脏均出现肿胀现象, 且对小鼠肺体比影响较大.
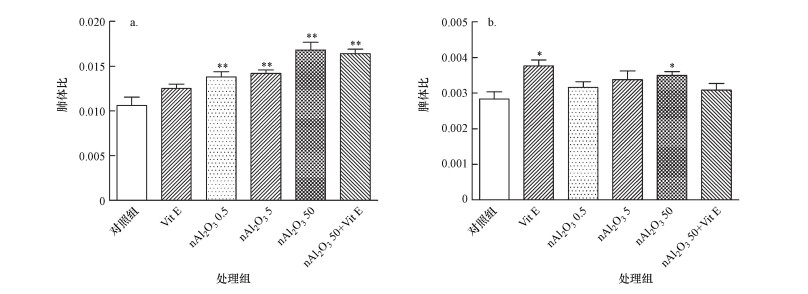 |
| 图 3 小鼠脏体比的变化(a.肺体比, b.脾体比; *:p < 0.05, **:p < 0.01, 与对照组相比) Fig. 3 Changes of the ratio of various organs to the body weight in mice |
ROS为活性氧自由基, 是氧分子的活性代谢产物, 正常时机体可产生少量活性氧参与正常代谢, 同时体内存在清除自由基的体系, 一旦体系失衡, 则这些过量的自由基将会对机体造成损伤(高斌等, 2002).小鼠各脏器ROS水平变化如图 4所示.与对照组相比, nAl2O3 0.5组小鼠肺部中ROS含量(以其相对荧光强度表征)显著增加(p < 0.05), nAl2O3 5和nAl2O3 50组肺部中ROS含量极显著增加(p < 0.01)(图 4a).nAl2O3 0.5组小鼠脾脏中ROS含量有上升趋势, 但无统计学意义(p > 0.05), nAl2O3 5组和nAl2O3 50组脾脏中ROS含量均显著增加(p < 0.05)(图 4b).nAl2O3 0.5组小鼠肝脏中ROS含量有上升趋势, nAl2O3 5组肝脏中ROS含量显著增加(p < 0.05), nAl2O3 50组肝脏中ROS含量极显著增加(p < 0.01) (图 4c).nAl2O3 0.5组小鼠肾脏中ROS含量无上升趋势, nAl2O3 5组肾脏中ROS含量显著增加(p < 0.05), nAl2O3 50组肾脏中ROS含量极显著增加(p < 0.01)(图 4d).与nAl2O3 50组相比, nAl2O3 50+Vit E组小鼠肝脏中ROS含量显著减少(p < 0.01), 肺部、脾脏和肾脏中ROS含量均有下降趋势, 但无统计学意义(p > 0.05).
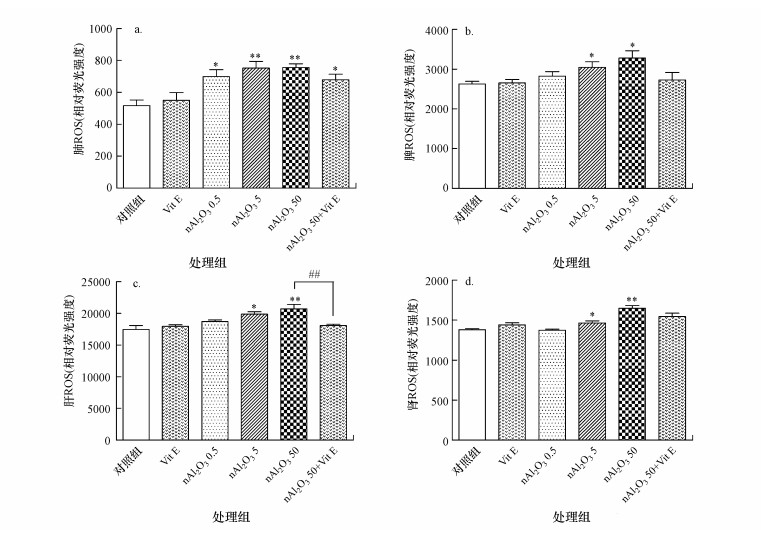 |
| 图 4 各组小鼠脏器ROS水平变化(a.肺, b.脾, c.肝, d.肾; *:p < 0.05, **:p < 0.01, 与对照组相比; ##:p < 0.01, 与nAl2O3 50组相比, 下同) Fig. 4 The ROS content in different organs in different groups |
还原型谷胱甘肽(GSH)是人类细胞中一种自然合成的由谷氨酸、半胱氨酸和甘氨酸组成的三肽, 含有巯基(SH), 广泛分布于人体各脏器内, 对维持细胞的生物功能、保护细胞膜完整性有着重要的作用(宓余强, 2008).小鼠各脏器GSH含量如图 5所示.与对照组相比, nAl2O3 0.5组小鼠肺部中GSH含量有下降趋势, 但无统计学意义(p > 0.05), nAl2O3 5组、nAl2O3 50组肺部中GSH含量均显著减少(p < 0.05)(图 5a).nAl2O3 0.5、nAl2O3 5和nAl2O3 50组小鼠脾脏中GSH含量均有下降趋势, 但无统计学意义(p > 0.05).nAl2O3 0.5、nAl2O3 5和nAl2O3 50组小鼠组肝脏中GSH含量均显著减少(p < 0.05)(图 5c).nAl2O3 0.5、nAl2O3 5、nAl2O3 50组小鼠肾脏中GSH含量均有下降趋势, 但无统计学意义(p > 0.05).与nAl2O3 50组相比, nAl2O3 50+VitE组小鼠肺部中GSH含量极显著增加(p < 0.01), 脾脏、肝脏和肾脏中GSH含量有增加趋势, 但无统计学意义(p > 0.05).
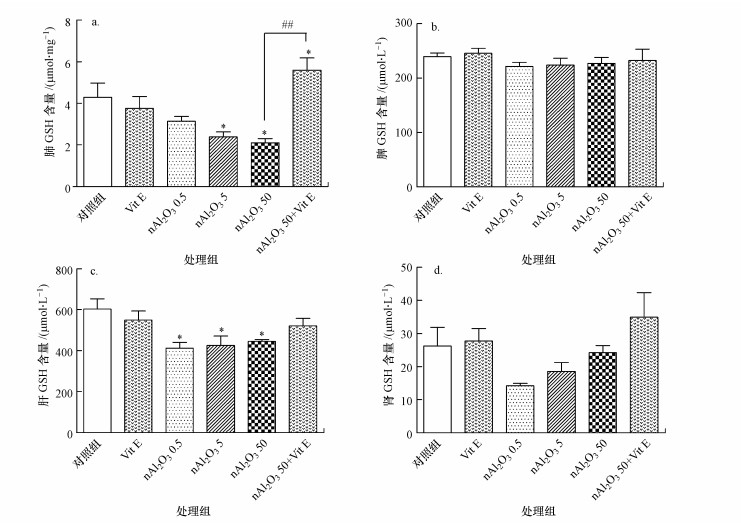 |
| 图 5 各组小鼠脏器GSH含量(a.肺, b.脾, c.肝, d.肾) Fig. 5 The GSH content in different organs in different groups |
H&E染色能够直接显示小鼠气道结构的变化, 以及气道重塑现象, 如气道壁增厚、气道腔皱缩和气道周围及肺泡间隙处嗜酸性粒细胞等炎症细胞的浸润.Masson染色直接可反映组织的胶原纤维化状况, 如气道胶原沉积现象、肺组织纤维化程度.本实验采用H&E染色和Masson染色研究小鼠的肺组织病理学变化, 结果如图 6所示.
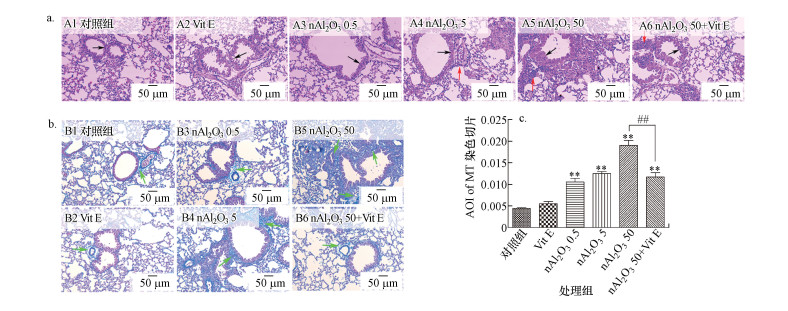 |
| 图 6 nAl2O3处理对肺组织病理的影响及维生素E对肺组织病理的保护作用(a:H&E染色, b:MT染色, c:MT染色的光密度分析; 黑色箭头表示气道壁结构的变化, 红色箭头表示炎症细胞的浸润, 绿色箭头表示肺组织纤维化的病理症状) Fig. 6 Effects of nAl2O3 treatment on lung histopathology and protective effect of Vitamin E on lung histopathology |
由图 6a和6b可知, 与对照组相比, 随着nAl2O3染毒剂量的增加, 小鼠肺组织中气道壁不断增厚, 气道腔不断皱缩, 肺组织纤维化程度逐渐增强, 胶原沉积逐渐增多, 即气道重塑现象逐渐增强, 同时出现炎症细胞的大量浸润, 表明nAl2O3暴露造成了小鼠的肺组织结构损伤.与nAl2O3 50组相比, 维生素E的应用缓解了小鼠肺组织的气道重塑及炎症细胞的浸润现象.
3.4.2 小鼠BALF中炎症细胞数目的测定结果小鼠BALF中炎症细胞的测定结果如图 7所示.由图 7a可知, 与对照组相比, 白细胞、嗜酸性粒细胞和淋巴细胞的总体变化趋势大致相同, nAl2O3 0.5组各细胞数目有上升趋势, 但差异无显著性, nAl2O3 5和nAl2O3 50组这些细胞数目均出现显著上升(p < 0.05或p < 0.01);而嗜中性粒细胞的变化较为缓和, nAl2O3 0.5和nAl2O3 5组嗜中性粒细胞并无显著变化, nAl2O3 50组有上升趋势, 但差异无显著性.由图 7b、7c可知, 随着nAl2O3处理剂量的不断增加, 总的细胞数目和嗜酸性粒细胞数目不断增加, 且结果显示, 维生素E处理能够显著降低细胞数目(p < 0.05).研究表明, 较高剂量nAl2O3的暴露可导致BALF中炎症细胞的大量浸润, 而抗氧化剂维生素E能够有效减少炎症细胞的浸润现象.
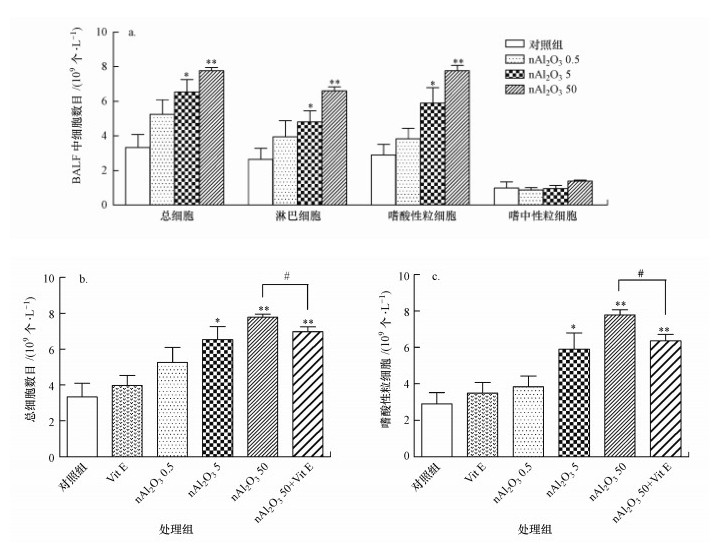 |
| 图 7 BALF中炎症细胞数目的变化(a:nAl2O3对炎症细胞浸润的影响, *:p < 0.05, **:p < 0.01, 与对照组相比; b:维生素E对炎症细胞浸润的影响, #:p < 0.05, 与nAl2O3 50组相比; c:维生素E对嗜酸性粒细胞浸润的阻断作用; #: p < 0.05, 与nAl2O3 50组相比) Fig. 7 Changes of inflammatory cells in bronchoalveolar lavage fluid |
近年来, 随着纳米材料产品的不断普及和规模化生产, 纳米材料研究者、生产者、消费者及其废物处理者的职业接触和环境暴露机会也逐渐增加, 因此, 人们也愈加关注纳米材料与纳米技术的发展所带来的潜在的健康安全风险与环境问题(Environment, Health, Safety, EHS)(Fadel et al., 2015).研究表明, 碳纳米管(Carbon Nanotube, CNT)、纳米二氧化钛(Titanium dioxide Nanoparticles, TiO2-NPs)等纳米颗粒材料的暴露可诱导机体肺部发生氧化应激反应和病理学改变(Hussain et al., 2011; Li et al., 2013; Park et al., 2016; Kinaret et al., 2017; Shang et al., 2017).本研究中, 纳米氧化铝的暴露同样造成了小鼠肺部氧化损伤和病理学改变, 且nAl2O3 5和nAl2O3 50组中ROS含量极显著增加.肺是呼吸吸入的主要靶器官, 也是机体进行气体交换的场所, 而纳米颗粒能够穿透肺泡-毛细血管屏障, 从而进入血液循环, 最终蓄积于其他靶器官(Kim et al., 2006; Hoet et al., 2004).本研究结果显示, nAl2O3 5和nAl2O3 50组小鼠脾脏、肝脏和肾脏中ROS含量均显著增加, 这表明nAl2O3的暴露不仅造成了肺部的氧化损伤, 还可能穿过肺泡-毛细血管屏障, 进入血液循环, 造成包括脾脏、肝脏和肾脏在内的多脏器发生氧化损伤, 从而加重对机体的伤害(图 8).生理条件下, 机体可产生少量氧自由基参与正常代谢, 且体内存在调控自由基平衡的体系, 一旦遭到破坏, 过多的自由基可造成细胞损伤, 而巯基是GSH重要的功能集团, 参与集体各种重要的生化反应, 过多的ROS可氧化体内重要的酶蛋白巯基, 使其灭活, 从而破坏机体正常的能量代谢和细胞利用(高斌等, 2002; 宓余强, 2008).本实验nAl2O3 5、nAl2O3 50组小鼠肺部和nAl2O3 0.5、nAl2O3 5、nAl2O3 50组肝脏中GSH含量均显著减少, nAl2O3 0.5、nAl2O3 5和nAl2O3 50组脾脏和肾脏中GSH活性出现下降趋势, 表明由nAl2O3诱导产生的过多氧自由基降低了各脏器的GSH巯基活性, 从而加重机体肺部、脾脏、肝脏和肾脏细胞的损伤, 同时减弱各脏器的抗氧化能力.
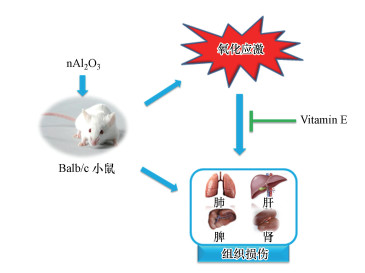 |
| 图 8 由nAl2O3诱导组织损伤的潜在机制 Fig. 8 Potential mechanism of nAl2O3-induced tissue damage |
Lin等(2014)研究表明, nAl2O3暴露可造成A549肺上皮细胞发氧化应激反应, 造成肺上皮细胞损伤, 进而促进肺泡腔中出现间充质细胞和细胞外基质的浸润, 造成肺部出现纤维化增生等现象(White et al., 2003).本研究中, nAl2O3的暴露不仅可造成肺部发生氧化应激反应, 而且通过组织切片观察发现5和50 mg·kg-1·d-1剂量的nAl2O3暴露组中肺部均出现明显的气道壁增厚、气道腔皱缩、胶原沉积、组织纤维化等气道重塑及炎症细胞的大量浸润现象(图 6、图 7).气道重塑是气道结构发生改变的结果, 主要包括支气管壁增厚、气道腔皱缩、粘液分泌增加、组织纤维化、胶原蛋白沉积、气道及周围组织中的炎症细胞浸润等现象, 而这不可逆的结构改变可降低机体的肺功能(Shifren et al., 2012).因此, 本实验结果表明, nAl2O3的暴露不仅破坏了小鼠肺部氧自由基体系及其抗氧化能力, 产生过多的氧自由基, 造成肺上皮细胞损伤, 且导致组织纤维化等气道重塑现象, 从而影响小鼠的肺功能, 加重机体的氧化损伤和炎症反应.
维生素E是非常重要的阻断自由基链式反应的抗氧化剂, 能够保持组织的完整性, 预防并减轻体内细胞膜脂质过氧化的破坏, 且抗氧化剂维生素E能够通过消除氧自由基含量来减少由纳米颗粒材料所造成的氧化损伤(Korotkova et al., 2004; Cho et al., 2010, Li et al., 2014).本研究发现, 50 mg·kg-1·d-1维生素E的阻断能够显著降低肝脏中ROS含量, 有效恢复肺部GSH活性.相关研究发现, 维生素E对肝损伤具有保护作用, 对肝纤维化有延缓作用(Lautt et al., 2008).而肺部组织为气道滴注的靶器官, 氧化损伤较为严重, 故维生素E无法显著降低ROS水平, 但或许能够通过恢复GSH活性来缓解肺组织损伤.由于各脏器结构与功能不同, 因此, 维生素E对各脏器的保护效应也就不同.但由于各脏器的氧化损伤程度不同, 且抗氧剂维生素E的剂量过小, 不足以消除较多的氧自由基和有效降低机体各脏器的氧化损伤.故本实验结果表明, 50 mg·kg-1·d-1维生素E能够缓解小鼠机体的氧化损伤, 且能够显著减轻肺部气道重塑现象及白细胞和嗜酸性粒细胞的浸润等炎症反应.
5 结论(Conclusions)1) nAl2O3经气道滴注可造成小鼠肺部发生氧化损伤及炎症反应.同时, 由于其超细微性的特点, 使得nAl2O3可能透过肺泡-毛细血管屏障, 从而对小鼠脾脏、肝脏和肾脏也造成不同程度的氧化损伤.
2) nAl2O3的暴露可导致小鼠肺部出现支气管壁增厚、气道腔皱缩、组织纤维化等气道重塑及嗜酸性粒细胞等炎症细胞大量浸润的现象.
3) nAl2O3的毒性作用具有一定的剂量-效应关系, 本研究中0.5 mg·kg-1·d-1的nAl2O3为最低有效应剂量, 这为nAl2O3的安全使用提供了理论依据.
4) 抗氧化剂维生素E(50 mg·kg-1·d-1)的使用能够有效缓解由nAl2O3诱导的氧化损伤和炎症反应, 可有效预防由纳米材料引起的危害作用.
Borm P J, Robbins D, Haubold S, et al. 2006. The potential risks of nanomaterials:a review carried out for ECETOC[J]. Particle & Fibre Toxicology, 3(1): 11.
DOI:10.1186/1743-8977-3-11
|
Burklew C E, Ashlock J, Winfrey W B, et al. 2012. Effects of aluminum oxide nanoparticles on the growth, development, and microrna expression of tobacco (Nicotiana tabacum)[J]. Plos One, 7(5): e34783.
DOI:10.1371/journal.pone.0034783
|
Cho Y S, Moon H B. 2010. The role of oxidative stress in the pathogenesis of asthma[J]. Allergy Asthma & Immunology Research, 2(3): 183–187.
|
Donaldson K, Stone V, Tran C L, et al. 2004. Nanotoxicology[J]. Occupational & Environmental Medicine, 61(9): 727–728.
|
丁勇, 杨川丽, 陈佳慧, 等. 2015. 纳米氧化铝致雄性小鼠生殖系统损害[J]. 毒理学杂志, 2015, 29(3): 177–180.
|
Fadel T R, Steevens J A, Thomas T A, et al. 2015. The challenges of nanotechnology risk management[J]. Nano Today, 10(1): 6–10.
DOI:10.1016/j.nantod.2014.09.008
|
高斌, 高洪. 2002. 氧自由基与细胞损伤[J]. 动物医学进展, 2002, 23(5): 34–36.
DOI:10.3969/j.issn.1007-5038.2002.05.011 |
Hoet P H M, Nemmar A, Nemery B. 2004. Health impact of nanomaterials?[J]. Nature Biotechnology, 22(1): 19.
DOI:10.1038/nbt0104-19
|
Hood E. 2004. Nanotechnology:.Looking as we leap[J]. Environmental Health Perspectives, 112(13): 740–749.
|
Hussain S, Vanoirbeek J A, Luyts K, et al. 2011. Lung exposure to nanoparticles modulates an asthmatic response in a mouse model[J]. European Respiratory Journal, 37(2): 299–309.
DOI:10.1183/09031936.00168509
|
Kerkwijk B, Winnubst A J A, Verweij H, et al. 1999. Tribological properties of nanoscale alumina-zirconia composites[J]. Wear, s225-229(4): 1293–1302.
|
Kim J S, Yoon T J, Yu K N, et al. 2006. Toxicity and tissue distribution of magnetic nanoparticles in mice[J]. Toxicological Sciences an Official Journal of the Society of Toxicology, 89(1): 338–347.
DOI:10.1093/toxsci/kfj027
|
Kinaret P, Ilves M, Fortino V, et al. 2017. Inhalation and oropharyngeal aspiration exposure to rod-like carbon nanotubes induce similar airway inflammation and biological responses in mouse lungs[J]. Acs Nano, 11(1): 291–303.
DOI:10.1021/acsnano.6b05652
|
Korotkova E I, Avramchik O A, Kagiya T V, et al. 2004. Study of antioxidant properties of a water-soluble vitamin E derivative-tocopherol monoglucoside (TMG) by differential pulse voltammetry[J]. Talanta, 63(3): 729–734.
DOI:10.1016/j.talanta.2003.12.030
|
Krondahl E, Tronde A, Eirefelt S, et al. 2002. Regional differences in bioavailability of an opioid tetrapeptide in vivo in rats after administration to the respiratory tract[J]. Peptides, 23(3): 479–488.
DOI:10.1016/S0196-9781(01)00629-5
|
Lautt W W, Ming Z.2008.Use of S-Adenosylmethionine, Vitamin E, and Vitamin C for the Treatment of Oxidative Liver Injury or Insulin Resistance[P].US20080262002.US
|
Li J, Li L, Chen H, et al. 2014. Application of vitamin E to antagonize SWCNTs-induced exacerbation of allergic asthma[J]. Scientific Reports, 4(3): 4275.
DOI:10.1038/srep04275
|
Li J Y, Wu B L, Liu Z F. 2007. The application and advances of nanometer alumina and nanometer aluminium hydroxide[J]. Light Metals(8): 9–12.
|
Li X B, Zheng H, Zhang Z R, et al. 2009. Glia activation induced by peripheral administration of aluminum oxide nanoparticles in rat brains[J]. Nanomedicine Nanotechnology Biology & Medicine, 5(4): 473–479.
|
李欢.2015.纳米氧化铝颗粒对小鼠免疫系统调节的影响[D].太原: 山西医科大学
http://cdmd.cnki.com.cn/Article/CDMD-10114-1015985833.htm |
Lin W, Pal A K, Isaacs J A, et al. 2014. Nanomaterial induction of oxidative stress in lung epithelial cells and macrophages[J]. Journal of Nanoparticle Research, 16(9): 1–14.
|
马继轩, 陈艳, 苏德奇, 等. 2014. 纳米氧化铝致大鼠肺部急性损伤研究[J]. 新疆医科大学学报, 2014, 37(7): 846–852.
DOI:10.3969/j.issn.1009-5551.2014.07.009 |
宓余强. 2008. 还原型谷胱甘肽临床研究及应用进展[J]. 中国医疗前沿, 2008, 6(6): 373–375.
|
Oberdörster G, Maynard A, Donaldson K, et al. 2005a. Principles for characterizing the potential human health effects from exposure to nanomaterials:elements of a screening strategy[J]. Particle & Fibre Toxicology, 2(1): 8.
DOI:10.1186/1743-8977-2-8
|
Oberdörster G, Oberdörster E, Oberdörster J. 2005b. Nanotoxicology:An emerging discipline evolving from studies of ultrafine particles[J]. Environmental Health Perspectives, 113(7): 823–839.
DOI:10.1289/ehp.7339
|
Park J W, Lee I C, Shin N R, et al. 2016. Copper oxide nanoparticles aggravate airway inflammation and mucus production in asthmatic mice via MAPK signaling[J]. Nanotoxicology, 10(4): 445.
DOI:10.3109/17435390.2015.1078851
|
Ravichandran R. 2010. Nanotechnology Applications in food and food processing:innovative green approaches, opportunities and uncertainties for global market[J]. International Journal of Green Nanotechnology Physics & Chemistry, 1(2): 72–96.
|
Shah S A, Yoon G H, Ahmad A, et al. 2015. Nanoscale-alumina induces oxidative stress and accelerates amyloid beta (Aβ) production in ICR female mice[J]. Nanoscale, 7(37): 15225–15237.
DOI:10.1039/C5NR03598H
|
Shifren A, Witt C, Christie C, et al. 2012. Mechanisms of remodeling in asthmatic airways[J]. Journal of Allergy, 6: 316049–316049.
|
Shuai S, Li J, Yun Z, et al. 2017. Oxidized graphene-aggravated allergic asthma is antagonized by antioxidant vitamin E in Balb/c mice[J]. Environmental Science & Pollution Research, 24(2): 1784–1793.
|
Siemiatycki J, Richardson L, Straif K, et al. 2005. Listing occupational carcinogens[J]. Environmental Health Perspectives, 113(3): 1447–1459.
|
Sikkeland L, Alexis N E, Fry R C, et al. 2016. Inflammation in induced sputum after aluminium oxide exposure:an experimental chamber study[J]. Occupational & Environmental Medicine, 73(3): 199–205.
|
White E S, Lazar M H, Thannickal V J. 2003. Pathogenetic mechanisms in usual interstitial pneumonia/idiopathic pulmonary fibrosis[J]. Journal of Pathology, 201(3): 343.
DOI:10.1002/(ISSN)1096-9896
|
Wu D M, Lu J, Zhang Y Q, et al. 2013. Ursolic acid improves domoic acid-induced cognitive deficits in mice[J]. Toxicol Appl Pharmacol, 271(2): 127–136.
DOI:10.1016/j.taap.2013.04.038
|
Xia T, Kovochich M, Brant J, et al. 2006. Comparison of the abilities of ambient and manufactured nanoparticles to induce cellular toxicity according to an oxidative stress paradigm[J]. Nano Letters, 6(8): 1794–1807.
DOI:10.1021/nl061025k
|
Xing M, Zou H, Gao X, et al. 2015. Workplace exposure to airborne alumina nanoparticles associated with separation and packaging processes in a pilot factory[J]. Environmental Science Processes & Impacts, 17(3): 656–666.
|
Zhang Q, Wang H, Ge C, et al. 2017. Alumina at 50 and 13 nm nanoparticle sizes have potential genotoxicity[J]. Journal of Applied Toxicology, 37(9): 1053–1064.
DOI:10.1002/jat.v37.9
|
 2019, Vol. 39
2019, Vol. 39


