2. 广东省测试分析研究所, 广东省化学危害应急检测技术重点实验室, 广东省水环境污染在线监测工程技术研究中心, 广州 510070
2. Guangdong Engineering and Technology Research Center for Online Monitoring of Environment Water Pollution, Guangdong Provincial Key Laboratory of Emergency Test for Dangerous Chemicals, Guangdong Institute of Analysis, Guangzhou 510070
柘林湾位于广东省东北部, 是全国最大的海水网箱养殖示范基地和广东省最大海水养殖区之一.由于工业污染物的陆源输入、港口通航、海水养殖等造成了柘林湾沉积物中重金属的富集(Wang et al., 2016).重金属污染具有生物富集性、难降解等特点, 通过环境介质或食物链对人体健康产生危害影响(Pruden, 2013).沉积物是众多底栖生物的生存场所和食物来源, 其中的重金属可被底栖生物直接或间接利用(Mcquillan et al., 2014; 马鑫宇等, 2016; Dai et al., 2017).沉积物中的重金属不会在自然退化过程发生迁移和降解, 而会在沉积物中长期积累储存下来, 成为水体污染的内源(Yi et al., 2011; Diao et al., 2013), 再通过一系列物理、化学、生物等作用重新回到水体, 造成二次污染(Stahl et al., 2012; 乔敏敏等, 2013; 王馨慧等, 2016).沉积物中重金属的环境行为、迁移能力与重金属的赋存形态及生物有效态密切相关(范英宏等, 2010; Beady et al., 2016).重金属赋存形态和有效态的分析和评价为考察环境中重金属污染危害风险的重要研究方法(Tokalioglu et al., 2000; Ardestani et al., 2014).
沉积物中重金属有效态的分析方法主要有单级提取法(Kenndy et al., 1997)、同位素稀释法(Degryse et al., 2007)、Donnan膜技术(Weng et al., 2005)、薄膜扩散梯度技术(DGT)(Davison et al., 1994)等.其中, DGT技术因可原位测定沉积物中重金属的有效态, 避免采样、前处理及提取过程中重金属形态的变化, 且几乎不受沉积物性质影响等特点, 已被广泛应用于河流、河口沉积物中重金属生物有效性的测定(Amato et al., 2005; Gorny et al., 2015).目前沉积物中重金属生态风险评价方法主要有基于总量的Hakanson指数法(Hakanson, 1980)、基于赋存形态的风险评价指数法(RAC)(车霏霏等, 2017)等.Hakanson指数法综合考虑沉积物中重金属的总量及生物毒性大小, 能反映重金属对环境生物的危害, 但该方法未考虑沉积物中重金属赋存形态迁移性的影响, RAC法基于赋存形态对重金属生物有效性的重要性, 考虑了重金属不同赋存形态的生物效应不同, 但其没有考虑不同重金属的生物毒性效应.因此两种方法综合评价会使生态风险评价结果更科学、合理(Rafiei et al., 2012).本研究针对柘林湾表层沉积物中重金属生物有效性、迁移性及含量分布进行了考察, 对该沉积物中重金属的生态风险进行了评价, 为柘林湾重金属污染控制及管理等提供科学依据.
2 材料与方法(Materials and methods) 2.1 样品采集与预处理柘林湾是一个半封闭小型河口湾, 具有水深(平均水深4.8 m)、稳定性好、潮差大(平均潮差3.43 m)等特点, 是华南地区深水良港之一, 牡蛎、网箱鱼排养殖密集.沉积物样品于2013年8月采自柘林湾养殖区(图 1).使用彼得森采样器采集表层底泥(0~5 cm), 快速装入充满氮气的采样袋中, 放入装有冰块的保冷箱中运回.每个位点采集3份样品, 运回实验室后, 一部分样品用冷冻干燥机冷冻干燥(-75 ℃, 真空度5.0 Pa), 另一部分样品放入冰箱(4 ℃)冷藏储存.
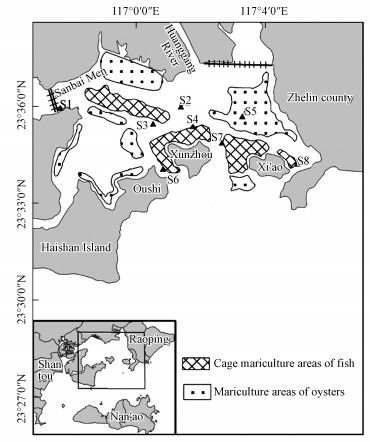 |
| 图 1 柘林湾采样点布设 Fig. 1 Sketch map of sires in Zhelin Bay |
沉积物的有机质(OM)含量采用重铬酸钾容量法测定, 沉积物的Eh和pH分别采用ORP电极和pH计测定.
2.3 重金属总量测定分别称取0.2000 g沉积物冷冻干燥样于聚四氟乙烯消解管中, 加入10 mL HNO3和2 mL氢氟酸, 在微波消解仪中进行消解, 程序升温消解45 min.程序结束后, 取出消解管, 用高纯水将消解管盖上的液体洗至消解管中, 向消解管中加入1 mL高氯酸后, 将消解管置于赶酸仪, 160 ℃加热至溶液余约2~3 mL时, 将溶液倒入25 mL容量瓶中, 用高纯水定容至刻度线.取部分消解液过0.45 μm滤膜, 采用电感耦合等离子体质谱仪(ICP-MS/MS)测定其中重金属(Cr、Ni、Zn、Cu、Cd、Pb)含量.每个样品平行消解3份, 同时带流程空白.
2.4 重金属生物有效性测定将冷藏的沉积物放入玻璃容器中并搅拌均匀, 去除小石块和其它杂物, 轻轻压实沉积物后稳定1周.将购置的DGT装置(盘式Chelex-DGT, 采样窗口直径为2 cm, 结合相厚度为0.4 mm, 扩散相厚度为0.78 mm)放入高纯水中通氮气12 h, 以去除装置中的氧气, 然后取出DGT装置并用高纯水冲洗.在DGT采样窗口(滤膜)涂抹少量沉积物后, 将DGT装置采样窗口朝下轻按使其采样窗口没入到沉积物中约1 cm深, 记下温度和时间.24 h后取出DGT, 用去离子水冲洗后拆开, 取出树脂凝胶放入带刻度的5 mL离心管中, 加入1 mL 1 mol · L-1的HNO3提取24 h, 并于离心管中用高纯水定容至4 mL待测.树脂层固定的金属质量(M)可以通过式(1)计算:
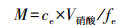
|
(1) |
式中, ce为HNO3稀释液中金属的浓度(ng · mL-1); V硝酸为HNO3稀释液的体积(mL); fe为硝酸对树脂凝胶中重金属的提取系数, 1 mL 1 mol · L-1 HNO3提取时, fe通常取0.8.
根据M可计算出测量期间内DGT装置与沉积物界面处的金属离子平均浓度cDGT, 如式(2)所示:
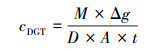
|
(2) |
式中, Δg为扩散凝胶厚度(cm); D为金属离子在扩散层中的扩散系数(cm2 · s-1), 扩散系数受温度影响, 不同温度下的扩散系数可由文献查出(Luo et al., 2010), 28 ℃时, Cr、Ni、Zn、Cu、Cd和Pb的扩散系数分别为5.47×10-6、6.25×10-6、6.58×10-6、6.74×10-6、6.60×10-6和8.69×10-6 cm2 · s-1; A为DGT窗口面积(cm2); t为DGT装置的放置时间(s).
2.5 间隙水中重金属浓度测定间隙水中的自由态金属可直接产生生物效应, 也被认为是其生物可利用部分(Alcock et al., 2003).通常沉积物间隙水中重金属浓度(cIW)采用离心法测定(Campana et al., 2012), 取20 g沉积物, 加入到50 mL的离心管中, 4000 r · min-1离心15 min, 上清液过0.45 μm滤膜, 加入10 μL浓HNO3酸化过滤液, 用ICP-MS/MS测定过滤液中Cr、Ni、Zn、Cu、Cd和Pb浓度.
2.6 重金属的补给能力沉积物间隙水中金属被转移或消耗时, 沉积物固相补充金属的能力(R)通常用cDGT与cIW的比值计算(式(3))(Happer et al., 1998; 罗军等, 2011):
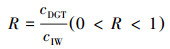
|
(3) |
根据R值, 可将沉积物固相补充金属的能力分为3种类型:
① 单扩散型(R=Rdiff).在该情况下, 当DGT移除其界面的间隙水中金属离子后, 沉积物固相无法补充金属到间隙水中, 只能靠溶液中的离子扩散从其他高浓度区域补充离子到DGT界面.
② 部分持续型(Rdiff<R<0.95).此情况下, 间隙水中金属浓度降低时, 沉积物固相能够部分补给有效的金属到间隙水中, 但是再补给速率不足以维持DGT\沉积物界面处的有效浓度.
③ 完全持续型(0.95<R<1).即间隙水中重金属浓度降低时, 沉积物固相中的金属能迅速补给到间隙水中, 再补给速率大于金属在扩散凝胶中的扩散速率.
其中Rdiff为假设沉积物中不存在固相到液相的补给时, DGT装置和沉积物间的理论界面浓度与间隙水浓度的比值, 由DGT装置的大小、沉积物间隙水中金属有效态的扩散系数及测量时间决定, 可通过DIFS模型(Happer et al., 2000)模拟得到.
2.7 重金属形态连续提取称取1.0000 g沉积物干样于50 mL离心管中, 采用连续提取方法提取各形态的金属(郭鹏然等, 2009), 该方法根据海水养殖区沉积物环境的特点, 将重金属分为弱酸提取态、还原态、有机质结合态、硫化物结合态、残渣态, 提取方法如表 1所示.每个样品设3个平行, 同时带流程空白.
| 表 1 重金属形态连续提取方法的目标形态及萃取操作 Table 1 Fraction and extraction operations of heavy metals in sequential extraction procedure |
采用Hakanson指数法(Hakanson, 1980)和RAC指数法(Singh et al., 2005; Ke et al., 2017)对柘林湾海水养殖区沉积物中重金属进行生态风险评价.在本研究中, 综合文献中潜在生态危害指数(RI)调整值(孙照斌等, 2009; 王丽平等, 2017), 根据考察的污染元素毒性响应系数和元素个数, 对柘林湾研究中RI取值进行了调整.沉积物Eri值和RI值的评价指标见表 2.
| 表 2 潜在生态危害评价指标 Table 2 Indicators for potential ecological risk assessment |
柘林湾沉积物的pH值和氧化还原电位分别在7.50~7.76和-20.7~-36.5 mV范围(表 3), 沉积物处于弱碱性状态和弱还原状态.沉积物中Ni、Zn和Cd的含量空间差异较大, 变化范围分别是15.45~62.56、132.62~193.59和0.04~0.15 mg · kg-1, 而Cr、Cu和Pb含量空间差异较小.据海洋沉积物质量标准(GB 18668—2002, MSQs)(GB 18668), 柘林湾各位点沉积物重金属含量皆符合Ⅰ类水平限值(除Zn在S6位点和Pb在S2位点处于Ⅱ类水平外), 各位点沉积物中重金属含量大小顺序为:S6>S4>S2>S3>S1>S5>S7>S8.
| 表 3 沉积物主要理化性质及重金属含量 Table 3 Characteristic parameters and heavy metals concentrations of sediments |
沉积物间隙水中Cr、Ni、Zn、Cu、Cd和Pb的浓度cIW分别为0.42~0.81、2.90~8.58、4.76~19.49、2.88~8.75、0.22~0.31和20.97~30.62 ng · mL-1(图 2).考察单个重金属, 间隙水中Pb浓度较高, 其次为Zn浓度, 而Cr和Cd浓度较低.Pb浓度在各位点均处于较高水平, Zn在S1、S2和S3位点处浓度较高.考察位点状况, S1、S2、S3位点处沉积物间隙水中重金属浓度较高, 沉积物中重金属的生物有效部分含量较高.
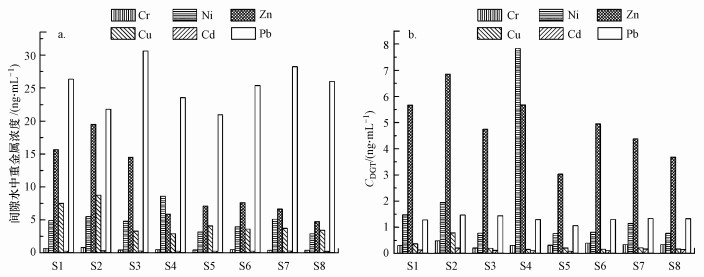 |
| 图 2 沉积物间隙水中重金属浓度及分布特征(a)和沉积物中DGT提取重金属浓度(cDGT)及分布特征(b) Fig. 2 Contents and distribution characteristics of heavy metals in sediment pore water (a) and (cDGT) in sediments extracted by DGT (b) |
DGT测定的沉积物中Cr、Ni、Zn、Cu、Cd和Pb的浓度分别为0.21~0.48、0.77~7.83、3.03~6.86、0.15~0.79、0.08~0.20和1.06~1.47 ng · mL-1(图 2b).由图 2b可知, Zn的CDGT较高, 其次是Ni和Pb, 而Cu和Cd的cDGT较低.考察位点状况, S2和S4位点处cDGT较高, 其次为S1处, 而S5和S8位点处cDGT较低, 沉积物中重金属的生物可利用性较低.
3.3 沉积物中重金属的补给能力R和Rdiff是判断沉积物固相中重金属补给能力的重要参数.由表 4分析结果可知, 沉积物Rdiff介于0.041~0.052之间, R介于0.045~0.965之间.Zn在S4点处为完全持续扩散类型(0.95<R<1), 沉积物固相中的Zn在间隙水浓度降低时可快速补给到间隙水中; Zn在其余位点和Cr、Ni、Cu、Cd、Pb在所有位点均为部分持续型扩散型, 沉积物固相中重金属能够通过解吸作用部分补给到间隙水中, 但补给速率不足以维持DGT-沉积物界面处的有效浓度.总体而言, 柘林湾沉积物中重金属固相到液相的迁移补给能力为:Cr>Zn>Cd>Ni>Cu≈Pb, Cu和Pb几乎不存在补给.
| 表 4 沉积物R与Rdiff Table 4 The R and Rdiff of sediments |
沉积物中重金属形态分析结果见图 3.柘林湾海水养殖区沉积物中, Cr主要以残渣态(85.28%~89.54%)和硫化物结合态(8.82%~13.03%)存在, 而弱酸提取态(0.91%~1.21%)、有机质结合态(0.27%~0.60%)、还原态(0.03%~0.17%)百分含量稍低.Ni主要以残渣态(63.61%~80.01%)存在, 其次是弱酸提取态(3.09%~19.99%)和硫化物结合态(8.02%~17.62%), 而还原态(0.86%~3.51%)和有机质结合态(0~6.34%)百分含量较低.Zn主要以残渣态(54.45%~74.54%)和硫化物结合态(21.27%~37.04%)存在, 其次为弱酸提取态(1.87%~4.83%)和还原态(1.64%~3.43%), 有机质结合态(0.55%~1.63%)百分含量较低.Cu主要以残渣态(65.49%~79.00%)存在, 其次为硫化物结合态(8.58%~16.40%)、有机质结合态(7.14%~10.73%)和弱酸提取态(3.28%~7.25%), 还原态(0.30%~0.70%)百分含量较低.Cd主要以弱酸提取态(32.54%~66.05%)和残渣态(25.05%~58.57%)存在, 其次为还原态(0~11.87%)和硫化物结合态(2.73%~9.25%), 有机质结合态(0~2.18%)百分含量较低.Pb主要以弱酸提取态(30.23%~48.21%)和残渣态(32.48%~39.56%)存在, 其次为有机质结合态(8.64%~20.19%)和硫化物结合态(8.00%~13.10%), 还原态(1.19%~2.74%)百分含量较少.
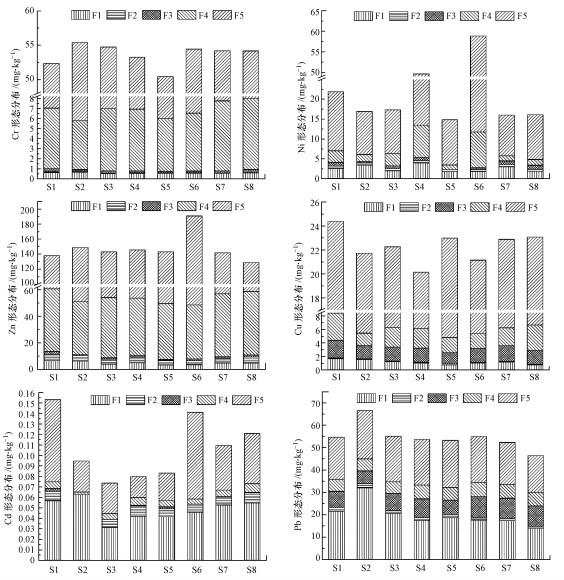 |
| 图 3 沉积物中重金属化学形态分布特征 Fig. 3 The chemical speciation distribution characteristics of heavy metals in sediments |
Hakanson指数法评价的柘林湾海水养殖区沉积物中Cr、Ni、Zn、Cu、Cd和Pb潜在生态风险结果见图 4, 各重金属Eri平均值高低顺序依次为:Cd>Ni>Pb>Cu>Cr>Zn, 单个重金属在各位点的Eri值皆小于40, 为轻微潜在生态危害程度, 但部分位点(S1、S4和S6)沉积物中重金属RI在55~110之间, 位点沉积物中重金属存在中等潜在生态风险, 其余位点为轻微生态危害风险.总体而言, 柘林湾海水养殖区沉积物具有轻度到中度潜在生态风险程度, 其中S1和S6位点潜在生态风险程度较高, 而S3和S5位点潜在生态风险程度较低.
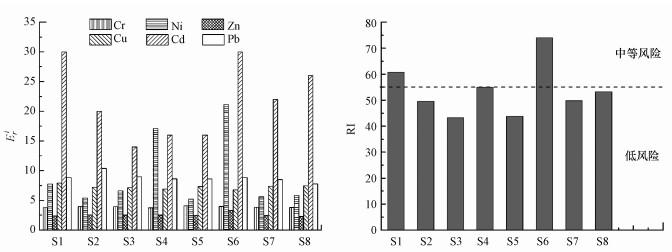 |
| 图 4 柘林湾沉积物中重金属Hakanson指数法潜在生态风险评价结果 Fig. 4 Potential ecological risk assessment results of Hakanson for heavy metals in sediments of Zhelin Bay |
由图 5可知, RAC法考察的柘林湾沉积物中重金属生态危害风险大小顺序为Cd>Pb>Ni>Cu>Zn>Cr, Cd和Pb存在高生态风险, Ni具有中等生态风险, Cu、Zn和Cr为低生态危害风险.RAC法对重金属生态危害风险评价结果明显高于Eri评价结果.
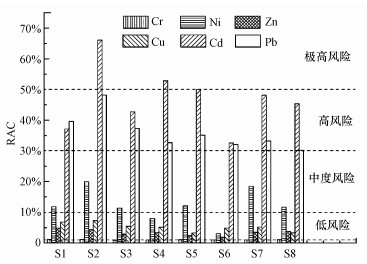 |
| 图 5 柘林湾沉积物中重金属RAC法生态风险评估结果 Fig. 5 Ecological risk assessment results of RAC for heavy metals in sediments of Zhelin Bay |
重金属含量是海洋生态系统风险评价的重要指标(Kim et al., 2015).根据我国MSQs, 柘林湾沉积物中Cr、Cu和Cd含量皆低于第一类指标, 大多位点Zn和Pb含量也满足第一类指标(除S6位点Zn、S2位点Pb超过一类指标外), 柘林湾沉积物质量基本符合海洋渔业要求, 但重金属含量明显高于大亚湾(Ni et al., 2017)、白沙湾(Gu et al., 2013)等海水养殖区, 而这些区域沉积物重金属对甲壳类、多毛类底栖生物产生了体内蓄积等不利影响(Du et al., 2017), 并且这些底栖生物中重金属可通过食物链传递到养殖海产品(Zhang et al., 2015).牡蛎和鱼类是柘林湾主要养殖产品, 牡蛎为滤食性贝类, 移动能力较差, 可直接滤食含有重金属的泥沙颗粒物以及底栖生物, 造成重金属的体内富集; 对于鱼类而言, 除投放饵料外, 以浮游生物为食, 而浮游生物以底栖生物为食, 且所在区域水交换能力不佳(Wang et al., 2013), 易导致沉积物释放出的重金属不易被交换、稀释.这些因素使重金属在养殖海产品中有较高蓄积风险, 这会对水生生物资源的利用价值造成长期不利影响.不同采样位置沉积物中重金属含量不同, S6位点重金属总量最高, 其次是S4, 这是由于S4和S6为鱼类网箱养殖处, 且S6位点接近沿岸, 生活污水排放、垃圾渗滤和水道疏浚等人为活动密集, 而S4位点由于汛洲岛的阻碍, 使其海流水体交换能力相对较差.S7、S8位点重金属总量较低, 这是由于S7和S8位于湾口, 易受湾外水体影响, 与Xia等(2016)研究结果一致.
重金属cDGT(Zn>Ni>Pb>Cr>Cu>Cd)与cIW(Pb>Zn>Ni>Cu>Cr>Cd)大小分布基本相符, 沉积物中Zn、Ni和Pb生物可利用性较高.由Pearson相关分析(表 5和表 6), cDGT和cIW与pH值、氧化还原电位和有机质含量皆呈负相关关系, 这可能是由于柘林湾缺氧养殖底泥状态下, 较低的氧化还原电位和有机质含量促进了重金属的迁移释放, 增加了重金属生物可利用态含量(Sauve et al., 2000).沉积物中重金属的cDGT与cIW及各提取形态中含量的相关分析(表 7)表明, cDGT随重金属cIW、总量、弱酸提取态及还原态含量的增加而增加.Cu的cDGT与弱酸提取态含量中等水平正相关(r=0.695), Ni、Cr、Zn和Cd的cDGT与弱酸提取态含量呈显著正相关(r分别为0.796、0.745、0.722和0.764), 沉积物中重金属的生物有效性更多的取决于重金属的弱酸提取态, 与Pardo等(1990)的研究结果一致.Ni和Cu的cDGT与cIW显著正相关(r分别为0.905和0.870), 较与弱酸提取态含量相关性更显著, 这可能是由于Ni和Cu碳酸盐结合态的沉淀平衡常数(Ksp)较大, 柘林湾沉积物固相Ni和Cu的碳酸盐结合态较少, 沉积物固相向间隙水的补给较少, 生物可利用态Ni和Cu大部分存在于间隙水中.Cr、Zn和Cd的cDGT与cIW中等程度正相关(r分别为0.588、0.697和0.518), 而与弱酸提取态含量显著正相关, 这可能是柘林湾沉积物固相中Cr、Zn和Cd的碳酸盐结合态较多, Cr、Zn和Cd补给能力较强, 重金属从固相到液相的补给过程较快.
| 表 5 cDGT与沉积物理化性质的相关性 Table 5 The correlation between cDGT and sediment characteristic parameters |
| 表 6 cIW与沉积物理化性质的相关性 Table 6 The correlation between cIW and sediment characteristic parameters |
| 表 7 cDGT与cIW及重金属各形态之间的相关性 Table 7 Correlation of cDGT, CIW and chemical speciation of heavy metals |
RAC法和Hakanson指数法评价的柘林湾沉积物中重金属的生态风险大小顺序分别为:Cd>Pb>Ni>Cu>Zn>Cr(Cd和Pb具有高生态风险, Ni存在中等生态风险, Cu、Zn和Cr为低生态风险)和Cd>Ni>Pb>Cu>Cr>Zn(6种重金属皆处于轻微潜在生态风险).两种评价方法对重金属危害风险大小评价次序一致, 但Cd和Pb的生态风险程度大小则存在较大差异.由于养殖区沉积物重金属总量并不高, 因此基于重金属总量的Hakanson指数法评价的重金属危害风险较低, 但沉积物中Cd和Pb主要以生物有效性较高的弱酸提取态存在, 因此RAC法评价的Cd和Pb处于高生态风险.两种方法评价结果中Cd皆为柘林湾沉积物的最主要风险来源, 其中Hakanson指数法评定Cd对RI值的贡献率达40.53%, 这与乔永民和袁国明等(乔永民等, 2010; 袁国明等, 2015)对柘林湾沉积物的生态风险评价结果一致, 即主要重金属污染物是Cd.
据柘林湾沉积物背景值(乔永民等, 2009), 柘林湾沉积物中重金属主要为外源输入, 污染源可能是海洋水产养殖排放、沿海工业和农业排放、海洋运输和其他人为活动.Ni、Cu和Pb因其耐海水腐蚀而被广泛应用于船舶保护, 且Ni也是汽油中的微量金属元素, 在海洋运输过程中易对柘林湾沉积物造成污染; Cr和Zn的存在可以归因于镀锌行业; Cd作为柘林湾主要污染物, 一方面可能是由于三百门火力发电厂的运行, 另一方面可能是由于黄冈河径流输入, 河水中含有大量可强烈吸附Cd的黏土矿物(Lackovia et al., 2003), 带来黄冈河沿岸工业污染所致.因此, 除养殖污染外, 柘林湾底泥中重金属也可能来自三百门火力发电厂、黄冈河沿岸工业污染物排放及船舶通行.
5 结论(Conclusions)1) 柘林湾沉积物中Cr、Cu和Cd含量低于Ⅰ类标准限定值, 极少数位点沉积物中Zn和Pb含量超过Ⅰ类标准限值但低于Ⅱ类标准限值, 柘林湾沉积物质量基本符合海洋渔业要求; 各位点中S4和S6处重金属总量较高, 可能是人为活动和地理位置共同导致的结果.
2) 柘林湾沉积物中重金属cDGT大小顺序为Zn>Ni>Pb>Cr>Cu>Cd, cIW大小顺序为Pb>Zn>Ni>Cu>Cr>Cd, Zn、Ni和Pb生物有效性较高.Cr、Ni、Zn和Cu主要以残渣态存在, Cd和Pb主要以弱酸提取态存在.沉积物中Cu的cDGT与弱酸提取态含量中等水平正相关, Cr、Ni、Zn和Cd的cDGT与弱酸提取态含量呈显著正相关, 重金属弱酸提取态含量能较好反应其生物有效性.柘林湾沉积物中重金属总体存在轻度到中度生态危害风险, 其中Cd生态危害风险较高, 在柘林湾沉积物生态风险中起主导作用, Pb生态危害风险次之.
Alcock S, Barcelo D, Hansen P D. 2003. Monitoring freshwater sediments[J]. Biosensors and Bioelectronics, 18(8): 1077–1083.
DOI:10.1016/S0956-5663(02)00210-5
|
Aleksandra B G, Eva R, Kraysztof Z. 2013. Distribution, bioavailability and fractionation of metallic elements in allotment garden soils using the BCR sequential extraction procedure[J]. Polish Journal of Environmental Studies, 22(4): 1013–1021.
|
Amato E D, Simpson S L, Jaromilek C V, et al. 2014. Diffusive gradients in thin films technique provide robust prediction of metal bioavailability and toxicity in estuarine sediments[J]. Environmental Science & Technology, 8(48): 4485–4494.
|
Ardestani M M, van Straalen N M, van Gestel C. 2014. The relationship between metal toxicity and biotic ligand binding affinities in aquatic and soil organisms:A review[J]. Environmental Pollution, 195: 133–147.
DOI:10.1016/j.envpol.2014.08.020
|
Beady J P, Kinave I, Goonetilleke A, et al. 2016. Comparison of partial extraction reagents for assessing potential bioavailability of heavy metals in sediments[J]. Marine Pollution Bulletin, 106(1/2): 329–334.
|
Campana O, Simpson S L, Spadaro D A, et al. 2012. Sub-Lethal effects of copper to benthic invertebrates explained by sediment properties and dietary exposure[J]. Environmental Science & Technology, 46(12): 6835–6842.
|
车霏霏, 甄卓, 王大鹏, 等. 2017. 太湖不同营养水平湖区表层沉积物的砷分布特征及其生态风险[J]. 环境科学学报, 2017, 37(5): 1623–1631.
|
Dai Y Y, Wang H, Gao Y. 2017. Potential ecological risks of Cd for different benthos in artificial reefs[J]. Marine Science Bulletin, 19(1): 91–96.
|
Davison W, Zhang H. 1994. In situ speciation measurements of trace components in natural waters using thin-film gels[J]. Nature, 367: 546–548.
DOI:10.1038/367546a0
|
Degryse F, Waegeneers N, Smolders E. 2007. Labile lead in polluted soils measured by stable isotope dilution[J]. European Journal of Soil Science, 58(1): 1–7.
|
Diao Z H, Shi T H, Wang S Z, et al. 2013. Silane-based coatings on the pyrite for remediation of acid mine drainage[J]. Water Research, 47(13): 4391–4402.
DOI:10.1016/j.watres.2013.05.006
|
Du S, Zhou Y Y, Zhang L. 2017. Application of stable isotopes (δ13C and δ15N) in studies on heavy metals bioaccumulation in Daya Bay food web[J]. Chinese Journal of Applied Ecology, 28(7): 2327–2338.
|
范英宏, 高亮, 赵国堂, 等. 2010. 沉积物中重金属铅的释放动力学模拟[J]. 环境化学, 2010, 30(3): 587–592.
|
Gorny J, Lesven L, Billon G, et al. 2015. Determination of total arsenic using a novel Zn-ferrite binding gel for DGT techniques:Application to the redox speciation of arsenic in river sediments[J]. Talanta, 144: 890–898.
DOI:10.1016/j.talanta.2015.07.016
|
Gu Y G, Yang Y F, Lin Q. 2013. Heavy metal speciation and potential risk assessment in sediments from the mariculture areas in Baisha Bay, Nanao, Shantou[J]. Marine Environmental Science, 32(3): 333–337.
|
国家质量监督检验检疫总局.2002.海洋沉积物质量(GB 18668-2002)[S].北京: 中国标准出版社
|
郭鹏然, 牟德海, 王畅, 等. 2009. 连续萃取法研究海湾养殖区沉积物中重金属形态[J]. 分析化学, 2009, 11: 1645–1650.
DOI:10.3321/j.issn:0253-3820.2009.11.016 |
Hakanson L. 1980. An ecological risk index for aquatic pollution control.a sedimentological approach[J]. Water Research, 14(8): 975–1001.
DOI:10.1016/0043-1354(80)90143-8
|
Happer M P, Davison W, Tych W. 2000. DIFS-a modelling and simulation tool for DGT induced trace metal remobilisation in sediments and soils[J]. Environment Modelling & Software, 15: 55–66.
|
Happer M P, Davison W, Zhang H, et al. 1998. Kinetics of metal exchange between solids and solutions in sediments and soils interpreted from DGT measured fluxes[J]. Geochimica Et Cosmochimica Acta, 62(16): 2757–2770.
DOI:10.1016/S0016-7037(98)00186-0
|
Huang Z Y, Chen T, Y J, et al. 2011. Labile Cd and Pb in vegetable-growing soils estimated with isotope dilution and chemical extractants[J]. Geoderma, 160(3/4): 400–407.
|
Ke X, Gui S F, Huang H, et al. 2017. Ecological risk assessment and source identification 1 for heavy metals in surface sediment from the Liaohe River protected area, China[J]. Chemosphere, 175: 473–509.
DOI:10.1016/j.chemosphere.2017.02.029
|
Kenndy H V, Sanchez A L, Oughton D H, et al. 1997. Use of single and sequential chemical extractants to assess radionuclide and heavy metal availability from soils for root uptake[J]. Analyst, 122: 89–100.
DOI:10.1039/a605155c
|
Kim D, Amy G, Karanfil T. 2015. Disinfection by-product formation during seawater desalination:A review[J]. Water Research, 81: 343–355.
DOI:10.1016/j.watres.2015.05.040
|
Lackovia K, Angove M J, Wells J D, et al. 2003. Modeling the adsorption of Cd(Ⅱ) onto Muloorina illite and related clay minerals[J]. Journal of Colloid and Interface Science, 257(1): 31–40.
DOI:10.1016/S0021-9797(02)00031-0
|
罗军, 王晓蓉, 张昊, 等. 2011. 梯度扩散薄膜技术(DGT)的理论及其在环境中的应用Ⅰ:工作原理、特性与在土壤中的应用[J]. 农业环境科学学报, 2011, 30(2): 205–213.
|
Luo J, Zhang H, Santner J, et al. 2010. Performance characteristics of diffusive gradients in thin films equipped with a binding gel layer containing precipitated ferrihydrite for measuring arsenic(Ⅴ), selenium(Ⅵ), vanadium(Ⅴ), and antimony(Ⅴ)[J]. Analytical Chemistry, 82(21): 8903–8909.
DOI:10.1021/ac101676w
|
马鑫雨, 杨浩, 姚逊, 等. 2016. 典型养殖型湖泊中的重金属含量及健康风险特征——以宿鸭湖为例[J]. 环境科学学报, 2016, 36(6): 2281–2289.
|
Mcquillan J S, Kille P, Powell K, et al. 2014. The regulation of copper stress response genes in the polychaete nereis diversicolor during prolonged extreme copper contamination[J]. Environmental Science & Technology, 48(22): 13085–13092.
|
Ni Z X, Zhang L, Yu S, et al. 2017. The porewater nutrient and heavy metal characteristics in sediment cores and their benthic fluxes in Daya Bay, South China[J]. Marine Pollution Bulletin, 124: 547–554.
DOI:10.1016/j.marpolbul.2017.07.069
|
Pardo R, Barrado E, Perez L, et al. 1990. Determination and speciation of heavy metals in sediments of the Pisuerga River[J]. Water Reserach, 24(3): 373–379.
|
Pruden A. 2013. Balancing water sustainability and public health goals in the face of growing concerns about antibiotic resistance[J]. Environmental Science & Technology, 48(1): 5–14.
|
乔敏敏, 季宏兵, 朱先芳, 等. 2013. 密云水库入库河流沉积物中重金属形态分析及风险评价[J]. 环境科学学报, 2013, 33(12): 3324–3333.
|
乔永民, 黄长江, 杨扬. 2009. 粤东柘林湾沉积物重金属背景值初步研究[J]. 热带海洋学报, 2009, 28(2): 81–85.
DOI:10.3969/j.issn.1009-5470.2009.02.013 |
乔永民, 黄长江, 赵建刚. 2010. 粤东柘林湾沉积物重金属富集特征与环境质量评价[J]. 海洋环境科学, 2010, 29(3): 324–327.
DOI:10.3969/j.issn.1007-6336.2010.03.008 |
Sauve S, Hendershot W, Allen H E. 2000. Solid-Solution partitioning of metals in contaminated soils:dependence on pH, total metal burden, and organic matter[J]. Environmental Science & Technology, 34(7): 1125–1131.
|
Singh Kunwar P, Mohan D, Singh V K, et al. 2005. Studies on distribution and fractionation of heavy metals in Gomti river sediments-a tributary of the Ganges, India[J]. Journal of Hydrology, 312(1/4): 14–27.
|
Stahl H, WarnkenK. W, Sochaczewsk L, et al. 2012. A combined sensor for simultaneous high resolution 2-D imaging of oxygen and trace metals fluxes[J]. Limnology and Oceanog raphy:Methods, 10(5): 389–401.
DOI:10.4319/lom.2012.10.389
|
孙照斌, 邴海健, 吴艳宏, 等. 2009. 太湖流域西氿湖沉积岩芯中重金属污染及潜在生态风险[J]. 湖泊科学, 2009, 21(4): 563–569.
DOI:10.3321/j.issn:1003-5427.2009.04.016 |
Tokalioglu S, Kartal S, Elci L. 2000. Determination of heavy metals and their speciation in lake sediments by flame atomic absorption spectrometry after a four-stage sequential extraction procedure[J]. Analytica Chimica Acta, 413(1): 33–40.
|
王丽平, 雷坤, 乔艳珍. 2017. 天津渤海湾近岸海域沉积物中4种常见重金属的分布及其风险分析[J]. 海洋环境科学, 2017, 36(5): 693–698.
|
王馨慧, 单保庆, 唐文忠, 等. 2016. 典型城市河流表层沉积物中汞污染特征与生态风险[J]. 环境科学学报, 2016, 36(4): 1153–1159.
|
Wang Y, Wei Y N, Guo P R, et al. 2016. Distribution variation of heavy metals in maricultural sediments and their enrichment, ecological risk and possible source-a case study from Zhelin bay in Southern China[J]. Marine Pollution Bulletin, 113(1/2): 240–246.
|
Wang Z H, Feng J, Jiang T, et al. 2013. Assessment of metal contamination in surface sediments from Zhelin Bay, the South China Sea[J]. Marine Pollution Bulletin, 76(1/2): 383–388.
|
Weng L P, Riensdijk W H V, Rtenninghoff E J M. 2005. Kinetic aspects of donnan membrane technique for measuring free trace cation concentration[J]. Analytical Chemistry, 77(9): 2852–2861.
DOI:10.1021/ac0485435
|
Xia B, Guo P R, Lei Y Q, et al. 2016. Investigating speciation and toxicity of heavy metals in anoxic marine sediments-a case study from a mariculture bay in Southern China[J]. Journal of Soils and Sediments, 16(2): 665–676.
DOI:10.1007/s11368-015-1267-3
|
Yi Y J, Yang Z F, Zhang S H. 2011. Ecological risk assessment of heavy metals in sediment and human health risk assessment of heavy metals in fishes in the middle and lower reaches of the Yangtze River basin[J]. Environmental Pollution, 159(10): 2575–2585.
DOI:10.1016/j.envpol.2011.06.011
|
袁国明, 何桂芳. 2015. 广东柘林湾至大埕湾海域表层沉积物重金属分布与环境地球化学特征[J]. 地球与环境, 2015, 2: 190–197.
|
Zhang G Z, Pan Z K, Hou X W, et al. 2015. Distribution and bioaccumulation of heavy metals in food web of Nansi Lake, China[J]. Environmental Earth Sciences, 73: 2429–2439.
DOI:10.1007/s12665-014-3592-z
|
 2019, Vol. 39
2019, Vol. 39


