2. 河南大学环境与规划学院, 开封 475004
2. College of Environment and Planning, Henan University, Kaifeng 475004
有色溶解有机物(Chromophoric Dissolvable Organic Matter, CDOM)又称黄色物质, 广泛存在于各种自然水体中, 是溶解性有机物的重要组成部分(Bricaud et al., 1981).CDOM显著影响水下光场, 在水体中会发生光化学反应, 进而影响水体生物地球化学循环和碳循环(张运林, 2011).CDOM是由陆源物质和浮游植物降解产生, 在大洋水体中CDOM浓度来源主要是海水中低等植物残体腐烂降解, 而在近海及内陆水体, CDOM受陆源物质和浮游植物降解共同影响, 陆源物质输入成为其主要组成部分(张运林等, 2005).CDOM由腐殖酸、富里酸、芳烃聚合物等一系列物质组成, 在紫外波段的强烈吸收限制了UV-B辐射, 对水体生态系统产生影响(陈晓玲等, 2009).CDOM吸收光后释放光子的部分作为荧光溶解有机物(FDOM), 它可用于追踪DOM的不同部分的供应、混合和去除(Fukuzaki et al., 2014).因此, CDOM中的腐殖酸与富里酸的比例以及不同类型的荧光峰值均能在一定程度上展示水体的污染状况(Vahatalo et al., 2005).因此, 对于CDOM光学特性的研究能很好地反映水体生态环境, 同时对水色遥感反演具有重要作用.
近年来, 内陆自然水体中有关CDOM的研究已经成为热点.国内外一些学者对CDOM的光学特性、组成及空间分布、基于三维荧光光谱示踪CDOM来源等方面做出了大量的研究, 主要集中在平原地区的大型湖泊、河流、河口等(张运林等, 2007;朱伟建等, 2010).张运林等(2007)对于夏季太湖CDOM来源及空间分布差异的研究;朱伟建等(2010)对长江口及其邻近海域CDOM光学特性及混合行为进行研究;Zhang等(2010)通过营养状态和海拔高度的差异, 研究云贵高原湖泊CDOM的特征和来源;王书航等(2016)利用三维荧光光谱-平行因子分析法研究蠡湖CDOM的分布特征及其来源, 并探讨不同组分荧光强度与水质因子的相关性.还有一些学者主要针对于环境要素对CDOM光学特征的影响研究(Williams et al., 2010;Hong et al., 2012;魏珈等, 2016).河流溶解有机物(DOM)的组成可能受到地貌、水文、土地利用/土地覆盖、水生光强度和流域内的微生物活动等各种环境因素的影响(Yamashita et al., 2010;Williams et al., 2010;Hong et al., 2012).如Graeber等(2012)对欧洲中部上游河流DOM研究发现, 其组成受到不同土地利用类型强烈影响;Yang等(2012)对中国东南部亚热带河流的研究发现, 流域土地利用变化对DOM组成有影响;Shao等(2016)研究发现, 在干旱-半干旱区, 降雨量、蒸发量、土地利用均对辽河流域CDOM的光学特性产生影响.但目前有关高原地区河流中CDOM的光学特性、来源及其分布特征的研究, 以及高原地区环境要对CDOM特征的影响的研究相对较少, 尤其是对于干旱区高原地区河流CDOM光学特性的研究更加缺乏.因此开展干旱区高原河流CDOM光学特性、组成及来源的研究, 对干旱区河流生态系统碳循环过程、生物光学模型的参数化都具有重要的意义.
湟水流域位于青海省东部, 地处青藏高原与黄土高原的交界地带, 海拔在1400 m以上;无定河流域位于陕西省北部, 地处黄土高原, 海拔高于550 m.湟水和无定河是黄河流域的重要支流, 由于流域海拔较高, 降水量较少, 降水变率大, 水资源较为短缺.因此水资源对于两个流域社会经济发展具有重要作用.有研究表明, 海拔高度可通过抑制人类活动、改变UV-B辐射和集水区面积来影响CDOM的光学特征(Jansson et al., 2008).因此, 本文通过选择高海拔地区河流CDOM的吸收光谱参数、荧光参数及三维荧光光谱分析其光学特征、组成与来源, 并通过冗余分析(RDA)对水质参数与CDOM的光学特征参数进行分析, 对影响CDOM的因素进行初步判断, 以期为西北高原地区河流水资源管理与水质变化特征的研究提供数据参考.
2 材料与方法(Materials and methods) 2.1 研究区概况湟水(108°00′E~110°35′E, 37°00′N~39°00′N)是黄河上游的一级支流, 发源于青海省海晏县境内的包呼图山, 经兰州市汇入黄河, 流经青海、甘肃两省.河流干、支流呈羽状水系, 流域内河流落差大, 大部分海拔为2200~3000 m, 地势西北高东南低;流域地处西北内陆高原, 属凉温干旱半干旱气候区, 降水量集中, 6—9月降水占全年降水量的70%左右.湟水水体受工业生活污水排放影响较大, 氨氮和总氮污染严重, 其流经西宁市的河段污染最重(邱瑀等, 2017).无定河(99°00′E~103°20′E, 36°00′N~38°15′N)位于陕西省北部黄土高原地区, 是黄河中游的一级支流, 发源于定边县白于山北麓, 干流全长491 km, 流域面积30261 km2, 由西北向东南于清涧县河口注入黄河.无定河流域属于温带大陆性干旱半干旱季风气候, 多年降水平均值387.8 mm, 流域内水土流失严重, 面积23137 km2, 河流含沙量大(任宗萍等, 2019).
2.2 研究区样点分布于2017年夏季分别对无定河和湟水河流及其支流进行实地采样, 分别采集30个和28个样品, 样点分布如图 1所示.样点的布设原则是尽量均匀分布于各河流, 在充分考虑子流域自然和人文状况的前提下, 根据实际采样点周围环境的实际情况进行适当调整.水样采集的同时使用手持式GPS记录每个样点的经纬度和海拔高度、溶解氧(DO)、酸碱度(pH)、温度、透明度等.采样前将采样器和样品瓶润洗, 采集水样后, 冷藏储存并带回实验室进行分析, 整个分析过程在2~3 d内完成.
 |
| 图 1 采样点分布及土地利用类型 Fig. 1 Distribution of sampling points and land use for the study areas |
CDOM吸收系数的测定:CDOM的测定是通过0.2 μm微孔聚碳酸酯膜过滤水样后, 利用岛津-紫外分光光度计UV-3600(Shimadzu UV-3600PC, 日本岛津)测得200~800 nm波长处的吸光度, 然后根据式(1)计算得到各波长处的吸收系数:
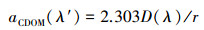
|
(1) |
式中, aCDOM(λ′)为未校正的CDOM吸收系数(m-1), D(λ)为吸光度;r为光路径(m).为消除过滤液中残留细小颗粒物的散射影响, 本文用750 nm处吸收系数进行校正(Bricaud et al., 1981), 如式(2)所示, 得到校正后的吸收系数(m-1):
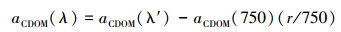
|
(2) |
由于CDOM浓度无法直接测定, 各研究区域的水体理化性质与光学性质的差异性对CDOM丰度表征的波段不同(江俊武等, 2017).目前研究多采用350、355、375和440 nm处的吸收系数来表征CDOM浓度(Kowalczuk et al., 2005;Zhang et al., 2005;Zhang et al., 2011).为了更好的与前人的研究进行对比分析, 本文采用CDOM在440 nm处的吸收系数[a(440)]表征CDOM的浓度.
CDOM的三维荧光数据(EMMs)通过日立F-7000荧光光度计(Hitachi Fluorescence spectrophotometer F-7000)测定获得, 扫描光谱进行仪器自动校正.EMMs主要受到瑞利散射、拉曼散射以及内部滤波器的影响.其中, 拉曼散射可以通过扣除空白平均值的方法进行消除;瑞利散射主要是将发射波长≤激发波长+5 nm以及发射波长≥激发波长+300 nm的2个区域内的数值全部用0值来取代;对仪器的激发与发射光谱的校正主要是去除仪器内部滤波器的影响, 从而得到CDOM真实荧光光谱(Zhang et al., 2011;Mc Knight et al., 2001).
叶绿素a浓度(chloropyhll a, Chla)的测定采用0.45 μm GF/F玻璃纤维滤纸(Whatman)过滤150~200 mL水样, 将滤膜剪碎放入15 mL离心管中, 加入10 mL 90%的丙酮溶液, 混合均匀后避光冷藏24~48 h, 取其离心后上清液倒入1 cm石英比色皿中, 用90%的丙酮溶液作空白参考, 置于UV-3600紫外分光光度计分别测得630、647、664和750 nm处的吸光度, 计算得出Chla的浓度(Arar et al., 1997).
溶解有机碳(DOC)浓度测定:水样经灼烧过后的Whatman GF/F膜过滤, 将过滤完成后的水样置于TOC分析仪(vario TOC select, Elementar)测定DOC浓度, 单位mg · L-1.总氮(TN)的测定参照《湖泊富营养化调查规范》(金相灿等, 1990).悬浮物浓度(TSM)的测定方法采用灼烧称重法测定(张运林等, 2004).
2.4 数据预处理S值的确定:S值通常用以下公式表示, 如式(3)所示(Bricaud et al., 1981):
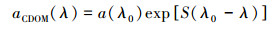
|
(3) |
式中, aCDOM(λ)为CDOM的吸收系数;λ为波长;λ0为参考波长;S为光谱斜率值, 本文选取440 nm作为参考波长, 利用Matlab软件, 采用最小二乘法拟合得到斜率值S.
CDOM比吸收系数的计算:如式(4)所示(Kowalczuk et al., 2010):
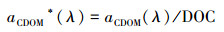
|
(4) |
式中, aCDOM*(λ)和aCDOM(λ)分别为波长为λ处的CDOM比吸收系数和吸收系数, 单位分别为L · mg-1 · m-1和m-1.
SUVA254:为254 nm处UV的吸光度与DOC浓度之比, 表征DOM的芳香性.SUVA254的计算方法如式(5)所示(Weishaar et al., 2003):
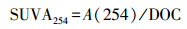
|
(5) |
荧光强度(Fn)采用同步测定的硫酸奎宁作参照, 在激发波长355 nm、发射波长450 nm处的荧光值作为该点的荧光强度, 用QSU单位表示(Wada et al., 2007).CDOM的各荧光分量可以通过平行因子分析法(PARAFAC)将三维荧光光谱进行解谱, 从而获得最优CDOM组分数目, 即各荧光分量.但由于本文研究对象为河流, 不同河流之间的荧光成分差别较大, 平行因子分析法并不能完全识别各分量.因此, 本文采用“Peak Picking”方法进行各荧光峰的识别.荧光指数FI是指激发波长Ex为370 nm时, 荧光发射光谱Em在450 nm和500 nm处的荧光强度比值(Mc Knight et al., 2001).生物源指数BIX是激发波长Ex为310 nm时, 发射波长在380 nm与430 nm处荧光强度的比值(Huguet et al., 2009).腐殖化指数HIX为激发波长Ex为254 nm时, 发射波长在435~480 nm与300~345 nm波段内的荧光强度积分值的比率(Huguet et al., 2009).
2.5 数据分析与处理运用SPSS19.0软件进行数据统计分析, 包括样本平均值和标准差等, 为了检验两组变量之间的差异, 使用Mann-Whitney U检验(显著性水平为0.05);显著性水平为:p<0.01为极显著相关;0.01<p<0.05为显著性相关;p>0.05为不相关.利用Origin9.0软件进行相关分析作图, Conoco5.0进行冗余分析(RDA).
3 结果与分析(Results and analysis) 3.1 流域水质状况水质参数是用来表示水体质量优劣程度和变化趋势特征指标.水质参数的测定对于确定水体污染等级及水体中所含污染物质状况具有重要作用.通过测定Chla、DO等水质参数来反映湟水与无定河的水质状况, 如图 2所示.湟水与无定河DOC浓度的差异较大, 变化范围及均值分别为3.82~6.62(5.06±0.67)、1.27~10.48(3.77±2.21) mg · L-1.研究表明, 河流DOC浓度受河流排放、污染、土地利用/覆盖、土壤类型和气候的影响(Zhao et al., 2018).一方面, 湟水流经西宁市, 工农业废水的排放导致其DOC浓度较高;另一方面, 湟水海拔高、温度低, 有机质分解慢.湟水TSM、TN均高于无定河(p<0.05), 而无定河Chla((27.54±47.37) μg · L-1)高于湟水((2.96±2.99) μg · L-1), Chla浓度存在显著差异(p<0.05).出现这一现象的主要原因是无定河流域土质疏松, 生产活动及降雨对于河流沿岸侵蚀导致地表较多营养盐物质进入河流促进浮游植物的生长, 进而使其Chla浓度增高.此外, 水下光照条件也是影响浮游植物生长的重要因素, 而TSM能够改变水下光照条件(钱昊钟等, 2013).无定河TSM浓度低于湟水说明无定河水下光照条件相对较好, 促进浮游植物的生长, 导致其Chla浓度较高.
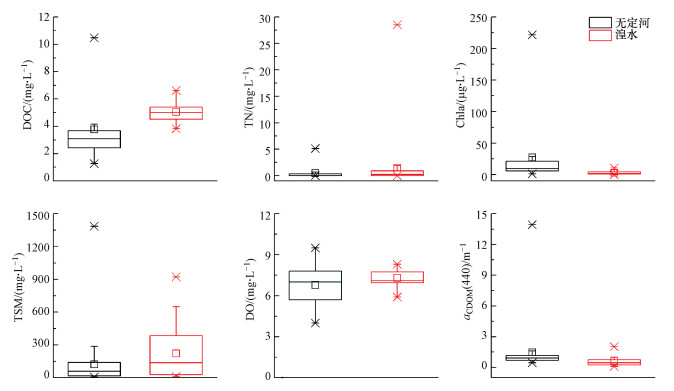 |
| 图 2 湟水、无定河水质状况 Fig. 2 Water quality of Huangshui River and Wudinghe River |
湟水和无定河水体CDOM在280~750 nm的吸收光谱随波长的增加呈现出逐渐衰减的趋势, 无明显吸收谷与吸收峰, 无定河CDOM吸收光谱变化范围明显高于湟水(图 3).湟水和无定河a(440)的变化范围分别为0.09~2.03 m-1和0.46~13.93 m-1, 其均值分别为(0.65±0.53) m-1和(1.47±2.41) m-1.
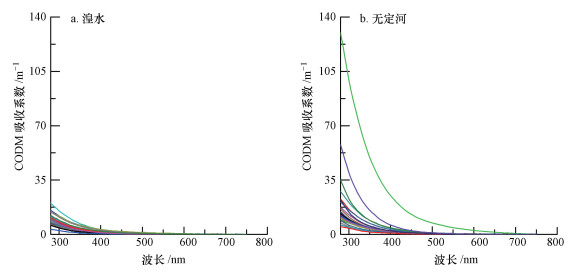 |
| 图 3 湟水、无定河CDOM光谱吸收系数 Fig. 3 Spectral absorption coefficients of CDOM in Huangshui and Wudinghe rivers |
前人研究表明, CDOM吸收系数与DOC浓度存在正相关(Vecchio et al., 2004).本文分别对湟水与无定河a(440)与DOC的回归分析发现, a(440)与DOC均呈线性正相关(R2=0.295、p<0.01;R2=0.452、p<0.01), 与张运林(2007)对太湖梅梁湾夏季研究的结果相似.DOC分为有色与无色部分, 而CDOM代表其中有色的部分(张运林等, 2007).因此, DOC中的无色部分的比例是影响CDOM与DOC相关与否的主要原因.一方面, 夏季浮游植物降解产生较多的无色DOC(张运林, 2011);另一方面, 光的漂白作用即夏季强烈的紫外辐射会导致CDOM发生光降解, 产生较多无色的DOC(张运林等, 2007), 因此导致本文中CDOM与DOC的相关性较低.
通过对a(440)与Chla浓度进行回归分析发现, 湟水a(440)与Chla浓度具有线性正相关关系(R2=0.24, p<0.01);而无定河a(440)与Chla浓度不具有线性相关(R2=0.001, p=0.899), 说明夏季无定河CDOM浓度以流域内陆源物质输入为主(张运林等, 2007).
CDOM比吸收系数a*(λ)表征单位DOC浓度的CDOM对光的吸收能力, 随不同的水体而发生变化(张运林等, 2007).通过对a(440)与a*(440)进行回归分析发现, 两者存在显著的线性相关, 湟水与无定河两者的线性拟合结果分别为R2=0.962(p<0.01)、R2=0.776(p<0.01).这与Kowalczuk等(2010)得到的结果一致, 即较高的CDOM吸收系数对应较高的CDOM比吸收系数.
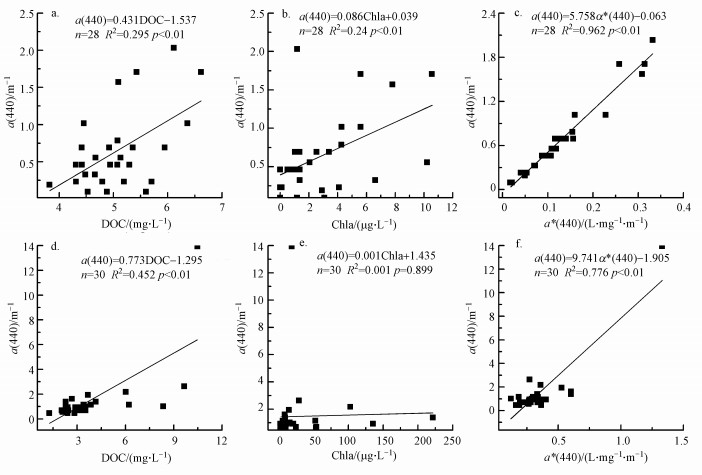 |
| 图 4 湟水、无定河a(440)与水质参数相关性 (a~c湟水、d~f无定河) Fig. 4 The Correlations between water quality parameters and a(440) of Huangshui River and Wuding River (a~c: Huangshui River; d~f: Wudinghe River) |
研究表明, S275~295、SUVA254与DOM的相对分子量和芳香性有关(Helms et al., 2008;Chowdhury et al., 2013), 因此本研究利用S275~295、SUVA254研究湟水与无定河CDOM的来源.湟水与无定河S275~295的变化范围及均值为0.012~0.027、(0.018±0.004) nm-1和0.014~0.019、(0.016±0.002) nm-1.可以看出, 湟水S275~295的变化范围及均值均大于无定河, 说明其分子量组成小于无定河.与其它水体相比, 湟水和无定河S275~295高于长江CDOM的S275~295值(0.011~0.016 nm-1)(Chen et al., 2013);湟水S275~295均值与西辽河结果较为接近, 而无定河则低于西辽河(邵田田等, 2018).因此, 与其它平原河流的研究相比, 湟水与无定河的分子量大小的变化也更为复杂.SUVA254值越大表示其芳香性程度越高(Weishaar et al., 2003).湟水SUVA254(1.06±0.29)低于无定河(2.66±1.10), 进而说明无定河CDOM芳香性高于湟水.
3.5 CDOM荧光特性差异通过对比研究发现, 无定河的荧光强度Fn变化范围大于湟水(图 5), 主要是因为无定河处于黄土高原地区, 土层脆弱, 降水变化大, 河流沿岸陆源物质输入强烈且各点的差异较大.从两流域河流Fn的空间分布来看, 湟水的Fn主要集中在7~50范围内, 多分布于湟水支流大通河, 少数高值分布于湟水干流, 特别是西宁市附近;而无定河则集中分布于20~100之间, 高值多分布于无定河下游.通过与土地利用对比发现, 两条河流的Fn相对高值点主要分布于流域内的耕地或城市等一些受人类干扰较大的区域(邵田田等, 2014).本文对a(440)与Fn(355)回归分析发现(图 6), 湟水与无定河a(440)与Fn(355)均具有较好的拟合优度.而湟水相关性略高于无定河, 主要是由于无定河耕地分布较大受人为干扰较严重, 使其相关性较低(邵田田等, 2014).
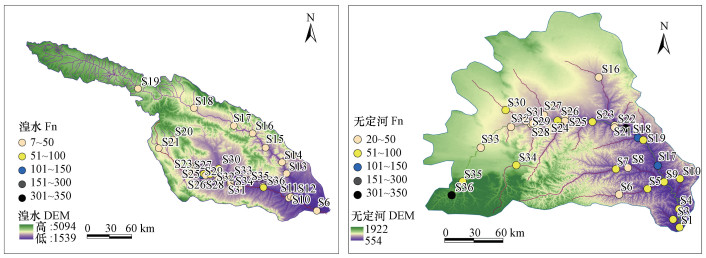 |
| 图 5 湟水、无定河Fn空间分布 Fig. 5 Spatial distribution of Fn in Huangshui River and Wudinghe River |
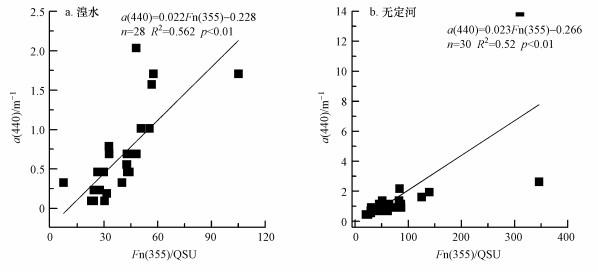 |
| 图 6 a(440)与Fn(355)相关性 Fig. 6 Correlations between a(440) and Fn(355) |
为了解水体中CDOM的来源和腐殖化程度(Helms et al., 2008;Zhang et al., 2010), 本文采用FI、BIX和HIX研究河流CDOM来源性质特征.FI可用来表征溶解有机质中腐殖质的来源, 湟水(1.01±0.17)、无定河(1.11±0.04)的FI均小于1.4, 说明两条河流水体CDOM的来源以陆源输入为主(Mc Knight et al., 2001).BIX是反映新产生的DOM在整体DOM中所占的比例, BIX越高, 说明新近自生源组分的比例越高.湟水的BIX为0.16~0.75(均值0.61±0.11), 大多数样点BIX小于0.7, 仅有S26、S32处于0.7~0.8之间, 说明湟水具有较少的自生成分(Huguet et al., 2009).无定河BIX为0.49~0.95(均值0.70±0.09), 除S25、S34外, 大部分样点处于0.7~0.8之间, 说明无定河具有中度新近自生源特征(Huguet et al., 2009).HIX通常用来表征有机质的腐殖化程度, HIX越高则腐殖化程度越高, 芳香性越强.通过对湟水HIX统计发现, 其最小值为2.11, 表明湟水的腐殖化程度较高, 且存在较多的富里酸物质(Zhang et al., 2010).无定河HIX表明河流主要以陆源为主, HIX的低值区主要集中在河流中上游的林地和草地区域, 高值区主要分布于河流下游的耕地区.
通过对各样点CDOM的三维荧光光谱分析得到各样点的荧光峰.荧光峰主要包括生物降解来源的类蛋白质荧光峰(类酪氨酸荧光峰B, Ex/Em=220~225/340~380 nm或Ex/Em=270~280/305~320 nm;类色氨酸荧光峰T, Ex/Em=230~235/345~390 nm)和外源输入的类腐殖质荧光峰(紫外区类腐殖酸荧光峰A, Ex/Em=230~270/440~455 nm;可见光区类腐殖酸荧光峰C, Ex/Em=305~340/410~450 nm)(黄昌春等, 2010;傅平青等, 2005).
为进一步了解湟水与无定河CDOM不同组分来源, 本文分别对两条河流的4个荧光峰、a(440)、S、SUVA254、Fn进行相关分析发现, 两条河流的类腐殖质荧光峰(A峰、C峰)均存在显著性相关(p<0.01)(表 1), 说明湟水与无定河类腐殖质荧光峰所表示的腐殖质组分存在同源性, 结果与学者对贵州湖泊和辽河的研究发现一致(傅平青等, 2005;邵田田等, 2018).湟水的类蛋白质荧光峰之间不存在相关性, 无定河则显著正相关(p<0.01), 说明无定河类蛋白质荧光峰间存在一定的联系或其组成具有相同的来源.无定河流域耕地分布广泛(图 1), 人类活动干扰较大, 导致其类蛋白质组分受到陆源输入的较大影响(Mostofa et al., 2010), 从而展现出较好的相关性.
| 表 1 CDOM荧光组分与a(440)、S、SUVA254、Fn相关性 Table 1 Correlations between CDOM fluorescence components and a(440), S, SUVA254, Fn |
另外, 湟水和无定河样品的Fn与类腐殖质荧光峰(A、C)均存在相关性(表 1).湟水A峰、C峰、T峰与S值存在负相关而与SUVA254具有正相关;无定河的各荧光峰与S值不相关, 而与SUVA254具有显著正相关.Fn与类腐殖质荧光峰(A、C)的相关性表明类腐殖质荧光峰是湟水与无定河CDOM荧光的主要贡献者, 同时也表明控制两条河流吸收的发色团与控制荧光的荧光团之间存在一定的内部联系(程远月等, 2010).另外, 湟水的T峰与a(440)也具有相关性, 说明CDOM发色团对T峰具有一定的影响.
3.6 河流水质参数与荧光参数的关系本研究将荧光组分、荧光指数、荧光峰作为一组数据矩阵, 将水质参数作为另一组数据矩阵, 通过Canoco5.0软件进行RDA分析, 确定CDOM荧光参数与水质参数的关系.为了使CDOM光学特征参数与水质参数获得正态分布, 对原始数据进行lg(x+1)的转换, 并剔除偏相关系数大于0.8和膨胀因子大于20的水质因子, 并用999次的蒙的卡罗检验来验证变量的显著性.
可以发现(图 7), 湟水第一、第二排序轴特征值分别为0.373、0.151, 无定河的两个排序轴特征值分别为0.42、0.1.湟水Chla、DOC、Tur与类腐殖质荧光峰(A峰、C峰)、Fn呈显著相关, 说明Chla与DOC是湟水类腐殖质组分的主要组成物质, 同时对Fn的影响较大.TN、浊度(Tur)与FI呈负相关;Tur与T峰、Fn正相关;pH与A峰、C峰、T峰及Fn负相关, 与HIX正相关.无定河DOC与A峰、C峰、T峰、Fn及HIX都呈现出正相关性而DO与之呈显著负相关;pH与HIX正相关;TSM、EC、Tur与A峰、C峰、Fn呈显著正相关(p<0.05).在本文所研究的高原河流中, TN与B峰之间均存在负相关.
 |
| 图 7 湟水、无定河各荧光参数与水质参数的冗余分析 Fig. 7 Redundancy analysis of fluorescence parameters and water quality parameters of Huangshui and Wudinghe river |
研究表明, DO与水温、浮游生物、pH、悬浮物浓度等多种因素相互制约(Yamada et al., 2012).湟水和无定河的DO与CDOM荧光参数间相关性的差别主要是由于DO受悬浮物浓度的影响, 两样区河流TSM差别较大, 从而导致相关性的不同.pH对DOM的光降解速率具有显著影响, 增加pH会增加DOM的吸光度(Timko et al., 2015);同时, pH会影响腐殖质和富里酸的荧光强度, 随着pH的增加, 腐殖质类物质的荧光强度也会增加(Patel-Sorrentino et al., 2002).而本文中, pH与A峰、C峰之间表现出负相关性, 主要原因在于研究区的海拔高度和pH同时增强了CDOM的光降解速率, 导致与前人的研究有所不同(Timko et al., 2015).湟水和无定河都是以陆源物质输入为主, 河流的Tur影响水下光照条件, 进而抑制CDOM的吸光度, 促使湟水与无定河的Tur与Fn正相关.水质参数与荧光参数之间不同的相关系数表明, 可变来源和变化过程可能掩盖了广泛的水生环境中DOM的质量和数量之间的任何广泛的关系(Yamashita et al., 2015).
| 表 2 CDOM光学特征参数与水质参数相关性 Table 2 Correlations between CDOM optical characteristic parameters and water quality parameters |
1) 通过水质参数分析发现湟水与无定河DOC浓度的显著差异受流域内工农业废水的排放、海拔高度和自然状况的影响;无定河Chla浓度高于湟水是由于其地表土质状况以及TSM对于水下光照条件的影响.a(440)与Chla浓度的相关性说明无定河河流现场产生(生物活动)作用较小.
2) 基于S275~295、SUVA254的研究发现, 无定河分子量和芳香性程度均大于湟水, 湟水分子量变化较大.
3) 通过FI、BIX和HIX的分析表明湟水以陆源输入为主, 腐殖化程度高;无定河以陆源输入为主, 同时BIX指示其存在一定的自生成分.
4) 通过分析CDOM荧光峰发现, 类腐殖质荧光峰是湟水与无定河CDOM荧光的主要贡献者.
5) 湟水DOC、Chla、pH对类腐殖质荧光峰及荧光强度影响较大(p<0.01);无定河DOC、电导率(EC)、浊度(Tur)与类腐殖质荧光峰及荧光强度呈显著正相关(p<0.01).
Arar E J, Collins G B. 1997. Method 445.0 in vitro determination of chlorophyll a and phytoplankton in marine and freshwater algae by fluorescence[Z].United States Environmental Protection Agency, Office of Research and Development, National Exposure Research Laboratory
|
Bricaud A, Morel A, Prieur L. 1981. Absorption by dissolved organic matter of the sea(Yellow Substance)in the UV and Visible Domains[J]. Limnology and Oceanography, 26: 43–53.
DOI:10.4319/lo.1981.26.1.0043
|
Chen H, Meng W, Zheng B, et al. 2013. Optical signatures of dissolved organic matter in the watershed of a globally large river (Yangtze River, China)[J]. Limnologica-Ecology and Management of Inland Waters, 43(6): 482–491.
DOI:10.1016/j.limno.2013.04.004
|
Chowdhury S. 2013. Trihalomethanes in drinking water:Effect of natural organic matter distribution[J]. Water, 39(1): 1–7.
|
陈晓玲, 陈莉琼, 于之峰, 等. 2009. 长江中游湖泊CDOM光学特性及其空间分布对比[J]. 湖泊科学, 2009, 21(2): 248–254.
DOI:10.3321/j.issn:1003-5427.2009.02.014 |
程远月, 郭卫东, 龙爱民, 等. 2010. 利用三维荧光光谱和吸收光谱研究雨水中CDOM的光学特性[J]. 光谱学与光谱分析, 2010, 30(9): 2413–2416.
DOI:10.3964/j.issn.1000-0593(2010)09-2413-04 |
傅平青, 刘丛强, 吴丰昌. 2005. 溶解有机质的三维荧光光谱特征研究[J]. 光谱学与光谱分析, 2005, 25(12): 2024–2028.
DOI:10.3321/j.issn:1000-0593.2005.12.031 |
Fukuzaki K, Imai I, Fukushima K, et al. 2014. Fluorescent characteristics of dissolved organic matter produced by bloom-forming coastal phytoplankton[J]. Journal of Plankton Research, 36(3): 685–694.
DOI:10.1093/plankt/fbu015
|
Graeber D, Gelbrecht J, Pusch M T, et al. 2012. Agriculture has changed the amount and composition of dissolved organic matter in Central European headwater streams[J]. Science of the Total Environment, 438(1): 435–446.
|
Helms J R, Stubbins A, Ritchie J D, et al. 2008. Absorption spectral slopes and slope ratios as indicators of molecular weight, source and photobleaching of chromophoric dissolved organic matter[J]. Limnology and Oceanography, 53(3): 955–969.
DOI:10.4319/lo.2008.53.3.0955
|
Hong H S, Yang L Y, Guo W D, et al. 2012. Characterization of dissolved organic matter under contrasting hydrologic regimes in a subtropical watershed using PARAFAC model[J]. Biogeochemistry, 109(1/3): 163–174.
|
Huguet A, Vacher L, Relexans S, et al. 2009. Properties of fluorescent dissolved organic matter in the Gironde Estuary[J]. Organic Geochemistry, 40(6): 706–719.
DOI:10.1016/j.orggeochem.2009.03.002
|
黄昌春, 李云梅, 王桥, 等. 2010. 基于三维荧光和平行因子分析法的太湖水体CDOM组分光学特征[J]. 湖泊科学, 2010, 22(3): 375–382.
|
江俊武, 李帅东, 等. 2017. 夏季太湖CDOM光学特性空间差异及其来源解析[J]. 环境科学研究, 2017, 30(7): 1020–1030.
|
金相灿, 屠清瑛. 1990. 湖泊富营养化调查规范(第2版)[M]. 北京: 中国环境科学出版社: 197–206.
|
Jansson M, Hickler T, Jansson A, et al. 2008. Links between terrestrial primary production and bacterial production and respiration in lakes in a climate gradient in subarctic Sweden[J]. Ecosystems, 11(3): 367–376.
DOI:10.1007/s10021-008-9127-2
|
Kowalczuk P, Ston'-Egiert J, Cooper W J, et al. 2005. Characterization of chromophoric dissolved organic matter (CDOM) in the Baltic Sea by excitation emission matrix fluorescence spectroscopy[J]. Marine Chemistry, 96(3): 273–292.
|
Kowalczuk P, Zablocka M, Sagan S, et al. 2010. Fluorescence measured in situ as a proxy of CDOM absorption and DOC concentration inthe Baltic Sea[J]. Oceanologia, 52(3): 431–471.
DOI:10.5697/oc.52-3.431
|
Mc Knight D M, Boyer E W, Westerhoff P K, et al. 2001. Spectrofluorometric characterization of dissolved organic matter for indication of precursor organic material and aromaticity[J]. Limnology and Oceanography, 46(1): 38–48.
DOI:10.4319/lo.2001.46.1.0038
|
Mostofa K M G, Wu F C, Liu C Q, et al. 2010. Characterization of Nanming River(southwestern China) sewerage-impacted pollution using an excitation-emission matrix and PARAFAC[J]. Limnology, 11(3): 217–231.
DOI:10.1007/s10201-009-0306-4
|
Patel-Sorrentino N, Mounier S, Benaim J Y. 2002. Excitation-emission fluorescence matrix to study pH influence on organic matter fluorescence in the Amazon basin rivers[J]. Water Research, 36(10): 2571–2581.
DOI:10.1016/S0043-1354(01)00469-9
|
钱昊钟, 赵巧华, 钱培东. 2013. 太湖叶绿素a浓度分布的时空特征及其影响因素[J]. 环境化学, 2013, 32(5): 789–796.
|
邱瑀, 卢诚, 徐泽, 等. 2017. 湟水河流域水质时空变化特征及其污染源解析[J]. 环境科学学报, 2017, 37(8): 2829–2837.
|
任宗萍, 马勇勇, 王友胜, 等. 2019. 生态建设条件下无定河不同地貌区径流变化归因分析[J]. 生态学报, 2019, 39(7): 1–10.
|
Shao T T, Song K S, Jacinthe P A, et al. 2016. Characteristics and sources analysis of riverine chromophoric dissolved organic matter in Liaohe River, China[J]. Water Science and Technology, 74(12): 2843–2859.
DOI:10.2166/wst.2016.457
|
邵田田, 李柳阳, 王涛, 等. 2018. 辽河流域河流秋季CDOM光学特性及影响因素研究[J]. 环境科学学报, 2018, 38(4): 1558–1568.
|
邵田田, 赵莹, 宋开山, 等. 2014. 辽河下游CDOM吸收与荧光特性的季节变化研究[J]. 环境科学, 2014, 35(10): 3755–3763.
|
Timko S A, Gonsior M, Cooper W J. 2015. Influence of pH on fluorescent dissolved organic matter photo-degradation[J]. Water Research, 85(15): 266–274.
|
Vahatalo A V, Wetzel R G, Paerl H W. 2005. Light absorption byphytoplankton and chlromophoric dissolved organic matter in the grainage basin and estuary of the Neuse River, North Carolina(U.S.A)[J]. Freshwater Biology, 50(3): 477–493.
DOI:10.1111/fwb.2005.50.issue-3
|
Vecchio R D, Blough N V. 2004. Spatial and seasonal distribution of chromophoric dissolved organic matter and dissolved organic carbon in the Middle Atlantic Bight[J]. Marine Chemistry, 89(1/4): 169–187.
|
Wada S, Aoki M N, Tsuchiya Y, et al. 2007. Quantitative and qualitative analyses of dissolved organic matter released from Ecklonia cava Kjellman, in Oura Bay, Shimoda, Izu Peninsula, Japan[J]. Journal of Experimental Marine Biology and Ecology, 349(2): 344–358.
DOI:10.1016/j.jembe.2007.05.024
|
Weishaar J L, Aiken G R, Bergamaschi B A, et al. 2003. Evaluation of specific ultraviolet absorbance as an indicator of the chemicalcomposition and reactivity of dissolved organic carbon[J]. Environmental Science Technology, 37(20): 4702–4708.
DOI:10.1021/es030360x
|
Williams C J, Yamashita Y H, Wilson H F, et al. 2010. Unraveling the role of land use and microbial activity in shaping dissolved organic matter characteristics in stream ecosystems[J]. Limnology and Oceanography, 55(3): 1159–1171.
DOI:10.4319/lo.2010.55.3.1159
|
王书航, 王雯雯, 姜霞. 2016. 基于三维荧光光谱-平行因子分析技术的蠡湖CDOM分布特征[J]. 中国环境科学, 2016, 36(2): 517–524.
DOI:10.3969/j.issn.1000-6923.2016.02.031 |
魏珈, 郭卫东, 王志恒, 等. 2016. 降雨事件对不同流域背景河流DOM组成及入海通量的影响[J]. 农业环境科学学报, 2016, 35(4): 737–744.
|
Yamada Y, Mito Y, Igeta A, et al. 2012. Dissolved oxygen concentration in river sediment of the Lake Biwa tributaries, Japan[J]. Limnology, 13(1): 149–154.
DOI:10.1007/s10201-011-0348-2
|
Yamashita Y H, Maie N, Briceno H, et al. 2010. Optical characterization of dissolved organic matter in tropical rivers of the Guayana Shield, Venezuela[J].Journal of Geophysical Research Biogeosciences, 115(G1): https://doi.org/10.1029/2009JG000987
https://www.researchgate.net/publication/235936797_Optical_characterization_of_dissolved_organic_matter_in_tropical_rivers_of_the_Guayana_Shield_Venezuela?ev=auth_pub |
Yamashita Y, Maie N, Briceño H, et al. 2015. Optical characterization of dissolved organic matter in tropical rivers of the Guayana shield, Venezuela[J]. Journal of Geophysical Research Biogeosciences, 115(G1): 214–221.
|
Yang L Y, Hong H S, Guo W D, et al. 2012. Effects of changing land use on dissolved organic matter in a subtropical river watershed, southeast China[J]. Regional Environmental Change, 12(1): 145–151.
DOI:10.1007/s10113-011-0250-9
|
Zhang Y L, Qin B Q, Zhang L, et al. 2005. Spectral absorption and fluorescence of chromophoric dissolved organic matter in Shallow Lakes in the Middle and Lower Reaches of theYangtze River[J]. Journal of Freshwater Ecology, 20(3): 451–459.
DOI:10.1080/02705060.2005.9664760
|
Zhang Y L, Yin Y, Feng L Q, et al. 2011. Characterizing chromophoric dissolved organic matter in Lake Tianmuhu and its catchment basin using excitation-emission matrix fluorescence and parallel factor analysis[J]. Water Research, 45(16): 5110–5122.
DOI:10.1016/j.watres.2011.07.014
|
Zhang Y L, Zhang E L, Yin Y, et al. 2010. Characteristics and sources of chromophoric dissolved organic matter in lakes of the Yungui Plateau, China, differing in trophic state and altitude[J]. Limnology and Oceanography, 55(6): 2645–2659.
DOI:10.4319/lo.2010.55.6.2645
|
Zhao Y, Song K S, Lv L L, et al. 2018. Relationship changes between CDOM and DOC in the Songhua River affected by highly polluted tributary, Northeast China[J]. Environmental Science and Pollution Research, 25(25): 25371–25382.
DOI:10.1007/s11356-018-2604-z
|
张运林, 秦伯强, 陈伟民, 等. 2004. 太湖水体中悬浮物研究[J]. 长江流域资源与环境, 2004, 13(3): 266–271.
DOI:10.3969/j.issn.1004-8227.2004.03.014 |
张运林, 秦伯强, 马荣华. 2005. 太湖典型草、藻型湖区有色可溶性有机物的吸收及荧光特性[J]. 环境科学, 2005, 26(3): 142–147.
|
张运林, 秦伯强. 2007. 梅梁湾、大太湖夏季和冬季CDOM特征及可能来源分析[J]. 水科学进展, 2007, 18(3): 415–423.
DOI:10.3321/j.issn:1001-6791.2007.03.018 |
张运林. 2011. 湖泊光学研究进展及其展望[J]. 湖泊科学, 2011, 23(4): 483–497.
|
朱伟建, 沈芳, 洪官林. 2010. 长江口及邻近海域有色溶解有机物(CDOM)的光学特性[J]. 环境科学, 2010, 31(6): 2292–2298.
|
 2019, Vol. 39
2019, Vol. 39


