在氯代有机污染物中, 氯酚类化合物由于芳环结构和氯取代原子的存在而具有很强的抗降解能力(Wang et al., 1999).其中, 2,4-二氯苯酚(2,4-DCP)是合成一系列农药、杀菌剂等的中间体, 同时还用于制造防蛀、防腐和种子消毒过程中经常使用的某些甲基氯酚类化合物.其排放后在环境中具有一定的稳定性, 通过地下水迁移扩散, 污染范围可进一步扩大(Keith et al., 2003).美国EPA和中国环境监测总站的优先污染物名单中2,4-二氯苯酚均被列为近期控制对象(Chunming et al., 1999;Hurdzan et al., 2009).Gillham和O′Hannesin(Gillham et al., 1994)提出零价铁(ZVI)可用于地下水的原位修复, 以及去除水体或土壤中的含氯有机物.
ZVI作为一种强还原剂, 因价格低廉, 无毒性等优势被广泛用于水处理领域, 且已被证实可去除多种污染物, 包括含氯有机物(Scherer et al., 2001)、重金属(Chen et al., 2008)、硝酸盐(Yang et al., 2005)和染料(Nam et al., 2000)等.与ZVI相比, 纳米零价铁(NZVI)有更大的比表面积与更强的还原能力, 在受污染地下水的原位修复中表现出极大的潜力与优势(Zhao et al., 2016).因此本研究使用NZVI对2,4-二氯苯酚进行脱氯去除.目前关于纳米零价铁的研究较多, 已趋于成熟(Song et al., 2005;And et al., 1997).但是, NZVI在自然环境中极易聚集与氧化, 这大大降低了其反应活性和迁移扩散能力(Li et al., 2011;Laumann et al., 2014).并且NZVI对低氯代有机物的还原降解能力有限(Lien et al., 1999).这两个因素限制了NZVI的应用与发展.
针对NZVI对低氯有机物降解能力有限的问题, 有研究表明, 在NZVI表面负载上另一种还原电位高的金属后, 形成双金属体系, 可进一步提高其反应活性(Mallát et al., 1991).目前研究比较多的铁基双金属有Fe/Pd双金属(Fang et al., 2008;Wang et al., 2013)、Fe/Ag双金属(Sahu et al., 2017;Zhou et al., 2016)、Fe/Cu双金属(Wang et al., 2015;Wu et al., 2017)等.曾宪委等(2013)制备了Fe/Ag、Fe/Pb、Fe/Cu 3种双金属对六氯苯(HCB)进行降解, 比较其催化性能, 实验结果表明3种过渡金属对HCB的脱氯都有显著的促进作用, 且催化能力依次为:Ag>Pb>Cu.曾宪委等的实验结果显示Pb与Ag的催化作用优于Cu, 但是零价铁技术最终将应用于地下水的修复, 在修复工程中, 金属的用量很大, Pb与Ag价格昂贵将会增加工程的成本, 而Cu价格低廉且来源丰富, 并且有研究发现Cu能够降低打开碳氯键所需要的活化能(Yang et al., 1997).因此本研究选用Cu作为铁的复合金属.
针对NZVI在自然环境中极易聚集与氧化的问题, 有研究表明, 对NZVI进行表面改性可以很大程度上避免其聚集与氧化(Zhao et al., 2016).表面改性的材料种类众多, 使用较为广泛的有:聚苯乙烯磺酸钠(PSS)(Schrick et al., 2004)、聚丙烯酸(PAA)(Kanel et al., 2007)、聚丙烯酰胺(PAM)(Sirk et al., 2009)、聚乙烯醇(PVA)(Feng et al., 2014)、羧甲基纤维素纳(CMC)(Hang et al., 2013)等.将这些物质包覆于NZVI表面, 可使其与氧气部分隔绝, 抗氧化性显著提升, 又通过空间位阻效应有效地阻止了NZVI的聚集和沉降(张永祥等, 2017).Cirtiu等(2011)测试了4种材料(CMC、PSS、PAA、PAM)对NZVI改性的影响.制得的NZVI平均粒径依次为:PAA-NZVI(189 nm)>PSS-NZVI(182 nm)> PAM-NZVI (101 nm)>CMC-NZVI(84 nm), 得出CMC是最有效的稳定剂.并且, CMC是一种环境友好且价格低廉的材料.因此, 本研究选用CMC作为改性材料.
综上, 本研究采用铜作为纳米铁的复合金属, 制得纳米Fe/Cu双金属, 并用CMC对其改性.利用扫描电子显微镜、X射线晶体衍射仪、比表面积分析仪对其结构组成进行分析表征.通过沉降实验对比不同CMC包覆比下纳米Fe/Cu双金属的分散性, 并进行不同CMC包覆比下双金属对2,4-二氯苯酚的去除实验, 分析反应活性.该研究对于应用NZVI修复被污染水体具有重要意义, 为NZVI在地下水原位修复中的运用奠定了理论基础.
2 材料与方法(Materials and methods) 2.1 试剂主要试剂:羧甲基纤维素钠(优级纯, 天津市三江科技有限公司);2,4-二氯苯酚(>99.99%, 上海阿拉丁生化科技股份有限公司);硼氢化钠(优级纯, 天津市光复精细化工研究所);七水硫酸亚铁(优级纯, 天津市光复精细化工研究所);无水硫酸铜(优级纯, 天津市光复精细化工研究所);无水乙醇(分析纯, 天津市光复精细化工研究所)
2.2 不同CMC包覆比的改性纳米Fe/Cu双金属的合成包覆比的控制关键在于CMC投加量的不同.制得的NZVI质量一定, 当投加的CMC与NZVI的质量比(CMC:NZVI)为0:1、0.2:1、0.4:1、0.6:1、0.8:1、1:1时, 即可制得包覆比分别为0%、20%、40%、60%、80%、100%的改性NZVI.实验流程如下:称取一定量的CMC置入1000 mL的三口烧瓶中, 加入300 mL无氧水, 使用搅拌桨持续搅拌至透明粘稠状, 实验全程通高纯氮气(N2)以确保反应环境为无氧状态.实验采用液相还原法(Shahwan et al., 2010)制备NZVI, 具体方法是:将称取的七水硫酸亚铁(FeSO4·7H2O)加入CMC溶液中, 持续搅拌5 min后, 缓慢滴入硼氢化钠(NaBH4)溶液, 反应如下:
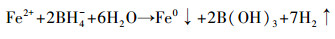
|
待滴加完毕后继续搅拌15min使反应完全, 搅拌完毕后将溶液过滤并用无水乙醇将制备的改性NZVI冲洗3遍以去除杂质离子, 然后迅速转移至真空干燥箱中, 并于70 ℃下干燥24 h以备用(蒋婷等, 2017).
林英杰(2016)的研究表明, 当Cu负载率≤5%时, 脱氯率随Cu负载率增加而增大, 而当Cu负载率大于5%, 进一步增加Cu的剂量会造成脱氯率的下降.因此本研究进行Fe/Cu双金属的制备时将Cu的负载率选为5%.称取一定量的无水硫酸铜(CuSO4), 溶解后缓慢滴入改性NZVI溶液中, 反应如下:

|
滴加完毕后继续搅拌10 min使反应完全.反应依旧在不断通氮气的无氧环境中进行.搅拌完毕后将溶液过滤并用无水乙醇将制备的改性Fe/Cu双金属洗涤3遍, 然后在70 ℃的真空干燥箱中干燥24 h, 密封保存于煤油中.
2.3 改性与未改性的双金属的表征使用扫描电子显微镜(SEM, JEM-7800F, 日本理学株式会社)对材料的表面形态特征进行观察.扫描样品之前, 先进行120 s的喷金操作, 以增加样品的导电性能.材料的晶体结构使用X射线晶体衍射仪(XRD, Ultima/2036E202, 日本理学株式会社)进行表征.扫描模式为步进扫描模式, 加速电压为40 kV, 发射电流为40 mA, 步长设为0.02, 扫描范围为10~80.最后使用比表面积分析仪(BET, Gemini V 2365, 美国麦克公司)以77.3 K下的氮气吸附/脱附等温线来表征材料的比表面积以及孔隙结构.
2.4 不同CMC包覆比下改性纳米Fe/Cu双金属的沉降实验将CMC包覆比分别为0、20%、40%、60%、80%、100%的双金属溶液倒入比色皿中(浓度均设为1 g·L-1), 并轻轻摇晃使溶液中粒子分散均匀, 然后将比色皿放入紫外可见分光光度计(MAPADA UV-6300)中, 进行动力学测量, 测量时间设为3600 s, 延迟时间设为1 s, 时间间隔设为5 s, 扫描模式设为吸光度, 扫描波长设为508 nm.
2.5 不同CMC包覆比下改性纳米Fe/Cu双金属对2,4-二氯苯酚的降解实验在14个50 mL血清瓶中分别加入一定体积的2,4-二氯苯酚与一定质量的双金属, 然后定容到30 mL, 确保2,4-二氯苯酚浓度为20 mg·L-1, 双金属浓度为5 ·L-1.然后盖上瓶盖放入恒温振荡器中振荡, 温度设为30 ℃, 转速设为130 r·min-1.在不同的时间点(0、1、5、10、20、30、60、90 min、2、3、4、5、6、7 h)用注射器取样, 并使用0.22 μm聚四氟乙烯(PTFE)滤膜过滤(陈静等, 2017), 使污染物与纳米颗粒分离开.随即利用高效液相色谱仪(Agilent1100 Series, 美国安捷伦公司)对2,4-二氯苯酚及其产物与中间产物(Wei et al., 2006)的浓度进行测定, 检测条件如下:色谱柱为Agilent SB-C18柱(4.6 mm×250 mm, 5 μm), 流动相为甲醇/水(60:40), 流速为0.8 mL·min-1, 进样量为20 μL, 检测波长为280 nm.
3 结果与讨论(Results and discussions)图 1是使用SEM对材料的表面结构特征进行观测的表征图.其中图 1是纳米Fe/Cu双金属, 图 1b是在空气中放置48 h的双金属, 图 1c是使用CMC改性的双金属, 图 1d是在空气中放置48 h的CMC改性双金属.由图 1a中可以看出, 未改性的双金属颗粒是球形结构, 大部分颗粒的尺寸在50~100 nm之间, 且这些纳米颗粒大多连接成链状结构.而在空气中放置48 h之后, 图 1b中观测到未改性的材料表面出现了明显的片状结构, 可以推测出这种薄片状的物质是NZVI氧化后形成的Fe2O3或Fe3O4.与未改性的材料不同的是, 图 1c中观测到的CMC改性后的双金属的表面覆盖有一层较浅的薄膜状物质, 可以推断CMC已成功包覆到材料的表面, 且改性后纳米颗粒的尺寸显著变大也证明了这一点.从图 1d中可以看到, 改性后的材料在氧化了48 h之后, 其表面并未出现片状结构, 即双金属没有氧化.这说明使用CMC改性之后, 改善了纳米Fe/Cu双金属与氧气的接触情况, 使其抗氧化性能有了显著的提高.
 |
| 图 1 SEM图(a.纳米Fe/Cu双金属, b.氧化48h的双金属, c.使用CMC改性的双金属, d.氧化48h的CMC改性双金属) Fig. 1 SEM images |
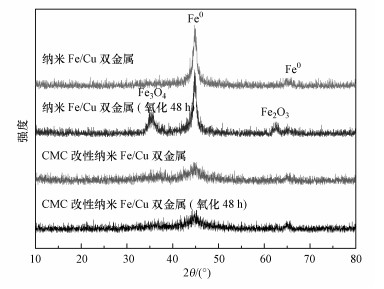
材料的XRD谱图也证实了SEM观测的结果.由图 2所示, 未改性的双金属在氧化48 h之后分别在35.84°处出现了Fe3O4在220晶面的衍射峰以及62.36°处出现了Fe2O3的衍射峰.而在被氧化之前, 这两处均未出现衍射峰.并且在图中可以看出, 即使在空气中氧化48 h, 改性后材料的图谱中也未出现Fe3O4和Fe2O3的衍射峰, 这与SEM观测的结果一致.改性后材料在44.72°处的Fe0110晶面的衍射峰强度降低可能是以下3种原因中某一种或多种原因共同作用的结果:
 |
| 图 2 XRD谱图 Fig. 2 XRD patterns |
① CMC的加入导致晶化温度提高, 而使得在相同的温度下, 加入CMC后的样品结晶度降低.
② CMC的加入会使材料的表面积增大, 而表面层结构的缺陷是比较严重的.结构的缺陷会导致衍射峰强度的降低.
③ 进行XRD表征的材料中CMC包覆比为80%, 铁量几乎减少了一半, 且改性后的材料分散性变强, 会使得衍射峰强度降低.
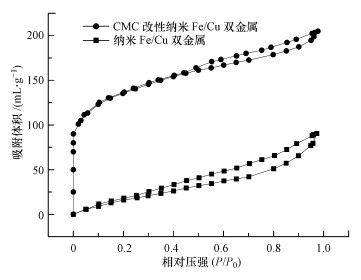
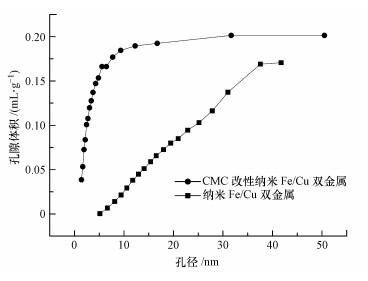
图 3是材料的氮气吸附/脱附等温线图.可以看出改性后双金属的等温线出现了明显的滞后环, 表明材料中存在大量孔隙结构(Sun et al., 2013).这种等温线与国际理论与应用化学联合会(IUPAC)分类的6种物理吸附等温线的Ⅳ型曲线很好的契合(Sing et al., 1985).材料的孔径分布情况如图 4所示, 可以看出改性后的材料产生了大量孔径介于0~10 nm的微孔.详细的参数如表 1所示.可见改性之后材料的比表面积大幅增加, 而这正是改性材料较之未改性材料反应活性更强的原因之一.
 |
| 图 3 氮气吸附/脱附等温线 Fig. 3 N2 adsorption/desorption isotherms |
 |
| 图 4 孔径分布 Fig. 4 Pore size distributions |
| 表 1 改性前后纳米Fe/Cu双金属的孔隙结构参数 Table 1 Pore structure parameters of nanoscale Fe/Cu bimetal before and after modification |
图 5是采用浓度为1 ·L-1的CMC包覆双金属, 包覆比分别为0%、20%、40%、60%、80%、100%的双金属的沉降曲线.其横坐标为时间, 纵坐标为吸光度测定值A与最初吸光度值A0的比值, 即相对吸光度A/A0.由图中可以看出, 当包覆比为0, 即未对双金属进行改性时, 其沉降速度极为迅速, 500 s就已沉降了77.84%, 且最终的悬浮量只有9.47%.这是因为新鲜制备的NZVI本身具有磁性, 会互相吸引, 当其进入水溶液之后, 会迅速吸引并团聚, 形成体积较大的团块颗粒, 这便使得其沉降速度变快.而使用CMC进行包覆之后, 包覆比从20%升高到100%所对应的双金属最终悬浮量分别为21.26%、40.75%、63.96%、71.35%、44.01%, 同比未包覆时的悬浮量均大幅提高.且可以看出当CMC包覆比小于80%时, 双金属的分散性随着CMC包覆比的上升而增强, 这是因为包覆于双金属表面的CMC分子层之间存在的静电斥力与双电层斥力(Comba et al., 2009)在与NZVI之间存在的磁力以及分子间范德华力(Feng et al., 2005)的对抗中取得优势, 从而使颗粒之间互相排斥, 表现为分散性的大幅提高.且CMC包覆的比越大, NZVI之间的磁力就越小, 颗粒之间的排斥力就越大, 即表现为颗粒的分散性变大.而当CMC包覆比大于80%时, 随着包覆比的增加, 分散性逐渐下降.这是因为, 当CMC投加量大到一定值后, 包裹后的颗粒质量巨大, 其自身重力将无法忽略, 并在重力的做功之下, 颗粒会以一定的加速度沉降至底部.所以可得出结论:当CMC包覆比为80%时, 纳米Fe/Cu双金属的分散性最好.
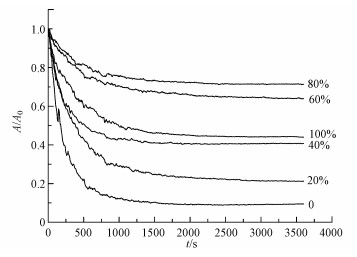 |
| 图 5 不同CMC包覆比的双金属的沉降曲线 Fig. 5 Settlement curves of bimetal with different proportion of CMC cladding |
不同包覆比的双金属在溶液中分散稳定性的差异也可用Zeta电位来说明.Zeta电位是表征溶液分散稳定性的重要指标, 是对颗粒之间的排斥力与吸引力强度的度量.一般来说, Zeta电位的绝对值越大体系越稳定, 即分散可以抵抗团聚.反之, 则体系越不稳定, 分子间引力大于斥力, 分散被破坏而发生团聚.6种不同包覆比的双金属的Zeta电位见图 6.有研究表明(Sun et al., 2007), Zeta电位的绝对值超过30 mV时, 悬浮液开始表现出较好的分散稳定性.图中只有包覆比为60%和80%的双金属的Zeta电位绝对值超过了30 mV, 且80%的Zeta电位绝对值最大, 为46.4 mV.这说明当包覆比为80%时, 双金属的分散稳定性最好.Zeta电位的检测结果不仅证实了材料分子间引力与斥力的存在与作用, 也验证了上述沉降实验所得出的结论.
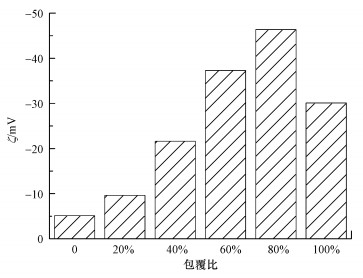 |
| 图 6 不同CMC包覆比的双金属的Zeta电位 Fig. 6 Zeta potentials of bimetal with different proportion of CMC cladding |
CMC对纳米Fe/Cu双金属的理化性质的影响已在第2.1节进行了详细的说明, 而双金属理化性质的改变势必会影响它在化学反应中的反应活性(Zhu et al., 2013).因此, 本研究于室温下用5 g·L-1的改性双金属材料在水溶液(pH=7.00(Sun et al., 2012))中对20 mg·L-1的2,4-二氯苯酚进行脱氯, 以探究不同CMC包覆比对纳米Fe/Cu双金属反应活性的影响.
图 7表明了不同CMC包覆比对双金属的脱氯效率以及2,4-二氯苯酚的产物与中间产物的影响.从图 7a可以看出, 随着时间的增加, 2,4-二氯苯酚的最终浓度均比初始浓度有所下降, 且每一条曲线的趋势均为先大幅下降后小幅提升, 然后缓慢下降并最终稳定.分析其原因为, 不论材料是否改性, 其对2,4-二氯苯酚均有较强的吸附作用.因此实验刚开始的数分钟内, 在材料对2,4-二氯苯酚的物理吸附与化学脱氯的双重作用之下, 2,4-二氯苯酚的浓度有一个快速下降的过程.但是这种强吸附作用并不能维持很长的时间, 当吸附量到达某一定值之后, 2,4-二氯苯酚逐渐从材料表面脱附(Jia et al., 2012), 但在脱附过程中, 2,4-二氯苯酚脱附的速度明显高于材料对其的脱氯速度, 因此其浓度会有一个小幅的升高, 但升高的速度不及之前下降的速度.在脱附完成之后, 2,4-二氯苯酚只受材料对其的化学脱氯作用, 且其浓度下降的幅度与速度则完全由双金属材料的反应活性决定.
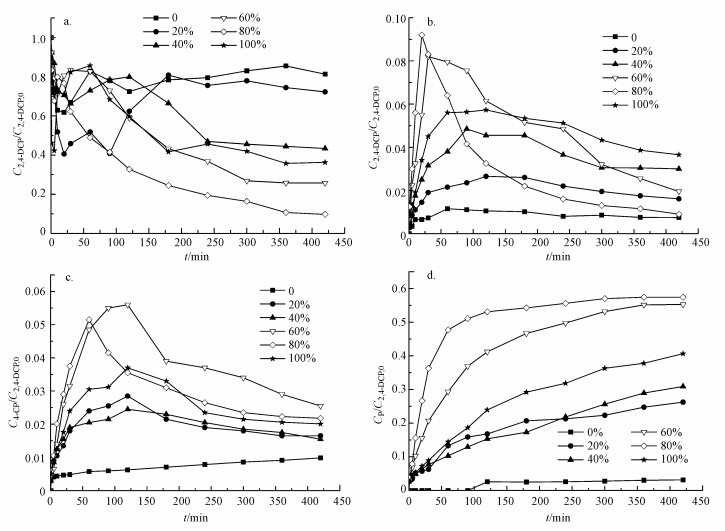 |
| 图 7 不同CMC包覆比的双金属对2,4-二氯苯酚的脱氯情况(a. 2,4-二氯苯酚的浓度变化; b. 2-氯苯酚的浓度变化; c. 4-氯苯酚的浓度变化; d.苯酚的浓度变化) Fig. 7 Dechlorination of 2,4-DCP by bimetal with different proportion of CMC cladding |
当CMC包覆比为0, 即未对双金属进行改性时, 经过420 min的反应, 2,4-二氯苯酚的去除率只有18.7%, 是所有实验组中效果最差的.这是因为未经改性的纳米Fe/Cu双金属具有超高比表面积与高反应性, 新鲜制备的纳米颗粒暴露于空气中时极易被氧化(Wang et al., 2010).纳米颗粒表面形成的氧化层在一定程度上抑制了2,4-二氯苯酚进入颗粒表面的活性位点, 从而降低了它们对2,4-二氯苯酚的反应活性.且未改性的纳米颗粒分散性极差, 极易团聚, 材料表面的活性位点互相屏蔽, 使可用的位点减少, 这同样会导致反应活性的降低.而对双金属进行改性之后, 包覆比从20%升高到100%所对应的2,4-二氯苯酚去除率分别为27.75%、56.65%、74.25%、90.3%、63.7%.可以看出当CMC包覆比小于80%时, 2,4-二氯苯酚的去除效率随着包覆比的增加而提高.这是因为CMC加入后, 包裹于双金属表面, 减少了材料与氧气的接触, 抗氧化性提高, 同时CMC阻止了材料的团聚, 分散性得以提高, 材料表面被屏蔽的活性位点得以释放, 且随着CMC的投加量增加, 包覆的面积增大, 材料与氧气的接触进一步减少, 材料的分散性也更强, 虽然增加CMC的投加量会屏蔽一部分活性位点, 但是因分散性的增强而释放的活性位点比屏蔽的位点更多, 这便使得材料的反应活性更强.而当CMC包覆比大于80%时, 随着比例的增加, 去除率下降, 比例为100%时相比80%去除率下降了26.6%.这是因为CMC使用过多后, 其屏蔽的活性位点个数已多于其释放的位点个数, 因此表现为反应活性的下降.那么可以得出结论, 当CMC包覆比为80%时, 制得的纳米Fe/Cu双金属对2,4-二氯苯酚的去除效果最好.而这一结论也验证了第2.2节中沉降实验得出的结果, 即良好的分散性使得材料在与2,4-二氯苯酚的反应中获得更强的反应活性, 并在CMC包覆比为80%时反应活性达到最大.
3.2.2 脱氯实验中2-氯苯酚和4-氯苯酚的浓度变化研究该化学反应的中间产物亦是评估所制纳米材料反应性以及性质的有效方法.图 7b、c、d显示了在该反应中2,4-二氯苯酚的脱氯副产物随时间的变化.由图 7b、c所示, 使用CMC改性之后, 纳米材料对2,4-二氯苯酚的脱氯产物2-氯苯酚(2-CP)与4-氯苯酚(4-CP)随时间先增加后减少并逐渐趋于稳定.未使用CMC改性时, 2-氯苯酚只在前50 min有少量的增加, 且无明显的下降趋势, 而4-氯苯酚在整个反应过程中均在缓慢增加, 亦无明显的下降趋势.这说明, 在420 min内, 2-氯苯酚与4-氯苯酚是改性后的材料对2,4-二氯苯酚脱氯的中间产物, 但它们是未改性的材料对2,4-二氯苯酚脱氯的最终产物.另外值得注意的是, 在同样的时间内, 生成的2-氯苯酚比4-氯苯酚多, 这是因为2,4-二氯苯酚的结构中对位C相较于邻位C是更容易发生亲核反应的位点, 因此对位Cl比邻位Cl更易从苯环上脱去, 所以2-氯苯酚比4-氯苯酚更容易生成.
3.2.3 脱氯实验中苯酚的浓度变化图 7d显示了苯酚(P)在溶液中的形成过程.同样时间内, 使用改性材料后生成的苯酚浓度远远高于未改性的.未使用CMC改性的情况下, 420 min内几乎没有苯酚生成.这意味着, 材料的改性与否直接决定了2,4-二氯苯酚脱氯过程中最终产物苯酚的生成.结合图 7中所有的发现, 可以得出结论:使用CMC对纳米Fe/Cu双金属进行包裹, 可以增强其与2,4-二氯苯酚的反应活性, 并直接改变脱氯进程.
3.3 CMC改性的机理如图 8(1)~(5)所示, CMC遇水形成溶液之后, 其分子链逐渐解开并拉伸, 形成复杂的梳状三维结构以及“齿状”链, 而这种结构将会控制随后纳米颗粒的生成.随着FeSO4与NaBH4的先后引入, NZVI逐渐生成, CMC分子中的羧酸酯基团通过静电吸附与NZVI相互作用, 这便使NZVI可以更好的分散而不再聚集.且在羧酸酯基团静电吸附的过程中, 其在NZVI表面可以形成保护层并在一定程度上抵抗氧化.CMC的羧酸酯基团与NZVI表面可能的结合方式如图 8a~c所示.当CuSO4引入之后, Cu的负载立即发生在分散良好的NZVI表面, 形成CMC改性的纳米Fe/Cu双金属.
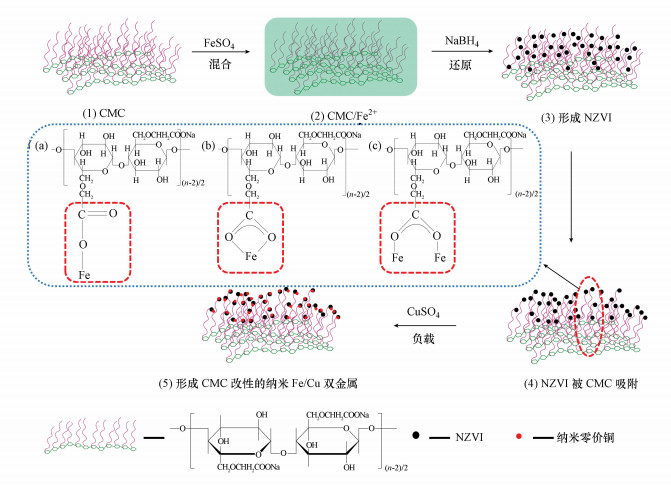 |
| 图 8 CMC改性的机理图 Fig. 8 Mechanism diagram of CMC modification |
1) 使用3种方法对采用CMC改性前后的纳米Fe/Cu双金属进行了表征, 表明改性后的材料具有更大的尺寸以及比表面积, 包覆的CMC增强了纳米Fe/Cu双金属材料的抗氧化性, 而且减弱了材料的聚集性.
2) CMC的包覆比对改性后双金属的分散性与反应活性影响较大, 但非简单的随包覆比增大而增强的关系.CMC改性会增强双金属分散性, 释放因材料聚集而屏蔽的活性位点, 另一方面CMC的包覆也会屏蔽材料表面的部分活性位点, 当释放位点多于屏蔽位点, 则表现为反应活性的增强, 反之则表现为反应活性的降低.在包覆比为80%时, 包覆于双金属表面的CMC分子层之间存在的静电斥力与双电层斥力在与NZVI之间存在的磁力以及分子间范德华力的对抗中取得最大优势, 双金属的分散稳定性达到最大, 此时释放的活性位点个数最多, 最终表现为最强的反应活性.
3) CMC改性后的Fe/Cu双金属材料, 不仅使系统脱氯率大幅提高, 而且直接改变了Fe/Cu双金属系统的脱氯进程.实验表明:CMC改性后的Fe/Cu双金属脱氯系统不仅脱氯率由改性前的18.7%提高到改性后的90.3%, 提高了71.6%, 且脱氯产物由2-氯苯酚与4-氯苯酚进一步脱氯至苯酚, 抑或由2,4-二氯苯酚直接还原为苯酚.
陈静, 陈海, 金歆, 等. 2017. 纳米零价铁降解水中四氯化碳的试验研究[J]. 环境科学学报, 2017, 37(2): 610–616.
|
And C B W, Zhang W. 1997. Synthesizing Nanoscale Iron Particles for Rapid and Complete Dechlorination of TCE and PCBs[J]. Environmental Science & Technology, 31(18): 9602–9607.
|
Chen S Y, Chen W H, Shih C J. 2008. Heavy metal removal from wastewater using zero-valent iron nanoparticles.[J]. Water Science & Technology, 58(10): 1947–1954.
|
Chunming Su † A, Puls‡ R W. 1999. Kinetics of Trichloroethene Reduction by Zerovalent Iron and Tin: Pretreatment Effect, Apparent Activation Energy, and Intermediate Products[M]//Introduction to the physics of many-body systems. Изд-во Иностр. лит. 163-168
|
Cirtiu C M, Raychoudhury T, Ghoshal S, et al. 2011. Systematic comparison of the size, surface characteristics and colloidal stability of zero valent iron nanoparticles pre-and post-grafted with common polymers[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 390(1): 95–104.
|
Comba S, Sethi R. 2009. Stabilization of highly concentrated suspensions of iron nanoparticles using shear-thinning gels of xanthan gum[J]. Water Research, 43(15): 3717–26.
DOI:10.1016/j.watres.2009.05.046
|
Fang Y, Al-Abed S R. 2008. Dechlorination kinetics of monochlorobiphenyls by Fe/Pd:effects of solvent, temperature, and PCB concentration[J]. Applied Catalysis B Environmental, 78(3/4): 371–380.
|
Feng He, Zhao D. 2005. Preparation and Characterization of a New Class of Starch-Stabilized Bimetallic Nanoparticles for Degradation of Chlorinated Hydrocarbons in Water[J]. Environmental Science & Technology, 39(9): 3314–3320.
|
冯婧微, 徐英侠, 兰希平, 等. 2014. 纳米零件铁的改性及其应用研究进展[J]. 材料导报, 2014, 28(15): 83–86, 97.
|
Feng J, Yingxia X U, Lan X, et al. 2014. Advances in Modification and Application of Nanoscale Zero-valent Iron[J]. Materials Review.
|
Gillham R W, O'Hannesin S F. 1994. Enhanced Degradation of Halogenated Aliphatics by Zero-Valent Iron[J]. Groundwater, 32(6): 958–967.
DOI:10.1111/gwat.1994.32.issue-6
|
Hang J I, Xian H E, Cao X, et al. 2013. Removal of Chromium(Ⅵ) in Water by Carboxymethyl Cellulose Stabilized Nano Zero-valent Iron[J]. Geoscience, 27(6): 1484–1488.
|
Hurdzan C M, Lanno R P. 2009. Determining exposure dose in soil:The effect of modifying factors on chlorinated benzene toxicity to earthworms[J]. Chemosphere, 76(7): 946–951.
DOI:10.1016/j.chemosphere.2009.04.036
|
Jia H, Wang C. 2012. Adsorption and dechlorination of 2,4-dichlorophenol (2,4-DCP) on a multi-functional organo-smectite templated zero-valent iron composite[J]. Chemical Engineering Journal, 191(5): 202–209.
|
蒋婷, 鲍玥, 李威, 等. 2017. nZVI/AC复合材料对水中锑的去除[J]. 环境科学, 2017(11): 4632–4640.
|
Kanel S R, Goswami R R, Clement T P, et al. 2007. Two Dimensional Transport Characteristics of Surface Stabilized Zero-valent Iron Nanoparticles in Porous Media[J]. Environmental Science & Technology, 42(3): 896–900.
|
Keith L, Telliard W. 2003. ES&T Special Report:Priority pollutants:Ⅰ-a perspective view[J]. Environmental Science & Technology, 13(4): 416–423.
|
Laumann S, Micić V, Hofmann T. 2014. Mobility enhancement of nanoscale zero-valent iron in carbonate porous media through co-injection of polyelectrolytes.[J]. Water Research, 50(1): 70–79.
|
林英杰, 张硕, 孙力平, 等. 2016. VB12协同Fe/Cu双金属去除二氯甲烷过程调控与机理[J]. 中国环境科学, 2016, 36(9): 2650–2657.
DOI:10.3969/j.issn.1000-6923.2016.09.016 |
Lien H L, Zhang W X. 1999. Transformation of Chlorinated Methanes by Nanoscale Iron Particles[J]. Journal of Environmental Engineering, 125(11): 1042–1047.
DOI:10.1061/(ASCE)0733-9372(1999)125:11(1042)
|
Shi L N, Zhang X, Chen Z L. 2011. Removal of Chromium (Ⅵ) from wastewater using bentonite-supported nanoscale zero-valent iron[J]. Water Research, 45(2): 886–892.
DOI:10.1016/j.watres.2010.09.025
|
Mallát T, Bodnár Z, Petró J. 1991. Reduction by dissolving bimetals[J]. Tetrahedron, 47(3): 441–446.
DOI:10.1016/S0040-4020(01)90501-0
|
Nam S, Tratnyek P G. 2000. Reduction of azo dyes with zero-valent iron[J]. Water Research, 34(6): 1837–1845.
DOI:10.1016/S0043-1354(99)00331-0
|
Sahu R S, Bindumadhavan K, Doong R. 2017. Boron doped reduced graphene oxide based bimetallic Ni/Fe nanohybrids for rapid dechlorination of trichloroethylene[J]. Environmental Science Nano, 4(3): 565–576.
DOI:10.1039/C6EN00575F
|
Scherer M M, Johnson K M, Westall J C, et al. 2001. Mass transport effects on the kinetics of nitrobenzene reduction by iron metal.[J]. Environmental Science & Technology, 35(13): 2804–2811.
|
Schrick B, Hydutsky B W, Blough J L, et al. 2004. Delivery Vehicles for Zerovalent Metal Nanoparticles in Soil and Groundwater[J]. Chemistry of Materials, 16(11): 2187–2193.
DOI:10.1021/cm0218108
|
Shahwan T, Üzüm, Ç, EroǧLu A E, et al. 2010. Synthesis and characterization of bentonite/iron nanoparticles and their application as adsorbent of cobalt ions.[J]. Applied Clay Science, 47(3): 257–262.
|
Sing K S W. 1985. Reporting physisorption data for gas/solid systems with special reference to the determination of surface area and porosity (Recommendations 1984)[J]. Pure & Applied Chemistry, 57(4): 603–619.
|
Sirk K M, Saleh N B, Phenrat T, et al. 2009. Effect of adsorbed polyelectrolytes on nanoscale zero valent iron particle attachment to soil surface models.[J]. Environmental Science & Technology, 43(10): 3803–8308.
|
Song H, Carraway E R. 2005. Reduction of chlorinated ethanes by nanosized zero-valent iron:kinetics, pathways, and effects of reaction conditions.[J]. Environmental Science & Technology, 39(16): 6237–6245.
|
Sun Q, Zhou H Y, Cao M H, et al. 2012. Degradation of 2,4-Dichlorophenol in Aqueous Solution by ZVI/EDDS/Air System[J]. Environmental Science, 33(11): 3833–3839.
|
Sun Y P, Li X Q, Zhang W X, et al. 2007. A method for the preparation of stable dispersion of zero-valent iron nanoparticles[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 308(1): 60–66.
|
Sun Y, Yue Q, Gao B, et al. 2013. Adsorption of hexavalent chromium on Arundo donax Linn, activated carbon amine-crosslinked copolymer[J]. Chemical Engineering Journal, 217(2): 240–247.
|
Wang J, Qian Y. 1999. Microbial degradation of 4-chlorophenol by microorganisms entrapped in carrageenan-chitosan gels[J]. Chemosphere, 38(13): 3109–3117.
DOI:10.1016/S0045-6535(98)00516-5
|
Wang W, Zhou M H, Jin Z H, et al. 2010. Reactivity characteristics of poly(methyl methacrylate) coated nanoscale iron particles for trichloroethylene remediation.[J]. Journal of Hazardous Materials, 173(1/3): 724–730.
|
Wang X, Zhu M, Liu H, et al. 2013. Modification of Pd-Fe nanoparticles for catalytic dechlorination of 2,4-dichlorophenol[J]. Science of the Total Environment, 449: 157–167.
DOI:10.1016/j.scitotenv.2013.01.008
|
Wang Z, Huang W, Peng P A, et al. 2015. Rapid dechlorination of 1, 2, 3, 4-TCDD by Ag/Fe bimetallic particles[J]. Chemical Engineering Journal, 273: 465–471.
DOI:10.1016/j.cej.2015.03.102
|
Wei J, Xu X, Liu Y, et al. 2006. Catalytic hydrodechlorination of 2,4-dichlorophenol over nanoscale Pd/Fe:reaction pathway and some experimental parameters[J]. Water Research, 40(2): 348–354.
DOI:10.1016/j.watres.2005.10.017
|
Wu H, Feng Q. 2017. Fabrication of bimetallic Ag/Fe immobilized on modified biochar for removal of carbon tetrachloride[J]. Journal of Environmental Sciences, 54(4): 346–357.
|
Yang G C, Lee H L. 2005. Chemical reduction of nitrate by nanosized iron:kinetics and pathways[J]. Water Research, 39(5): 884–894.
DOI:10.1016/j.watres.2004.11.030
|
Yang M X, Sutapa S, Bent E B, et al. 1997. Degradation of Multiply-Chlorinated Hydrocarbons on Cu(100)[J]. Langmuir, 13(2): 127–137.
DOI:10.1021/la962029f
|
Zhao X, Liu W, Cai Z, et al. 2016. An overview of preparation and applications of stabilized zero-valent iron nanoparticles for soil and groundwater remediation[J]. Water Research, 100: 245–266.
|
Zhao X, Liu W, Cai Z, et al. 2016. An overview of preparation and applications of stabilized zero-valent iron nanoparticles for soil and groundwater remediation[J]. Water Research, 100: 245–266.
|
Zhou Z, Ruan W, Huang H, et al. 2016. Fabrication and characterization of Fe/Ni nanoparticles supported by polystyrene resin for trichloroethylene degradation[J]. Chemical Engineering Journal, 283: 730–739.
DOI:10.1016/j.cej.2015.07.076
|
Zhu M, Wang X, Yang J, et al. 2013. Study on the physicochemical properties of poly(methylmethacrylate) (PMMA) modified Pd/Fe nanocomposites:Roles of PMMA and PMMA/ethanol[J]. Applied Surface Science, 282(10): 851–861.
|
张永祥, 常杉, 李飞, 等. 2017. 稳定型纳米零价铁去除地下水中2,4-二氯苯酚[J]. 环境科学, 2017, 38(6): 2385–2392.
|
曾宪委, 刘建国, 聂小琴. 2013. 基于零价铁的双金属体系对六氯苯还原脱氯研究[J]. 环境科学, 2013, 34(1): 182–187.
DOI:10.3969/j.issn.1003-6504.2013.01.038 |
 2019, Vol. 39
2019, Vol. 39


