2. 山东省林业科学研究院, 山东省森林植被生态修复工程技术研究中心, 济南 250014
2. Shandong Academy of Forest, Shandong Engineering Research Center for Ecological Restoration of Forest Vegetation, Jinan 250014
细菌在土壤中无处不在, 土壤中大约80%~90%的微生物结合在土壤矿物表面并与土壤胶体颗粒相互作用(Loosdrecht et al., 1989;宋长青等, 2013).铁铝氧化物是土壤的主要组分之一, 具有较高的活性, 对土壤中细菌的粘附作用起着重要的影响(Deo et al., 2001;Cai et al., 2013).在环境中铁铝氧化物表面主要带正电荷, 而细菌表面主要带负电荷(Poortinga et al., 2002;Hamadi et al., 2011), 因此铁铝氧化物与细菌之间的静电引力导致铁铝氧化物对细菌有较大的吸附容量.细菌与单一铁、铝氧化物相互作用的研究已有较多报道(Yee et al., 2000;Lower et al., 2001;Darabdhara et al., 2017).大肠杆菌(Escherichia coli)和枯草芽孢杆菌(Bacillus subtilis)在非晶态Al(OH)3表面的粘附量大于非晶态Fe(OH)3(Liu et al., 2015a).细菌和矿物之间的相互作用受到很多作用的影响, 如静电相互作用、疏水性、范德华力、表面粗糙度和表面张力等(Liu et al., 2015a).经典的DLVO理论表明静电作用力在Fe、Al氢氧化物对细菌的粘附中起着重要的作用.FTIR光谱揭示了化学键的形成促进细菌与无定形Fe和Al氢氧化物之间的相互作用(Hong et al., 2018).
细菌与土壤和氧化物之间的相互作用, 会导致土壤或氧化物表面特性的变化, 进而对土壤中养分元素的循环以及污染物的迁移和归趋产生重要的影响(宋长青等, 2013).研究表明细菌在土壤表面的粘附, 增加了土壤表面的负电荷, 进而增加土壤对钾及重金属等的吸附能力(Huang et al., 2005; Liu et al., 2015b).细菌与蒙脱石复合后, 对铜的吸附量增加16%~30%, 而与针铁矿复合后, 则导致体系吸附量下降(Franzblau et al., 2016).高比例的恶臭假单胞菌对针铁矿表面位点有掩蔽作用(Qu et al., 2018).细菌存在条件下, 砷在针铁矿、赤铁矿和磁铁矿表面的吸附量分别降低了78%、36%和79%(Zhang et al., 2016).硒酸盐在大肠杆菌和铁氧化物复合体表面的吸附量显著低于铁氧化物(Franzblau et al., 2014).
尽管单一铁、铝氧化物与细菌相互作用的研究已有较多报道, 但土壤中铁、铝氧化物通常共生形成复合体, 铁铝复合氧化物的活性及其对细菌的吸附容量与单一氧化物之间存在较大的差异, 对复合氧化物与细菌相互作用的研究更接近实际土壤中氧化物与细菌的相互作用.本研究以土壤中常见的枯草芽孢杆菌和荧光假单胞菌为研究对象, 研究不同pH和细菌浓度下, 两种铁铝复合氧化物对细菌的粘附特性, 为土壤中氧化物与细菌的相互作用提供更丰富的理论支持, 并为土壤中养分及污染物的迁移转化提供理论借鉴.
2 材料与方法(Materials and methods) 2.1 铁铝复合氧化物的制备采用沉淀法制备铁铝复合氧化物(任丽英等, 2014), 将三氯化铁和三氯化铝以3:1和1:3两种摩尔比配制成铁铝离子的混和溶液, 总浓度为1 mol·L-1, 向溶液中滴加NaOH溶液调节pH值至7.4, 继续搅拌, 将溶液放置于60 ℃恒温箱中24 h, 离心分离得到沉淀物, 即为铁铝复合氧化物.
2.2 细菌的培养采用枯草芽孢杆菌和荧光假单胞菌两种细菌为研究对象, 菌种购买自中国普通微生物菌种保存中心.首先将细菌冻干粉加入5 mL牛肉膏蛋白胨培养基中, 在28 ℃、180 r·min-1条件下振荡7 h, 进行细菌活化.然后将活化好的细菌在相同条件下进行扩大培养至细菌的指数生长期, 离心得到细菌, 将细菌配制成20 mg·mL-1的溶液进行吸附实验.
2.3 细菌的等温粘附分别称取0.100 g氧化物于一系列离心管中, 向离心管中分别加入0~10 mL细菌溶液, 用0.01 mol·L-1 NaCl溶液定容至总体积20 mL, 用稀HCl或NaOH调节并保持溶液pH 6, 28 ℃、180 r·min-1条件下振荡1 h, 反应结束后, 向悬液加入5 mL 60 %的蔗糖, 通过密度梯度离心法分离未被粘附的细菌, 于420 nm下测定吸光度, 计算细菌的粘附量.所有的实验重复3次, 所用数据为平均值±标准差.
2.4 pH对细菌粘附的影响分别称取0.100 g氧化物于一系列离心管中, 加入5 mL浓度为20 mg·mL-1的细菌溶液, 用0.01 mol·L-1NaCl定容至总20 mL, 用稀HCl或NaOH将溶液pH调至3~8之间, 28 ℃、180 r·min-1条件下振荡1 h, 反应结束后, 向悬液加入5 mL 60 %的蔗糖, 通过密度梯度离心法分离未被粘附的细菌, 于420 nm下测定吸光度, 计算细菌的粘附量(Liu et al., 2015a;蒋代华等, 2007;Ren et al., 2018).所有的实验重复3次, 所用数据为平均值±标准差.
2.5 氧化物与细菌的相互作用能氧化物和细菌的交互作用能通过Derjaguin-Landau-Verwey-Overbeek(DLVO)理论计算.DLVO理论中细菌与氧化物的相互作用主要包括静电作用力(EL)和范德华力(LW), 总作用能GTot(d)主要计算过程如下(Bos et al., 1999;Gotić et al., 2007).
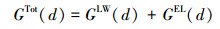
|
(1) |
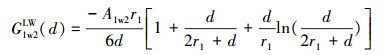
|
(2) |
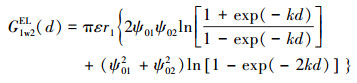
|
(3) |
式中, G (d)为距离为d(m)时, 铁铝复合氧化物与细菌之间的交互作用能;下标1代表细菌,2代表缺铝氧化物,w代表水; r1代表细菌的半径(m);ε代表水的介电常数(6.96×10-10 m-1·V-2);A1w2代表哈克常数, 取7.78×10-20 J(Liu et al., 2015a);ψ01和ψ02分别代表细菌和铁铝复合氧化物的表面电位(V), 可以通过Zeta计算, 计算方程如下:
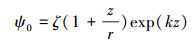
|
(4) |
式中, ζ代表铁铝复合氧化物的Zeta电位(V); r代表颗粒的半径(m);z代表铁铝复合氧化物表面到剪切面的距离, 取5×10-10 m(Liu et al., 2015a);k代表德拜长度的倒数(m-1), 可通过下面方程计算:
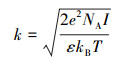
|
(5) |
式中, e代表电荷量(1.602×10-19 C);NA代表阿伏加德罗数(6.02 × 1023 mol-1);kB代表玻耳兹曼常数(3.81×10-23 J·k-1);T代表温度(298 K);I代表离子强度(mol·m-3).
3 结果与讨论(Results and discussion) 3.1 细菌在铁铝氧化物表面的等温粘附枯草芽孢杆菌和荧光假单胞菌在铁铝复合氧化物表面的等温粘附如图 1所示.两种铁铝氧化物对枯草芽孢杆菌和荧光假单胞菌的吸附量均随着细菌平衡浓度的增加而上升, 但上升速度越来越缓, 最终趋于平衡.并且两种氧化物对两种细菌的粘附量均呈现铁铝氧化物1:3>铁铝氧化物3:1的规律.通过Langmuir方程拟合细菌的等温粘附, 方程如下所示:
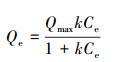
|
(6) |
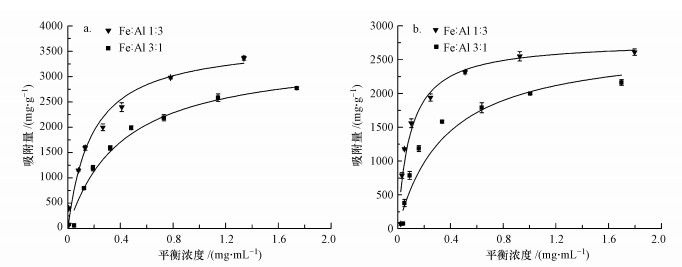 |
| 图 1 枯草芽孢杆菌(a)和荧光假单胞菌(b)在铁铝复合氧化物表面等温粘附Langmuir拟合曲线(反应时间1 h, pH 6, 背景电解质1 mmol·L-1 NaCl (n=3)) Fig. 1 Langmuir fitting for isothermal adhesion of Bacillus subtilis(a) and Pseudomonas fluorescens(b) to the surface of iron-aluminum composite oxide (reaction time 1 h, pH 6, background electrolyte 1 mmol·L-1 NaCl (n=3)) |
式中, Qe表示细菌在铁铝复合氧化物表面的粘附量(mg·g-1);Ce表示细菌的平衡浓度(mg·L-1);Qmax表示细菌在铁铝复合氧化物表面的最大粘附量(mg·g-1);k表示粘附平衡常数(L·mg-1);R2表示可决系数.
已有研究表明细菌的粘附可用Langmuir方程拟合(Hendricks et al., 1979;Vasiliadou et al., 2011;Ren et al., 2018).本研究发现Langmuir方程可较好地描述两种细菌在铁铝复合氧化物表面的粘附过程, 拟合结果见表 1.通过Langmuir方程拟合得到Fe:Al 1:3和Fe:Al 3:1两种复合氧化物对枯草芽孢杆菌的最大吸附量分别为3717.43 mg·g-1和3455.58 mg·g-1.Fe:Al 1:3和Fe:Al 3:1两种复合氧化物对荧光假单胞菌的最大吸附量分别为2792.29 mg·g-1和2760.33 mg·g-1.结果表明枯草芽孢杆菌在两种氧化物表面的最大吸附量均大于荧光假单胞菌.Langmuir方程中常数k代表细菌与氧化物的亲和度, k越大表明细菌亲和力越高.Fe:Al 1:3和Fe:Al 3:1两种复合氧化物对枯草芽孢杆菌的吸附常数k分别为5.42和2.44 L·mg-1, 对荧光假单胞菌的吸附常数k分别为10.73和2.74 L·mg-1.铁铝1:3复合氧化物对两种细菌的亲和力均大于铁铝3:1, 表明铁铝复合氧化物中铝的比例越高, 其对细菌的亲和力和吸附量越大.这与文献报道中铝氧化物对大肠杆菌(Escherichia coli)和枯草芽孢杆菌(Bacillus subtilis)的吸附量大于铁氧化物的结果相吻合(Liu et al., 2015a).
| 表 1 枯草芽孢杆菌和荧光假单胞菌在两种氧化物表面粘附的Langmuir方程拟合常数 Table 1 Parameters of Langmuir equation for adhesion of Bacillus subtilis and Pseudomonas fluorescence on the surface of two oxides |
随着pH的增加, 两种铁铝氧化物对枯草芽孢杆菌和荧光假单胞菌的吸附量均呈下降的趋势(图 2).pH从4下降到8时, 铁铝1:3复合氧化物对枯草芽孢杆菌和荧光假单胞菌的吸附量分别降低了22.01%和33.14%.铁铝3:1复合氧化物对枯草芽孢杆菌和荧光假单胞菌的吸附量分别降低了46.16%和53.39%.pH对铁铝复合氧化物粘附细菌的影响与单一铁或铝氧化物对细菌粘附的影响一致(Yee et al., 2000;Deo et al., 2001;Jiang et al., 2007), 随着pH的增加, 恶臭假单胞菌(Pseudomonas putida)在铁氧化物表面的吸附(Jiang et al., 2007), 大肠杆菌(Escherichia coli)在无定形Al(OH)3氧化物表面, 多粘类芽孢杆菌(Paenibacillus polymyxa)在赤铁矿表面的吸附(Deo et al., 2001), 均随着呈现降低的趋势.铁铝氧化物表面正电荷随着pH的增加而降低, 是导致细菌在氧化物表面粘附量降低的主要原因之一(Liu et al., 2015a).
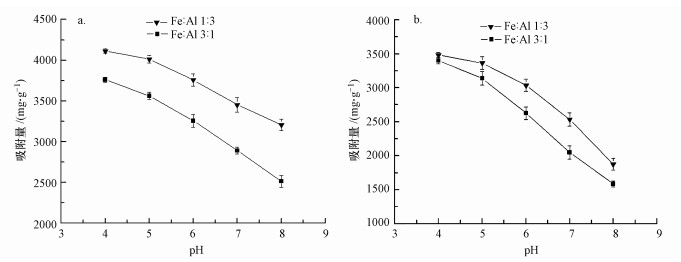 |
| 图 2 不同pH条件下枯草芽孢杆菌(a)和荧光假单胞菌(b)在两种铁铝复合氧化物表面的粘附作用(反应时间1 h, 背景电解质1 mmol·L-1 NaCl (n=3)) Fig. 2 Adhesion of Bacillus subtilis(a) and Pseudomonas fluorescence(b) to the surface of the two iron-aluminum composite oxides under different pH (The reaction time was 1 h, the background electrolyte was 1 mmol·L-1 NaCl (n=3) |
静电作用力对细菌在铁、铝氧化物(Jiang et al., 2007;Liu et al., 2015a;Hong et al., 2018)、高岭石(Wu et al., 2014)、蒙脱石(Hong et al., 2012)以及土壤黏粒表面(Liu et al., 2015b;Ren et al., 2018)的吸附起着重要的作用.通过经典的DLVO理论, 计算不同pH条件下细菌与铁铝复合氧化物之间的相互作用能(图 3).结果发现在pH 4~8的范围内, 铁铝复合氧化物与细菌之间的作用能均为负值, 表明二者之间存在静电引力作用, 这也是铁铝氧化物对细菌粘附的主要机制之一.但不同氧化物与不同细菌之间的静电引力有较大的差别(图 4).两种铁铝复合氧化物与枯草芽孢杆菌之间的静电引力均大于它们与荧光假单胞菌之间, 这和枯草芽孢杆菌比荧光假单胞菌表面带有更多的负电荷有关(Jiang et al., 2007).而两种铁铝氧化物相比较发现, 铁铝1:3复合氧化物与两种细菌相互作用的静电引力均大于铁铝3:1复合氧化物.可以看出铁铝复合氧化物中, 铝的比例越高, 其对细菌的吸引能力越大, 与前面有关铁铝复合氧化物对细菌的吸附量结果相呼应(图 1~2).也与枯草芽孢杆菌(Bacillus subtilis)和大肠杆菌(Escherichia coli)与无定形Al(OH)3之间的静电引力高于无定形Fe(OH)3(Liu et al., 2015a)的研究结果相一致, 进一步证实了氧化物与细菌之间的静电引力是它们相互作用的主要机制之一(荣兴民等, 2011).
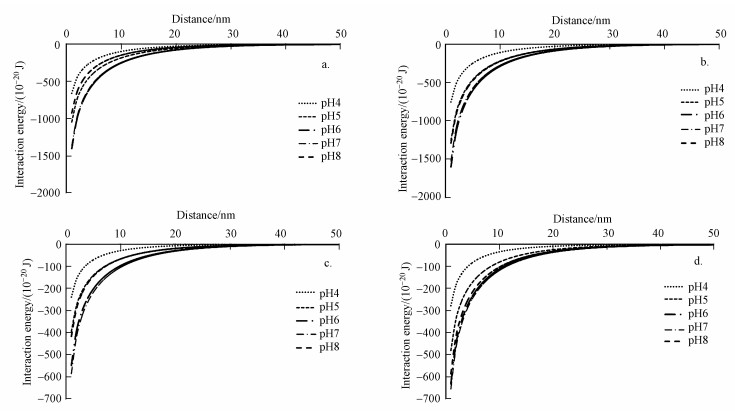 |
| 图 3 不同pH条件下铁铝复合氧化物与细菌的相互作用能(a.枯草芽孢杆菌与铁铝氧化物3:1, b.枯草芽孢杆菌与铁铝氧化物1:3, c.荧光假单胞菌与铁铝氧化物3:1, d.荧光假单胞菌与铁铝氧化物1:3, 背景电解质1 mmol·L-1 NaCl) Fig. 3 Interaction energy between iron-aluminum composite oxides and bacteria under different pH (a.Bacillus subtilis and Fe:Al oxide 3:1, b. Bacillus subtilis and Fe:Al oxide 1:3, c. Pseudomonas fluorescence and Fe:Al oxide 3:1, d. Pseudomonas fluorescence and Fe:Al oxide 1:3, background electrolyte 1 mmol·L-1 NaCl) |
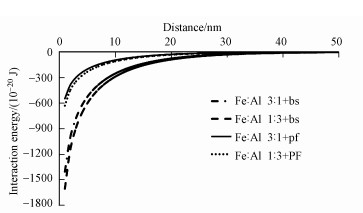 |
| 图 4 pH 6.0时两种铁铝复合氧化物与枯草芽孢杆菌(bs)和荧光假单胞菌(pf)的相互作用能(背景电解质1 mmol·L-1 NaCl) Fig. 4 Interaction energy between iron-aluminum composite oxides and Bacillus subtilis and Pseudomonas fluorescence at pH 6.0 (Background electrolyte 1 mmol·L-1 NaCl) |
细菌在两种铁铝复合氧化物表面的等温粘附实验表明, 两种氧化物对两种细菌的最大粘附量均呈现铁铝氧化物1:3>铁铝氧化物3:1的规律.Langmuir拟合结果表明铁铝1:3复合氧化物对两种细菌的亲和力常数k均大于铁铝3:1复合氧化物, 表明铁铝复合氧化物中铝的比例越高, 其对细菌的亲和力和吸附量越大.随着pH的增加, 两种铁铝氧化物对枯草芽孢杆菌和荧光假单胞菌的吸附量均呈现下降的趋势, 铁铝氧化物表面正电荷随着pH的增加而降低, 是导致细菌在氧化物表面粘附量降低的主要原因之一.DLVO理论表明, 静电引力是铁铝复合氧化物与细菌相互作用的主要机制之一.研究结果可为深入理解土壤中氧化物对细菌的粘附行为提供理论指导.
Bos R, Mei H C V D, Busscher H J. 1999. Physico-chemistry of initial microbial adhesive interactions-its mechanisms and methods for study[J]. FEMS Microbiology Reviews, 23(2): 179–230.
|
Cai P, Huang Q Y, Walker S L. 2013. Deposition and survival of Escherichia coli O157:H7 on clay minerals in a parallel plate flow system[J]. Environmental Science and Technology, 47(4): 1896–1903.
DOI:10.1021/es304686a
|
Darabdhara G, Boruah P K, Hussain N, et al. 2017. Magnetic nanoparticles towards efficient adsorption of gram positive and gram negative bacteria:an investigation of adsorption parameters and interaction mechanism[J]. Colloids and Surfaces A Physicochemical and Engineering Aspects, 516: 161–170.
|
Deo N, Natarajan K A, Somasundaran P. 2001. Mechanisms of adhesion of Paenibacillus polymyxa onto hematite, corundum and quartz[J]. International Journal of Mineral Processing, 62: 27–39.
DOI:10.1016/S0301-7516(00)00042-9
|
Franzblau R E, Daughney C J, Moreau M, et al. 2014. Selenate adsorption to composites of Escherichia coli and iron oxide during the addition, oxidation, and hydrolysis of Fe(Ⅱ)[J]. Chemical Geology, 383(383): 180–193.
|
Franzblau R E, Daughney C J, Moreau M, et al. 2015. Cu(Ⅱ) removal by E.coli -iron oxide composites during the addition and oxidation of Fe(Ⅱ)[J]. Chemical Geology, 409: 136–148.
DOI:10.1016/j.chemgeo.2015.05.019
|
Gotić M, Musić S. 2007. Mössbauer, FT-IR and FE SEM investigation of iron oxides precipitated from FeSO4 solutions[J]. Journal of Molecular Structure, 834-836: 445–453.
DOI:10.1016/j.molstruc.2006.10.059
|
Hamadi F, Latrache H, Zahir H, et al. 2011. Evaluation of the relative cell surface charge by using microbial adhesion to hydrocarbon[J]. Microbiology, 80: 488–491.
DOI:10.1134/S0026261711040072
|
Hendricks D W, Post F J, Khairnar D R. 1979. Adsorption of bacteria on soils:experiments, thermodynamic rationale and application[J]. Water Air Soil Pollution, 12: 219–232.
DOI:10.1007/BF01047124
|
Hong Z N, Jiang J, Li J Y, et al. 2018. Preferential adhesion of surface groups of Bacillus subtilis on gibbsite at different ionic strengths and pHs revealed by ATR-FTIR spectroscopy[J]. Colloids and Surfaces B:Biointerfaces, 165: 83–91.
DOI:10.1016/j.colsurfb.2018.02.020
|
Hong Z N, Rong X M, Cai P, et al. 2012. Initial adhesion of Bacillus subtilis on soil minerals as related to their surface properties[J]. European Journal of Soil Science, 63: 457–466.
DOI:10.1111/ejss.2012.63.issue-4
|
Huang Q Y, Chen W L, Xu L H. 2005. Adsorption of copper and cadmium by Cu and Cd-resistant bacteria and their composites with soil colloids and kaolinite[J]. Geomicrobiology Journal, 22: 227–236.
DOI:10.1080/01490450590947779
|
Jiang D, Huang Q, Cai P, et al. 2007. Adsorption of Pseudomonas putida on clay minerals and iron oxide[J]. Colloids and Surfaces B:Biointerfaces, 54: 217–221.
DOI:10.1016/j.colsurfb.2006.10.030
|
蒋代华, 黄巧云, 蔡鹏, 等. 2007. 粘粒矿物对细菌吸附的测定方法[J]. 土壤学报, 2007, 44(4): 656–662.
DOI:10.3321/j.issn:0564-3929.2007.04.011 |
Liu Z D, Wang H C, Li J Y, et al. 2015a. Adhesion of Escherichia coli, and Bacillus subtilis, to amorphous Fe and Al hydroxides and their effects on the surface charges of the hydroxides[J]. Journal of Soils and Sediments, 15(11): 2293–2303.
DOI:10.1007/s11368-015-1147-x
|
Liu Z D, Hong Z N, Li J Y, et al. 2015b. Interactions between Escherchia coli and the colloids of three variable charge soils and their effects on soil surface charge properties[J]. Geomicrobiology Journal, 32(6): 511–520.
DOI:10.1080/01490451.2014.967419
|
Loosdrecht M C M V, Lyklema J, Norde W, et al. 1989. Bacterial adhesion:A physicochemical approach[J]. Microbial Ecology, 17: 1–15.
DOI:10.1007/BF02025589
|
Lower S K, Hochella M F J R, Beveridge T J. 2001. Bacterial recognition of mineral surfaces:nanoscale interactions between Shewanella and alpha-FeOOH[J]. Science, 292: 1360–1363.
DOI:10.1126/science.1059567
|
Poortinga A T, Bos R, Norde W, et al. 2002. Electric double layer interactions in bacterial adhesion to surfaces[J]. Surface Science Reports, 47: 1–32.
DOI:10.1016/S0167-5729(02)00032-8
|
Qu C C, Ma M K, Chen W L, et al. 2018. Modeling of Cd adsorption to goethite-bacteria composites[J]. Chemosphere, 193: 943–950.
DOI:10.1016/j.chemosphere.2017.11.100
|
任丽英, 赵敏, 董玉良, 等. 2014. 两种铁氧化物对土壤有效态汞的吸附作用研究[J]. 环境科学学报, 2014, 34(3): 749–753.
|
Ren L Y, Hong Z N, Liu Z D, et al. 2018. ATR-FTIR investigation of mechanisms of Bacillus subtilis adhesion onto variable-and constant-charge soil colloids[J]. Colloids and Surfaces B:Biointerfaces, 162: 288–295.
DOI:10.1016/j.colsurfb.2017.11.067
|
荣兴民, 黄巧云, 陈雯莉, 等. 2011. 细菌在两种土壤矿物表面吸附的热力学分析[J]. 土壤学报, 2011, 48(2): 331–337.
|
宋长青, 吴金水, 陆雅海, 等. 2013. 中国土壤微生物学研究10年回顾[J]. 地球科学进展, 2013, 10(10): 1087–1105.
DOI:10.11867/j.issn.1001-8166.2013.10.1087 |
Vasiliadou I A, Chrysikopoulos C V. 2011. Cotransport of Pseudomonas putida and kaolinite particles through water-saturated columns packed with glass beads[J]. Water Resources Research, 47: 2144–2150.
|
Wu H, Chen W, Rong X, et al. 2014. Adhesion of Pseudomonas putida onto kaolinite at different growth phases[J]. Chemical Geology, 390: 1–8.
DOI:10.1016/j.chemgeo.2014.10.008
|
Yee N, Fein J B, Daughney C J. 2000. Experimental study of the pH, ionic strength, and reversibility behavior of bacteria-mineral adsorption[J]. Geochim Cosmochim Acta, 64: 609–617.
DOI:10.1016/S0016-7037(99)00342-7
|
Zhang Z N, Yin N Y, Du H L, et al. 2016. The fate of arsenic adsorbed on iron oxides in the presence of arsenite-oxidizing bacteria[J]. Chemosphere, 151: 108–115.
DOI:10.1016/j.chemosphere.2016.02.065
|
 2019, Vol. 39
2019, Vol. 39


