2. 太极计算机股份有限公司, 北京 100102;
3. 中国科学院地理科学与自然资源研究所, 北京 100101
2. Taiji Computer Corporation Limited, Beijing 100102;
3. Institute of Geographic Sciences and Natural Resources Research, Chinese Academy of Sciences, Beijing 100101
氮淋溶是农田土壤中氮素损失的重要途径之一, 同时, 淋溶损失也是导致地下水硝态氮污染的重要原因(串丽敏等, 2010).沟渠作为农业污染源与水体之间的缓冲过渡区, 能够通过土壤吸附、植物吸收、生物降解等一系列自然净化机制降低非农田系统中氮、磷污染物的含量, 在农业非点源氮素污染控制及农业景观水质保护中起着重要作用(张燕等, 2012).Luo等(2009)的研究发现, 沟渠底泥中富含有机质, 团粒结构好, 吸附能力强, 且在底泥中生长的微生物种类和数量多, 有助于其吸附、降解污染物.有研究表明, 提高沟渠湿地特性可以减少农业景观对相邻水生生态系统的养分流失(Cooper et al., 2002; Moore et al., 2010; Kröger et al., 2011; Baker et al., 2015).因此, 如何加强农业区排水沟渠的调控和管理, 结合新技术减少氮素淋溶损失, 是我国治理农业氮素污染的重要方向.近年来, 利用生物炭来改良土壤进而减少养分淋失的研究日益增多(Ding et al., 2010; Laird et al., 2010; Galvez et al., 2012), 生物炭能够减少土壤中氮素淋失的结论也已得到广泛认可(刘玉学, 2011; 邢英等, 2011;Dempster et al., 2012).
生物炭是作物秸秆等有机物质及其衍生物在无氧条件下碳化的产物, 它能够改善土壤质量、保持土壤肥力(Lehmann et al., 2003; Hayes, 2006; Woods et al., 2006; Lehmann et al., 2007).研究发现, 添加生物炭能够提高土壤对氮素的固持能力(刘玮晶等, 2012;Kameyamal et al., 2012;刘玉学等, 2015).不同生物炭使用量对土壤氮素淋失的抑制效果不同(周志红等, 2011), 生物炭的制备材料、炭化温度等因素也影响着生物炭对土壤氮素的固持能力.相关研究表明, 生物炭在300~400 ℃条件下热解速率最快、质量损失最大, 在400 ℃以上热解比较完全, 且生物炭灰分随热解温度的升高而升高, 其芳香化程度亦随之提高(林肖庆等, 2016).同时, 生物炭对土壤持氮能力的影响还与土壤性质有关, 包括土壤的pH值、孔隙大小等因素(周志红等, 2011).玉米秸秆作为三江平原主要的农业生物质废弃物, 其归宿也一直是该地区的主要问题.将这些生物质废弃物热解为生物炭并作为土壤吸附剂是一种值得研究的利用途径(Cheng et al., 2018).目前, 我国东北粮食产区逐渐开始采用生物炭技术来缓解土壤中氮素的流失问题.
冻融交替是土壤在大气季节或昼夜温差下发生的反复“冻结-融化”过程, 是一种土壤热量动态表现形式(孙辉等, 2008).三江平原位于我国东北地区, 存在着明显的季节性冻融过程, 冻结期长达7~8个月.由于集约化农业活动, 三江平原水系氮污染问题日益严重, 冻融交替对农田氮素输出过程影响的研究也逐渐增多.研究表明, 频繁的冻融交替会使土壤水分经历多次“液相-固相”转变, 打破土壤原有物理结构和化学性质, 促进有机质分解和氮素供应(Freppaz et al., 2007).冻融过程能够影响土壤的理化性质(贾国晶等, 2012)及微生物的生存和繁殖(谭波等, 2011;隽英华等, 2015), 从而改变土壤氮素的矿化和固定过程(Henry et al., 2007), 影响土壤固持氮素的能力.受全球变暖的影响, 土壤冻融循环格局的改变具有很大的可能性(陈哲等, 2016), 而土壤氮素淋溶特征在很大程度上受冻融格局的影响, 因此, 冻融循环次数、冻融速率和冻融强度等因素的改变使东北地区黑土氮素淋失过程存在很大的不确定性(Gardenas et al., 2011).同时, 生物炭对东北季节性冻融条件下土壤固持氮素能力的影响亦需继续探索.
本研究选择东北沟渠土壤作为实验对象, 开展室内土柱模拟淋溶实验, 研究土壤添加不同比例生物炭对土壤中不同形态氮素淋失的影响规律, 并进一步探讨在冻融交替条件下添加生物炭对两种形态氮素淋失的影响效果, 总结不同冻融频次对添加生物炭的土壤固持氮素能力的影响规律.以期拓展生物炭的应用方向, 提升农田沟渠对农业氮污染的阻控效果, 为减少三江平原农田氮素流失提供参考.
2 材料与方法(Materials and methods) 2.1 实验材料 2.1.1 供试土壤供试土壤采自三江平原阿布胶河流域八五九农场(47°26′~47°41′N, 134°11′~134°12′E).选择具有典型性的水田沟渠, 采集沟渠底部0~20 cm的土壤约30 kg.将含水量较高的沟渠土壤分割成条状, 剔除植物残骸和石子, 自然风干后, 研磨, 过2 mm筛, 室温下保存.供试土壤的理化性质见表 1.
| 表 1 供试土壤理化性质 Table 1 Physical and chemical properties of the soil used in this study |
考虑到生物炭的产量和灰分成分及实验室实验器材的限制, 本研究采用400 ℃作为制作生物炭的最终温度, 这样既可以快速制备生物炭, 而且还可使生物炭热解完全, 灰分含量低, 性质更加稳定.选择研究区域常见的农田废弃物玉米秸秆为原材料, 在400 ℃厌氧条件下, 采用马弗炉(SX-2-4-10, 武汉亚华工业炉有限责任公司)制备生物炭, 其基本属性见表 2.
| 表 2 本研究所用生物炭的基本属性 Table 2 Biochar characteristics used in this study |
污染物在土壤中淋溶迁移的研究方法主要有土壤薄层层析法、柱淋洗法和渗漏计法等, 本实验选取柱淋洗法作为实验室内模拟研究的方法, 实验所用土柱由Hodson的实验土柱改良而来(Hodson et al., 1999).
2.2.1 实验装置实验设计的淋溶柱由内径3 cm、高40 cm的密封有机玻璃管制成.底端采用有机玻璃胶进行密封, 顶端采用可拆卸式密封螺旋塞, 并缠绕止水带以防止管口处存在渗漏.为保证淋溶液正常导入并防止渗滤过程中产生的气压差, 在淋溶柱螺旋塞上留有两个0.3 cm内径的导管.填充淋溶柱时首先在底部依次垫2层滤纸、3层40目尼龙纱, 再分别装入约2 cm的1~3 mm石英砂, 形成2 cm高的反滤层.其作用是保证土柱充分均匀排水, 防止滞水面的形成及土粒渗流堵塞出水孔.土柱中主要土壤添加层为100 g实验土壤, 土柱上下分别添加10 g未添加任何生物炭的原始土壤作为缓冲层, 中间100 g土壤作为实验土壤层(将生物质碳与供试土壤按一定质量比例混合, 搅拌均匀后放在可透气性塑料袋内, 在4 ℃条件下保存至少7 d, 使其充分混合).填充土壤时将供试土壤分多次均匀严实地填入柱中, 形成高15 cm的土壤层.填充过程中严密且均匀填充使下层土壤接近自然状态下的容重, 并保证各淋溶柱内土壤密度接近.在缓冲层上最后添加1层过1 mm筛的石英砂覆盖, 再垫1层滤纸, 形成初滤层, 从而将水量均匀分配到土壤表面.淋溶液自上而下依次通过初滤层、缓冲层、实验层、缓冲层和反滤层后从底部出水口流出.土壤出滤层以上留有10 cm高度的液面, 模拟沟渠水在表面流过(农田在沟渠上方约2 m左右, 沟渠水深度约为10 cm).
实验冻融土柱的填充方法与淋溶土柱相似, 为方便冻融过程实施, 本实验选用内径2.5 cm、高25 cm的密封有机玻璃管制作冻融土柱, 每处理做3组平行.实验所用土柱及淋溶装置示意图见图 1.
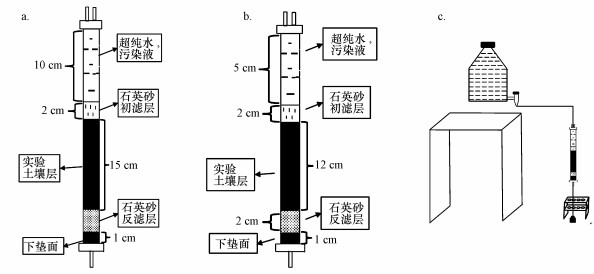 |
| 图 1 实验装置示意图(a.淋溶土柱装置, b.冻融土柱装置, c.淋溶装置) Fig. 1 Schematic diagram of soil column device used in the experiment |
① 淋溶实验过程:土柱装好后垂直放置于有机玻璃架上, 装满淋溶液的聚乙烯桶置于土柱上方约2 m处(农田在沟渠上方约2 m, 沟渠水深度约为10 cm)并通过橡胶导管连接土柱, 利用重力和高程差模拟沟渠水淋溶, 从上而下向土柱中输入淋溶液, 在土柱中形成一个稳定的流场进行淋溶, 土柱下端连接收集器采集淋溶液.首先用去离子水灌溉土柱至饱和, 之后用配制的NH4NO3溶液作为污染液开展淋溶实验, 污染液(NH4NO3溶液)的浓度梯度依次为1、2、5、10 mg·L-1, 各组淋溶柱中加入2 L相应的淋溶液.由于在实际实验中发现添加生物炭的土柱具有更快的淋溶速率, 在无法保证4种浓度淋溶液具有相同的淋溶速率的前提下, 采用统一收集相同体积的淋溶液, 实验过程中始终保持淋溶柱上层10 cm高度的液面.为了使淋出液具有代表性同时兼顾实验时间, 每次淋溶液达到100~150 mL时, 停止淋溶, 收集淋溶液, 记录淋溶液体积及所需时间.淋溶液用0.45 μm水系滤膜过滤后置于4 ℃冰箱, 并测定.
② 冻融实验过程:另外填充土柱并将其放置于有机玻璃架上, 首先用去离子水饱和土柱, 然后加入2 L 5 mg·L-1的NH4NO3溶液淋溶, 约12 h后停止淋溶, 收集淋溶液.之后将实验土柱放入-25 ℃的冰箱内冻结12 h, 然后取出放置在5 ℃的恒温箱中融化, 以此为一个冻融循环, 共进行4次冻融循环.每次冻融循环结束后, 将土柱取出放置在支架上, 用50 mL 5 mg·L-1的NH4NO3溶液对冻融后的土柱进行淋溶, 实验过程中始终保持冻融柱上层5 cm高度的液面, 每次收集约20 mL淋溶液, 过滤后置于4 ℃冰箱, 并测定.
2.3 测定方法土壤和生物炭理化性质的测定参考常规分析方法(鲁如坤, 2000).pH值采用pH计(pH400, Spectrum Technologies公司, 美国)测定(水土比为2.5:1);TN、C、H、O等含量采用元素分析仪(EuroVector S.P.A EA3000, Milan公司, 意大利)测定, 土壤无机氮含量测定时需先用0.01 mol·L-1氯化钙溶液浸提, 浸提液通过流动分析仪(AACE, 德国)测定硝态氮和铵态氮含量.淋溶液中硝态氮、铵态氮含量通过离子色谱仪(Dionex, DX-600和ICS-2100, 美国)测定.生物炭的灰分含量测定采用直接灰化法(Yuan et al., 2011), 比表面积、孔容、微孔率利用比表面积及介孔微/孔分析仪(ASAP-2020, Micromeritics公司, 美国)进行分析.
2.4 数据处理利用Origin 9.2软件作图, 所有数据采用SPSS 16.0统计软件进行单因素方差分析, 多重比较采用Duncan法.
3 结果与分析(Results and discussion) 3.1 不同比例生物炭对淋溶液淋出速率的影响不同配比生物炭条件下沟渠土壤淋溶液淋出速率情况如图 2所示.由图可知, 施加生物炭的土柱淋溶液的淋出速率高于未施加生物炭的土柱, 在相同浓度淋溶液淋溶下, 4组添加不同比例生物炭土柱淋溶液的淋溶速率之间差异显著, 且每一组土柱均呈现生物炭配比越高淋溶速率越快的规律, 其中, 生物炭配比为3.00%的土柱的淋溶速率约是空白组淋溶速率的2倍.比较不同浓度淋溶液淋出速率发现, 相同配比生物炭的土柱, 淋溶液浓度越高, 淋出速率越低, 即淋溶速率随着淋溶液浓度的升高呈下降趋势.
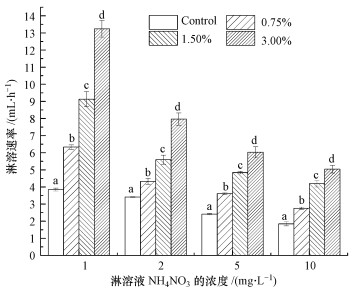 |
| 图 2 不同配比生物炭处理下淋溶液淋出速率变化 (Control:不添加生物炭;0.75%、1.50%、3.00%分别表示添加0.75%、1.50%、3.00%的生物炭(炭/干土);下同不同小写字母表示处理间差异显著(p < 0.05), 下同) Fig. 2 Leaching speed of solution under different ratio of biochar addition |
本研究结果表明, 添加生物炭的土壤中淋溶液的淋溶速率加快.这一现象与Major等(2009)的部分研究结论一致, 该研究发现吸附到较大生物炭颗粒的有机和无机养分在经过土壤剖面时可能通过其与小颗粒的胶体运输作用而促进淋溶.还有研究发现, 生物炭能够通过改变土壤孔隙度和团聚体来影响土壤养分的淋溶过程(陈温福等, 2014), 提高土壤团聚体能促进土壤水分的渗透, 进而增加土壤中移动而非流失的水分, 这可能会导致溶解态和可移动离子淋溶的增加(刘玉学等, 2015).由此可见, 生物炭的多孔结构及与土壤混合过程中可能造成土壤孔隙和团聚体的改变, 进而使得淋溶液能够较快速地通过, 加快淋溶过程.
3.2 不同比例生物炭对沟渠土壤中氮素淋失量的影响不同配比生物炭条件下沟渠土壤的无机氮淋失情况如图 3所示.从图 3a可以看出, 随着NH4NO3溶液浓度的升高, 硝态氮的淋失量在增加.在相同浓度的NH4NO3溶液条件下, 与空白组相比, 添加不同比例的生物炭均能够减少硝态氮的淋失.同时, 当NH4NO3溶液浓度分别为5和10 mg·L-1时, 添加不同比例生物炭对减少土壤硝态氮淋失效果的影响不同.从硝态氮淋失量来看, 与空白组相比, 在淋溶液的浓度分别为2、5和10 mg·L-1时, 添加0.75%生物炭的土壤中硝态氮淋失量最少, 生物炭阻控硝态氮淋失的效果最好.在淋溶液NH4NO3的浓度分别为1和2 mg·L-1时, 空白组与实验组的硝态氮淋失量存在显著性差异, 但实验组中不同配比生物炭之间硝态氮的淋失量差异性不显著, 这在一定程度上表明不同配比生物炭在这一淋溶液浓度下对土壤中硝态氮淋失的阻控效果相似.
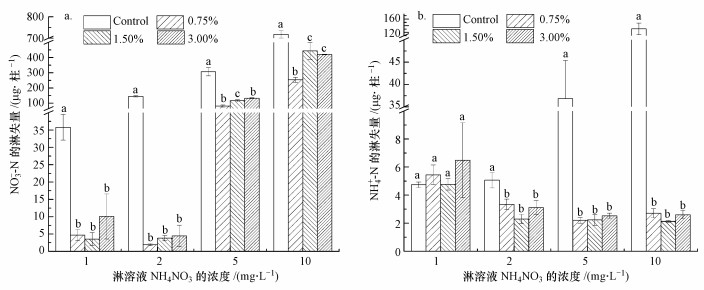 |
| 图 3 不同配比生物炭处理下硝态氮(a)及铵态氮(b)淋失量的变化 Fig. 3 Nitrate nitrogen(a) and ammonium nitrogen(b) leaching loss in different treatments |
图 3b结果显示, 施用生物炭能够大幅度降低土壤中铵态氮的淋失量, 在淋溶液浓度为2 mg·L-1时, 相对于空白组, 添加0.75%、1.50%、3.00%生物炭的土壤对铵态氮淋失量的降低率分别为33.9%、54.7%和38.6%.不同浓度NH4NO3溶液淋溶下, 添加生物炭的土壤中铵态氮淋失量变化规律与硝态氮的变化趋势基本一致.随着淋溶液NH4NO3浓度的升高, 铵态氮的淋失量也在增加, 但其数值远小于硝态氮.当淋溶液浓度大于2 mg·L-1后, 生物炭阻控土壤中铵态氮淋失的效果变得显著.与硝态氮淋失规律不同的是, 尽管空白处理与添加生物炭处理铵态氮淋失量存在一定程度的差异, 但在同一浓度淋溶液淋溶后, 不同配比生物炭处理之间对铵态氮淋失阻控效果的差异并不明显.
图 3b显示, 在淋溶液浓度分别为5和10 mg·L-1时, 添加生物炭的土壤对铵态氮淋失量的降低率均高于90%.一方面可能是因为生物炭孔隙发达, 比表面积大, 能够为氮素提供大量的吸附位点, 增强了土壤对氮素的固持能力(Saito et al., 2000);另一方面, 生物炭呈弱碱性, 能够提高土壤pH(高海英等, 2012), 增加土壤含氧官能团的数量, 从而提高阳离子交换量(刘玮晶, 2012), 减少土壤中铵态氮的淋失.相较于淋溶液浓度为5和10 mg·L-1时, 淋溶液浓度为1和2 mg·L-1时土柱中铵态氮的淋失量较大, 即生物炭在淋溶液浓度为1和2 mg·L-1时对铵态氮淋失量降低的程度较小.这一现象与邢英等(2011)研究生物炭对氮素吸附特征的结论一致, 该研究表明, 生物炭对铵态氮的吸附量在铵氮浓度为0~100 mg·L-1范围内, 随着水溶液中铵氮浓度的升高而增加.同时, 在吸附动力学研究中发现, 在铵氮浓度分别为5和10 mg·L-1时, 假二级方程能更好地描述铵氮在生物炭上的吸附动力学行为, 其吸附行为受外部液膜扩散、表面吸附和颗粒内扩散等过程的影响(邢英等, 2011).因此, 生物炭在淋溶液浓度为1和2 mg·L-1时对铵态氮淋失量降低的程度要小于淋溶液浓度为5和10 mg·L-1时.
有研究认为, 随着生物炭配比的增加, 生物炭对土壤中氮肥淋失的降低作用在减小(盖霞普等, 2015).而另一些研究结果则显示, 土壤氮素淋失量随着生物炭施用比例的增加而降低(周志红等, 2011).另外, 相对于生物炭配比为1.50%和3.00%的处理, 0.75%的生物炭添加量对硝态氮的淋失表现出较好的阻控能力.Cheng等(2018)的研究表明, 添加0.75%的生物炭, 能够增加沉积物pH值, 增强底泥持水能力.由此看来, pH值及持水能力的改变很可能改变了土壤含氧官能团的数量, 加强了土壤对氮素的阻控能力.
但由于本研究淋溶实验的周期不长, 因此, 这一实验结果具有一定的局限性.若要探明提高土壤固持氮素能力的最优生物炭配比, 仍需进一步开展长期、多梯度的淋溶实验.
3.3 冻融条件下不同比例生物炭对土壤氮素淋失的影响冻融条件下, 添加不同配比生物炭沟渠土壤的无机氮淋失情况如图 4所示.图 4a显示, 冻融过程前后, 空白组土壤中硝态氮的淋失量均高于其他实验组土壤中硝态氮的淋失量.经历第1次冻融后, 硝态氮得到了大量的释放, 土壤淋溶液中硝态氮大幅度提高, 空白组与实验组硝态氮淋失量之间存在显著性差异.在第2次冻融循环后, 空白组和0.75%生物炭实验组的土壤仍有硝态氮淋溶出, 剩余的实验组淋溶液中氮素淋出量较少.经历过第3次和第4次冻融循环后, 4组土柱淋出液中氮素含量之间不存在显著性差异, 说明之后的冻融循环不会再将土壤中的氮素释放出来.最后采用5 mg·L-1的NH4NO3溶液进行淋溶, 可以看到实验组与空白组土壤氮素淋出量十分相近, 这一现象说明4次冻融循环能够削弱添加生物炭的土壤对氮素污染物的阻控能力, 原因可能在于冻融过程使得生物炭与土壤之间的耦合能力下降, 对氮素的吸附能力受到限制(陈温福等, 2014).
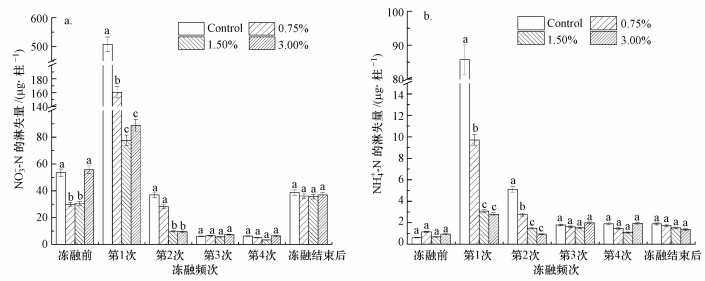 |
| 图 4 冻融条件下不同处理硝态氮(a)及铵态氮(b)淋失量变化 Fig. 4 Nitrate nitrogen(a) and ammonium nitrogen(b) leaching loss in different treatments under freeze-thaw conditions |
图 4b显示, 经历第1次冻融后, 淋出的土壤溶液中铵态氮含量大幅度提高, 铵态氮得到释放, 这是由土壤微裂隙或冰晶融化后形成的大孔隙导致土壤渗透系数增大造成的(Zimmie et al., 1990).第1次冻融之后的4组土柱进行对比, 未添加生物炭的土柱淋溶液中氮素的释放量最大, 约是0.75%实验组土柱铵态氮淋失量的9倍, 1.50%和3.00%实验组土柱铵态氮释放量约为0.75%实验组铵态氮释放量的1/3, 存在显著差异.1.50%和3.00%实验组土柱铵态氮释放量之间没有显著性差异.在经过第2次冻融循环后, 实验组土柱淋出液中铵态氮含量均低于空白组土柱, 呈现出随生物炭添加比例增高, 铵态氮淋失量逐渐减小的趋势.经过第3次和第4次冻融循环, 实验组和空白组土柱淋出液中铵态氮含量均达到了恒定值, 且4组土柱铵态氮含量之间的差异不大.最后对其进行5 mg·L-1的NH4NO3溶液淋溶, 可以看到4组土柱中铵态氮的淋失量不大, 且数值相近.与硝态氮相比, 这一现象表明经过多次冻融循环之后土壤中添加生物炭对减少铵态氮淋失量的效果较小.
有研究认为, 土壤团块由于水在冻融过程中凝结成冰挤压后碎块化, 使土壤团粒间的空间发生改变, 影响了氮素的附着能力, 降低了土壤对氮素的固持作用(Jackson-Blake et al., 2012; 苟小林等, 2014).同时, 其他研究发现, 冻融过程能够增加土壤孔隙, 从而使土壤持水能力下降, 土壤水分流失增加(Wu et al., 2010;刘绪军等, 2015), 进而导致土壤释放可溶性无机氮, 造成土壤氮素淋失量增加(苟小林等, 2014).通过4组土柱对比, 发现空白组土壤氮素释放量最大, 其硝态氮释放量是0.75%实验组释放量的3倍.1.50%和3.00%实验组土壤的硝态氮淋出量约为0.75%实验组土壤硝态氮淋出量的1/2.这一结果表明, 生物炭的施用可以增加土壤对氮素的固持能力, 从而减缓冻融过程加速土壤氮素流失的作用.但要实现减少土壤氮素淋失这一目的, 需要摸索合适的生物炭与土壤的比例.
在经历冻融循环后, 生物炭对氮素污染物的阻控能力有所下降.这是因为在冻融过程中水的膨胀作用使生物炭的粒径变大, 生物炭表面积减小, 吸附能力变差, 因此, 冻融过程在一定程度上能够削弱生物炭固持氮素的作用.李美璇等(2016)的研究也发现, 冻融频次对生物炭固持氮素的效果会有影响, 且冻融频次越高, 生物炭对土壤固持氮素能力的改善作用就越差.
4 结论(Conclusions)1) 不同配比生物炭的添加对土壤固持不同形态氮素的影响不同, 单从吸附效果来看, 生物炭添加比例为0.75%、1.50%和3.00%的土柱都显著增大了土壤对无机氮的吸附.添加生物炭也能够增大淋溶液的淋出速率, 且添加比例越高, 淋溶液的淋出速率越快.在不同浓度淋溶液的作用下, 0.75%添加比例的玉米秸秆生物炭对硝态氮的固持能力较好, 1.50%添加比例的生物炭对铵态氮的固持能力较好, 因此, 生物炭的添加能使氮素尽可能地保持在作物根际层进而被作物利用.
2) 冻融过程能够减弱生物炭对土壤氮素的固持效果, 这种作用与冻融频次有关, 尽管生物炭添加比例不同, 但生物炭对硝态氮和铵态氮的固持能力均在经历第1次冻融循环之后大幅降低.经过2次以上冻融循环过程之后, 氮素淋出量降低, 冻融过程显现出对生物炭吸附氮素作用的抵消效应.
Baker B H, Kröger R, Brooks J P, et al. 2015. Investigation of denitrifying microbial communities within an agricultural drainage system fitted with low-grade weirs[J]. Water Research, 87: 193–201.
DOI:10.1016/j.watres.2015.09.028
|
串丽敏, 赵同科, 安志装, 等. 2010. 土壤硝态氮淋溶及氮素利用研究进展[J]. 中国农学通报, 2010, 26(11): 200–205.
|
陈温福, 张伟明, 孟军. 2014. 生物炭与农业环境研究回顾与展望[J]. 农业环境科学学报, 2014, 33(5): 821–828.
|
陈哲, 杨世琦, 张晴雯, 等. 2016. 冻融对土壤氮素损失及有效性的影响[J]. 生态学报, 2016, 36(4): 1083–1094.
|
Cheng Q D, Cheng H G, Lu L, et al. 2018. Fate of nitrogen in overlying water with biochar addition to sediment in planted ditches[J]. Environmental Science:Processes & Impacts, 20(2): 384–394.
|
Cooper C M, Moore M T, Bennett E R, et al. 2002. Alternative benefits of agricultural drainage ditches[J]. Verhandlungen Der Internationalen Vereinigung Für Theoretische und Angewandte Limnologie, 28: 1678–1682.
|
Dempster D N, Jones D L, Murphy D V. 2012. Clay and biochar amendments decreased inorganic but not dissolved organic nitrogen leaching in soil[J]. Soil Research, 50(3): 216–221.
DOI:10.1071/SR11316
|
Ding Y, Liu Y X, Wu W X, et al. 2010. Evaluation of biochar effects on nitrogen retention and leaching in multi-layered soil columns[J]. Water, Air, &Soil Pollution, 213(1): 47–55.
|
Freppaz M, Williams B L, Edwards A C, et al. 2007. Simulating soil freeze-thaw cycles typical of winter alpine conditions:implications for N and P availability[J]. Applied Soil Ecology, 35(1): 247–255.
DOI:10.1016/j.apsoil.2006.03.012
|
盖霞普, 刘宏斌, 翟丽梅, 等. 2015. 玉米秸秆生物炭对土壤无机氮素淋失风险的影响研究[J]. 农业环境科学学报, 2015, 34(2): 310–318.
|
Galvez A, Sinicco T, Cayuela M L, et al. 2012. Short term effects of bioenergy by-products on soil C and N dynamics, nutrient availability and bio-chemical properties[J]. Agriculture Ecosystems and Environment, 160: 3–14.
DOI:10.1016/j.agee.2011.06.015
|
Gardenas A I, Agren G I, Bird J A, et al. 2011. Knowledge gaps in soil carbon and nitrogen interactions-from molecular to global scale[J]. Soil Biology and Biochemistry, 43(4): 702–717.
DOI:10.1016/j.soilbio.2010.04.006
|
高海英, 何绪生, 陈心想, 等. 2012. 生物炭及炭基硝酸铵肥料对土壤化学性质及作物产量的影响[J]. 农业环境科学学报, 2012, 31(10): 1948–1955.
|
苟小林, 吴福忠, 杨万勤, 等. 2014. 季节性冻融格局变化对高山森林土壤氮素淋溶损失的影响[J]. 环境科学学报, 2014, 34(2): 439–448.
|
Hayes M H B. 2006. Biochar and biofuels for a brighter future[J]. Nature, 443(7108): 144–144.
|
Henry H A L. 2007. Soil freeze thaw cycle experiments:Trends, methodological weaknesses and suggested improvements[J]. Soil Biology and Biochemistry, 39(5): 977–986.
DOI:10.1016/j.soilbio.2006.11.017
|
Jackson-Blake L, Helliwell R C, Britton A J, et al. 2012. Controls on soil solution nitrogen along an altitudinal gradient in the Scottish uplands[J]. Science of the Total Environment, 431: 100–108.
DOI:10.1016/j.scitotenv.2012.05.019
|
贾国晶, 周永斌, 代力民, 等. 2012. 冻融对长白山森林土壤碳氮矿化的影响[J]. 生态环境学报, 2012, 21(4): 624–628.
DOI:10.3969/j.issn.1674-5906.2012.04.006 |
隽英华, 刘艳, 田路路, 等. 2015. 冻融交替对农田棕壤氮素转化过程的调控效应[J]. 土壤, 2015, 47(4): 647–652.
|
Kameyamal K, Miyamoto T, Shiono T, et al. 2012. Influence of sugarcane bagasse derived biochar application on nitrate leaching in calcaric dark red soil[J]. Journal of Environmental Quality, 41(4): 1131–1137.
DOI:10.2134/jeq2010.0453
|
Kettunen R, Saarnio S. 2013. Biochar can restrict N2O emissions and the risk of nitrogen leaching from an agricultural soil during the freeze-thaw period[J]. Agricultural and Food Science, 22(4): 373–379.
DOI:10.23986/afsci.7887
|
Laird D, Fleming P, Wang B, et al. 2010. Biochar impact on nutrient leaching from a midwestern agricultural soil[J]. Geoderma, 158(3/4): 436–442.
|
Lehmann J. 2007. A handful of carbon[J]. Nature, 447(7141): 143–144.
DOI:10.1038/447143a
|
Lehmann J, da Silva J P, Steiner C, et al. 2003. Nutrient availability and leaching in an archaeological anthrosol and a ferralsol of the central Amazon basin:fertilizer, manure and char co al amendments[J]. Plant and Soil, 249(2): 343–357.
DOI:10.1023/A:1022833116184
|
李美璇, 王观竹, 郭平. 2016. 生物炭对冻融黑土中铵态氮和硝态氮淋失的影响[J]. 农业环境科学学报, 2016, 35(7): 1360–1367.
|
Luo Z X, Zhu B, Tang J L, et al. 2009. Phosphorus retention capacity of agricultural headwater ditch sediments under alkaline condition in purple soils area, China[J]. Ecological Engineering, 35(1): 57–64.
DOI:10.1016/j.ecoleng.2008.09.021
|
刘玮晶, 刘烨, 高晓荔, 等. 2012. 外源生物质炭对土壤中铵态氮素滞留效应的影响[J]. 农业环境科学学报, 2012, 31(5): 962–968.
|
刘玮晶.2012.生物质炭对土壤中氮素养分滞留效应的影响[D].南京: 南京农业大学
http://cdmd.cnki.com.cn/Article/CDMD-10307-1013284599.htm |
林肖庆, 吕豪豪, 刘玉学, 等. 2016. 生物质原料及炭化温度对生物炭产率与性质的影响[J]. 浙江农业学报, 2016, 28(7): 1216–1223.
DOI:10.3969/j.issn.1004-1524.2016.07.019 |
刘绪军, 景国臣, 杨亚娟, 等. 2015. 冻融交替作用对表层黑土结构的影响[J]. 中国水土保持科学, 2015, 13(1): 42–46.
DOI:10.3969/j.issn.1672-3007.2015.01.007 |
刘玉学.2011.生物质炭输入对土壤氮素流失及温室气体排放特性的影响[D].杭州: 浙江大学
http://cdmd.cnki.com.cn/article/cdmd-10335-1011051877.htm |
刘玉学, 吕豪豪, 石岩, 等. 2015. 生物质炭对土壤养分淋溶的影响及潜在机理研究进展[J]. 应用生态学报, 2015, 26(1): 304–310.
|
鲁如坤. 2000. 土壤和农业化学分析法[M]. 北京: 中国农业科技出版社.
|
Major J, Steiner C, Downie A, et al. 2009. Biochar Effects on Nutrient Leaching//Lehmann J, Joseph S, eds.Biochar for Environmental Management:Science and Technology[M]. London: Earthscan Publishers: 271–287.
|
Hodson M E, Langan S J. 1999. A long-term soil leaching column experiment investigating the effect of variable sulphate loads on soil solution and soil drainage chemistry[J]. Environmental Pollution, 104: 11–19.
DOI:10.1016/S0269-7491(98)00164-X
|
Moore M T, Kröger R, Locke M A, et al. 2010. Nutrient mitigation capacity in Mississippi Delta, USA drainage ditches[J]. Environmental Pollution, 158: 175–184.
DOI:10.1016/j.envpol.2009.07.024
|
Kröger R, Moore M T, Farris J L, et al. 2011. Evidence for the use of low-grade weirs in drainage ditches to improve nutrient reductions from agriculture[J]. Water Air Soil Pollution, 221: 223.
DOI:10.1007/s11270-011-0785-x
|
Saito Y, Mori M, Shida S, et al. 2000. Formaldehyde adsorption and desorption properties of wood-based charcoal[J]. Journal of the Japan Wood Research Society, 46: 596–601.
|
孙辉, 秦纪洪, 吴杨. 2008. 土壤冻融交替生态效应研究进展[J]. 土壤, 2008, 40(4): 505–509.
DOI:10.3321/j.issn:0253-9829.2008.04.001 |
谭波, 吴福忠, 杨万勤, 等. 2011. 雪被去除对川西高山森林冬季土壤温度及碳、氮、磷动态的影响[J]. 应用生态学报, 2011, 22(10): 2553–2559.
|
Woods W I, Falcao N P S, Teixeira W G. 2006. Biochar trials aim to enrich soil for smallholders[J]. Nature, 443(7108): 144–144.
|
Wu F, Yang W, Zhang J, et al. 2010. Fine root decomposition in two sub-alpine forests during the freeze-thaw season[J]. Canadian Journal of Forest Research, 40(2): 298–307.
DOI:10.1139/X09-194
|
邢英, 李心清, 王兵, 等. 2011. 生物炭对黄壤中氮淋溶影响:室内土柱模拟[J]. 生态学杂志, 2011, 30(11): 2483–2488.
|
Yuan J H, Xu R K, Zhang H. 2011. The forms of alkalis in the biochar produced from crop residues at different temperatures[J]. Bioresource Technology, 102(3): 3488–3497.
DOI:10.1016/j.biortech.2010.11.018
|
张燕, 阎百兴, 祝惠, 等. 2012. 三江平原农田源头排水沟渠截留排水中氮素动态[J]. 生态与农村环境学报, 2012, 28(2): 176–180.
DOI:10.3969/j.issn.1673-4831.2012.02.011 |
周志红, 李心清, 邢英, 等. 2011. 生物炭对土壤氮素淋失的抑制作用[J]. 地球与环境, 2011, 39(2): 278–284.
|
Zimmie T F, La Plante C. 1990. The effect of the frequency of cyclic loading on tension leg platforms foundation soils[J]. British Maritime Technology, 18(1): 3271–3282.
|
 2019, Vol. 39
2019, Vol. 39


