2. 山西大学环境与资源学院, 太原 030006;
3. 山西中医药大学基础医学院, 太原 030024
2. College of Environment and Resource, Shanxi University, Taiyuan 030006;
3. Basic Medicine School, Shanxi University of Chinese Medicine, Taiyuan 030024
砷(As)是环境中广泛存在的一种类金属元素.自然过程或人为因素(如采矿、金属冶炼等)导致世界上许多地区的地下水As含量超出世界卫生组织(WHO)饮用水标准(≤10 μg·L-1).通过饮水摄入As成为人群暴露As的主要途径(Smith et al., 2002; Watanabe et al., 2003).据不完全统计, 全球约有2亿人面临着饮用高As水的健康风险(Chakraborti et al., 2017), 我国高As地下水暴露人群高达1960万(Rodríguez-Lado et al., 2013).长期饮用高As水会诱发皮肤癌、肺癌、肝癌、肾癌和膀胱癌等多种癌症, 增加呼吸系统、消化系统、心血管系统及Ⅱ型糖尿病的患病率(Liu et al., 2013; Lu et al., 2014;Chakraborti et al., 2017).由于污染范围广及不良的健康效应, 慢性As中毒已经成为一个全球性的公共卫生问题.
肠道既是消化、吸收的主要场所, 也是人体主要的免疫器官, 在维持机体正常免疫功能、阻止有害物质入侵等方面有重要的作用(Miller et al., 2007).经口摄入的As通过肠道吸收进入血液, 随后分布到其他组织器官, 肠道是As进入血液循环发挥全身毒性的通道(Gonzalez et al., 1997).此外, 通过粪便排泄的As也会在肠道内滞留较长时间, As在肠道滞留期间会直接作用于肠道细胞.流行病学调查显示, 长期摄入As会出现厌食、恶心、消化不良、腹痛和腹泻等消化道症状(Guha Mazumder et al., 2011; Chakraborti et al., 2017).动物研究表明, 公鸡摄入含As的饲料后肠道组织发生氧化应激, 细胞因子及免疫球蛋白基因表达改变(Guo et al., 2015; Zhao et al., 2018);啮齿动物长期暴露于高浓度的单甲基胂酸, 大肠肠壁出现扩张、水肿、出血及坏死, 肠黏膜溃疡或穿孔(Arnold et al., 2003).体外肠道细胞毒性实验证明, As可抑制肠上皮细胞紧密连接蛋白的表达, 导致细胞跨上皮电阻抗值降低, 细胞间隙通透性增加(Jeong et al., 2017).但目前有关As对肠道结构及功能的影响仍缺乏较为系统深入的研究.本课题组前期研究发现, 饮用5 mg·L-1和50 mg·L-1 As的亚砷酸钠(NaAsO2)水溶液后, 小鼠体重、饮水量及摄食量均显著降低(Li et al., 2018;曾群等, 2018; Zeng et al., 2019), 提示小鼠肠道功能和组织结构可能受损.
现有研究认为, As暴露会破坏机体原有的氧化/还原平衡, 诱导活性氧(ROS)水平增高(Hei et al., 2004), 高水平的ROS会攻击胞内的蛋白质、脂类、DNA等生物大分子, 引起细胞结构和功能损伤, As诱发的炎症、疾病及机体功能紊乱大多与体内ROS水平的增高相关(Flora, 2011).空肠是小肠食物消化和吸收的主要部位, 本研究以小鼠为研究对象, 检测慢性饮水型As暴露对小鼠空肠的氧化应激、组织结构特征及免疫相关基因表达的影响, 并对肠黏膜杯状细胞进行相对定量分析, 探讨As对小鼠空肠黏膜的损伤效应, 以期为揭示慢性饮水摄入As对肠道的毒作用机制提供实验依据.
2 材料和方法(Materials and methods) 2.1 动物分组及染毒模拟居民饮水As污染, 实验动物采用自由饮用三价砷化物NaAsO2水溶液的方式摄入As.考虑到大部分实验动物比人更耐受As(Hughes, 2002; Kim et al., 2015), 同时结合课题组的前期研究, 确定实验组所用饮用水As浓度为5 mg·L-1(略高于目前世界上高As暴露地区饮用水As含量)或50 mg·L-1, 对照组小鼠(Control)饮用蒸馏水.从中国食品药品检定研究院购4周龄SPF级雄性C57BL/6小鼠24只, 体重(15±2) g, 按体重随机分为3组(n=8).饲养条件:小鼠自由饮水及摄食, 喂食山西医科大学提供的专用全价大颗粒饲料, 温度(23±1) ℃, 湿度55%±10%, 光照12 h·d-1.适应1周后开始染毒, 连续染毒6个月.染毒结束禁食12 h后取材.
2.2 动物解剖及取材采用1%的戊巴比妥钠麻醉小鼠, 称重后迅速打开腹腔取出空肠, 采用预冷的生理盐水漂洗去除肠腔内容物.滤纸吸干水分后, 取0.5 cm的空肠固定于4%的中性甲醛中, 用于组织病理学分析;其余空肠组织切成小块分装于冻存管内, 经液氮冷冻后于-80 ℃保存备用.
2.3 切片的制备及观察组织经中性甲醛固定后梯度酒精脱水、二甲苯透明、石蜡包埋, 切成4~5 μm厚的切片.苏木素-伊红(H&E)染色用于空肠组织的形态学观察, 阿辛蓝/苏木素-伊红(AB/H&E)染色用于空肠上皮杯状细胞的观察及计数.
2.4 组织氧化指标测定取冻存的空肠组织100~150 mg, 加入9倍体积的生理盐水, 玻璃匀浆器冰浴匀浆, 制备10%的组织匀浆液, 3500 r·min-1下低温离心15 min后取上清液, 用于氧化指标的测定.丙二醛(MDA)含量、总超氧化物歧化酶(T-SOD)活性和总抗氧化能力(T-AOC)测定均严格按试剂盒(南京建成)操作说明进行.蛋白含量测定采用考马斯亮蓝法, 牛血清白蛋白做标准曲线(Bradford, 1976).
2.5 总RNA提取及qPCR采用Trizol法提取空肠组织总RNA, 去除基因组DNA后, 以oligo dT为引物反转录合成cDNA.参照qPCR试剂说明建立20 μL反应体系进行靶基因相对表达量的测定, 每个样本设两个重复, 在ABI 7500 system进行基因扩增.以β-actin作为内参, 采用2-ΔΔCt法(Livak et al., 2001)计算每个靶基因的相对表达量, 引物序列见表 1.
| 表 1 qPCR引物序列 Table 1 Primers sequences used for real-time PCR |
本实验采用SPSS 21软件对数据进行统计分析, 结果以Mean±SE表示.通过单因素方差分析(one-way ANOVA), LSD和Dunnett′s T3做多重比较, 检验各组之间的差异显著性.*p < 0.05, **p < 0.01, ***p < 0.001, 表示处理组与对照组间的差异显著;#p < 0.05, ##p < 0.01, ###p < 0.001, 表示50 mg·L-1 As组与5 mg·L-1 As组间的差异显著.
3 结果(Results) 3.1 染毒小鼠一般情况及As摄入量整个实验期间小鼠活动正常, 精神状况良好, 未出现死亡.根据饮水量及体重计算5 mg·L-1 As组和50 mg·L-1 As组小鼠的As摄入量分别为0.82 mg·kg-1·d-1和4.82 mg·kg-1·d-1.
3.2 As暴露对空肠组织的氧化损伤效应饮用含As水6个月后, 5 mg·L-1 As和50 mg·L-1 As组小鼠空肠组织的MDA含量(以prot计)显著增加, T-SOD活性(以prot计)和T-AOC(以prot计)显著降低(图 1), 且具有浓度依赖效应, 说明As暴露抑制了空肠组织的抗氧化能力, 使氧化/还原平衡破坏, 导致组织的氧化损伤.
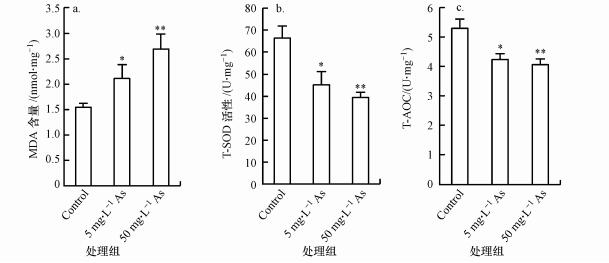 |
| 图 1 As暴露对小鼠空肠组织MDA含量(a)、T-SOD活性(b)和T-AOC(c)的影响 Fig. 1 Effects of arsenic exposure on MDA content (a), T-SOD activity (b), and T-AOC (c) in the jejunum of mice |
显微镜观察发现, 对照组小鼠空肠黏膜结构完整, 肠绒毛呈圆锥状, 排列紧密, 纹状缘整齐, 上皮吸收细胞排列有序, 肠腺发达(图 2a).5 mg·L-1 As组肠黏膜表面受到侵蚀, 纹状缘不规则, 上皮吸收细胞排列紊乱, 部分绒毛脱落, 黏膜固有层内有炎症细胞浸润(图 2b).50 mg·L-1As组肠黏膜严重受损, 多数肠绒毛脱落, 肠腺萎缩(图 2c).结果表明, As暴露造成了小鼠空肠结构损伤, 且随着暴露浓度的增加损伤加重.
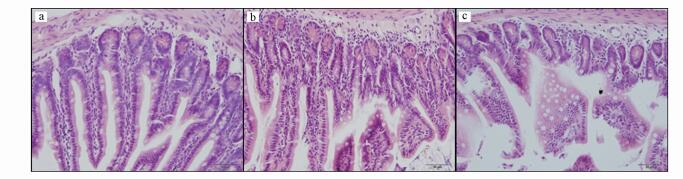 |
| 图 2 小鼠空肠组织结构H&E染色切片图像 (400×, 标尺=50 μm;a.对照组;b.5 mg·L-1 As组; c.50 mg·L-1 As组) Fig. 2 Representative histopathological images of H&E staining in the jejunum of mice |
肠黏膜受损会直接影响黏膜免疫功能.肿瘤坏死因子α(TNF-α)和干扰素γ(IFN-γ)是两种典型的促炎细胞因子, 由免疫细胞产生.qPCR检测发现(图 3), 小鼠空肠TNF-α和IFN-γ的mRNA水平在5 mg·L-1 As组显著升高, 在50 mg·L-1As组显著下降;与5 mg·L-1As组相比, 50 mg·L-1 As组空肠TNF-α和IFN-γ的mRNA水平极显著降低.以上结果表明, 一定水平的As摄入诱导了肠道促炎细胞因子的表达, 诱发炎症的产生;高剂量的As摄入则抑制了促炎细胞因子的转录.此结果与空肠组织结构损伤结果(图 2)一致.
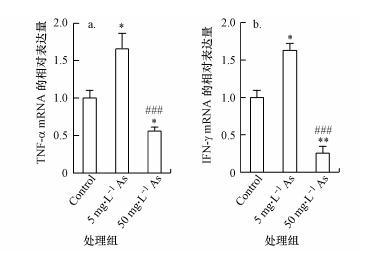 |
| 图 3 As暴露对小鼠空肠TNF-α(a)和IFN-γ(b)基因转录的影响 Fig. 3 Effects of arsenic exposure on the mRNA levels of TNF-α (a) and IFN-γ (b) in the jejunum of mice |
Th2细胞是体内重要的免疫调节细胞, 其分泌的IL-4、IL-5、IL-13等细胞因子可刺激B细胞增殖并产生免疫球蛋白, 参与机体的体液免疫应答.由图 4可知, 5 mg·L-1 As组小鼠空肠IL-4、IL-5和IL-13的转录水平显著增高, 50 mg·L-1As组IL-4、IL-5和IL-13的转录水平不同程度降低, 其中IL-4差异显著.与5 mg·L-1 As组相比, 50 mg·L-1 As组IL-4、IL-5和IL-13的转录水平均显著降低.以上结果表明, 低剂量As诱导空肠Th2细胞因子的表达, 高剂量As抑制Th2细胞因子的转录.该结果与促炎细胞因子基因的表达结果(图 3)一致.
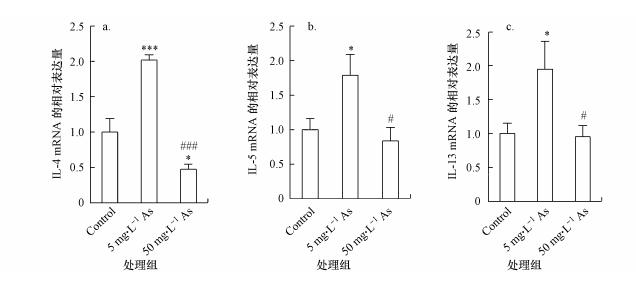 |
| 图 4 As暴露对小鼠空肠IL-4(a)、IL-5(b)和IL-13(c)基因转录的影响 Fig. 4 Effects of arsenic exposure on the mRNA levels of IL-4 (a), IL-5 (b), and IL-13 (c) in the jejunum of mice |
杯状细胞可在炎症介质的刺激下释放黏液, 在一定程度上阻挡有害物质或病原微生物对肠道上皮的损伤, 参与机体防御(Smirnova et al., 2003).同时, 杯状细胞也是重要的免疫相关细胞.经AB/H&E染色后蓝色的杯状细胞相对均匀地分布于对照组的肠绒毛上, As组吸收细胞排列紊乱、肠绒毛脱落, 黏膜杯状细胞分布极不均匀(图 5).杯状细胞数量在5 mg·L-1As组显著增多, 而50 mg·L-1 As组与对照组无显著差异(图 6).以上结果表明, 一定剂量的As暴露可诱导肠黏膜杯状细胞的增殖, 促进肠道黏液的分泌.
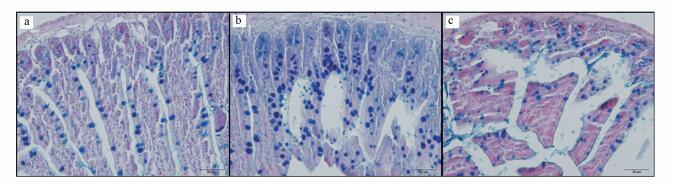 |
| 图 5 小鼠空肠黏膜杯状细胞的AB/H&E染色图像 (400×, 标尺=50 μm; a.对照组;b.5 mg·L-1As组; c.50 mg·L-1 As组) Fig. 5 Representative histopathological images of AB/H&E staining in the jejunum of mice |
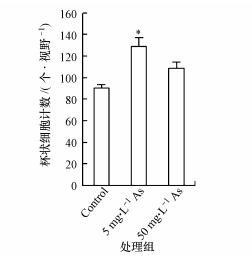 |
| 图 6 小鼠空肠黏膜杯状细胞计数 Fig. 6 Goblet cell count in the jejunum of mice |
长期饮用含As水会造成机体多个器官和组织损伤, 世界各地报道的As中毒大多与饮水型As暴露相关(Evens et al., 2004; Wu et al., 2010).无机As对巯基(—SH)有很高的亲和力, 可以与含—SH的功能蛋白、酶及小分子化合物发生反应, 干扰细胞的正常代谢过程, 抑制多种抗氧化酶活性及抗氧化物质水平, 最终导致胞内ROS的积累(Flora, 2011;Chakraborti et al., 2017).SOD是体内关键的抗氧化酶, 能将毒性较强的超氧阴离子(O2·-)转化为过氧化氢(H2O2), 随后H2O2被酶解产生H2O和O2;T-AOC反映机体酶促与非酶促两大防御体系总的抗氧化水平高低;MDA作为脂质过氧化产物, 可反映脂质过氧化水平, 从而间接反映细胞的氧化损伤程度.本文中As组T-SOD和T-AOC下降, 说明As暴露抑制了内源性抗氧化酶及抗氧化物质的活性, 使机体清除自由基的能力下降, 导致体内自由基水平升高, 膜脂过氧化产物增加, 表现为空肠MDA水平升高, 组织氧化损伤.Acharyya等(2014)报道, 绿茶多酚可通过提高机体抗氧化能力缓解As对大鼠肠道组织的损伤.体外实验也证明, 抗氧化剂N-乙酰半胱氨酸(NAC)预处理可逆转As对肠上皮细胞紧密连接蛋白表达的抑制, 使细胞跨上皮电阻抗值恢复(Jeong et al., 2017).因此, 我们推测本研究As暴露引起空肠组织结构的改变可能与其诱导的氧化损伤相关.
小肠绒毛及其微绒毛大大增加了肠道吸收营养物质的面积, 微绒毛的膜上还有负责消化双糖和多肽的酶(Chiocchetti et al., 2018), 这些结构的改变会影响机体的消化和吸收功能.As摄入引起肠道菌群构成及生理功能的改变(Lu et al., 2014), 也会影响食物的正常消化和吸收, 导致体重下降.本研究As组小鼠空肠绒毛脱落、吸收细胞排列紊乱、纹状缘(由密集排列的微绒毛构成)不整齐, 提示As的摄入可能引起了小鼠肠道消化和吸收功能异常.As诱导的小肠结构损伤是导致As组小鼠体重降低(曾群等, 2018)的一个重要原因.
肠道黏膜受损不仅会影响营养物质的正常消化吸收, 还会干扰黏膜免疫.肠上皮内淋巴细胞位于黏膜上皮细胞间, 介导黏膜局部免疫预防, 黏膜受损会直接影响肠上皮内淋巴细胞的数量及分布.黏膜受损还会改变肠道细胞间的通透性, 致使有害物质或微生物可以直接与固有层的免疫系统接触, 干扰肠道免疫功能(Chiocchetti et al., 2018).此外, 杯状细胞分泌的黏液层包含有大量的分泌型免疫球蛋白(slgA), 杯状细胞还可将糖类抗原传递到树突细胞, 在肠道免疫稳态中发挥重要作用(McDole et al., 2012).本研究5 mg·L-1 As组高表达的免疫相关因子(TNF-α、IFN-γ、IL-4、IL-5和IL-13)、固有层内炎症细胞的浸润及显著增多的杯状细胞提示, 低剂量As暴露造成空肠结构损伤的同时可能激活了肠道免疫应答反应, 诱发肠道炎症, 以增强机体的防御能力.50 mg·L-1 As组未观察到炎症表型, 可能与空肠黏膜严重破坏, 局部组织坏死有关(Arnold et al., 2003);同期出现的TNF-α、IFN-γ和IL-4等免疫相关因子基因表达下调, 提示肠道免疫功能被抑制.无机As可因暴露剂量、暴露时间及砷化物种类的不同而引起免疫激活或抑制(Di Gioacchino et al., 2007).本研究的结果提示, 长期摄入As可能破坏了小鼠空肠组织的免疫平衡, 诱发肠道黏膜免疫紊乱, 这与Zhao等(2018)报道的As摄入引起公鸡空肠免疫紊乱的结果类似.
综上, 本文通过饮水型As暴露模型初步探讨了慢性As摄入对小鼠肠道结构及免疫功能的影响.虽然As导致肠道损伤的机制很复杂, 但As诱导的活性氧途径可能是As污染地区预防和/或治疗消化道疾病的一个潜在靶点.
5 结论(Conclusions)通过饮用水摄入一定剂量的As诱导了小鼠空肠氧化损伤及组织结构改变, As对空肠的损伤呈现剂量依赖性增高.饮水摄入As还会影响肠道的免疫功能, 使免疫相关的上皮结构破坏, 免疫相关分子基因表达改变.
Acharyya N, Sajed Ali S, Deb B, et al. 2014. Green tea (Camellia sinensis) alleviates arsenic-induced damages to DNA and intestinal tissues in rat and in situ intestinal loop by reinforcing antioxidant system[J]. Environmental Toxicology, 30(9): 1033–1044.
|
Arnold L L, Eldan M, van Gemert M, et al. 2003. Chronic studies evaluating the carcinogenicity of monomethylarsenic acid in rats and mice[J]. Toxicology, 190: 197–219.
DOI:10.1016/S0300-483X(03)00165-3
|
Bradford M M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 72: 248–254.
DOI:10.1016/0003-2697(76)90527-3
|
Chakraborti D, Rahman M M, Das B, et al. 2017. Groundwater arsenic contamination and its health effects in India[J]. Hydrogeology Journal, 25: 1165–1181.
DOI:10.1007/s10040-017-1556-6
|
Chiocchetti G M, Vélez D, Devesa V. 2018. Effect of subchronic exposure to inorganic arsenic on the structure and function of the intestinal epithelium[J]. Toxicology Letters, 286: 80–88.
DOI:10.1016/j.toxlet.2018.01.011
|
Di Gioacchino M, Verna N, Di Giampaolo L, et al. 2007. Immunotoxicity and sensitizing capacity of metal compounds depend on speciation[J]. International Journal of Immunopathology and Pharmacology, 20: 15–22.
DOI:10.1177/03946320070200S204
|
Evens A M, Tallman M S, Gartenhaus R B. 2004. The potential of arsenic trioxide in the treatment of malignant disease:past, present, and future[J]. Leukemia Research, 28(9): 891–900.
DOI:10.1016/j.leukres.2004.01.011
|
Flora S J. 2011. Arsenic-induced oxidative stress and its reversibility[J]. Free Radical Biology and Medicine, 51: 257–281.
DOI:10.1016/j.freeradbiomed.2011.04.008
|
Gonzalez M J, Aguilar M V, Martinez M C. 1997. Mechanisms of absorption of As2O5 from rat small intestine:the effect of different parameters[J]. Journal of Trace Elements in Medicine and Biology, 11: 239–247.
DOI:10.1016/S0946-672X(97)80019-3
|
Guha Mazumder D, Dasgupta U B. 2011. Chronic arsenic toxicity:studies in west Bengal, India[J]. Kaohsiung Journal of Medical Sciences, 27: 360–370.
DOI:10.1016/j.kjms.2011.05.003
|
Guo Y, Zhao P P, Guo G Y, et al. 2015. The role of oxidative stress in gastrointestinal tract tissues induced by arsenic toxicity in cocks[J]. Biological Trace Element Research, 168: 490–499.
DOI:10.1007/s12011-015-0357-9
|
Hei T K, Filipic M. 2004. Role of oxidative damage in the genotoxicity of arsenic[J]. Free Radical Biology and Medicine, 37: 574–581.
DOI:10.1016/j.freeradbiomed.2004.02.003
|
Hong Y S, Song K H, Chung J Y. 2014. Health effects of chronic arsenic exposure[J]. Journal of Preventive Medicine and Public Health, 47(5): 245–252.
DOI:10.3961/jpmph.14.035
|
Hughes M F. 2002. Arsenic toxicity and potential mechanisms of action[J]. Toxicology Letters, 133: 1–16.
DOI:10.1016/S0378-4274(02)00084-X
|
Jeong C H, Seok J S, Petriello M O, et al. 2017. Arsenic downregulates tight junction claudin proteins through p38 and NF-κB in intestinal epithelial cell line, HT-29[J]. Toxicology, 379: 31–39.
DOI:10.1016/j.tox.2017.01.011
|
Kim Y J, Kim J M. 2015. Arsenic toxicity in male reproduction and development[J]. Development & Reproduction, 19(4): 167–180.
|
Li X J, Yi H L, Wang H. 2018. Sulphur dioxide and arsenic affect male reproduction via interfering with spermatogenesis in mice[J]. Ecotoxicology and Environmental Safety, 165: 164–173.
DOI:10.1016/j.ecoenv.2018.08.109
|
Liu F F, Wang J P, Zheng Y J, et al. 2013. Biomarkers for the evaluation of population health status 16 years after the intervention of arsenic-contaminated groundwater in Xinjiang, China[J]. Journal of Hazardous Materials, 262: 1159–1166.
DOI:10.1016/j.jhazmat.2013.03.058
|
Livak K J, Schmittgen T D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 25: 402–408.
DOI:10.1006/meth.2001.1262
|
Lu K, Abo R P, Schlieper K A, et al. 2014. Arsenic exposure perturbs the gut microbiome and its metabolic profile in mice:an integrated metagenomics and metabolomics analysis[J]. Environmental Health Perspectives, 122: 284–291.
DOI:10.1289/ehp.1307429
|
McDole J R, Wheeler L W, McDonald K G, et al. 2012. Goblet cells deliver luminal antigen to CD103+ DCs in the small intestine[J]. Nature, 483(7389): 345–349.
DOI:10.1038/nature10863
|
Miller H, Zhang J B, KuoLee R, et al. 2007. Intestinal M cells:the fallible sentinels?[J]. World Journal of Gastroenterology, 13(10): 1477–1486.
DOI:10.3748/wjg.v13.i10.1477
|
Rodríguez-Lado L, Sun G, Berg M, et al. 2013. Groundwater arsenic contamination throughout China[J]. Science, 341(6148): 866–868.
DOI:10.1126/science.1237484
|
Smirnova M G, Guo L, Birchall J P, et al. 2003. LPS up-regulates mucin and cytokine mRNA expression and stimulates mucin and cytokine secretion in goblet cells[J]. Cellular Immunology, 211: 42–49.
|
Smith A H, Lopipero P A, Bates M N, et al. 2002. Public health.Arsenic epidemiology and drinking water standards[J]. Science, 296: 2145–2146.
DOI:10.1126/science.1072896
|
Watanabe C, Inaoka T, Matsui T, et al. 2003. Effects of arsenic on younger generations[J]. Journal of Environmental Science and Health (Part A), 38(1): 129–139.
DOI:10.1081/ESE-120016885
|
Wu L H, Yi H L, Yi M. 2010. Assessment of arsenic toxicity using Allium/Vicia root tip micronucleus assays[J]. Journal of Hazardous Materials, 176: 952–956.
DOI:10.1016/j.jhazmat.2009.11.132
|
曾群, 仪慧兰, 黄立群, 等. 2018. 砷暴露对小鼠葡萄糖稳态的影响[J]. 环境科学学报, 2018, 38(8): 3353–3360.
|
Zeng Q, Yi H L, Huang L Q, et al. 2019. Long-term arsenite exposure induces testicular toxicity by redox imbalance, G2/M cell arrest and apoptosis in mice[J]. Toxicology, 411: 122–132.
DOI:10.1016/j.tox.2018.09.010
|
Zhao H J, Wang Y, Liu Z X, et al. 2018. Subchronic arsenism disorders mRNA expression of cytokines and immunoglobulins in the intestinal tract of the cock[J]. Biological Trace Element Research, 182: 111–118.
DOI:10.1007/s12011-017-1073-4
|
 2019, Vol. 39
2019, Vol. 39


