2. 华东理工大学国家环境保护化工过程环境风险评价与控制重点实验室, 上海 200237;
3. 上海城投水务(集团)有限公司制水分公司闵行水厂, 上海 200245
2. State Environmental Protection Key Laboratory of Environmental Risk Assessment and Control on Chemical Process, East China University of Science and Technology, Shanghai 200237;
3. Minhang Water Treatment Plant Shanghai SMIW Water Production Branch, Shanghai 200245
饮用水原水异嗅异味问题已成为供水中仅次于余氯的第二大投诉主题, 日益受到居民的广泛关注.事实上, 早在1850年美国就发生过水体异味的情况(Mcguire, 1995).我国2007年5月集中爆发的太湖水危机事件使得数十万无锡市民无法正常使用自来水(宋立荣等, 2004).同时, 滇池、巢湖、东湖等富营养化湖泊中, 有害藻类的过度繁殖也使得大量挥发性次生代谢产物进入水体, 导致饮用水原水水质下降, 从而对人体健康构成严重威胁(李勇等., 2008).
前期研究发现, 引起水体土霉味的物质主要包括土臭素(也称为反-1, 10-二甲基-反-萘烷醇, Trans-1, 10-dimethyl-trans-9-decalol或Geosmin, GSM)、二甲基异冰片(也称为二甲基异莰醇, 2-methylisoborneol, MIB或2-MIB)、2, 3, 6-三氯代茴香醚(2, 3, 6-trichloroanisole, TCA)等.其中, 土臭素和二甲基异莰醇出现最为频繁、影响最为严重(Suffet et al., 1999), 成为当前的研究热点.值得注意的是, 这两者的嗅阈值极低, 均为ng·L-1级别(Watson et al., 2000), 我国2007年颁布的《生活饮用水卫生标准》(GB5749- 2006)附录中明确规定其限值参考值均为10 ng·L-1.这两种嗅味物质最早发现于放线菌(Bentley et al., 1981), 进一步的研究表明, 它们也可能由一些丝状蓝藻如席藻、颤藻、鱼腥藻等合成(Jüttner et al., 2007).陈娇等(2014)从水库水样中分离了40株放线菌, 发现不同菌种产生嗅味物质的能力存在显著差异; Anuar等(2017)提取了某水域中6种放线菌, 并在实验室条件下研究了其致嗅机理, 基本证实了嗅味物质的微生物来源.
尽管如此, 这些研究多数集中于实验室纯培养微生物合成嗅味物质, 而较少有针对实际水体的致嗅机制探讨.由于放线菌和蓝藻生长受季节影响显著, 水体中的蓝藻细胞在春、夏季节含量显著高于秋、冬季节, 而放线菌的丰度则恰好相反(Lanciotti et al., 2003), 因此, 其合成嗅味物质的能力同样可能受季节影响.本研究依据上海某水厂致嗅物质浓度变化规律, 选取夏、冬两季具有代表性的原水水样和混凝沉淀池泥样提取微生物核酸序列进行高通量测序, 根据微生物基因测序信息进行聚类分析微生物种群组成, 探讨疑似致嗅微生物的种属分布, 以求掌握黄浦江原水致嗅机制, 为饮用水原水嗅味污染控制提供理论参考.
2 材料与方法(Materials and methods) 2.1 样品采集定期采集自来水厂原水水样2.5 L和混凝沉淀池泥样50 g, 将采集的样品低温运回实验室.其中, 2 L水样用0.22 μm醋酸纤维滤膜抽滤, 过滤后的滤膜剪碎后装入经灭菌处理的离心管中, 加70%乙醇固定, 置于-4 ℃冰箱保存, 待提取DNA.泥样真空冻干过筛, 置于-4 ℃冰箱中低温保存.
2.2 嗅味物质浓度测定采用顶空固相微萃取-气相色谱/质谱联用法对水样进行嗅味物质浓度测定.将5 mL水样加入预先装有1.5 g氯化钠的20 mL棕色顶空玻璃瓶, 待样品温度稳定在60 ℃后插入固相微萃取头萃取30 min.而后将萃取头送入GC-MS进样口解析5 min, 定量测定嗅味物质浓度.色谱采用Rtx-5MS毛细管色谱柱(30 m×0.25 mm×0.25 μm), 以高纯度氦气(99.999%)为载气.进样方式为不分流进样, 进样口温度为250 ℃, 柱流量为1.2 mL·min-1, 升温模式为初始温度40 ℃, 以15 ℃·min-1速率升至250 ℃, 维持10 min, 传输线温度为250 ℃.质谱采用EI为离子源, 70 eV的离子化能量, 230 ℃的离子源温度, 扫描中定性采用全扫描(Full Scan), 定量采用离子检测(SIM).
2.3 样品DNA提取和高通量测序将抽滤后的膜和冻干后过筛的泥样按照FastDNA®Spin kit for soil(Biomedicals, USA)试剂盒操作手册提取DNA.提取后的DNA经Nanodrop检测吸光度, 检测值A260/A280(Abs)范围均在1.76~1.95, 符合检测纯度要求后送至生物测序公司对16S rDNA V3~V4区域进行高通量测序.
2.4 微生物群落分布分析测序数据在mothur平台根据Miseq SOP步骤除杂去除冗余数据后(Kozich et al., 2013), 上传到RDP (Ribosomal Database Project)数据库中进行classifier分类(Wang et al., 2007), 据此分析各样品的微生物种群分布特征.
3 结果与讨论(Results and discussion) 3.1 致嗅物质浓度分布根据前期经验, 本实验同步在上海市某自来水厂日常采集了4—12月连续9个月的原水水样, 并应用顶空固相微萃取-气相色谱/质谱联用方法检测水样中土臭素的浓度, 数据结果经与自来水厂日常监测数据对比基本一致.由检测结果可知, 在总计18个水样的检测中, 土臭素的浓度为0.20~109.60 ng·L-1(图 1), 其中仅有4个样品的土臭素浓度近似最低检测限(0.20 ng·L-1).根据采样记录, 4月26日、10月24日和11月7日采样前均出现了明显降水, 6月1日采样时段正处于梅雨季节, 这4个采样时间点空气中湿度较高, 雨水较丰富, 故推测可能是频繁的降雨稀释了黄浦江原水中的土臭素浓度.初夏5月份的两个水样中土臭素浓度分别为11.14和11.50 ng·L-1, 而冬季12月份的3个水样中土臭素浓度分别为20.34、20.81和12.71 ng·L-1, 均超过标准浓度限值(10 ng·L-1), 说明该季节黄浦江原水中已经出现水体嗅味物质超标情况.此检测结果与陈蓓蓓等(2007)对上海市饮用水水源痕量污染物研究中的嗅味物质浓度变化基本一致.夏季和初秋季节的土臭素浓度均低于国家标准, 推测可能是高温导致原水水体中群落结构发生改变(该时间段水温27~34 ℃), 降低了产土臭素微生物的丰度和活性(李璇, 2015).值得注意的是, 10月17日原水水样中土臭素浓度达到109.60 ng·L-1, 远超标准限值10倍.此前有研究表明25 ℃左右的温度有助于蓝藻的代谢增殖及土臭素的产生(Zonglai et al., 2012), 因此, 推测此次嗅味物质爆发可能与该时间段环境因子如温度、溶解氧等剧烈变化有关.另一个可能的原因是, 进入10月中下旬后水体表层温度昼夜变化较大, 表层水体降温容易逐渐下沉至下层水体, 完成一次“翻库”, 导致氮、磷等元素和底层污染物被携带至上层, 给表层水体的微生物提供养分, 造成土臭素浓度严重超标(史建超, 2016).
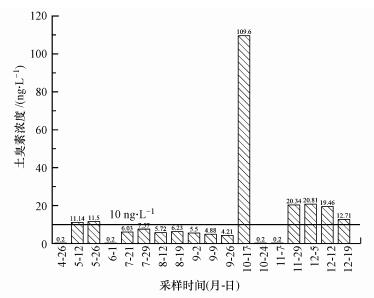 |
| 图 1 黄浦江原水中土臭素浓度 Fig. 1 Geosmin concentration of raw water from Huangpu River |
整体而言, 黄浦江饮用水原水中的土臭素浓度冬季较高, 而春、夏季基本低于检测限.基于夏、冬季土臭素浓度显著差异的特点, 研究中选取夏、冬季两组具有代表性样品进行高通量测序, 分析其微生物种群差异并探讨原水中致嗅物的变化原因, 以及泥样对原水水样中致嗅微生物丰度和活性的贡献及影响.由于致嗅微生物存在于原水、混凝沉淀泥样、沉积物等各个介质层中, 研究中选取不同土臭素浓度的水样和对应的混凝沉淀泥样及初冬水体沉积物样品, 提取其DNA样品并进行高通量测序.样品中DNA的浓度为18.1~183.5 ng·μL-1, 所有样品测序的覆盖范围为0.96~0.99, 测序深度足以评估微生物群落.21个样品经质量控制后产生总共885993个序列, 其中, 夏季污泥的测序深度最小为33880个序列, 冬季水样的测序深度最大为61724个序列.为了使不同的样品具有可比性, 在进一步分析之前将样品的测序数据归一化处理, 除杂去除冗余序列后提交到RDP进行分类注释, 选取总体丰度大于3‰的phylum分类绘制微生物种群组成(图 2).
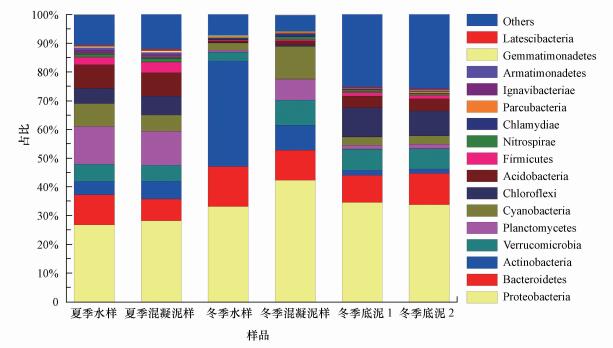 |
| 图 2 夏、冬季微生物种群组成结构 Fig. 2 Bacterial community structure of summer and winter samples |
从图 2中可以看出, 夏季水样和泥样中微生物在门分类级别上的组成几乎一致, 而冬季水样和泥样中微生物在门级别上的组成差异明显.其中, 冬季水样中的放线菌丰度明显高于泥样, 而泥样中的Verrucomicrobia、Planctomycetes和Cyanobacteria显著高于水样.由此表明, 原水中放线菌较难通过混凝沉淀去除, 而Verrucomicrobia、Planctomycetes和Cyanobacteria较为容易被混凝沉淀去除.相比较而言, 夏季水样中Planctomycetes和Cyanobacteria虽然高于冬季水样, 但其土臭素浓度反而低于冬季水样, 表明Cyanobacteria可能不是引发冬季原水土臭素污染的微生物; 而冬季水样中丰度明显增高的Actinobacteria更可能是引发嗅味污染的主体(夏季水样、夏季泥样、冬季水样、冬季泥样、冬季沉积物1、冬季沉积物2中放线菌占总微生物组成比例分别为4.6%、6.2%、36.7%、8.7%、1.8%和1.5%).其中, 在土臭素含量最高的冬季水样中, 放线菌属占比高达40%, 初步判定放线菌在该原水嗅味物质浓度升高中发挥了重要作用, 与此前研究中认定的放线菌是自然中嗅味物质主要生产者的研究结论相一致(Klausen et al., 2005).另一方面, 冬季水体沉积物中微生物种群结构与夏、冬季水体微生物种群虽有较大差异, 但丰度较高的主要是厌氧型的Chloroflexi和Acidobacteria, 前期研究的潜在致嗅微生物蓝藻Cyanobacteria和放线菌Actinobacteria丰度都不高, 表明“翻库”可能并不是引发嗅味物质污染的主因.
3.3 微生物种群差异性分析为了对比分析夏、冬季水样中微生物种群结构的差异, 研究中依据RDP注释分类选取各样品中丰度大于1‰的种属及其所含的序列绘制韦恩图(图 3).从中可以看出, 虽然3类样品中共有的微生物在属级别上只有13个, 但其所含的序列数却占总序列数的40.4%, 由此表明多数高丰度微生物属是共有的, 即夏、冬季主体微生物种群基本稳定.相比较而言, 夏季样品的平均香农指数为6.42, 明显高于冬季样品(4.74).夏季样品虽然香农指数较高, 独有的微生物种类也较多, 但其占序列总数的比例偏低, 即低丰度菌属较多, 更可能是偶然引入的.冬季水样和沉积物样品间的共有微生物种属数为0, 即冬季水样和泥样较夏季水样并无其他独特的微生物种属, 表明疑似致嗅物更可能是冬季水相中微生物产生的, 而非沉积物内微生物经“翻库”进入水相产生的.
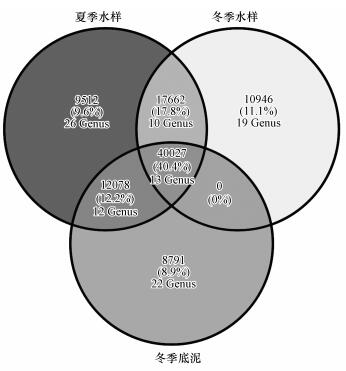 |
| 图 3 夏、冬季不同采样点韦恩图 Fig. 3 Venn diagram of summer and winter samples |
选取3类样品中序列总数前50的种属及其序列数绘制聚类heatmap, 以进一步探讨各样品间及样品内微生物种群的相关性(图 4).一般认为, 样品内聚类在一起的微生物具有较高的相关性, 容易出现同步消长; 而聚类在一起的样品表明该样本群落组成结构关系更为密切, 有相似度较高的生态特性.从图中可以看出, 夏季水样和泥样、冬季水样和泥样及冬季沉积物样品分别聚类在一起, 表明各自样品的相关性较为一致, 即样本群落组成结构相似度较高; 而冬季沉积物甚至与夏季样品的相关性优先于冬季水样和泥样, 表明其更可能来源于夏季增殖的微生物, 与冬季水样土臭素浓度升高近似无关.冬季水样和泥样中丰度较高的微生物主要为Flavobacterium、Candidatus Pelagibacter及Limnohabitans, 其构成的聚类分支显著区别于冬季沉积物和夏季水样, 这些微生物被认为是与水华蓝藻的分解相关的(Šimek et al., 2013);另一方面, 尽管其含有较高丰度的Actinobacteria门微生物, 但在丰度前50的种属中均未发现传统意义上合成土臭素的优势菌属Streptomyces.相反, 夏季水样和沉积物中丰度较高的微生物是GPXI(Microcystis)、GPIIa(Synechococcus)等蓝藻类及Subdivision3_genera(Verrucomicrobiales), 其中, 部分蓝藻种属被认为是水体致嗅的主要微生物, 而有研究表明蓝藻细胞会产生嗅味物质等次生代谢产物(Alghanmi et al., 2017), 且绝大多数代谢产物存于细胞内(Chorus et al., 1999).尽管如此, 夏季黄浦江原水土臭素浓度仍远低于冬季, 由此导致致嗅微生物与嗅味物质浓度出现了季节性的错位, 结合夏季水样与冬季沉积物样品的相关性可知, 这些夏季增殖的蓝藻可能汇集于沉积物中, 并在冬季分解微生物的作用下释放出储存于体内的土臭素从而导致冬季原水土臭素超标.值得注意的是, Hoefel等(2006)的研究发现, Novosphigobium、Sphigomonas和Pseudomonas 3个菌属同时存在时可降解土臭素, 而这3个菌属均存在于冬季水样中且丰度较高, 其在夏季水样中的丰度仅为冬季的1/10甚至1/100.这意味着其可能与土臭素的释放与降解存在一定的正相关性, 冬季水样中土臭素浓度较高, 同时其降解量也较大.因此, 黄浦江原水冬季嗅味物质超标可能源于蓝藻类微生物分解所释放的储存于藻华细胞内的嗅味物质.
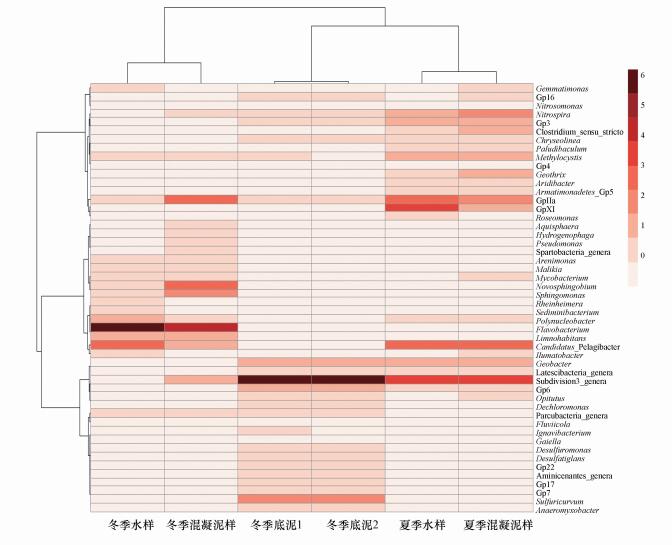 |
| 图 4 夏、冬季微生物组成热图 (纵向为样品间聚类, 横向为微生物菌种间的聚类情况, 图标中数字表示将菌属序列数取对数后的数值, 数字越大, 丰度越高; 颜色深浅表示微生物丰度, 颜色越深, 丰度越高) Fig. 4 Heatmap of summer and winter samples |
1) 黄浦江原水中土臭素浓度呈现冬季明显高于夏季的现象, 且冬季原水浓度存在超标现象.
2) 通过对比分析夏、冬季微生物种群结构发现, 冬季水样中占比最高的为放线菌门类微生物, 而夏季水样中相对丰度较高的是蓝藻类微生物.
3) 进一步分析表明, 夏季水样微生物菌群与冬季沉积物存在一定相关性, 且夏季蓝藻微生物与致嗅物合成有关, 而冬季微生物与水华蓝藻分解有关, 据此推测蓝藻类微生物分解可能是导致冬季原水嗅味物质超标的主要原因.
Alghanmi H A, Alkam F A M, Al-Taee M M. 2017. Effect of light and temperature on new cyanobacteria producers for geosmin and 2-methylisoborneol[J]. Journal of Applied Phycology, 30(1): 319–328.
|
Anuar N S S, Kassim A A, Utsumi M, et al. 2017. Characterization of musty odor-producing actinomycetes from tropics and effects of temperature on the production of musty odor compounds[J]. Microbes & Environments, 32(4): 352–357.
|
Bentley R, Meganathan R. 1981. Geosmin and methylisoborneol biosynthesis in streptomycetes[J]. Febs Letters, 125(2): 220–222.
DOI:10.1016/0014-5793(81)80723-5
|
陈蓓蓓, 高乃云, 马晓雁, 等. 2007. 饮用水中嗅味物质-土臭素和二甲基异冰片去除技术[J]. 四川环境, 2007, 26(3): 87–93.
DOI:10.3969/j.issn.1001-3644.2007.03.024 |
陈娇, 白晓慧, 卢宁, 等.2014.上海市供水系统中致嗅放线菌变化规律[C].2014中国环境科学学会学术年会.成都: 3937-3941
http://cpfd.cnki.com.cn/Article/CPFDTOTAL-HJKP201408006084.htm |
Chorus I, Bartram J. 1999. Toxic Cyanobacteria in Water:A Guide to Their Public Health Consequences, Monitoring and Management[M]. London: CRC Press.
|
Hoefel D, Ho L, Aunkofer W, et al. 2006. Cooperative biodegradation of geosmin by a consortium comprising three gram-negative bacteria isolated from the biofilm of a sand filter column[J]. Letters in Applied Microbiology, 43(4): 417–423.
DOI:10.1111/lam.2006.43.issue-4
|
Jüttner F, Watson S B. 2007. Biochemical and ecological control of geosmin and 2-methylisoborneol in source waters[J]. Applied and Environmental Microbiology, 73(14): 4395–4406.
DOI:10.1128/AEM.02250-06
|
Šimek K, Kasalicky' V, Jezbera J, et al. 2013. Differential freshwater flagellate community response to bacterial food quality with a focus on Limnohabitans bacteria[J]. Isme Journal, 7(8): 1519–1530.
DOI:10.1038/ismej.2013.57
|
Klausen C, Nicolaisen M H, Strobel B W, et al. 2005. Abundance of actinobacteria and production of geosmin and 2-methylisoborneol in Danish streams and fish ponds[J]. Fems Microbiology Ecology, 52(2): 265–278.
DOI:10.1016/j.femsec.2004.11.015
|
Kozich J J, Westcott S L, Baxter N T, et al. 2013. Development of a dual-index sequencing strategy and curation pipeline for analyzing amplicon sequence data on the MiSeq Illumina sequencing platform[J]. Applied & Environmental Microbiology, 79(17): 5112–5120.
|
李璇.2015.分层型富营养化水源水库水质演变机制与水质污染控制[D].西安: 西安建筑科技大学
http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D717340 |
李勇, 陈超, 张晓健, 等. 2008. 饮用水中典型致嗅物质去除技术研究[J]. 环境科学, 2008, 29(11): 3049–3053.
DOI:10.3321/j.issn:0250-3301.2008.11.009 |
Lanciotti E, Santini C, Lupi E, et al. 2003. Actinomycetes, cyanobacteria and algae causing tastes and odours in water of the River Arno used for the water supply of Florence[J]. Journal of Water Supply Research & Technology Aqua, 52(7): 489–500.
|
Mcguire M J. 1995. Off-flavor as the consumer's measure of drinking water safety[J]. Water Science & Technology, 31(11): 1–8.
|
Suffet I H, Khiari D, Bruchet A. 1999. The drinking water taste and odor wheel for the millennium:Beyond geosmin and 2-methylisoborneol[J]. Water Science & Technology, 40(6): 1–13.
|
史建超.2016.分层型水源水库水质变化特征与水质原位改善技术研究[D].西安: 西安建筑科技大学
http://cdmd.cnki.com.cn/Article/CDMD-10703-1017737279.htm |
宋立荣, 李林, 陈伟, 等. 2004. 水体异味及其藻源次生代谢产物研究进展[J]. 水生生物学报, 2004, 28(4): 434–439.
DOI:10.3321/j.issn:1000-3207.2004.04.018 |
Wang Q, Garrity G M, Tiedje J M, et al. 2007. Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J]. Applied & Environmental Microbiology, 73(16): 5261–5267.
|
Watson S B, Brownlee B, Satchwill T, et al. 2000. Quantitative analysis of trace levels of geosmin and MIB in source and drinking water using headspace SPME[J]. Water Research, 34(10): 2818–2828.
DOI:10.1016/S0043-1354(00)00027-0
|
Zonglai L, Peter H, Wei A, et al. 2012. Earthy odor compounds production and loss in three cyanobacterial cultures[J]. Water Research, 46(16): 5165–5173.
DOI:10.1016/j.watres.2012.06.008
|
 2019, Vol. 39
2019, Vol. 39


