2. 福建师范大学地理科学学院, 福州 350007;
3. 华东师范大学河口海岸学国家重点实验室, 上海 200062;
4. 华东师范大学地理科学学院, 地理信息科学教育部重点实验室, 上海 200241
2. School of Geographical Sciences, Fujian Normal University, Fuzhou 350007;
3. State Key Laboratory of Estuarine and Costal Research, East China Normal University, Shanghai 200062;
4. Key Laboratory of Geographic Information Science of the Ministry of Education, School of Geographic Sciences, East China Normal University, Shanghai 200241
河口是全球变化和人类活动响应的敏感性生态系统之一(Lunau et al., 2013;王纯等, 2017), 在全球生物地球化学循环中发挥着重要的作用.因人类活动的影响, 大量的活性氮被输入到河口环境(Deek et al., 2012), 使得该环境成为氮循环发生的热区(Santoro, 2010; Howarth et al., 2011).迄今为止, 国内外学者对河口环境中反硝化和厌氧氨氧化过程进行了大量的研究(徐继荣等, 2005;Dahnke et al., 2008;Crowe et al., 2012;Wang et al., 2012;Hou et al., 2013;汪旭明等, 2015;李家兵等, 2017).随着硝酸盐异化还原成铵过程在河口环境中的发现(Gardner et al., 2006), 以及硝酸盐异化还原成铵在硝酸盐还原过程中的重要贡献(Dong et al., 2011;陶怡乐等, 2016), 硝酸盐异化还原成铵过程受到了广泛关注(Dong et al., 2011;Roberts et al., 2014;Robertson et al., 2016), 成为了氮循环研究的热点.
硝酸盐异化还原成铵过程是以NO3-/NO2-为电子受体, 氧化NADH产生NH4+, 存在于细菌和真菌中(陶怡乐等, 2016), 该过程能够将硝态氮转化为更容易被植物利用的铵态氮, 是重要的氮循环过程之一, 在维持河口环境中氮平衡方面具有重要的作用(Gardner et al., 2006).有研究发现, 河口环境中硝酸盐异化还原成铵过程能够贡献高达80%的硝酸盐还原总量, 表明硝酸盐异化还原成铵是河口环境中起主导作用的硝酸盐还原过程(Kreiling et al., 2011;Cao et al., 2016).受咸淡水交替、潮汐循环和冲淤变化等海陆相互作用的影响, 河口环境因子复杂多变, 进而会对硝酸盐异化还原成铵过程产生重要的影响.目前, 虽然有机质、硝酸盐、盐度、温度、硫化物和二价铁等因素对硝酸盐异化还原成铵过程影响的研究取得了一定的进展(An et al., 2002; Gardner et al., 2006;Gardner et al., 2009;Laverman et al., 2007; Nizzoli et al., 2010;Giblin et al., 2013;Roberts et al., 2014;Robertson et al., 2016), 但对于潮汐影响下湿地土壤硝酸盐异化还原成铵的认识仍然不足.滨海河口环境中不同的潮滩位置受到潮汐淹水和空气暴露的频率不同, 故其物理和生物因子呈现出明显的梯度差异(Li et al., 2015a;高灯州等, 2016), 进而也会深刻地影响硝酸盐异化还原成铵过程.因此, 开展滨海河口湿地土壤硝酸盐异化还原成铵过程研究有助于深入认识潮汐作用对氮关键转化过程的作用机理, 具有重要的理论意义与科学价值.
基于此, 本文以典型滨海河口湿地—崇明东滩为研究区, 以空间代替时间的研究方法, 开展潮汐影响下湿地土壤硝酸盐异化还原成铵过程研究, 旨在揭示硝酸盐异化还原成铵过程在河口湿地的空间变异特征, 探讨潮汐影响下湿地土壤硝酸盐异化还原成铵过程的主要影响因素, 明确硝酸盐异化还原成铵过程对河口氮来源的贡献, 以期为河口环境保护与生态治理提供重要的参考依据.
2 材料与方法(Materials and methods) 2.1 研究区概况与样品采集崇明东滩位于长江口最大的冲击岛东端(121°50′~122°05′E, 31°25′~31°38′N), 面积约为326 km2.崇明东滩海拔高度为3.5~4.5 m, 属于长江口典型的河口沙洲(Tang et al., 2011), 从岸边到中心, 依次分布有环状砂质海滩、泥质海滩、盐水沼泽、盐化草甸等滨海湿地类型.该地区的气候类型为亚热带季风气候, 四季分明, 多年平均温度为15.3 ℃, 多年平均降水量为1022 mm(李小飞等, 2015).崇明东滩主要植被类型有芦苇(Phragmites communis)、海三棱藨草(Scirpus mariqueter)和互花米草(Spartina alterniflora), 此外, 还有短叶茳芏(Cyperus malaccensis)、咸草(Angelica keiskei)植被(Tang et al., 2011).近年来, 入侵种互花米草逐渐成为东滩湿地的优势植被, 严重地威胁着本土植被的生长和生态系统的安全.根据大小潮的高低潮位, 东滩湿地呈现出明显的高、中和低潮滩分布.因98大堤的影响, 东滩湿地的高潮滩面积较小, 大部分为中、低潮滩, 约占到总面积的85%(Tang et al., 2011).此外, 受潮周期的影响, 东滩湿地表现出不同的淹水频率和空气暴露特征.2016年6月, 在东滩湿地由低潮滩向高潮滩布设了8个采样点, 采集了无植被覆盖的地表下5~10 cm深度的土壤样品, 采样点空间分布如图 1所示.采样点A1~A4位于低潮滩, A5和A6位于中潮滩, A7和A8位于高潮滩.土壤样品采集过程中, 利用IQ150便携式pH/氧化还原电位计(IQ Scientific Instruments, USA)现场测定5~10 cm深度土壤的氧化还原电位(Eh).采集的土壤盛装在干净的自封袋中, 保存于带有冰块的保温箱中, 并立即送回实验室处理.在实验室里, 将土壤样品充分混匀后, 分成两份, 一份保存于4 ℃冰柜中, 用于测定硝酸盐异化还原成铵潜在速率与理化性质, 另一份保存于-80 ℃环境, 用于功能nrfA基因拷贝数的分析.
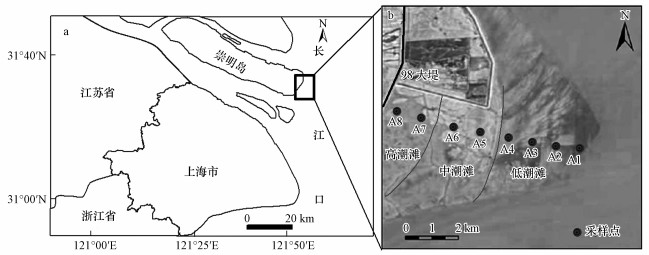 |
| 图 1 崇明东滩湿地(a)与采样点(b)地理位置 Fig. 1 Locations of Chongming East wetland(a) and sampling sites(b) |
按土水1:2.5的质量比混匀后, 采用pH计(雷磁, 上海)和盐度计(YSI Model 30, USA)分别测定其pH和盐度.土壤采用2 mol·L-1氯化钾溶液浸提后, 采用0.45 μm滤头过滤浸提液, 浸提液中的NH4+、NO3-和NO2-采用连续流动仪测定(SAN plus, Skalar, Netherlands).土壤中二价铁和三价铁用1 mol·L-1盐酸浸提, 采用邻菲罗啉比色法测定(Lovley et al., 1987).土壤硫化物采用亚甲基蓝分光光度法测定(Deng et al., 2015).土壤中微生物量碳(MBC)采用氯仿熏蒸法测定(Vance et al., 1987).可溶性有机碳(DOC)用0.5 mol·L-1 K2SO4浸提后, 采用总有机碳仪测定(Shimadzu, Japan) (王纯等, 2017).土壤易氧化有机碳(EOC)采用K2MnO4氧化-比色法测定(Vieira et al., 2007).土壤采用冷冻干燥机干燥, 采用玛瑙研钵研磨, 并过100目不锈钢筛, 用于后续分析.采用盐酸去除土壤中的无机碳后, 有机碳采用元素分析仪测定(MaxCNOHS, Germany).土壤理化性质测定按3个重复进行, 结果取其平均值.
2.3 硝酸盐异化还原成铵潜在速率测定土壤硝酸盐异化还原成铵(DNRA)潜在速率采用15NO3-同位素示踪结合次溴酸钠氧化剂氧化法测定(Yin et al., 2014).该测定方法的原理是次溴酸氧化剂能够将水中离子态的15NH4+氧化成气态30N2和29N2, 并溶解于水中.此外, 薄膜进样质谱仪(MIMS)能够对水溶解态的氮气进行相对丰度测定, 且能够区分30N2和29N2.该方法的具体步骤为:将土壤样品和蒸馏水以质量比1:7的比例混匀, 并用高纯(99.999%)氦气充分曝气20 min, 以消除泥浆中的氧, 然后转移至12.5 mL的顶空培养瓶中, 用顶空盖旋紧.将这些培养瓶在25 ℃水浴中预培养48 h, 以消除泥浆中残留的氧气、硝酸盐和亚硝酸盐.泥浆预培养结束后, 向每只培养瓶中加入0.1 mL 15NO3-溶液, 形成浓度大约为100 μmol·L-1的15N, 并在25 ℃水浴环境中进行培养.将这些培养瓶分成4组, 分别在培养的0、2、4和8 h时刻加入0.2 mL 50%的ZnCl2溶液以终止微生物的活性.培养结束的样品用高纯氦气充分曝气20 min, 消除由反硝化和厌氧氨氧化生成的30N2和29N2.随后, 加入0.2 mL次溴酸钠氧化剂将由DNRA过程生成的15NH4+氧化成30N2和29N2, 再采用薄膜进样质谱仪测定生成的30N2和29N2 (An et al., 2002; Yin et al., 2014).此外, 分别配制浓度为0、5、10、20 μmol·L-1的15NH4+溶液于12.5 mL的顶空瓶中, 用次溴酸氧化剂将15NH4+氧化成30N2和29N2.样品中30N2和29N2的丰度采用已知浓度的标准曲线计算.DNRA潜在速率采用以下公式计算:
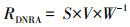
|
(1) |
式中, RDNRA为DNRA潜在速率(nmol·g-1·h-1), S为培养时间内15NH4+浓度(nmol·L-1·h-1), V为培养瓶体积(L), W为土壤样品的质量(g).
2.4 土壤DNA提取与PCR扩增土壤DNA采用土壤DNA试剂盒(MOBIO, 美国)按照所提供的操作步骤进行提取.提取后的DNA采用微量分光光度计(Thermo, USA)进行DNA的纯度和浓度测定, 并用1%琼脂糖进行电泳, 以确保所提DNA的质量.DNA中nrfA基因丰度测定时采用的引物为nrfA-2F ((5′-CAC GAC AGC AAG ACT GCC G-3′)和nrfA-2R (5′-CCG GCA CTT TCG AGC CC-3′) (Smith et al., 2007), 并采用实时荧光定量PCR法进行测定.定量PCR的反应体积为:12.5 μL Maxima SYBR Green/RoxqPCR Master Mix (Fermentas, Lithuania), 1 μL上下游引物(10 μmol·L-1, Sangon, China), 1 μL目标DNA, 以及9.5 μL灭菌水.定量PCR反应条件为:50 ℃反应2 min, 95 ℃预变性10 min, 随后进行95 ℃变性30 s, 60 ℃退火1 min, 72 ℃延伸1 min, 循环40次.以含有nrfA基因的质粒按照10倍稀释方式建立标准曲线.定量PCR采用ABI 7500定量PCR仪(Applied Biosystems, Canada)进行反应.此外, 采用阴性对照进行定量PCR的质量控制.所分析DNA样品中nrfA基因丰度采用标准曲线进行计算, 基因丰度的检测限为1.2×103 ~2.3×103 copies·g-1.
2.5 统计分析采用SPSS软件(19.0)进行统计分析并用OriginLab (8.0)绘制图.采用单因素方差(ANOVA)分析各采样点DNRA潜在速率和nrfA基因丰度的差异, 显著性采用SNK(Student-Newman-Keuls Test)检验.高、中潮滩和低潮滩DNRA潜在速率与nrfA丰度显著性差异采用独立样本t检验(p < 0.05).nrfA基因拷贝数进行对数转换, 用于统计分析.采用Pearson相关性分析DNRA潜在速率与理化因子和nrfA丰度的关系.采用逐步回归分析影响DNRA潜在速率和nrfA基因丰度的最关键性环境因子, 以F < 0.05时引入变量, 而当F>0.1时则剔除变量进行显著性检验.
3 结果与分析(Results and analysis) 3.1 土壤理化性质采样点土壤pH为7.62~8.03, 其中, 高潮滩pH一般较低(表 1).土壤盐度变化表现为从低潮滩向高潮滩逐渐降低, 其值为0.2‰~1.7‰.土壤Eh变化范围为-47~102 mV, 呈现出从低潮滩向高潮滩逐渐升高的变化趋势.土壤中不同组分的碳含量具有较大的差异, 其中, TOC含量为6.1~10.3 mg·g-1, 呈先升高后降低的趋势, 且样点A3含量最高, 而样点A7含量最低.土壤MBC含量为59.8~102.3 μg·g-1, 表现为低潮滩含量高, 而高潮滩含量低的特点.土壤DOC含量也呈现出低潮滩含量较高, 而高潮滩含量较低的变化趋势, 即DOC含量随着盐度和淹水频率的增加而增加.EOC含量为2.13~5.83 mg·g-1, 表现出高潮滩含量高, 而低潮滩含量低的特点.土壤中NH4+的含量为0.62~2.41 μg·g-1, 空间分布上表现为高潮滩的采样点含量一般较低, 而低潮滩的采样点含量较高.NO3-含量为0.68~1.45 μg·g-1, 其中, A3样点的含量最高, A5样点的含量最低.与土壤NH4+和NO3-相比, NO2-的含量最低, 仅为0.04~0.24 μg·g-1.土壤Fe(Ⅱ)的含量为5.3~7.6 mg·g-1, 表现为高潮滩的含量较高.硫化物含量为0.81~1.34 μmol·g-1, 表现为低潮滩含量高, 而高潮滩含量低的特点.
| 表 1 采样点土壤理化性质 Table 1 Physiochemical properties in soils of the sampling sites |
土壤DNRA潜在速率为0.17~0.71 nmol·g-1·h-1(图 2a), 其中, 样点A3和A4的DNRA潜在速率较大, 且显著高于其它采样点(p < 0.05).从空间分布来看, 土壤DNRA潜在速率存在明显的空间差异, 具体表现为先升高后降低的变化趋势.一般地, 低潮滩土壤的DNRA潜在速率较高, 而高潮滩土壤的DNRA潜在速率较低.然而, 在最低潮滩位置的A1和A2样点的土壤DNRA潜在速率低于A3和A4样点.通过统计分析, 低潮滩位的A1~A4样点的DNRA潜在速率显著高于高、中潮滩位的A5~A8样点的DNRA潜在速率(p < 0.05, t-test, 图 2b), 表明DNRA潜在速率在不同潮滩位置变异较大.
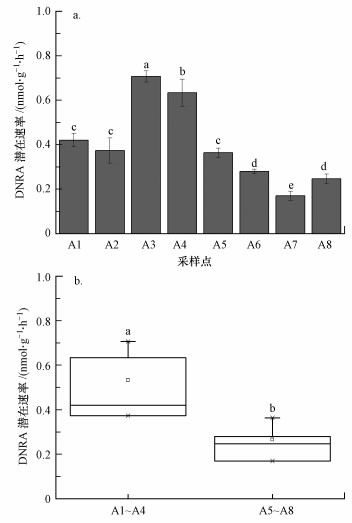 |
| 图 2 采样点土壤中DNRA潜在速率 (误差棒上的不同小写字母表示具有显著性差异, b图中方框表示潜在速率的平均值, 星形表示潜在速率的最大值和最小值) Fig. 2 Potential rates of DNRA in soils of sampling sites |
由图 3a可知, 土壤DNRA过程的功能基因nrfA丰度表现出较大的空间差异, 具体表现为从低潮滩向高潮滩先升高后降低的变化规律.土壤nrfA丰度为0.71×108~5.17×108 copies·g-1, 其中, 样点A7和A8基因丰度最低(0.71×108~81×108 copies·g-1), 样点A4基因丰度最高, 其值为5.17×108 copies·g-1.统计分析表明, 低潮滩位的A1~A4样点土壤nrfA基因丰度显著高于高潮滩位的A5~A8样点(p < 0.05, t-test, 图 3b), 说明不同潮滩湿地位置的DNRA微生物存在差别, 进而影响DNRA潜在速率.然而, 受到淹水频率最高的A1和A2样点的nrfA基因丰度低于A3和A4样点.
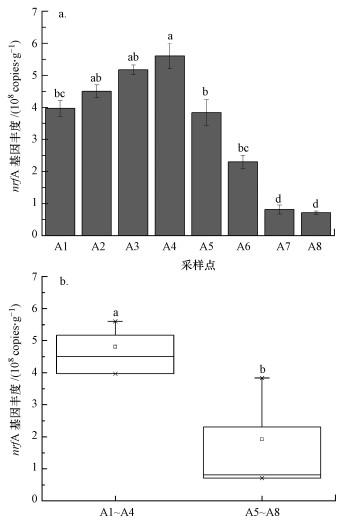 |
| 图 3 采样点土壤中nrfA基因丰度 (误差棒上的不同小写字母表示具有显著性差异, b图中方框表示基因丰度的平均值, 星形表示基因丰度的最大值和最小值) Fig. 3 Copy number of nrfA gene in soil of sampling sites |
通过相关性分析(表 2)可知, DNRA潜在速率与pH、TOC、MBC、DOC和硫化物呈显著正相关(p < 0.01), 与NH4+和NO3-呈显著正相关(p < 0.05), 而与Eh和EOC呈显著负相关.然而, 盐度、NO2-和Fe(Ⅱ)对DNRA潜在速率没有显著的影响.DNRA微生物的nrfA基因丰度与TOC和硫化物呈显著正相关(p < 0.01), 与pH、MBC、DOC和NH4+呈显著正相关(p < 0.05), 而与Eh和EOC呈显著负相关(p < 0.05).然而, 土壤盐度、NO3-、NO2-和Fe(Ⅱ)对nrfA基因丰度没有显著的影响.DNRA潜在速率与nrfA基因丰度呈显著相关(r=0.68, p < 0.01, 图 4), 表明微生物丰度也是影响DNRA活性的因素.此外, 本文采用逐步回归分析了理化性质与DNRA潜在速率和nrfA基因丰度的关系.从图 5可以看出, 对DNRA潜在速率影响显著的因子有DOC、MBC、NO2-和nrfA基因丰度, 其中, DOC的贡献程度达到78.8%, 而其他3个因素仅贡献了3.8%~6.6%.TOC、EOC和盐度为影响nrfA基因丰度的主要土壤因子, 分别贡献了总变异的50.3%、9.4%和10.6%, 其中, TOC是其最主要的土壤因子.
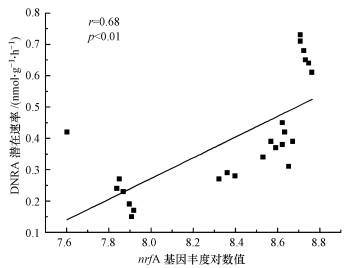 |
| 图 4 DNRA潜在速率与功能基因nrfA丰度的相关性分析 (n=24, 横纵标的基因丰度对数值以10为底,即log10) Fig. 4 Correlation analysis of DNRA rate and nrfA gene abundance |
| 表 2 土壤理化性质与DNRA潜在速率和nrfA基因丰度的相关分析(n=24) Table 2 Correlation analysis between sediment physiochemical properties and DNRA rate and nrfA gene abundance |
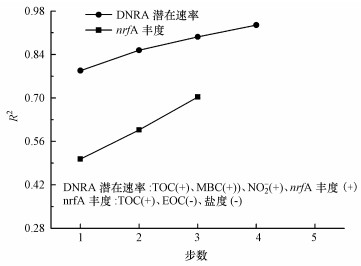 |
| 图 5 土壤理化性质对DNRA潜在速率与nrfA基因丰度影响的逐步回归分析 (n=24;图中所列出的理化因子为对变量具有显著性影响的因子, (+)和(-)分别表示正和负影响关系) Fig. 5 Stepwise multiple regression analysis between soil characteristics and DNRA rate and nrfA gene abundance |
潮汐是河口潮滩最为关键的环境变化因子之一, 对生物地球化学循环有着非常重要的影响(Spohn et al., 2013; 高灯州等, 2016).在河口潮滩地区, 由于潮汐周期性的淹没, 同时土壤由于海水的浸透, 促使土壤的含水率和盐分明显增加.有研究报道水分是调节湿地生态系统结构和功能的重要环境因子(孟宪民, 1999), 水分的变化会影响碳、氮循环过程的强度(高灯州等, 2016).受潮汐影响的土壤水分过于饱和, 形成低氧甚至还原条件, 促进有机质的厌氧分解及铁氧化物和硫酸盐的还原(黄佳芳等, 2015), 从而促进二价铁和硫化物产生(Li et al., 2015a; 2015b).王纯等(2017)对闽江口潮滩土壤不同活性碳组分进行研究, 结果表明, 低潮滩土壤中微生物量碳含量要比高潮滩高.然而, 也有研究表明, 因过度水淹导致土壤供养不足, 土壤微生物活性受到抑制, 微生物量碳会明显减少(侯翠翠等, 2012).本研究中, 潮汐淹水频率最高的低潮滩样点A1和A2的微生物量碳比样点A3低, 而比淹水次数较低的样点A5~A8土壤中微生物量碳高.因此, 河口潮滩湿地适度淹水或者干湿交替作用过程有利于促进土壤微生物的活性.许多研究报道, 因潮汐作用带来的硫酸根离子也会在厌氧环境下生成硫化物(Gardner et al., 2006;Roberts et al., 2014;Robertson et al., 2016), 因此, 本研究土壤中硫化物含量从低潮滩向高潮滩增加.此外, 潮滩土壤盐度升高, 也会促进硫酸根还原成硫化物, 这是因为一定范围内的盐度升高能够刺激硫酸盐还原菌的活性(She et al., 2016).此外, 淹水条件也会促进潮滩土壤的氮矿化和降低铵的氧化(Zhou et al., 2017), 从而有利于土壤中NH4+的保留, 故本研究土壤中NH4+的含量在低潮滩高, 而在高潮滩低.虽然高潮滩受潮汐淹水次数较少, 但土壤受到空气暴露的影响, NH4+也较易被氧化成NO3-和NO2-(Li et al., 2015a).然而, 因土壤中NO3-和NO2-不稳定, 在潮水的冲刷过程中容易被淋失带走, 不利于NO3-和NO2-在潮滩湿地土壤中的积累.因此, 潮滩湿地土壤无机氮动态变化与潮汐波动过程有着密切的关系.
河口潮滩湿地土壤盐度也是重要的环境因子, 会对土壤化学特征和生物因子产生较大的影响.高盐度具有较高的离子强度, 会导致微生物渗透压失衡, 影响细胞的新陈代谢与繁殖(Ikenaga et al., 2010), 进而对碳、氮转化过程产生较大的影响.由潮汐淹水导致的土壤盐度变化会影响微生物分解有机质, 进而导致DOC和EOC的含量发生变化(Morrissey et al., 2014; 高灯州等, 2016; 王纯等, 2017).有研究表明, DOC和EOC含量随着盐度的增加而增加, 这可能是因为盐度能促进土壤稳定有机质的分解和不稳定有机质的溶解(高灯州等, 2016).王纯等(2017)对闽江口不同盐度的潮滩土壤研究表明, 电导率会显著影响DOC和EOC的含量, 对DOC的影响贡献达60%.由于河口潮汐对湿地土壤环境的影响是一个动态过程, 很难从长周期时间尺度上分析潮汐作用对土壤理化特征动态过程的影响.因此, 本文采用空间代替时间的研究方法, 分析从低潮滩向高潮滩土壤环境的变化特征, 以反映潮汐作用对土壤特征的影响.采用能够代表潮汐过程的盐度和Eh这两个因子与其他土壤理化特征进行相关分析, 揭示潮汐对土壤环境因子的作用影响(表 3).从表 3中可以看出, Eh与各理化性质存在显著的相关性, 说明氧化还原电位是导致土壤理化性质变化的重要因素.一般地, 由于潮汐作用频率的增加, 土壤含水量过饱和, 向土壤传输氧气的能力较低, 随之进一步加强了土壤的还原性.从相关性结果看, Eh与土壤的TOC、MBC和DOC呈显著负相关(p < 0.01), 在一定程度上说明潮汐淹没有助于有机质的厌氧分解, 这是因为水分是微生物活动重要的条件(Tang et al., 2011;高灯州等, 2016;王纯等, 2017).此外, 潮汐过程导致的土壤还原条件也有利于NH4+的保留(Li et al., 2015a).
| 表 3 土壤盐度和Eh与理化性质的相关性 Table 3 Correlations between salinity, Eh and physiochemical properties |
尽管许多研究报道了滨海河口潮滩是硝酸盐异化还原成铵发生的重要环境, 对维持氮平衡具有重要的作用(Gardner et al., 2006;Dong et al., 2011;Kreiling et al., 2011;Roberts et al., 2014;Cao et al., 2016;Robertson et al., 2016), 但硝酸盐异化还原成铵过程在河口潮滩湿地的空间变化特征鲜见报道, 尤其是潮汐动态变化对湿地土壤的硝酸盐异化还原成铵过程的影响特征尚不明确.本文采用同位素示踪和分子生物学技术揭示了崇明东滩湿地硝酸盐异化还原成铵过程潜在速率与微生物丰度从低潮滩向高潮滩的沿程变化特征.研究结果表明, 东滩湿地土壤硝酸盐异化还原成铵潜在速率在空间上存在明显的差异, 表现出从低潮滩向高潮滩先增加后降低的空间变化特征, 该变化规律说明潮汐淹水能够促进土壤硝酸盐异化还原成铵过程发生的强度, 而过高频率的淹水也会抑制该过程的活性.硝酸盐异化还原成铵潜在速率受到潮汐淹水频率的影响, 这是因为土壤受到淹水频率的不同, 其土壤含水量和氧气通透性存在较大的差异(高灯州等, 2016).崇明东滩湿地因每天半日潮的影响, 低潮滩位每天大部分时间持续受到淹没, 土壤水分过于饱和;而高潮滩海拔高, 只有在大潮发生时才可能受到淹没, 淹水次数较少, 更多的受到空气暴露的影响(Tang et al., 2011; Li et al., 2015a).因此, 硝酸盐异化还原成铵潜在速率在河口潮滩湿地表现出的由低潮滩向高潮滩的空间变异规律, 一定程度上说明了潮汐作用会影响土壤硝酸盐异化还原成铵过程.
4.2.2 硝酸盐和有机质然而, 河口潮滩土壤理化性质复杂且变化多样, 会对硝酸盐异化还原成铵过程产生重要的影响(Gardner et al., 2006;Dong et al., 2011;Roberts et al., 2014;Robertson et al., 2016;Zhou et al., 2017).由于硝酸盐异化还原成铵的途径主要是有机质发酵型(Giblin et al., 2013), 因此, 硝酸盐异化还原成铵过程在丰富的有机质环境中容易发生;而且, 有机质还能够为生物活动提供所需要的能量和反应媒介.众多研究表明, 有机质与硝酸盐异化还原成铵的潜在速率呈显著相关性(Giblin et al., 2013;Roberts et al., 2014;Robertson et al., 2016).本文中, 土壤硝酸盐异化还原成铵潜在速率和nrfA基因丰度与TOC和DOC呈显著正相关(p < 0.05), 进一步说明有机质能够影响硝酸盐异化还原成铵的潜在速率.硝酸盐异化还原成铵过程会与反硝化竞争硝酸盐, 当环境中的有机质充足而硝酸盐不足时, 硝酸盐异化还原成铵过程能竞争过反硝化;如果有机质和硝酸盐都充足, 则硝酸盐异化还原成铵的竞争能力较弱(Hardison et al., 2015).本文分析发现, 硝酸盐异化还原成铵潜在速率与硝酸盐含量呈显著的正相关(p < 0.05), 由此也说明硝酸盐含量水平也是影响河口潮滩湿地硝酸盐异化还原成铵的重要因素.为了剔除土壤各环境因子之间的协同关系, 采用逐步回归和偏相关分析哪些因素是影响硝酸盐异化还原成铵过程的主要因素.偏相关分析发现,TOC、MBC和DOC是DNRA潜在速率和nrfA基因丰度的显著性影响因素(表 4), 进一步强调了有机质对硝酸盐异化还原成铵过程的重要影响.然而, 偏相关分析发现, 硝酸盐对硝酸盐还原成铵过程影响不显著, 这可能是因为硝酸盐的含量与土壤氧化还原程度密切相关(Li et al., 2015a).逐步回归分析表明, DOC是影响DNRA潜在速率的显著性因素, 且贡献了78.8%的总变异, 说明土壤中可溶性有机碳是影响硝酸盐异化还原成铵过程的主导性因素.此外, TOC、EOC和盐度为影响nrfA基因丰度的关键性因子, 分别贡献了总变异的50.3%、9.4%和10.6%.这些结果说明河口潮滩湿地土壤有机质是影响硝酸盐异化还原成铵的重要因素, 且进一步说明有机质发酵型硝酸盐异化还原成铵过程是主要发生途径.
| 表 4 控制土壤Eh因子的土壤理化性质与DNRA潜在速率和nrfA基因丰度的偏相关性分析 Table 4 Partial correlation analysis comparing soil properties to DNRA rate and nrfA gene abundance controlling for soil Eh |
有研究报道, 硫化物是影响硝酸盐异化还原成铵过程的因素之一, 这是因为硫化物能够驱动硝酸盐的还原(Plummer et al., 2015).盐度能促进硝酸盐异化还原成铵过程的发生, 可能是因为盐度升高会使硫酸盐的还原能力加强, 从而提高了土壤中硫化物的含量(Plummer et al., 2015).本研究中土壤硝酸盐异化还原成铵潜在速率和nrfA基因丰度与硫化物呈显著正相关, 由此说明了硫化物对硝酸盐异化还原成铵过程的重要影响.此外, 也有研究报道二价铁与硝酸盐异化还原成铵潜在速率有着密切的关系, 且二价铁添加培养实验也证明二价铁添加会促进硝酸盐异化还原成铵的潜在速率(Robertson et al., 2016), 这是因为二价铁对硝酸盐异化还原成铵起着化学催化作用(Giblin et al., 2013).虽然潮汐淹没会促进二价铁含量的增加, 但高潮滩土壤经过多年的沉积, 土壤背景中的二价铁比低潮滩高, 从而土壤中二价铁在空间差异上表现出较小的差异.所以, 本研究中二价铁对硝酸盐异化还原成铵过程并无显著影响, 这可能是因为二价铁呈现出较小的空间变化.此外, 土壤中其他因子的协同作用的影响, 也会削弱土壤中二价铁对硝酸盐异化还原成铵过程的作用程度.尽管从直接相关分析结果来看, 盐度并不是显著影响硝酸盐异化还原成铵过程的因素, 这可能是因为盐度受到淹水频率的影响, 导致盐度的影响作用容易被掩盖.通过控制土壤Eh的偏相关分析, 发现盐度也是影响硝酸盐异化还原成铵过程微生物nrfA基因的显著性因素(表 4).此外, 硫化物仍是影响硝酸盐异化还原成铵过程潜在速率的显著性因素, 由此说明河口潮滩湿地盐度和硫化物对硝酸盐异化还原成铵过程的重要作用.
4.3 滨海河口湿地硝酸盐异化还原成铵的环境意义在厌氧和还原环境中, 硝酸盐异化还原成铵过程在硝酸盐还原过程中起着重要的作用(Roberts et al., 2014; Hardison et al., 2015; Robertson et al., 2016).硝酸盐异化还原成铵过程将硝酸盐还原成更容易利用的铵盐, 进一步滞留在生态环境中, 参与氮的再循环过程(Gardner et al., 2006).由于研究水平的限制, 河口环境硝酸盐异化还原成铵过程常常被忽略, 相关的生态环境效应的认识也不明确.本研究通过氮同位素示踪技术, 得出潮滩湿地是硝酸盐异化还原成铵过程发生的热区, 且具有较大的空间变异特征.通过比较不同滨海河口生态系统中硝酸盐异化还原成铵的潜在速率(表 5), 发现该潜在速率一般在热带和亚热带河口地区较高, 说明温度对硝酸盐异化还原成铵过程有着重要的影响.较高的温度有利于提高微生物的活性和基质的有效性, 进而促进硝酸盐的还原(Dong et al., 2011; Cao et al., 2016).此外, 热带和亚热带地区, 由于温度高、降水丰富, 环境中硝酸盐容易被淋失, 从而导致硝酸盐浓度较低.在硝酸盐匮乏和有机质丰富的环境中, 硝酸盐还原成铵过程能够竞争过反硝化, 成为主导的硝酸盐还原过程(Nizzoli et al., 2010).因此, 热带与亚热带河口蓝藻赤潮频繁爆发, 硝酸盐异化还原成铵过程可能是一个重要的因素(Roberts et al., 2014).Dong等(2009;2011)对热带亚热带河口进行研究, 发现硝酸盐异化还原成铵过程是硝酸盐还原的主要过程, 其潜在速率达到330 μmol·m-2·h-1, 由此说明河口生态系统是硝酸盐异化还原成铵过程发生的重要环境.本研究采用研究区土壤硝酸盐异化还原成铵潜在速率和密度(1.2 g·cm-3, Liu et al., 2007)估算了东滩湿地硝酸盐转换为铵盐的潜力.通过估算, 东滩湿地土壤硝酸盐异化还原成铵过程将硝态氮转化铵态氮的潜力为2.5~10.4 t ·km-2·a-1.有研究表明, 长江口每年输入的无机氮的通量为367 t·km-2·a-1(Li et al., 2015a).因此, 硝酸盐异化还原成铵过程约贡献了长江口每年氮输入量的0.68%~2.85%, 由此说明硝酸盐异化还原成铵过程能够贡献河口环境一部分无机氮的来源.然而, 由于河口潮滩湿地理化性质具有高度的时空变异性, 所估算的硝酸盐异化还原成铵潜力具有一定的不确定性.此外, 在硝酸盐还原过程中, 反硝化和厌氧氨氧化会与硝酸盐异化还原成铵过程同时竞争硝酸盐(Robertson et al., 2016), 该竞争过程也会导致所估算的结果存在不确定性.有研究报道金属铁、锰及硫化物驱动的硝酸盐还原也会产生铵盐(Dhakal et al., 2013;Roberts et al., 2014;Robertson et al., 2016).因此, 后续的研究还应区分这些环境过程对铵盐产生的贡献, 才能得到更加准确的估算值.
| 表 5 不同滨海河口生态系统硝酸盐异化还原成铵潜在速率 Table 5 Potential rates of DNRA in this study and other estuarine and coastal ecosystems |
1) 崇明东滩湿地土壤硝酸盐异化还原成铵的潜在速率为0.17~0.71 nmol·g-1·h-1, 表现出由低潮滩向高潮滩先升高后降低的变化规律, 说明受潮汐作用不同的潮滩湿地土壤硝酸盐异化还原成铵过程存在较大的差异.
2) 土壤有机质和可溶性有机碳是影响硝酸盐异化还原成铵潜在速率和nrfA基因丰度的关键性因子, 此外, 无机氮、盐度和硫化物含量也是影响硝酸盐异化还原成铵过程的重要因素.
3) 东滩湿地硝酸盐异化还原成铵过程将硝态氮转化成铵态氮的潜力为6.54 t ·km-2·a-1, 约贡献了长江口每年无机氮输入量的1.78%, 从而说明硝酸盐异化还原成铵过程在很大程度上影响着河口潮滩湿地氮输入的来源与去除.
An S, Gardner W S. 2002. Dissimilatory nitrate reduction to ammonium (DNRA) as a nitrogen link versus denitrification as a sink in a shallow estuary (Laguna Madre/Baffin Bay, Texas)[J]. Marine Ecology Progress Series, 237: 41–50.
DOI:10.3354/meps237041
|
Cao W Z, Yang J X, Li Y, et al. 2016. Dissimilatory nitrate reduction to ammonium conserves N in an anthropogenically impacted sub-tropical mangrove sediments, Southeast China[J]. Marine Pollution Bulletin, 110: 155–161.
DOI:10.1016/j.marpolbul.2016.06.068
|
Christensen P B, Rysgaard S, Sloth N P, et al. 2000. Sediment mineralization, nutrient fluxes, denitrification and dissimilatory nitrate reduction to ammonium in an estuarine Fjord with Sea Cage Trout Farms[J]. Aquatic Microbial Ecology, 21: 73–84.
DOI:10.3354/ame021073
|
Crowe S A, Canfield D E, Sundby B, et al. 2012. Anammox, denitrification and fixed-nitrogen removal in sediments from the Lower St.Lawrence Estuary[J]. Biogeosciences, 9: 4309–4321.
DOI:10.5194/bg-9-4309-2012
|
Dahnke K, Bahlmann E, Emeis K. 2008. A nitrate sink in estuaries? An assessment by means of stable nitrate isotopes in the Elbe estuary[J]. Limnology Oceanography, 53: 1504–1511.
DOI:10.4319/lo.2008.53.4.1504
|
Deek A, Emeis K, Van Beusekom J. 2012. Nitrogen removal in coastal sediments of the German Wadden Sea[J]. Biogeochemistry, 108: 467–483.
DOI:10.1007/s10533-011-9611-1
|
Deng F Y, Hou LJ, Liu M, et al. 2015. Dissimilatory nitrate reduction processes and associated contribution to nitrogen removal in sediments of the Yangtze Estuary[J]. Journal of Geophysical Research:Biogeosciences, 120(8): 1521–1531.
DOI:10.1002/2015JG003007
|
Dhakal P, Matocha C J, Huggins F E, et al. 2013. Nitrite reactivity with magnetite[J]. Environmental Science and Technology, 47: 6206–6213.
DOI:10.1021/es304011w
|
Dong L F, Smith C J, Papaspyrou S, et al. 2009. Changes in benthic denitrification, nitrate ammonification, and anammox process rates and nitrate and nitrite reductase gene abundances along an estuarine nutrient gradient (the Colne Estuary, United Kingdom)[J]. Applied and Environmental Microbiology, 75(10): 3171–3179.
DOI:10.1128/AEM.02511-08
|
Dong L F, Sobey M N, Smith C, et al. 2011. Dissimilatory reduction of nitrate to ammonium (DNRA) not denitrification or anammox dominates benthic nitrate reduction in tropical estuaries[J]. Limnology and Oceanography, 56: 279–291.
DOI:10.4319/lo.2011.56.1.0279
|
Gardner W S, Mccarthy M J, An S, et al. 2006. Nitrogen fixation and dissimilatory nitrate reduction to ammonium (DNRA) support nitrogen dynamics in Texas estuaries[J]. Limnology and Oceanography, 51: 558–568.
DOI:10.4319/lo.2006.51.1_part_2.0558
|
Giblin A E, Tobias C R, Song B K, et al. 2013. The importance of dissimilatory nitrate reduction to ammonium (DNRA) in the nitrogen cycle of coastal ecosystems[J]. Oceanography, 26(3): 124–131.
DOI:10.5670/oceanog
|
高灯州, 曾从盛, 章文龙, 等. 2016. 水淹频率增加对闽江口湿地土壤有机碳及其活性组分的影响[J]. 环境科学学报, 2016, 36(3): 974–980.
|
侯翠翠, 宋长春, 李英臣, 等. 2012. 不同水分条件沼泽湿地土壤轻组有机碳与微生物活性动态[J]. 中国环境科学, 2012, 32(1): 113–119.
DOI:10.3969/j.issn.1000-6923.2012.01.018 |
黄佳芳, 倪进治, 仝川, 等. 2015. 闽江口半咸水沼泽湿地土壤甲烷产生过程及硫酸盐还原对其抑制作用研究[J]. 环境科学学报, 2015, 35(3): 862–872.
|
Hardison A K, Algar C K, Giblin A E, et al. 2015. Influence of organic carbon and nitrate loading on partitioning between dissimilatory nitrate reduction to ammonium (DNRA) and N2 production[J]. Geochimica et Cosmochimica Acta, 164: 146–160.
DOI:10.1016/j.gca.2015.04.049
|
Hou L J, Zheng Y L, Liu M, et al. 2013. Anaerobic ammonium oxidation (anammox) bacterial diversity, abundance, and activity in marsh sediments of the Yangtze Estuary[J]. Journal of Geophysical Research:Biogeosciences, 118: 1237–1246.
DOI:10.1002/jgrg.v118.3
|
Howarth R, Chan F, Conley D J, et al. 2011. Coupled biogeochemical cycles:eutrophication and hypoxia in temperate estuaries and coastal marine ecosystems[J]. Frontiers Ecology Environment, 9: 18–26.
DOI:10.1890/100008
|
Ikenaga M, Guevara R, Dean A L, et al. 2010. Changes in community structure of sediment bacteria along the Florida coastal everglades marsh-mangrove-seagrass salinity gradient[J]. Microbial Ecology, 59(2): 284–295.
DOI:10.1007/s00248-009-9572-2
|
Kreiling R M, Richardson W B, Cavanaugh J C, et al. 2011. Summer nitrate uptake and denitrification in an upper Mississippi River backwater lake:the role of rooted aquatic vegetation[J]. Biogeochemistry, 104: 309–324.
DOI:10.1007/s10533-010-9503-9
|
Laverman A M, Canavan R W, Slomp C P, et al. 2007. Potential nitrate removal in a coastal freshwater sediment (Haringvliet Lake, The Netherlands) and response to salinization[J]. Water Research, 41(14): 3061–3068.
DOI:10.1016/j.watres.2007.04.002
|
李家兵, 汪旭明, 谢蓉蓉, 等. 2017. 闽江口互花米草入侵过程对短叶茳芏沼泽沉积物硝化-反硝化作用的影响[J]. 环境科学学报, 2017, 37(3): 1065–1073.
|
李小飞, 林贤彪, 程吕, 等. 2015. 崇明东滩沉积物胞外酶活性与温室气体排放潜力及其影响因素[J]. 水土保持学报, 2015, 29(3): 202–207.
|
Li X F, Hou L J, Liu M, et al. 2015a. Evidence of nitrogen loss from anaerobic ammonium oxidation coupled with ferric iron reduction in an intertidal wetland[J]. Environmental Science & Technology, 49: 11560–11568.
|
Li X F, Hou L J, Liu M, et al. 2015b. Primary effects of extracellular enzyme activity and microbial community carbon and nitrogen mineralization in estuarine and tidal wetlands[J]. Applied Microbiology and Biotechnology, 99(6): 2895–2909.
DOI:10.1007/s00253-014-6187-4
|
Liu J P, Xu K H, Li A C, et al. 2007. Flux and fate of Yangtze River sediment delivered to the East China Sea[J]. Geomorphology, 85(3/4): 208–224.
|
Lovley D R, Phillips E J P. 1987. Rapid assay for microbially reducible ferric iron in aquatic sediments[J]. Applied and Environmental Microbiology, 53: 1536–1540.
|
Lunau M, Voss M, Erickson M, et al. 2013. Excess nitrate loads to coastal waters reduces nitrate removal efficiency:mechanism and implications for coastal eutrophication[J]. Environmental Microbiology, 15(5): 1492–1504.
DOI:10.1111/emi.2013.15.issue-5
|
Morrissey E M, Gillespie J L, Morina J C, et al. 2014. Salinity affects microbial activity and soil organic matter content in tidal wetlands[J]. Global Change Biology, 20: 1351–1362.
DOI:10.1111/gcb.2014.20.issue-4
|
Nizzoli D, Carraro E, Nigro V, et al. 2010. Effect of organic enrichment and thermal regime on denitrification and dissimilatory nitrate reduction to ammonium(DNRA) in hypolimnetic sediments of two lowland lakes[J]. Water Research, 44: 2715–2724.
DOI:10.1016/j.watres.2010.02.002
|
Plummer P, Tobias C, Cady D. 2015. Nitrogen reduction pathways in estuarine sediments:Influences of organic carbon and sulfide[J]. Journal of Geophysical Research:Biogeosciences, 120(10): 1958–1972.
DOI:10.1002/2015JG003057
|
Roberts K L, Velasquez L E, Joye S B. 2014. Increased rates of dissimilatory nitrate reduction to ammonium (DNRA) under oxic conditions in a periodically hypoxic estuary[J]. Geochimica et Cosmochimica Acta, 133: 313–324.
DOI:10.1016/j.gca.2014.02.042
|
Robertson E K, Roberts K L, Burdorf L D, et al. 2016. Dissimilatory nitrate reduction to ammonium coupled to Fe (Ⅱ) oxidation in sediments of a periodically hypoxic estuary[J]. Limnology and Oceanography, 61(1): 365–381.
DOI:10.1002/lno.10220
|
Santoro A E. 2010. Microbial nitrogen cycling at the saltwater-freshwater interface[J]. Hydrogeology Journal, 18(1): 187–202.
DOI:10.1007/s10040-009-0526-z
|
She C X, Zhang Z C, Cadillo-Quiroz H, et al. 2016. Factors regulating community composition of methanogens and sulfate-reducing bacteria in brackish marsh sediments in the Min River estuary, southeastern China[J]. Estuarine Coastal and Shelf Science, 181: 27–38.
DOI:10.1016/j.ecss.2016.08.003
|
Smith C J, Nedwell D B, Dong L F, et al. 2007. Diversity and abundance of nitrate reductase genes (narG and napA), nitrite reductase genes (nirS and nrfA), and their transcripts in estuarine sediments[J]. Applied and Environmental Microbiology, 73: 3612–3622.
DOI:10.1128/AEM.02894-06
|
Spohn M, Babka B, Giani L. 2013. Changes in soil organic matter quality during sea-influenced marsh soil development at the North Sea coast[J]. Catena, 107: 110–117.
DOI:10.1016/j.catena.2013.02.006
|
陶怡乐, 温东辉. 2016. 细菌硝酸盐异化还原成铵过程及其在河口生态系统中的潜在地位与影响[J]. 微生物学通报, 2016, 43(1): 172–181.
|
Tang Y S, Wang L, Jia J W, et al. 2011. Response of soil microbial respiration of tidal wetlands in the Yangtze River Estuary to different artificial disturbances[J]. Ecological Engineering, 37: 1638–1646.
DOI:10.1016/j.ecoleng.2011.06.004
|
Vance E D, Brookes P C, Jenkinson D S. 1987. An extraction method for measuring soil microbial biomass C[J]. Soil Biology and Biochemistry, 19: 703–707.
DOI:10.1016/0038-0717(87)90052-6
|
Vieira F C B, Bayer C, Zanatta J A, et al. 2007. Carbon management index based on physical fractionation of soil organic matter in an Acrisol under long-term no-till cropping systems[J]. Soil & Tillage Research, 96: 195–204.
|
Wang S Y, Zhu G B, Peng Y Z, et al. 2012. Anammox bacterial abundance, activity, and contribution in riparian sediments of the Pear River Estuary[J]. Environmental Science and Technology, 46: 8834–8842.
DOI:10.1021/es3017446
|
汪旭明, 任洪昌, 李家兵, 等. 2015. 河口区淡水和微咸水潮汐沼泽湿地沉积物反硝化作用[J]. 环境科学学报, 2015, 35(12): 3917–3926.
|
王纯, 刘兴土, 仝川, 等. 2017. 水盐梯度对闽江河口湿地土壤有机碳组分的影响[J]. 中国环境科学, 2017, 37(10): 3919–3928.
DOI:10.3969/j.issn.1000-6923.2017.10.037 |
徐继荣, 王友绍, 殷建平, 等. 2005. 珠江口入海河段DIN形态转化与硝化和反硝化作用[J]. 环境科学学报, 2005, 25(5): 686–692.
DOI:10.3321/j.issn:0253-2468.2005.05.021 |
盂宪民. 1999. 湿地与全球环境变化[J]. 地理科学, 1999, 19(5): 385–391.
DOI:10.3969/j.issn.1000-0690.1999.05.001 |
Yin G Y, Hou L J, Liu M, et al. 2014. A novel membrane inlet mass spectrometer method to measure 15NH4+ for isotope-enrichment experiments in aquatic ecosystems[J]. Environmental Science & Technology, 48(16): 9555–9562.
|
Zhou M, Butterbach-Bahl K, Vereecken H, et al. 2017. A meta-analysis of soil salinization effects on nitrogen pools, cycles and fluxes in coastal ecosystems[J]. Global Change Biology, 23(3): 1338–1352.
DOI:10.1111/gcb.2017.23.issue-3
|
 2019, Vol. 39
2019, Vol. 39


