2. 奥本大学工学院, 阿拉巴马 36849
2. College of Engineering, Auburn University, Alabama 36849
钒(Ⅴ)是地壳中第五大过渡金属, 在地壳中的含量约为0.02%~0.03%(刘世友, 2000).世界钒产量的88%来自于钒钛磁铁矿, 我国的钒钛磁铁矿资源丰富, 居世界第3位(杨金燕等, 2010).钒作为一种宝贵的战略资源, 已广泛运用于钢铁、冶金、宇航、化工等领域(杨金燕等, 2010).近年来, 钒资源的大量开发和广泛利用, 导致大气、水体和土壤中钒的含量逐步增加(Hope, 1997), 造成的环境污染也日趋严重.20世纪80年代末, 联合国环境规划署已建议将钒列入环境危险元素清单表的优先位置(Hindy et al., 1990).
目前, 工业上对于含钒废水的处理大都采用化学沉淀法、离子交换法、吸附法和生物法(张清明等, 2007).其中, 吸附法因具有占地面积小、吸附效率高、去除能力强等优点成为治理含钒废水的重要研究方向.纳米金属氧化物是一种具有较大比表面积和丰富价态、吸附活性强、选择性高等特点的吸附材料(张婵等, 2014).常用的纳米金属氧化物有纳米铁氧化物(张婵等, 2014)、锰氧化物(Su et al., 2010)、锌氧化物(Gao et al., 2008)、钛氧化物(Engates et al., 2011)、镁氧化物(Gao et al., 2008)等, 且这些材料吸附重金属都取得了很好的效果.近年来, 有关纳米铁锰氧化物吸附重金属的研究逐步增多, 例如, 将氧化石墨烯(GO)和纳米铁锰氧化物颗粒制备成新型三元纳米材料(TEPA-GO/MnFe2O4), 能有效地去除水溶液中的Pb(II)(Xu et al., 2018);MnFe2O4纳米颗粒可高效地去除刚果红和重金属离子Cr(VI)和Pb(II), 且通过磁分离技术回收样品还可再利用, 从而提高废水净化率(段连峰等, 2014);负载纳米铁的活性炭在3 h时呈最佳吸附状态, 对钒的去除率可达到99.70%(Sharififard et al., 2017);商用铁吸附剂CFH-12用量为10 g·L-1及初始钒浓度为58.2 mg·L-1时, 在pH=3~9范围内对钒的去除率可达到91%~94%(Leiviska et al., 2017);纳米铁锰氧化物对复合重金属(Se、As、Hg、Cr、Cd、Cu、Pb)吸附的研究表明(蒋晶等, 2013), 中性条件下纳米铁锰氧化物对复合重金属的去除效率可达到80%以上.这些研究表明, 纳米铁锰氧化物能有效去除多种重金属, 但主要集中在Cr、Pb、Cd、Cu等常见重金属离子, 对钒(Ⅴ)吸附作用的研究鲜有报道.因此, 本文通过模拟吸附试验方法, 系统地研究纳米铁锰氧化物对V5+的吸附动力学和热力学等吸附特性, 并通过红外谱和扫描电镜等表征分析, 探讨纳米铁锰氧化物对V5+的吸附机理, 以期为纳米铁锰氧化物的应用提供参考.
2 材料与方法(Materials and methods) 2.1 主要试剂与仪器试剂:纳米铁锰氧化物(MnFe2O4, 粒径40 nm)购于北京德科岛金科技公司;偏钒酸钠(NaVO3·2H2O)、硝酸、氢氧化钠、硝酸钠、盐酸均为分析纯.
仪器:雷磁PHS-3C型pH计(上海仪电科学仪器股份有限公司);DHG-9240A型电热鼓风干燥箱(上海一恒科学仪器有限公司);KQ-500E型超声波清洗器(昆山市超声仪器有限公司);高纯水制备仪(利康生物医疗科技控股集团);HZQ-F100全温震荡培养箱(苏州培英实验设备有限公司);电子天平(赛多利斯科学仪器(北京)有限公司);ICP-MS(iCAP Q, Thermo, Waltham, USA).
2.2 吸附实验 2.2.1 纳米铁锰氧化物添加量对钒吸附的影响分别称取10、20、30、50、80、100、120 mg纳米铁锰氧化物于50 mL塑料离心管中, 加入25 mL浓度为100 mg·L-1的钒溶液(用0.005 mol·L-1的NaNO3电解质溶液配制), 溶液中材料的浓度依次为0.4、0.8、1.2、2.0、3.2、4.0、4.8 g·L-1, 放入恒温振荡器中, 在25 ℃、250 r·min-1转速下振荡24 h, 然后以8000 r·min-1高速离心5 min, 取上清液经0.45 μm滤膜过滤(德国进口膜, PES), 加1滴浓硝酸并稀释样品数倍, 再使用ICP-MS测定样品中钒浓度.
2.2.2 pH值对钒吸附的影响称取100 mg纳米铁锰氧化物置于一系列50 mL塑料离心管中, 加入25 mL初始浓度为100 mg·L-1的钒溶液, 分别用0.1 mol·L-1HNO3和0.1 mol·L-1 NaOH调节溶液pH为2.00±0.02、3.00±0.02、4.00±0.02、5.00±0.02、6.00±0.02、7.00±0.02、8.00±0.02、9.00±0.02, 其他操作同上.
2.2.3 时间对钒吸附的影响称取100 mg纳米铁锰氧化物加入到一系列25 mL初始浓度为100 mg·L-1的钒溶液中, 调节pH值为4.00±0.02, 置于恒温振荡器中, 在25 ℃条件下以250 r·min-1转速振荡, 分别于反应0.5、1、2、4、6、12、24、48 h时取出, 其他操作同上.
2.2.4 温度对钒吸附的影响称取100 mg纳米铁锰氧化物于一系列50 mL塑料离心管中, 加入25 mL初始浓度为100 mg·L-1的钒溶液, 调节pH值到4.00±0.02, 分别在15、25、35、45 ℃下进行24 h吸附试验, 其他操作同上.
2.2.5 初始钒浓度对钒吸附的影响称取100 mg纳米铁锰氧化物于一系列50 mL塑料离心管中, 分别加入25 mL初始浓度为10、30、50、80、100、200 mg·L-1的钒溶液, 调节pH值到4.00±0.02, 置于恒温振荡器中, 在25 ℃条件下以250 r·min-1转速振荡24 h, 其他操作同上.
2.3 表征分析称取100 mg纳米铁锰氧化物于50 mL塑料离心管中, 加入25 mL初始浓度为100 mg·L-1的钒溶液, 调节pH值到4.00±0.02, 置于恒温振荡器中, 在25 ℃条件下以250 r·min-1转速振荡24 h后, 弃去上清液, 取出沉淀物, 用0.45 μm滤膜过滤后将沉淀物烘干(40 ℃, 6 h).通过红外光谱(Nicolet iS10, 美国)和扫描电镜(su8020, 日本)表征分析纳米铁锰氧化物吸附钒前后官能团、表面形态的变化, 揭示吸附机理.
2.4 测定指标与方法溶液重金属钒的浓度采用ICP-MS(Thermo, Waltham, USA)测定, 吸附量qe(mg·g-1)和吸附率φ分别由公式(1)和(2)计算.
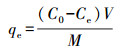
|
(1) |
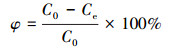
|
(2) |
式中, C0为溶液初始钒浓度(mg·L-1), Ce为吸附平衡时溶液钒浓度(mg·L-1), V为溶液体积(L), M为吸附材料用量(g).
3 结果与分析(Results and analysis) 3.1 纳米铁锰氧化物添加量对钒吸附效果的影响图 1表明, 随着MnFe2O4浓度的升高, MnFe2O4对溶液中钒的吸附率呈上升趋势, 而吸附量的变化则相反, 呈下降趋势.MnFe2O4浓度为0.4~4.0 g·L-1时, 钒的吸附速率逐步上升, MnFe2O4浓度为4.0 g·L-1时, 吸附率达到最大值64.32%.这可能是因为随着MnFe2O4浓度增加, 增大了吸附剂的表面积和有效活性位点;继续增加MnFe2O4浓度时, 溶液中钒浓度降低, 而MnFe2O4颗粒表面总吸附位增加不明显, MnFe2O4颗粒间产生相互碰撞和团聚效应, 导致有效活性位点减少, 吸附量减少(伊晨宇等, 2017).因此, 确定后续实验MnFe2O4浓度为4.0 g·L-1, 即添加量为100 mg.
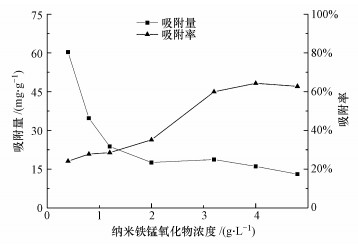 |
| 图 1 MnFe2O4浓度对钒吸附效果的影响 Fig. 1 Effect of MnFe2O4 concentration on vanadium adsorption |
图 2结果显示, 在pH为2~9范围内, 纳米铁锰氧化物(MnFe2O4)吸附钒(V5+)的效率呈先增后减的趋势, MnFe2O4在酸性条件下对钒(V5+)的吸附效率较高, pH=4时吸附率达到最大, 为51.94%.这可能是因为MnFe2O4在酸性条件下其表面存在Fe(OH)2+和FeO+或Mn(OH)2+和MnO+吸附中心(田喜强等, 2010), 在酸性条件下(pH>2), 溶液中的钒主要以钒酸根阴离子形式存在, 这时吸附剂表面带正电荷的吸附中心能与V5+产生正负电荷吸附和表面化合作用, 因而有很好的吸附效果.在极低的pH(<2)时, 钒酸盐以VO2+的形式存在, 不能与质子化位点交换(Guzmán et al., 2002).相反, pH较大(>7)时吸附剂表面带负电荷, 不利吸附发生(Hu et al., 2005).这与前人发现的纳米铁酸锰在pH=2时对Cr6+的吸附效果最好相一致(田喜强等, 2010b).因此, 后续实验溶液的pH值选择为4.
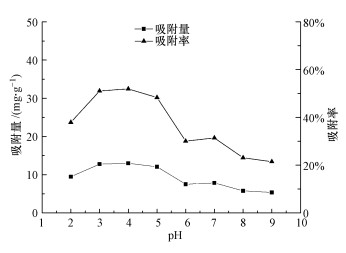 |
| 图 2 pH对MnFe2O4吸附钒效果的影响 Fig. 2 Effect of pH on the adsorption of vanadium by MnFe2O4 |
图 3结果显示, MnFe2O4对钒的吸附呈先快后慢, 最后趋平衡的特点.在0.5~6 h内, MnFe2O4对钒吸附量和吸附速率快速升高, 6~24 h内增加平缓, 24 h时吸附量和吸附率达到最大值, 分别为15.14 mg·g-1和60.54%.这是由于MnFe2O4吸附位点位于吸附剂外部, 吸附质很容易进入这些活性位点(田喜强等, 2010).随着活性位点逐渐被占据, V5+在表面吸附饱后则向MnFe2O4内部迁移, 该过程是一种比较缓慢过程, 因而减缓了吸附速率.
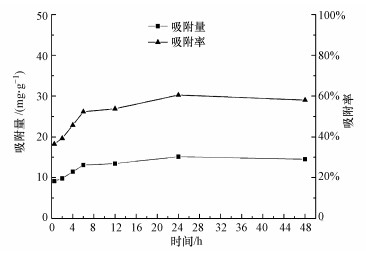 |
| 图 3 吸附时间对MnFe2O4吸附钒效果的影响 Fig. 3 Effect of time on the adsorption of vanadium by MnFe2O4 |
图 4表明, 纳米铁锰氧化物对V5+的吸附率随初始钒溶液浓度的增大而降低, 吸附量呈先增后降的趋势.当V5+浓度为100 mg·L-1时, 吸附量达到最高值12.11 mg·g-1, 这与MnFe2O4表面吸附位饱和及V5+之间的相互排斥增强有关(伊晨宇等, 2017).
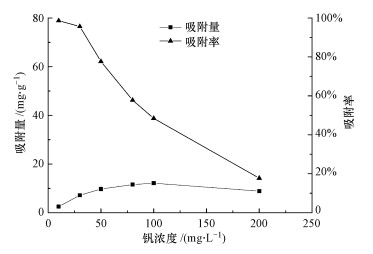 |
| 图 4 钒浓度对MnFe2O4吸附钒效果的影响 Fig. 4 Effect of vanadium concentration on vanadium adsorption by MnFe2O4 |
将图 3数据用伪一级模型、伪二级模型、叶洛维奇(Elovich)模型拟合, 结果表明(表 1), 伪二级动力学模型对纳米铁锰氧化物吸附钒过程的拟合效果最好, R2值为0.9967, 拟合算出平衡吸附量(qe·cal)与实验值(qe·exp)相差不太.表明纳米铁锰氧化物对钒的吸附是一个包含外部颗粒内部扩散、液膜扩散及表面吸附等的复杂过程.
| 表 1 纳米铁锰氧化物吸附钒的动力学拟合参数 Table 1 Kinetics fitting parameters of adsorption of vanadium by MnFe2O4 |
图 5表明, 温度对纳米铁锰氧化物吸附钒的影响显著, 纳米铁锰氧化物对钒的吸附量和吸附率随温度的增加而增加, 说明吸附过程为吸热反应.这是因为在一定范围内, 温度升高能促进离子扩散, 增加钒阴离子和锰矿表面的碰撞频率, 使钒离子在锰矿表面被吸附(黄永炳等, 2014).
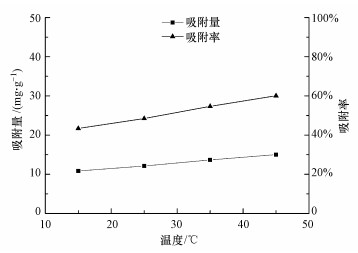 |
| 图 5 温度对MnFe2O4吸附钒效果的影响 Fig. 5 Effect of temperature on the adsorption of vanadium by MnFe2O4 |
对图 4等温线分别用Langmuir、Freundlich及Temkin等温模型拟合, 结果表明(表 2), 纳米铁锰氧化物吸附钒的过程采用Langmuir模型拟合的效果最好, R2>0.99, 最大吸附量(qm)为8.873 mg·g-1;其次为Freundlich模型和Temkin模型.这说明纳米铁锰氧化物吸附钒过程属单分子层吸附(Chen et al., 2010).
| 表 2 纳米铁锰氧化物等温吸附线拟合参数 Table 2 Isothermal adsorption line fitting parameters of MnFe2O4 |
根据3.6节分析可知, 随着温度的升高, 纳米铁锰氧化物对钒的吸附量呈增加趋势.对(288±1)、(298±1)、(308±1)、(318±1) K 4个不同温度下纳米铁锰氧化物对钒的吸附效果进行热力学分析.自由能变化(ΔG0)计算公式如下:
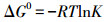
|
(3) |
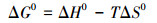
|
(4) |
式中, K为平衡常数, 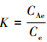
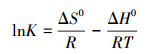
|
(5) |
由式(5)可知, lnK与1/T呈线性关系, 根据式(4)可求得不同温度下自由能变化ΔG0(kJ·mol-1), 根据线性拟合的斜率和截距能计算出焓变ΔH0(kJ·mol-1)及熵变ΔS0(kJ·mol-1·K-1).由表 3可知, 纳米铁锰氧化物吸附钒过程自由能变化ΔG0由正值变为负值, 表明高温条件下吸附钒能自发进行.有研究报道, △G0值在0~-20 kJ·mol-1之间以物理吸附为主, 范德华力占主导作用;△G0值在-80~-400 kJ·mol-1之间属化学吸附, 表现为不可逆吸(Zhang et al., 2014).本试验中纳米铁锰氧化物的ΔG0值范围在0.6812~-1.0468 kJ·mol-1之间, 表明该吸附过程主要为物理吸附且为吸热反应, 升高温度有利于吸附, ΔS0为正值, 表明纳米铁锰氧化物吸附钒酸根是一个熵增的过程, 钒酸根自发到纳米铁锰氧化物上后固-液界面无序度增大.
| 表 3 纳米铁锰氧化物的热力学参数 Table 3 Thermodynamic parameters of MnFe2O4 |
图 6为在扫描电镜下放大20000倍的纳米铁锰氧化物吸附钒酸根前后的结构变化.由图可知, 吸附前纳米铁锰氧化物呈颗粒状, 颗粒有聚集的现象, 这是因为在自然状态下, 为了减小巨大的比表面能, 纳米材料会自然聚集(张望, 2017).但由于MnFe2O4粒径较小, 粒子间有孔隙存在(田喜强等, 2010), 因而比表面积较大;吸附后颗粒呈团聚结构, 比表面积变小, 表面变得光滑一些.
 |
| 图 6 吸附前(a)和吸附后(b)纳米铁锰氧化物扫描电镜 Fig. 6 SEM images of MnFe2O4 before(a) and after adsorption(b) |
图 7为MnFe2O4吸附V5+前后的红外吸收光谱, 发现400~4000 cm-1中红外区在红外光谱分析中应用最广, 该区又分为指纹区(400~1330 cm-1)和官能团区(1330~4000 cm-1).比较发现, 纳米铁锰氧化物吸附V5+前在3385 cm-1处为水分子—OH的伸缩振动吸收峰(Huong et al., 2016), 吸附前此峰特别薄弱, 吸附后此峰略微增强并向低波数移动, 偏移到3373 cm-1处, 说明纳米铁锰氧化物表面在吸附钒酸根后氢键增加, 有利于颗粒物团聚沉淀(邢宇, 2016).1622 cm-1处的峰为H—O—H变形(Hashemian et al., 2015), 此峰吸附前后无变化.在特征波数区, 纳米铁锰氧化物在566 cm-1处有明显的出峰, 可能为Fe—Mn—O的伸缩振动吸收峰(Huong et al., 2016).在MFO NPs和GO-MFO的纳米杂化物的红外光谱中出现的558~590 cm-1附近特征吸收峰是与Fe—Mn—O拉伸振动相对应的特征峰(Huong et al., 2016).
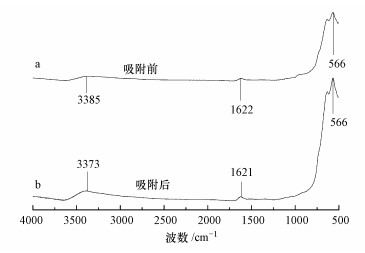 |
| 图 7 纳米铁锰氧化物吸附钒前后的红外光谱 Fig. 7 Infrared spectra of MnFe2O4 before and after adsorption of vanadium |
纳米铁锰氧化物(MnFe2O4)对钒的吸附特征系列实验表明, MnFe2O4吸附V5+的效果明显, 可作为处理钒污染废水的吸附材料.在25 ℃、pH=4、MnFe2O4添加量为0.1 g时, 吸附24 h可达到平衡, 最大吸附量和吸附率分别为15.14 mg·g-1和60.54%.MnFe2O4对钒的吸附符合伪二级动力学模型及Langmuir等温模型, 其热力学分析表明吸附为吸热过程.扫描电镜表明, MnFe2O4呈颗粒状, 具有巨大的比表面积.红外光谱表明, MnFe2O4吸附钒为颗粒间氢键增加的团聚沉淀.本文仅进行了纳米铁锰氧化物吸附钒酸根离子实验, 实际纳米铁锰氧化物处理污染废水中钒(V5+)的应用中, 还需考虑在与其他污染物共存条件下纳米铁锰氧化物对钒(V5+)污染废水的吸附效果, 这有待进一步研究.
Al-Saidi H M. 2016. The fast recovery of gold(Ⅲ) ions from aqueous solutions using raw date pits:Kinetic, thermodynamic and equilibrium studies[J]. Journal of Saudi Chemical Society, 20(6): 615–624.
DOI:10.1016/j.jscs.2013.06.002
|
Chen Y, Li F. 2010. Kinetic study on removal of copper(Ⅱ) using goethite and hematite nano-photocatalysts[J]. Journal of Colloid and Interface Science, 347(2): 277–281.
DOI:10.1016/j.jcis.2010.03.050
|
段连峰, 张雨, 王立民, 等. 2014. 溶剂热法合成不同形貌MnFe2O4纳米颗粒及其在污水处理中的应用[J]. 无机材料学报, 2014, 29(7): 763–768.
|
Engates K E, Shipley H J. 2011. Adsorption of Pb, Cd, Cu, Zn, and Ni to titanium dioxide nanoparticles:effect of particle size, solid concentration, and exhaustion[J]. Environmental Science and Pollution Research, 18(3): 386–395.
DOI:10.1007/s11356-010-0382-3
|
Gao C, Zhang W, Li H, et al. 2008. Controllable fabrication of mesoporous MgO with various morphologies and their absorption performance for toxic pollutants in water[J]. Crystal Growth & Design, 8(10): 3785–3790.
|
Guzmán J, Saucedo I, Navarro R, et al. 2002. Vanadium interactions with chitosan:Influence of polymer protonation and metal speciation[J]. Langmuir, 18(5): 1567–1573.
DOI:10.1021/la010802n
|
黄永炳, 黄聪, 杨秦霞, 等. 2014. 天然锰矿对钒(Ⅴ)的静态吸附性能[J]. 武汉大学学报(理学版), 2014, 60(4): 317–323.
|
Hashemian S, Saffari H, Ragabion S. 2015. Adsorption of cobalt(Ⅱ) from aqueous solutions by Fe3O4/bentonite nanocomposite[J]. Water, Air, & Soil Pollution, 226(1): 2212.
|
Hindy K T, Abdel Shafy H I, Farag S A. 1990. The role of the cement industry in the contamination of air, water, soil and plant with vanadium in Cairo[J]. Environmental Pollution, 66(3): 195–205.
DOI:10.1016/0269-7491(90)90001-S
|
Hope B K. 1997. An assessment of the global impact of anthropogenic vanadium[J]. Biogeochemistry, 37(1): 1–13.
DOI:10.1023/A:1005761904149
|
Hu J, Lo I M, Chen G. 2005. Fast removal and recovery of Cr(Ⅵ) using surface-modified jacobsite (MnFe2O4) nanoparticles[J]. Langmuir, 21(24): 11173–11179.
DOI:10.1021/la051076h
|
Huong P T L, Huy L T, Phan V N, et al. 2016. Application of graphene oxide-MnFe2O4 magnetic nanohybrids as magnetically separable adsorbent for highly efficient removal of arsenic from water[J]. Journal of Electronic Materials, 45(5): 2372–2380.
DOI:10.1007/s11664-015-4314-3
|
蒋晶, 李泽唐, 张旭, 等.2013.纳米铁锰氧化物去除复合重金属试验研究[C].2013中国环境科学学会学术年会.昆明: 5
http://cpfd.cnki.com.cn/Article/CPFDTOTAL-HJKP201308006353.htm |
Leiviska T, Khalid M K, Sarpola A, et al. 2017. Removal of vanadium from industrial wastewater using iron sorbents in batch and continuous flow pilot systems[J]. Journal of Environmental Management, 190: 231–242.
|
刘世友. 2000. 钒的应用与展望[J]. 稀有金属与硬质合金, 2000(2): 58–61.
DOI:10.3969/j.issn.1004-0536.2000.02.016 |
陆中桂, 黄占斌, 李昂, 等. 2018. 腐植酸对重金属铅镉的吸附特征研究[J]. 环境科学学报, 2018, 38(9): 1–17.
|
Sharififard H, Soleimani M, Ashtiani F Z. 2017. Optimization of chemical modification process of activated carbon surface with iron nanoparticles for efficient vanadium removal:Kinetics, equilibrium and surface complexation modelling[J]. Desalination and Water Treatment, 72: 343–353.
DOI:10.5004/dwt.2017
|
Su Q, Pan B, Wan S, et al. 2010. Use of hydrous manganese dioxide as a potential sorbent for selective removal of lead, cadmium, and zinc ions from water[J]. Journal of Colloid and Interface Science, 349(2): 607–612.
DOI:10.1016/j.jcis.2010.05.052
|
田喜强, 董艳萍, 赵东江, 等. 2010. 纳米铁酸锰的合成及其在污水处理中的应用[J]. 工业水处理, 2010, 30(12): 70–73.
DOI:10.3969/j.issn.1005-829X.2010.12.018 |
Xu W, Song Y, Dai K, et al. 2018. Novel ternary nanohybrids of tetraethylenepentamine and graphene oxide decorated with MnFe2O4 magnetic nanoparticles for the adsorption of Pb(Ⅱ)[J]. Journal of Hazardous Materials, 358: 337–345.
DOI:10.1016/j.jhazmat.2018.06.071
|
邢宇.2016.纳米级铁锰氧化物对山阴地下水中砷的去除[D].太原: 太原科技大学.62
http://cdmd.cnki.com.cn/Article/CDMD-10109-1016905659.htm |
杨金燕, 唐亚, 李廷强, 等. 2010. 我国钒资源现状及土壤中钒的生物效应[J]. 土壤通报, 2010, 41(6): 1511–1517.
|
伊晨宇, 杭春亮, 杨丽霞. 2017. 纳米铁酸锰吸附去除Cr(Ⅵ)的研究[J]. 硅酸盐通报, 2017, 36(9): 2900–2906.
|
Zhang J, Wu C, Jia A, et al. 2014. Kinetics, equilibrium and thermodynamics of the sorption of p-nitrophenol on two variable charge soils of Southern China[J]. Applied Surface Science, 298: 95–101.
DOI:10.1016/j.apsusc.2014.01.130
|
张婵, 徐宏英. 2014. 纳米金属氧化物去除水体重金属的研究进展[J]. 化学与生物工程, 2014, 31(3): 5–8.
DOI:10.3969/j.issn.1672-5425.2014.03.002 |
张清明, 艾南山, 徐帅, 等. 2007. 含钒废水的处理现状及发展趋势[J]. 科技情报开发与经济, 2007, 17(2): 142–144.
DOI:10.3969/j.issn.1005-6033.2007.02.086 |
张望.2017.工程纳米材料对铅和钒吸附性能的研究[D].杨凌: 西北农林科技大学.79
http://cdmd.cnki.com.cn/Article/CDMD-10712-1017064719.htm |
 2019, Vol. 39
2019, Vol. 39


