2. 山西大学环境与资源学院, 太原 030006
2. College of Environment and Resource, Shanxi University, Taiyuan 030006
砷(As)是一种广泛分布于世界各地的环境毒物, 其急性毒性早已被人们所熟知, 然而其慢性毒性作用在近50年才被了解(Hong et al., 2014).居民通过饮用水摄入砷是引发砷中毒的主要途径(James et al., 2015).高砷地下水分布于70多个国家, 约2亿人的饮用水中砷含量超出世界卫生组织(WHO)规定的最高限值10 μg·L-1 (Zhu et al., 2017).我国新疆、内蒙、山西、台湾等十几个省份存在饮水型砷中毒病区(汤洁等, 2013), 并且高砷地下水的治理是一个缓慢的过程(George et al., 2017).由燃煤过程产生的二氧化硫(SO2)造成了大气的SO2污染.在相当长的一段时间内, 饮用水As暴露与大气SO2污染将会影响居民的生活与健康.
流行病学调查结果显示, 长期As暴露与皮肤癌、生殖系统疾病及肝损伤的发生发展相关(Zhu et al., 2017).肝脏是砷代谢的重要组织器官, 无机砷在胃肠道被吸收后经由门静脉进入肝脏组织, 发生甲基化代谢产生三价As(如一甲基砷酸及二甲基砷), 在此过程中机体内含巯基酶活性被抑制, 导致细胞氧化还原平衡被改变产生细胞毒性(Rehman et al., 2012), 因此, As的长期暴露可引起不同程度的肝损伤、肝纤维化、肝硬化及肝癌(Chakraborti et al., 2017).同时, 组织炎症及炎性细胞浸润常伴随着肝脏损伤出现(Curtis et al., 2019).SO2暴露也被认为与人类肝脏疾病相关(Tong et al., 2015).动物实验发现, SO2除与呼吸系统疾病密切相关外, 还会引起肝组织炎性细胞浸润、肝窦充血、库普菲细胞增生等肝损伤(Liang et al., 2018).现有研究认为, As或SO2暴露引发组织自由基合成增加产生氧化应激是诱发机体疾病的原因(Meng, 2003; Jomovak et al., 2011), 但关于两种污染物的联合作用研究还鲜有报道.
迄今为止, 有关SO2对高砷地下水暴露人群的健康影响尚未可知, SO2与As共同暴露时对人群潜在的肝脏毒性作用也未见报道.因此, 本实验采用SO2和As联合染毒, 以分析SO2暴露对As致肝损伤的影响及其可能的毒性机制, 为共同暴露人群肝脏疾病预防提供实验依据.
2 材料与方法(Materials and methods) 2.1 试剂亚砷酸钠、亚硫酸氢钠及亚硫酸钠均购自Merck公司;Trizol和逆转录试剂购自日本Takara公司;RNA提取试剂盒和实时荧光定量PCR试剂盒购于上海生工生物工程有限公司;二甲基亚砜(DMSO)购自美国Sigma公司.
2.2 动物染毒及取材C57BL/6雄性小鼠(四周龄)为清洁级小鼠, 购于中国军事医学科学院.将动物按体重随机分为4组, 分别为:对照组、As染毒组、SO2染毒组、As与SO2联合染毒组.在As与SO2联合染毒组中, 小鼠饮用含5 mg·L-1砷(约8.67 mg·L-1 NaAsO2)水溶液60 d, 对照组与SO2组小鼠仅接受双蒸水.每周一早晨和周四下午, 新鲜制备含As水并提供给小鼠.从第31 d至第60 d, 根据文献(Li et al., 2018)的方法, SO2组及SO2与As联合染毒组的小鼠在熏蒸室中连续吸入5 mg·m-3 (约1.75 ppm)SO2 6 h·d-1.同时, 对照组和As组小鼠吸入过滤空气.在SO2暴露过程中, 所有小鼠禁食禁水.造模结束时, 空腹小鼠麻醉后处死, 取部分肝脏组织用40 g·L-1中性甲醛固定, 部分肝脏在0.9%的生理盐水中快速洗净, 滤纸拭干, 液氮冷冻后于-80 ℃保存.取冻存的肝组织, 加入9倍体积的生理盐水, 玻璃匀浆器冰浴匀浆, 制备10%的组织匀浆液, 并在液氮研磨约0.1 g组织用于RNA提取.10%的肝脏匀浆在3500 r·min-1下低温离心15 min后取上清液, 用于氧化指标的测定.
2.3 肝脏匀浆中氧化指标及肝功能测定丙二醛(MDA)测定试剂盒(TBA法)、过氧化氢(H2O2)测定试剂盒(比色法)、过氧化氢酶(CAT)测定试剂盒(可见光法)及总超氧化物歧化酶(T-SOD)测试盒(羟胺法)均购自南京建成生物技术研究所, MDA含量、H2O2含量、T-SOD活性和CAT活性测定均严格按试剂盒(南京建成)操作说明进行.活性氧(ROS)含量采用DCFH-DA ROS荧光探针(北京Solarbio公司)进行测定, 将肝脏匀浆与探针孵育后采用多功能酶标仪检测其数值.丙氨酸氨基转移酶(ALT)测试盒(紫外比色法)及天门冬氨酸氨基转移酶(AST)测试盒(紫外比色法)均购于南京建成生物技术研究所, ALT活性及AST活性测定均严格按照试剂盒操作说明进行.
2.4 实时荧光定量PCR法检测NF-κB和STAT-3信号通路基因表达采用Trizol法提取总RNA, 去除基因组DNA后, 以oligo dT为引物反转录合成cDNA.按照实时荧光定量PCR试剂盒说明进行PCR.用GAPDH基因对目的基因NF-κB、IL-β、TNF-α、STAT-3及IL-6表达量进行均一化处理.基因表达变化的计算采用倍增变化率, 基因倍增变化率=2-ΔΔCt (ΔCt为目的基因和内参照基因Ct值的差值).
2.5 组织切片制备取甲醛固定的肝脏标本, 梯度乙醇脱水, 二甲苯透明、石蜡包埋, 切成4~5 μm厚的切片, 进行常规伊红苏木素(H&E)染色, 显微镜下进行形态学观察.
2.6 统计学分析实验结果用平均值±标准差表示, 数据采用SPSS17软件进行统计分析, 多组间比较采用单因素方差分析, *和**表示与对照组(或处理组间)相比差异有统计学意义(*p < 0.05, **p < 0.01).
3 结果(Results) 3.1 As与SO2联合暴露对小鼠肝脏氧化应激反应的影响外来化学物质可引起机体氧化应激反应, 导致体内氧化与抗氧化作用失衡(Sies, 2015).肝脏氧化应激指标检测结果如图 1所示.相较于对照组, As与SO2联合组ROS荧光信号水平(以DCF荧光值表征)提升最大, 其次为SO2组、As组(图 1a).3个染毒组H2O2含量(以FW计)均显著高于对照组, 由大到小依次排序为:As与SO2联合组>SO2组>As组(图 1b).肝脏内MDA含量(以prot计)在3个染毒组均显著高于对照组, 其中, As与SO2联合组增幅最高(图 1c).SOD、CAT酶活性(以prot计)在经过不同染毒处理后相较于对照组均表现出下降趋势, 其中以As与SO2联合组降幅最大(图 1d和1e).结果说明, 相较于对照组, 3个染毒组肝脏组织均发生了氧化应激反应, As与SO2联合组的氧化胁迫及氧化损伤程度高于As或SO2单独处理组, SO2暴露会加剧由As摄入造成的氧化损伤.
 |
| 图 1 对照组、As染毒组、SO2染毒组与As-SO2共同染毒组对小鼠肝脏氧化应激指标的影响 (a.ROS水平, b.H2O2含量, c.MDA含量, d.SOD酶活性, e.CAT酶活性;*和**表示与对照组相比(或处理组间相比)差异有统计学意义(*p < 0.05, **p < 0.01), 下同) Fig. 1 Oxidative stress indexes of control group, As group, SO2 group and As-SO2 group in mouse livers |
氧化应激反应引起的肝脏组织炎性反应、炎症反应激活及炎症介质释放是As致肝脏疾病发生过程中的基本病理变化(Rana et al., 2015).采用实时荧光定量PCR检测小鼠肝脏的两条经典炎性信号通路, 得到图 2结果.由图可知, NF-κB及其下游效应因子IL-1β、TNF-α表达量为:联合处理组>As组>SO2组>对照组;STAT-3及其下游效应因子IL-6表达量趋势与NF-κB信号通路一致.结果表明, 相较于对照组, As、SO2及联合染毒均会导致炎性信号通路表达量上调, 而As与SO2联合组相较于As或SO2组可以加剧炎性信号通路的表达, 即SO2暴露加剧了As暴露导致的炎性反应.
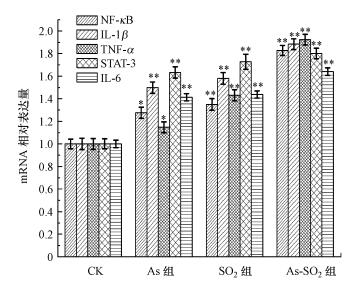 |
| 图 2 对照组、As染毒组、SO2染毒组与As-SO2共同染毒组肝脏中炎症因子的转录水平 Fig. 2 mRNA level of the inflammatory factors of control group, As group, SO2 group and As-SO2 group in mouse livers |
对肝组织切片观察发现, 相较于对照组(图 3a), As组肝组织(图 3b)中出现双核肝细胞且大部分肝细胞出现浊肿变性, SO2组(图 3c)中部分细胞出现气球样变, As与SO2联合组(图 3d)多数肝细胞出现气球样变, 并伴随有炎细胞浸润, 同时部分中央静脉和相邻肝窦内充血明显, 肝窦变形.肝脏损伤程度为:联合处理组>As组>SO2组.本文进一步检测了小鼠肝功能相关指标:AST及ALT活性.由表 1可知, As组及SO2组均会引起AST及ALT活性增高, 但增高程度均低于联合处理组.表明相较于As组与SO2组, 联合处理导致的肝功能受损更严重.以上结果表明, As与SO2均会造成肝脏组织及肝功能损伤, 而相较于As组, SO2与As共同暴露造成的肝损伤及肝功能损伤更加严重.
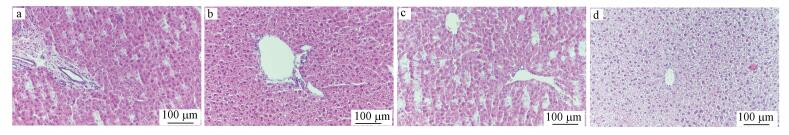 |
| 图 3 对照组(a)、As染毒组(b)、SO2染毒组(c)与As-SO2共同染毒组(d)的小鼠肝脏组织切片 (200×, 标尺=100 μm) Fig. 3 The mouse liver tissue slices of control group(a), As group(b), SO2 group(c) and As-SO2 group(d) |
| 表 1 对照组、As染毒组、SO2染毒组与As-SO2共同染毒组中小鼠肝脏功能指标 Table 1 ALT and AST index of control group, As group, SO2 group and As-SO2 group in mouse livers |
我国许多地区均存在人群同时暴露于高As地下水及SO2空气污染的情况(汤洁等, 2013;王燕等, 2017).长期暴露于As或SO2环境下会导致皮肤及呼吸道病变, 也会产生全身毒性(Bai et al., 2010; Chen, 2014).本研究组织切片显示As暴露可导致肝损伤, 此结果与前人研究结果一致(Chakraborti et al., 2017).另外, 本研究中首次发现小鼠进行长时间As水暴露之后, 再进行SO2气体暴露, SO2可加剧由As暴露所致的肝脏损伤, 但与此同时, 4个实验组的肝脏系数分别为0.95、1.04、0.90、1.06 mg·g-1, 组间没有显著性差异.
我国的居住区大气24 h平均SO2标准为0.15 mg·m-3 (约0.0525 ppm), 饮用水中砷的质量标准为10 μg·L-1.本研究中使用5 mg·m-3 (约1.75 ppm)SO2和5 mg·L-1 As作为染毒浓度, 虽然实验中的SO2和As暴露浓度可能被认为远远超出正常值, 但必须考虑以下几点:首先, 本研究中的动物每天SO2暴露时长仅为6 h, 暴露期间具有缓解期(18 h), 因此, 24 h平均暴露浓度为1.25 mg·m-3 (约0.438 ppm), 为中国空气质量标准的8.33倍;另一方面, 美国国家职业安全卫生研究所(NIOSH)给出的SO2暴露标准为从5 ppm持续暴露15 min至2 ppm持续暴露10 h不等.本研究中的SO2暴露量为5 mg·m-3(约1.75 ppm), 持续6 h, 略低于NIOSH标准.对于As暴露水平, 由于小鼠对As的敏感性远低于人类(Kim et al., 2015), 因此, 本文使用比饮用水标准高500倍的剂量来探索其不良反应.因此, 本研究中使用的小鼠模型更符合SO2和As污染严重污染区域的环境暴露, 以及高砷污染区域的SO2职业暴露.
As可与含巯基的功能蛋白、酶及小分子化合物发生反应, 干扰细胞的正常代谢过程, 抑制多种抗氧化酶活性及抗氧化物质水平, 最终通过氧化应激、炎性反应等途径造成肝细胞损伤(Kotyzova et al., 2013;周宗灿, 2015).当小鼠摄入无机As时, 会导致机体产生过量自由基, ROS与H2O2水平上升并引发脂质过氧化反应, 使膜脂过氧化产物MDA增多, 组织发生氧化损伤.本研究结果显示, 联合染毒组H2O2和MDA含量显著高于单独染毒组, 表明SO2、As联合作用可能是通过产生过量ROS, 继而诱导脂质过氧化作用增强, 进而加剧组织细胞的损伤.流行病学调查显示, 高As暴露人群血中ROS水平显著升高, 抗氧化物质水平显著下降, As通过诱导氧化应激产生对肝细胞的损害(Khodayar et al., 2016).脂质过氧化一直是被广为认可和深入研究的As损伤主要机制之一, 抗氧化酶类SOD与CAT活性是该过程中的关键酶(Altikat et al., 2015).而在本实验中, 联合染毒组中SOD及CAT相较于对照组及单独处理组均表现出明显的下降趋势.SOD与CAT活性被抑制, 可导致机体氧化与抗氧化机制的失调, 进一步加剧脂质过氧化反应.同时证实了SO2可通过抑制氧化酶活性、降低体内抗氧化物质来加剧As造成的氧化应激损伤.本实验中As染毒组与SO2染毒组出现的细胞浊肿与气球样变可能与其诱导的氧化损伤相关.相较于单独处理组, As与SO2联合染毒组中出现的肝脏组织损伤加剧及肝功能受损可能与SO2暴露加剧As暴露造成的氧化应激水平有关.
多项研究表明, 促炎因子在As中毒患者或As暴露动物模型中的肝脏组织及血清中的表达随损伤加重而上调(Choudhury et al., 2016).肝脏损伤常伴随着细胞浸润和炎症因子表达(Ghatak et al., 2011), 而NF-κB与STAT-3是两条经典的炎症信号通路.其中, NF-κB信号通路在多种器官炎症反应中均被发现持续性激活, NF-κB被激活后进行入核调控, 随后激活下游效应因子IL-1β、TNF-α等(Monaco et al., 2004).STAT-3是另一条经典炎症应答信号通路, 在炎症反应中常与NF-κB信号通路共同作用, 其被激活后可引起下游IL-6等一系列效应因子磷酸化(Vlahopoulos, 2017).在本实验中, 3个染毒组均引起了NF-κB及STAT-3信号通路mRNA表达量上调, 同时, 联合染毒组中NF-κB及其下游效应因子mRNA表达量显著高于对照组与单独暴露组, STAT-3及其下游效应因子也呈上升趋势, 证实SO2可加强As在肝脏中的促炎作用.本研究中, 3个染毒组的肝脏切片中均出现了炎性细胞浸润, 但联合染毒组肝脏组织切片炎性细胞浸润更为显著, 也证实了SO2可加剧As引发的炎性反应.
综上, 本文使用As与SO2共暴露小鼠模型初步探讨了SO2与As联合暴露对肝脏组织的影响, 证实了SO2与As造成的肝脏损伤加剧可能是通过调节氧化应激水平及炎症信号通路表达量造成的.虽然其联合作用的毒性机制很复杂, 但氧化应激及炎症反应可能是二者联合暴露所导致疾病的一个有效预防靶点.
5 结论(Conclusions)As与SO2共暴露可导致C57BL/6小鼠肝脏抗氧化酶与抗氧化物质发生改变, 导致肝脏氧化应激损伤.同时, 共暴露还导致了炎症信号通路NF-κB及STAT-3被激活, 最终引起小鼠肝脏器质性损伤.
Altikat S, Uysal k, Kuru H I, et al. 2015. The effect of arsenic on some antioxidant enzyme activities and lipid peroxidation in various tissues of mirror carp(Cyprinus carpio)[J]. Environmental Science and Pollution Research, 22(5): 3212–3218.
DOI:10.1007/s11356-014-2896-6
|
Bai J, Meng Z. 2010. Expression of caspase and apoptotic signal pathway induced by sulfur dioxide[J]. Environmental and Molecular Mutagenesis, 51(2): 112–122.
|
Chakraborti D, Rahman M M, Das B, et al. 2017. Groundwater arsenic contamination and its health effects in India[J]. Hydrogeology Journal, 25(4): 1165–1181.
DOI:10.1007/s10040-017-1556-6
|
Chen C J. 2014. Health hazards and mitigation of chronic poisoning from arsenic in drinking water:Taiwan experiences[J]. Reviews on Environmental Health, 29(1/2): 13–19.
|
Choudhury S, Ghosh S, Mukherjee S, et al. 2016. Pomegranate protects against arsenic-induced p53-dependent ROS-mediated inflammation and apoptosis in liver cells[J]. Journal of Clinical Biochemistry and Nutrition, 38: 25–40.
DOI:10.1016/j.jnutbio.2016.09.001
|
Curtis B J, Shults J A, Boe D M, et al. 2019. Mesenchymal stem cell treatment attenuates liver and lung inflammation after ethanol intoxication and burn injury[J]. Alcohol.
|
George C M, Inauen J, Perin J, et al. 2017. Behavioral determinants of switching to arsenic-safe water wells:An analysis of a randomized controlled trial of health education interventions coupled with water arsenic testing[J]. Health Education and Behavior, 44(1): 92–102.
DOI:10.1177/1090198116637604
|
Ghatak S, Biswas A, Dhali G K, et al. 2011. Oxidative stress and hepatic stellate cell activation are key events in arsenic induced liver fibrosis in mice[J]. Toxicology and Applied Pharmacology, 251(1): 59–69.
DOI:10.1016/j.taap.2010.11.016
|
Hong Y S, Song K H, Chung J Y. 2014. Health effects of chronic arsenic exposure[J]. Journal of Preventive Medicine and Public Health, 47(5): 245–252.
DOI:10.3961/jpmph.14.035
|
Khodayar M J, Javadipour M, Keshtzar E, et al. 2016. Role of berberine against arsenic induced oxidative damage in isolated rat liver[J]. Journal of Environmental Biology, 37(2): 285–290.
|
James K A, Byers T, Hokanson J E, et al. 2015. Association between lifetime exposure to inorganic arsenic in drinking water and coronary heart disease in Colorado residents[J]. Environmental Health Perspect, 123(2): 128–134.
DOI:10.1289/ehp.1307839
|
Jomova K, Jenisova Z, Feszterova M, et al. 2011. Arsenic:toxicity, oxidative stress and human disease[J]. Journal of Applied Toxicology, 31(2): 95–107.
|
Kim Y J, Kim J M. 2015. Arsenic toxicity in male reproduction and development[J]. Development & Reproduction, 19: 167–180.
|
Kotyzova D, Bludovska M, Eybl V. 2013. Differential influences of various arsenic compounds on antioxidant defense system in liver and kidney of rats[J]. Environmental Toxicology and Pharmacology, 36(3): 1015–1021.
DOI:10.1016/j.etap.2013.09.003
|
Li X, Huang L, Wang N, et al. 2018. Sulfur dioxide exposure enhances Th2 inflammatory responses via activating STAT6 pathway in asthmatic mice[J]. Toxicology Letters, 285: 43–50.
DOI:10.1016/j.toxlet.2017.12.020
|
Liang C, Gao Y, Zhao Y, et al. 2018. Effects of fluoride and/or sulfur dioxide on morphology and DNA integrity in rats′ hepatic tissue[J]. Biological Trace Element Research, 183(2): 335–341.
|
Meng Z. 2003. Oxidative damage of sulfur dioxide on various organs of mice:Sulfur dioxide is a systemic oxidative damage agent[J]. Inhalation Toxicology, 15(2): 181–195.
DOI:10.1080/08958370304476
|
Monaco C, Andreakos E, Kiriakidis S, et al. 2004. Canonical pathway of nuclear factor kappa B activation selectively regulates proinflammatory and prothrombotic responses in human atherosclerosis[J]. Proceedings of the National Academy of Sciences of the United States of America, 101(15): 5634–5639.
DOI:10.1073/pnas.0401060101
|
Rana T, Bera A K, Bhattacharya D, et al. 2015. Characterization of arsenic-induced cytotoxicity in liver with stress in erythrocytes and its reversibility with Pleurotus florida lectin[J]. Toxicology and Industrial Health, 31(2): 108–122.
DOI:10.1177/0748233712468026
|
Rehman K, Naranmandura H. 2012. Arsenic metabolism and thioarsenicals[J]. Metallomics, 4(9): 881–892.
DOI:10.1039/c2mt00181k
|
Sies H. 2015. Oxidative stress:a concept in redox biology and medicine[J]. Redox Biology, 4: 180–183.
DOI:10.1016/j.redox.2015.01.002
|
汤洁, 卞建民, 李昭阳, 等. 2013. 中国饮水型砷中毒区的水化学环境与砷中毒关系[J]. 生态毒理学报, 2013, 8(2): 222–229.
|
Tong L, Li K, Zhou Q X. 2015. The association between air pollutants and morbidity for diabetes and liver diseases modified by sexes, ages, and seasons in Tianjin, China[J]. Environmental Science and Pollution Research, 22(2): 1215–1219.
DOI:10.1007/s11356-014-3432-4
|
Vlahopoulos S A. 2017. Aberrant control of NF-kappa B in cancer permits transcriptional and phenotypic plasticity, to curtail dependence on host tissue:molecular mode[J]. Cancer Biology & Medicine, 14(3): 254–270.
|
王燕, 何大梽. 2017. 我国废气排放的空间分布与影响因素研究[J]. 西部论坛, 2017, 27(6): 42–48.
DOI:10.3969/j.issn.1674-8131.2017.06.006 |
周宗灿. 2015. 氧化还原信号和氧化应激/还原应激[J]. 毒理学杂志, 2015, 29(1): 1–14.
DOI:10.3867/j.issn.1000-3002.2015.01.001 |
Zhu Y P, Xi S H, Li M Y, et al. 2017. Fluoride and arsenic exposure affects spatial memory and activates the ERK/CREB signaling pathway in offspring rats[J]. Neurotoxicology, 59: 56–64.
DOI:10.1016/j.neuro.2017.01.006
|
 2019, Vol. 39
2019, Vol. 39


