2. 华中科技大学环境科学与工程学院, 武汉 430074
2. School of Environmental Science and Engineering, Huazhong University of Science and Technology, Wuhan 430074
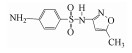
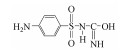
抗生素废水是一类含有难降解物质和生物毒性物质的高浓度有机废水.近年来, 由于制药工业的飞速发展, 特别是抗生素的出现给中国甚至世界的水资源带来了严重的污染, 对抗生素废水进行合理有效的治理已经迫在眉睫(林海龙等, 2012).磺胺类抗生素是一类被广泛使用的人工合成抗生素, 其中又以磺胺甲恶唑(SMZ)最为常见(Lu et al., 2018; 顾小钢, 2018; 李秀文等, 2018; 王超等, 2018).据统计, 我国自然水环境中目前已有约158种药品污染物(PPCPs)被报道检出, 其中, SMZ检出率居首位(Ray et al., 2018).
硫酸根自由基(SO4· -)的高级氧化技术是近年来刚刚兴起的一种高效、清洁的污染控制技术, SO4· -具有极高的氧化还原电位(E0=2.5~3.1 eV)(Huang et al., 2017), 能无选择性地降解矿化大部分难降解有机物.SO4· -可由过硫酸盐(PDS)的活化产生, 通常的活化手段包括紫外光、热、碱和过渡金属离子等(Wang et al., 2018).近年来, 研究者发现过渡金属氧化物同样可以高效活化PDS, 且具有活化成本低、易于控制、对环境友好等优点(Lei et al., 2015; Feng et al., 2016), 在国内外高级氧化领域受到越来越广泛的关注.
Fe2+、Cu+等低价态金属离子可以通过电子转移快速活化PDS产生SO4· -(And et al., 2004; Liang et al., 2009), 但随着体系中Fe2+和Cu+的消耗, 反应速率会越来越慢, 类似的现象也发生在基于Fe2+/H2O2的Fenton反应体系中(Xing et al., 2018).其原因在于高价态的Fe3+和Cu2+与PDS的反应速率慢, 导致Fe2+和Cu+的再生速率低, 极大地抑制了反应的持续高效进行.以Fe2+/H2O2体系为例, 如反应式(1)和(2)所示(Ma et al., 2006), Fe2+与H2O2的二级反应速率常数高达76 L · mol-1 · s-1, 比Fe3+与H2O2的反应速率常数高3~4个数量级, 结果导致体系中Fe2+不断消耗, 而Fe3+不断累积, 使Fenton反应速率越来越低, 显而易见, Fe3+向Fe2+的循环转化是体系中的限速步骤, 因此, 如何提高Fe3+的还原速率成为许多学者研究的重点.有学者发现, 有机还原剂能显著加快铁离子循环, 从而提高Fenton反应速率, 如Qin等(2015)发现, 原儿茶酸(Protocatechuic acid, PA)的加入能将Fenton体系中甲草胺(Alachlor)的降解速率提高10000倍, 同时由于PA具有络合作用, 使Fenton反应的有效pH扩展到了中性条件.同时, Lin等(2016)发现, 抗坏血酸(Ascorbic acid, AsA)能显著加快Fe2+/PDS体系中三氯丙烯的降解速率.近年来, Xing等(2018)发现, 无机金属硫化物, 如MoS2、WS2等也能高效还原Fe3+, 极大地促进Fenton反应速率, 该体系能应用于高COD的污水处理, 光辅助反应7 h后, COD可由初始的10400 mg · L-1降至360 mg · L-1, 具有极大的潜在应用价值.此外, 还原剂不仅可应用于均相反应体系中Fe3+的还原, 也能加快异相反应体系中的类Fenton反应速率, 如Qin等发现, 羟胺(HA)可大幅加快α-FeOOH/H2O2体系中铁在固液界面上的循环转化, 体系中羟基自由基(· OH)的产生速率是未加HA体系的102~104倍(Hou et al., 2017).由此可见, 还原剂的加入能加快Fe2+/Fe3+之间的循环转化, 从而大幅加快反应速率, 提高药剂利用率.但目前相关研究大多集中于还原剂对均相Fenton或异相铁氧化物/H2O2体系的强化活化, 而有关还原剂对过渡金属氧化物活化PDS的强化作用及机理研究几乎还是空白.

|
(1) |

|
(2) |
因此, 本研究选取赤铁矿(α-Fe2O3)、氧化钴(Co2O3)和氧化铜(CuO)3种过渡金属氧化物, 研究HA强化3种过渡金属氧化物活化PDS降解SMZ的反应效能及机理.首先研究不同参数条件对SMZ降解的影响, 其次探究体系中主要生成的活性氧物种, 最后检测SMZ的降解产物, 得到SMZ的可能降解路径.
2 材料与方法(Materials and methods) 2.1 试验试剂α-Fe2O3、SMZ购自上海阿拉丁试剂有限公司; CuO、PDS、HA、硫代硫酸钠(Na2S2O3)、氢氧化钠(NaOH)和硫酸(H2SO4)购自国药化学试剂有限公司; Co2O3购自上海丰顺化学科技有限公司.所有试剂均至少为分析纯, 实验所有溶液都采用超纯水(电阻率18.2 MΩ · cm-1)配制.
2.2 分析方法本研究中SMZ的浓度采用配备有紫外检测器的高效液相色谱仪(HPLC, LC-15C, 日本岛津)测定, 检测波长为270 nm, 色谱柱为Agilent C18柱(型号为ZORBAX SB-Aq, 5 μm, 4.6 mm×150 mm), 进样量为20 μL, 柱温箱温度为35 ℃, 流动相为0.1%乙酸和乙腈(40% : 60%), 流动相流速为0.7 mL · min-1.
本研究采用德国Bruker公司生产的EMX nano台式波谱仪(EPR)测定自由基, 采用DMPO作为电子自旋捕获剂.样品的具体检测参数为:微波频率9.597 GHz, 功率5.012 mW, 扫描宽度100 G, 调制频率100 G, 扫描时间30.0 s, 调制幅度1.00 G, 扫描次数4次.
本研究采用高效液相色谱-电喷雾质谱(HPLC-ESI-MS, Agilent1100, USA)检测SMZ的降解中间产物, 流动相为0.1%乙酸和乙腈(40% : 60%), 流动相流速为0.7 mL · min-1.电喷雾质谱ESI-MS中离子转移毛细管温度为300 ℃, 喷雾电压为45 kV.
2.3 实验方法实验在25 ℃下的250 mL烧杯中进行, 首先在烧杯中装入200 mL SMZ标准储备液, 用1 mmol · L-1 NaOH和H2SO4溶液调节反应液pH至6, 再加入一定量的HA和过渡金属氧化物, 最后加入一定量的PDS溶液启动反应, 采用平板磁力搅拌器搅拌.在不同时间取出1.5 mL水样经0.22 μm滤膜过滤至棕色液相瓶中, 并加入过量Na2S2O3猝灭反应, 然后采用HPLC在270 nm处对SMZ的浓度进行分析测定.实验中, 每组实验条件重复两次, 取两组实验结果的平均值进行数据分析.
3 结果与讨论(Results and discussion) 3.1 各因素对SMZ降解效果的影响 3.1.1 羟胺浓度对SMZ降解效果的影响HA作为一种强还原剂, 能加快高价态金属离子向低价态金属离子的循环转化, 促进反应的高效进行.本文首先研究了HA浓度对SMZ降解的影响规律, 结果如图 1所示.由图可知, 在α-Fe2O3/HA/PDS、CuO/HA/PDS和Co2O3/HA/PDS体系中, HA均能有效强化过渡金属氧化物对PDS的活化, 进而增加对SMZ的降解.随着HA浓度的提升, 3种体系中SMZ的降解效果均表现出先上升、后下降的趋势.以α-Fe2O3/HA/PDS体系为例, 当HA浓度从0 mmol · L-1增加到2 mmol · L-1时, SMZ的降解率由13.5%上升至31.3%, 但当HA浓度由2 mmol · L-1继续上升至4 mmol · L-1时, SMZ的降解率反而降低至25.5%.在金属离子活化PDS、H2O2等氧化剂过程中, 高价金属离子向低价金属离子的转变通常被认为是体系的限速步骤, 因而如何加快金属离子还原, 从而提高氧化剂利用率, 促进污染物降解是一个重要的研究课题.HA作为一种无机强还原剂, 能有效将高价态金属离子, 如Fe3+、Cu2+和Co3+, 还原为低价态的Fe2+、Cu+和Co2+, 从而大大增加PDS的活化效率, 加快体系中自由基的生成和SMZ的降解(Ding et al., 2016).然而, 当反应体系中HA浓度进一步提高时, 过量的HA会较快捕获SO4· -和· OH(式(3)和(4)), 从而降低SMZ的降解率(Zou et al., 2013).从图 1中可以看出, 羟胺的加入对α-Fe2O3/PDS体系的促进作用高于对CuO/PDS体系和Co2O3/PDS体系的促进作用, 这可能是由于不同过渡金属的氧化还原电位的差异, 导致不同过渡金属离子对PDS的活化能力存在差异.在探讨不同过渡金属离子活化PDS体系对2, 4-DCP降解效率的研究中, 发现不同过渡金属活化PDS降解有机污染物二氯苯酚的降解率顺序为:Co(Ⅱ)>Ru(Ⅲ)>Fe(Ⅱ)>Ce(Ⅲ)>V(Ⅲ)>Mn(Ⅱ)>Fe(Ⅲ), 同时, Co2+的氧化还原电位大于Fe2+的氧化还原电位(Wang et al., 2018).所以推测在本实验中羟胺加入使得体系中Co2+和Fe2+浓度增加, 而由于Co2+的氧化还原电位高于Fe2+的氧化还原电位, 所以形成的Co2+/PDS体系对SMZ的降解率高于Fe2+/PDS体系对SMZ的降解率.因而在本实验中, α-Fe2O3/HA/PDS、CuO/HA/PDS和Co2O3/HA/PDS体系中最佳羟胺浓度分别为2、2和0.5 mmol · L-1.
 |
| 图 1 羟胺浓度对α-Fe2O3/HA/PDS (a)、CuO/HA/PDS (b)和Co2O3/HA/PDS (c)体系降解SMZ的影响 (a:α-Fe2O3 2 g · L-1, PDS 5 mmol · L-1, SMZ 9.4 mg · L-1; b:CuO 2 g · L-1, PDS 5 mmol · L-1, SMZ 9.4 mg · L-1; c:Co2O3 0.7 g · L-1, PDS 2.5 mmol · L-1, SMZ 9.4 mg · L-1) Fig. 1 Effect of HA concentration on SMZ degradation in α-Fe2O3/HA/PDS(a), CuO/HA/PDS(b) and Co2O3/HA/PDS(c) systems |

|
(3) |

|
(4) |
在羟胺/过渡金属氧化物/过硫酸盐体系中, 过渡金属氧化物能活化PDS产生SO4· -和· OH, 从而实现对SMZ的降解.本文研究了过渡金属氧化物浓度对SMZ降解效果的影响规律, 结果如图 2所示.由图可知, 在α-Fe2O3/HA/PDS、CuO/HA/PDS和Co2O3/HA/PDS体系中, 过渡金属氧化物浓度的升高均能有效促进PDS的活化, 进而增加对SMZ的降解, 随着过渡金属氧化物浓度的提升, 3种体系中SMZ的降解均表现出上升的趋势, 以α-Fe2O3/HA/PDS体系为例, α-Fe2O3浓度从0.25 g · L-1上升至2 g · L-1时, α-Fe2O3/HA/PDS体系对SMZ的降解率从16.1%上升至24.6%.在金属离子活化PDS、H2O2等氧化剂过程中, 过渡金属氧化物与HA的相互作用形成Fe3+-HA、Cu2+-HA和Co3+-HA表面络合物, HA通过电子转移还原Fe3+、Cu2+、Co3+形成Fe2+、Cu+、Co2+, 从而使释放出的Fe2+、Cu+和Co2+活化PDS产生SO4· -和· OH降解SMZ(Lin et al., 2016).因此, 在一定浓度范围内, 过渡金属氧化物的浓度越高, 对SMZ的降解效果越好.因而在本实验中, α-Fe2O3/HA/PDS、CuO/HA/PDS和Co2O3/HA/PDS体系中最佳过渡金属氧化物浓度分别为2、2和0.7 g · L-1.
 |
| 图 2 过渡金属氧化物浓度对α-Fe2O3/HA/PDS (a)、CuO/HA/PDS (b)和Co2O3/HA/PDS (c)体系降解SMZ的影响 (a:HA 2 mmol · L-1, PDS 5 mmol · L-1, SMZ 9.4 mg · L-1; b:HA 2 mmol · L-1, PDS 5 mmol · L-1, SMZ 9.4 mg · L-1; c:HA 0.5 mmol · L-1, PDS 2.5 mmol · L-1, SMZ 9.4 mg · L-1) Fig. 2 Effect of different metal oxide concentrations on SMZ degradation inα-Fe2O3/HA/PDS(a), CuO/HA/PDS(b) and Co2O3/HA/PDS(c) systems |
PDS作为产生SO4· -和· OH的来源, 在SMZ的降解过程中起到了重要作用.本文研究了PDS浓度对SMZ降解的影响规律, 结果如图 3所示.由图可知, 在α-Fe2O3/HA/PDS和CuO/HA/PDS体系中, 随着PDS浓度从0.5 mmol · L-1逐渐上升至5 mmol · L-1, SMZ的降解率分别从5.0%和44.2%上升至17.1%和57.7%, 而在Co2O3/HA/PDS体系中, 随着PDS浓度从0.05 mmol · L-1上升至2.5 mmol · L-1, SMZ的降解率呈现出先升后降的趋势.分析认为, 在α-Fe2O3/HA/PDS和CuO/HA/PDS体系中, 当氧化剂PDS浓度小于5 mmo · L-1时, 催化剂表面活性位点未消耗完, PDS浓度是反应的限速步骤, 因此, SMZ的降解率会随着PDS浓度的升高而增大.而在Co2O3/HA/PDS体系中, 由于Co2O3表面活性位点少, 过多的PDS会与体系中的HA发生反应, 从而使SMZ的降解率下降(Feng et al., 2017).因而在本实验中, α-Fe2O3/HA/PDS、CuO/HA/PDS和Co2O3/HA/PDS体系中最佳过渡金属氧化物浓度分别为5、5和0.5 mmol · L-1.
 |
| 图 3 PDS浓度对α-Fe2O3/HA/PDS (a)、CuO/HA/PDS (b)和Co2O3/HA/PDS (c)体系降解SMZ的影响 (a:HA 2 mmol · L-1, α-Fe2O3 2 g · L-1, SMZ 9.4 mg · L-1; b:HA 2 mmol · L-1, CuO 2 g · L-1, SMZ 9.4 mg · L-1; c:HA 0.5 mmol · L-1, Co2O3 0.7 g · L-1, SMZ 9.4 mg · L-1) Fig. 3 Effects of different PDS concentrations on SMZ degradation inα-Fe2O3/HA/PDS(a), CuO/HA/PDS(b) and Co2O3/HA/PDS(c) systems |
SMZ初始浓度对其去除率也有重要影响, 如图 4所示, 3种体系中SMZ的降解率都随SMZ浓度的增加逐渐降低, 以α-Fe2O3/HA/PDS体系为例, 当SMZ浓度从9.4 mg · L-1增加到37.5 mg · L-1时, SMZ的降解率由29.8%下降至26.4%, 同时可以发现, 当SMZ初始浓度由9.4 mg · L-1上升至18.8 mg · L-1时, 其去除率下降明显.这是因为一定浓度的PDS产生的SO4· -和· OH的量是恒定的, 当SMZ浓度较低时, 与SO4· -和· OH反应的SMZ占总SMZ的比例较高, 所以对SMZ的降解率较高.因而在本实验中, α-Fe2O3/HA/PDS、CuO/HA/PDS和Co2O3/HA/PDS体系中最佳SMZ浓度均为9.4 mg · L-1.
 |
| 图 4 SMZ浓度对α-Fe2O3/HA/PDS (a)、CuO/HA/PDS (b)和Co2O3/HA/PDS (c)体系降解SMZ的影响 (a:HA 2 mmol · L-1, α-Fe2O3 2 g · L-1, PDS 5 mmol · L-1; b:HA 2 mmol · L-1, CuO 2 g · L-1, PDS 5 mmol · L-1; c:HA 0.5 mmol · L-1, Co2O3 0.7 g · L-1, PDS 2.5 mmol · L-1) Fig. 4 Effects of different SMZ concentrations on SMZ degradation in α-Fe2O3/HA/PDS(a), CuO/HA/PDS(b), Co2O3/HA/PDS(c) systems |
为了进一步确定3种体系中产生的活性自由基的种类及其作用, 本实验中采用EPR技术对体系中产生的自由基进行检测.由于体系中产生的活性自由基不稳定, 不易被直接检测, 所以在EPR实验中采用DMPO作为活性自由基捕获剂.DMPO会与体系中产生的· OH和SO4· -分别反应生成较稳定的加成产物DMPO-OH和DMPO-SO4, 进而通过EPR实验中DMPO-OH和DMPO-SO4的信号来分析体系中产生的· OH和SO4· -.
从图 5可以看出, 在α-Fe2O3/HA/PDS和Co2O3/HA/PDS降解SMZ的吸收波谱图中, 可以明显看出4个DMPO-OH特征峰(强度比例1 : 2 : 2 : 1), 证实了α-Fe2O3/HA/PDS和Co2O3/HA/PDS降解SMZ的主要活性自由基是· OH而不是SO4· -.而在CuO/HA/PDS降解SMZ体系中, 没有检测到· OH和SO4· -, 但在CuO/HA/PDS降解SMZ体系中, SMZ的降解率却能达到较高水平.Du等(2016)认为这可能是因为PDS在CuO表面形成了CuⅡ-S2O82-表面络合物, 此时PDS分子中的O—O键被拉伸, 形成一种具有较高反应活性的半活化态PDS, 进而实现对SMZ的降解, 反应原理如式(5)和(6)所示.值得注意的是, SMZ的降解并不依赖自由基的生成, 因而CuO/PDS体系降解有机物的反应是一个非自由基过程.
 |
| 图 5 α-Fe2O3/HA/PDS、CuO/HA/PDS和Co2O3/HA/PDS体系中EPR吸收波谱图 (对应DMPO-OH) Fig. 5 EPR absorption spectrum in α-Fe2O3/HA/PDS, CuO/HA/PDS and Co2O3/HA/PDS system |

|
(5) |

|
(6) |
为了确定SMZ在HA/MxOy/PDS体系中的降解机理, 本实验采用HPLC-ESI-MS技术, 测定反应15 min后, SMZ在Co2O3/HA/PDS体系降解的中间产物.分析结果表明, SMZ降解产物有8种, 表 1所示为各中间产物的质荷比、结构式等信息.
| 表 1 HPLC-ESI-MS获得的SMZ氧化中间产物 Table 1 SMZ oxidation intermediates obtained by HPLC-ESI-MS |
由表 1可以看出, 7种中间产物均为带苯环的芳香族有机物, 尤其是C2、C3、C5、C6、C7的结构是由SMZ或者SMZ的衍生物断裂产生的, 其质荷比m/z也相应的减小, 这是· OH氧化SMZ的结果.结合SMZ降解中间产物, 推测SMZ在Co2O3/HA/PDS体系的降解路径如图 6所示.
 |
| 图 6 SMZ在Co2O3/HA/PDS体系的降解路径 Fig. 6 SMZ degradation pathway in Co2O3/HA/PDS system |
由图 6可以看出, 在SMZ分子结构中, · OH的攻击部位包括氨基、不饱和碳碳双键、磺胺键.在· OH氧化过程中, · OH攻击SMZ是主导的转化途径, SMZ的电子转移是主要的氧化机理.在质谱图中, 核质比为m/z=301和m/z=284碎片的存在表明了SMZ分子中氨基被氧化为硝基, Qi等(2014)的研究产物与之相似.同时, C7(m/z=216)产物的检出表明· OH也可破坏SMZ分子中杂环上的碳碳双键, 这与· OH具有较强的亲电攻击能力有关.另外, 质谱色谱显示了其他几个碎片, 分别是m/z=175、m/z=112、m/z=107, 分别对应C1、C2、C5, 其可能是由于SMZ中磺胺键(N—S键)的断裂而产生的产物.基于以上的讨论, SMZ在Co2O3/HA/PMS体系中的降解机理可以由以下几个方面来解释:①氨基官能团的氧化衍生了硝态SMZ; ②不饱和碳碳双键的羟基化作用; ③磺胺键的断裂.
4 结论(Conclusions)1) HA的适量投加对α-Fe2O3/PDS、CuO/PDS和Co2O3/PDS 3种体系降解SMZ的促进效果明显.
2) α-Fe2O3/HA/PDA体系降解SMZ的最佳条件为:HA浓度为2 mmol · L-1, α-Fe2O3浓度为2 g · L-1, PDS浓度为5 mmol · L-1, SMZ浓度为9.4 mg · L-1; CuO/HA/PDS降解SMZ的最佳条件为:HA浓度为2 mmol · L-1, Co2O3浓度为2 g · L-1, PDS浓度为5 mmol · L-1, SMZ浓度为9.4 mg · L-1; Co2O3/HA/PDS体系降解SMZ的最佳条件为:HA浓度为0.5 mmol · L-1, Co2O3浓度为0.7 g · L-1, PDS浓度为0.5 mmol · L-1, SMZ浓度为9.4 mg · L-1.
3) α-Fe2O3/HA/PDA与Co2O3/HA/PDS体系中产生的主要活性氧物种是· OH, 而CuO/HA/PDS体系中的主要活性物种是表面络合态PDS.
4) SMZ的降解主要有3条路径:一是氨基官能团的硝基化, 二是不饱和碳碳双键的羟基加成, 三是磺胺键的断裂.
And G P A, Dionysiou D D. 2004. Radical generation by the interaction of transition metals with common oxidants[J]. Environmental Science & Technology, 38(13): 3705–3712.
|
Ding Y, Huang W, Ding Z, et al. 2016. Dramatically enhanced Fenton oxidation of carbamazepine with easily recyclable microscaled CuFeO2 by hydroxylamine:kinetic and mechanism study[J]. Separation & Purification Technology, 168: 223–231.
|
Du X, Zhang Y, Hussain I, et al. 2016. Insight into reactive oxygen species in persulfate activation with copper oxide:activated persulfate and trace radicals[J]. Chemical Engineering Journal, 313: 1023–1032.
|
Feng Y, Wu D L, Zhou Y, et al. 2017. A metal-free method of generating sulfate radicals through direct interaction of hydroxylamine and peroxymonosulfate:mechanisms, kinetics, and implications[J]. Chemical Engineering Journal, 1(2): 1–7.
|
Feng Y, Wu D, Deng Y, et al. 2016. Sulfate radical-mediated degradation of sulfadiazine by CuFeO2 rhombohedral crystal-catalyzed peroxymonosulfate:synergistic effects and mechanisms[J]. Environmental Science & Technology, 50(6): 3119–3127.
|
顾小钢. 2018. 盐酸羟胺强化Fe(Ⅲ)-EDDS/过硫酸盐处理水溶液中TCE[J]. 中国环境科学, 2018, 38(4): 1385–1390.
|
Hou X, Huang X, Jia F, et al. 2017. Hydroxylamine promoted goethite surface Fenton degradation of organic pollutants[J]. Environmental Science & Technology, 51(9): 5118–5126.
|
Huang G X, Wang C Y, Yang C W, et al. 2017. Degradation of Bisphenol A by peroxymonosulfate catalytically activated with Mn1.8Fe1.2O4 nanospheres:synergism between Mn and Fe[J]. Environmental Science & Technology, 51(21): 12611–12618.
|
李秀文, 何益得, 张巍, 等. 2018. 磺胺类抗生素对水环境的污染及生态毒理效应[J]. 环境科学与技术, 2018, 41(2): 62–67.
|
林海龙, 宋鸽, 司亮, 等. 2012. 抗生素废水生物处理法的研究进展[J]. 中国农学通报, 2012, 28(11): 258–261.
|
Lei Y, Chen C S, Tu Y J, et al. 2015. Heterogeneous degradation of organic pollutants by persulfate activated by CuO-Fe3O4:mechanism, stability, effects of pH and bicarbonate ions[J]. Environmental Science & Technology, 49(11): 6838–6845.
|
Liang C, Liang C P, Chen C C. 2009. pH dependence of persulfate activation by EDTA/Fe(Ⅲ) for degradation of trichloroethylene[J]. Journal of Contaminant Hydrology, 106(3): 173–182.
|
Lin Y T, Liang C, Yu C W. 2016. Trichloroethylene degradation by various forms of iron activated persulfate oxidation with or without the assistance of ascorbic acid[J]. Industrial & Engineering Chemistry Research, 55(8): 2302–2308.
|
Lu M, Niu X, Chen W, et al. 2018. Phosphine production in anaerobic wastewater treatment under tetracycline antibiotic pressure[J]. Journal of Environmental Sciences, 69(7): 239–250.
|
Ma J, Ma W, Song W, et al. 2006. Fenton degradation of organic pollutants in the presence of low-molecular-weight organic acids:Cooperative effect of quinone and visible light[J]. Environmental Science & Technology, 40(2): 618–624.
|
Qi C, Liu X, Lin C, et al. 2014. Degradation of sulfamethoxazole by microwave-activated persulfate:Kinetics, mechanism and acute toxicity[J]. Chemical Engineering Journal, 249: 6–14.
DOI:10.1016/j.cej.2014.03.086
|
Qin Y, Song F, Ai Z, et al. 2015. Protocatechuic acid promoted alachlor degradation in Fe(Ⅲ)/H2O2 Fenton system[J]. Environmental Science & Technology, 49(13): 7948–7956.
|
Ray S K, Dhakal D, Lee S W. 2018. Insight into sulfamethoxazole degradation, mechanism, and pathways by AgBr-BaMoO4 composite photocatalyst[J]. Journal of Photochemistry and Photobiology A:Chemistry, 364: 686–695.
DOI:10.1016/j.jphotochem.2018.07.007
|
Wang J, Wang S. 2018. Activation of persulfate (PS) and peroxymonosulfate (PMS) and application for the degradation of emerging contaminants[J]. Chemical Engineering Journal, 334: 1502–1517.
DOI:10.1016/j.cej.2017.11.059
|
王超, 姚淑美, 彭叶平, 等. 2018. 高级氧化法处理抗生素废水研究进展[J]. 化工环保, 2018, 38(2): 135–140.
DOI:10.3969/j.issn.1006-1878.2018.02.002 |
Xing M, Xu W, Dong C, et al. 2018. Metal sulfides as excellent co-catalysts for H2O2 decomposition in advanced oxidation processes[J]. Chemical Engineering Journal, 4(6): 1359–1372.
|
Zou J, Ma J, Chen L, et al. 2013. Rapid acceleration of Ferrous iron/peroxymonosulfate oxidation of organic pollutants by promoting Fe(Ⅲ)/Fe(Ⅱ) cycle with hydroxylamine[J]. Environmental Science & Technology, 47(20): 11685–11691.
|
 2019, Vol. 39
2019, Vol. 39