2. 中国科学院生态环境研究中心水污染控制实验室, 北京 100085;
3. 中国科学院大学, 北京 100049
2. Department of Water Pollution Control Technology, Research Center for Eco-Environmental Science, Chinese Academy of Sciences, Beijing 100085;
3. University of Chinese Academy of Sciences, Beijing 100049
以厌氧技术为核心的工艺路线中, COD通过厌氧工艺去除后, 以厌氧氨氧化进行脱氮成为低能耗污水处理技术的可行途径(Ma et al., 2016).在厌氧氨氧化工艺(anaerobic ammonia oxidation, ANAMMOX)中, 厌氧氨氧化菌以氨氮为电子供体、亚硝态氮为电子受体, 将两者在厌氧条件下转化为氮气和少量硝态氮(式(1))(Graaf et al., 1995; Strous et al., 1998).获得比例相应的亚硝态氮和解决反应产生的硝酸盐累积是厌氧氨氧化技术工程应用的关键.传统上, 通过好氧过程的曝气控制等方法实现部分亚硝化(partial nitritation, PN)来提供亚硝态氮(Kartal et al., 2010; Lackner et al., 2014), Cao等(2013)采用部分反硝化(partial denitrification, PD)途径, 通过调节碳氮比和碳源类型对接种泥进行驯化, 可以实现80%以上亚硝态氮累积, Si等(2018)通过PD途径在中试序批式反应器(sequencing batch reactor, SBR)实现了快速稳定的亚硝态氮累积, 这为厌氧氨氧化技术中亚硝态氮的来源和解决硝酸盐累积提供了一种新途径.

|
(1) |
反硝化细菌作为异养菌, 利用碳源进行产能和细胞合成, 同时以碳源为电子供体、硝酸盐氮为电子受体完成反硝化反应.因此不同有机物作为碳源被利用的程度、代谢产物均不相同, 其对反硝化过程产生的影响亦不相同(邵留等, 2007; Ge et al., 2012).研究表明, 厌氧消化液有机物组分中挥发性脂肪酸(volatile fatty acids, VFAs)作为碳源的反硝化, 效果很理想(徐亚同, 1995; Torà et al., 2011), 但厌氧消化不理想或短程发酵的沼液中, 有机物成分可能包含的中长链脂肪酸(燕艳等, 2013; 张永梅等, 2017)对反硝化性能影响却不清楚, 有待深入研究.
因此, 本文以两株筛选出的具有反硝化能力的假单胞菌为研究对象, 通过批次试验, 考察和比较中长链脂肪酸、城镇污水处理厂常用反硝化碳源甲醇、乙醇和葡萄糖对这两株假单胞菌反硝化过程氮素转化特性的影响, 明确碳源类型对反硝化途径及其过程中亚硝酸盐累积的影响, 在丰富反硝化细菌种质资源的同时, 以期为该菌在部分反硝化-厌氧氨氧化组合工艺脱氮中的应用提供科学依据.
2 材料与方法(Materials and methods) 2.1 实验材料菌株分离自某生活污水处理厂CASS工艺活性污泥池, 污水厂进水COD为300 mg · L-1, 总氮浓度为80 mg · L-1, 氨氮浓度为78.3 mg · L-1.出水COD为24 mg · L-1, 总氮浓度为13.2 mg · L-1, 氨氮浓度为0.2 mg · L-1.
2.2 培养基菌株筛选及培养试验使用培养基配方见表 1.液体反硝化培养基(denitrification medium, DM)以硝酸钾为唯一氮源, 配制硝酸盐浓度为100 mg · L-1(以N计), C/N指培养基中TC/TN(分子质量比), 配制C/N=15, 配制培养基在使用前调整pH=7.0~7.1, 121 ℃高压蒸汽灭菌15 min.
| 表 1 试验使用培养基配方 Table 1 The recipe for growth medium |
取10 mL活性污泥于装有90 mL灭菌的1 × PBS的150 mL锥形瓶中, 加入适量灭菌的玻璃珠, 30 ℃恒温摇床上以160 r · min-1培养1 h, 梯度稀释液涂布到BTB培养基上, 于30 ℃培养1~2 d.用接种环挑取周围培养基出现蓝色的单菌落, 多次经BTB固体平板划线纯化获得纯菌株, 在DM培养基中进行硝酸盐反硝化功能验证后, 开展后续试验研究.
筛选出的纯菌采用16S rDNA进行鉴定, PCR扩增引物采用细菌通用引物27f (5′-AGAGTTTGATCMTGGCTCAG-3′)和1492r (5′-GGTTACCTTGTTACGACTT-3′).PCR扩增反应体系为50 μL:DNA模板0.2 μL, 2 × Taq Master Mix 25 μL, 27f引物1 μL, 1492r引物1 μL, ddH2O 22.8 μL.在PCR扩增仪(Bio-Rad, C1000 Touch)上进行PCR扩增反应:95 ℃预变性10 min, 95 ℃变性45 s, 54.5 ℃退火30 s, 72 ℃延伸1 min, 变性-退火-延伸循环30次, 72 ℃延伸7 min.PCR扩增产物(约1400 bp)经2.0%琼脂糖凝胶电泳(GelRed染色)确定条带后, 送至北京博迈德基因技术有限公司进行测序分析, 测序结果提交至GenBank进行BLAST分析, 利用MEGA 7.0中的Neighbor-joining算法进行系统发育树的构建.
扫描电子显微镜(SEM)观察:取纯菌菌液至LB液体培养基中培养至浑浊(30 ℃, 160 r · min-1), 将菌液在4000 r · min-1条件下离心5 min, 弃去上清液, 使用2.5%的戊二醛溶液于4 ℃冰箱固定1.5 h后, 分别使用浓度为50%、70%、80%、90%、100%的乙醇对菌体进行脱水, 每次10~15 min; 之后分别使用乙醇/乙酸异戊酯1 : 1溶液和纯乙酸异戊酯进行置换, 每次15 min; 对置换后的菌体进行临界点干燥和喷金后, 通过扫描电子显微镜(HITACHI, S-3000N)拍摄观察菌株细胞形态.
2.4 碳源类型对反硝化性能的影响在考察碳源类型对反硝化性能的影响研究中, 本研究分别用甲醇、乙醇、葡萄糖、己酸钠、辛酸钠和壬二酸代替液体DM中的六水丁二酸钠, 液体DM中的甲醇、乙醇、葡萄糖、己酸钠、辛酸钠和壬二酸的初始浓度分别为4.01、2.88、3.75、2.88、2.60和2.61 g · L-1.
按照体积比1%的量(菌数在108 cfu · mL-1数量级)将PBS清洗后的菌体接种于装有100 mL灭菌的不同碳源液体DM中, 反应容器为无菌透气封口膜封口的150 mL玻璃锥形瓶, 于恒温振荡培养箱中培养(30 ℃、50 r · min-1), 每组试验设置3个平行, 1个空白对照.定时取样, 每次取样4 mL, 用于测定菌体生长情况、硝酸盐氮、亚硝酸盐氮、总氮和COD变化(曾庆武等, 2008; 康鹏亮等, 2018).
菌株利用不同碳源反硝化的亚硝酸盐累积动力学模型与Gompertz模型相似度较大, 故本研究采用Gompertz修正模型(Miao et al., 2014; 丁伟军, 2018)进行拟合分析.

|
(2) |
式中, S指某一时刻亚硝酸盐浓度(mg · L-1); Sm指亚硝酸盐浓度最大值(mg · L-1); Rm指亚硝酸盐最大累积速率(mg · L-1 · h-1); t0指迟滞时间(h); t指反应时间(h); e是数学常数.
菌株生长过程符合典型的微生物生长曲线迟滞期-对数期-稳定期的部分亦可使用Gompertz修正模型进行模拟(式(3)).

|
(3) |
式中, D指某一时刻菌密度OD600, Dm指菌密度OD600最大值; Gm指最大生长速率(h-1); t0指迟滞时间(h); t指反应时间(h).
2.5 分析方法硝酸盐:紫外分光光度法, 亚硝酸盐:N-(1-萘基)-乙二胺光度法, 总氮:碱性过硫酸钾消解紫外分光光度法(国家环境保护总局2002), COD:HACH COD试剂.菌体生长的测定采用光电比浊法, 使用分光光度计测定悬浮菌液在600 nm波长处的光密度(optical density, OD)OD600 (沈萍等, 2007).仪器采用HACH DR6000紫外/可见分光光度计.
反硝化功能基因:反硝化过程及关键功能基因如式(3)所示(Philippot, 2002), 其中narG基因编码膜结合硝酸盐还原酶, 能够催化硝酸盐还原为亚硝酸盐, 是反硝化过程的第一步; nirS和nirK基因编码亚硝酸盐还原酶, 将亚硝酸盐还原为NO, 这是反硝化过程中的限速步骤, 因此nir基因被认为是区分反硝化和其它氮还原过程的关键基因(Heylen et al. 2006).nosZ基因编码的氧化亚氮还原酶能够催化N2O转化为N2.

|
(4) |
以菌株的DNA为模板, 分别以3种反硝化功能基因(narG、nirS和nosZ)为扩增基因(引物序列见表 2), 得到的PCR产物用2.0%的琼脂糖凝胶电泳进行检测.
| 表 2 反硝化功能基因的扩增引物和序列 Table 2 Primers and sequences of target denitrifying functional genes |
通过平板划线纯化和初筛, 筛选出两株在DM液体培养基生长良好并对硝态氮具有良好去除效果的菌株W-22和W-39, 这两株菌在固体培养基上的培养特征和SEM分析如图 1所示.W-22菌落略呈黄色, 圆形凸起, 表面光滑, 细胞为杆状, 大小为(1.0~1.2) μm × (0.5~0.6) μm.W-39菌落黄色, 边缘不整齐, 表面光滑, 细胞为杆状, 大小为(1.5~2.0) μm × (0.4~0.5) μm.
 |
| 图 1 菌株W-22和W-39在固体培养基上的形态和SEM分析 Fig. 1 Morphology on the solid medium and SEM images of W-22 and W-39 |
菌株W-22和W-39的16S rDNA测序分别得到1405 bp和1404 bp的DNA序列, 将序列上传至NCBI进行BLAST, 结果显示菌株W-22与Pseudomonas veronii DSM 11331T(维罗尼假单胞菌)相似性最高, 为99.72%, 菌株W-39与Pseudomonas alcaliphila JCM 10630T(嗜碱假单胞菌)相似性最高, 为99.93%.在此基础上, 分别选取与W-22和W-39同源性最相近的6株标准菌, 利用MEGA 7, 以N-J法构建系统发育树如图 2所示, W-22与Pseudomonas veronii在同一分支, W-39与Pseudomonas alcaliphila在同一分支, 可初步鉴定W-22为维罗尼假单胞菌, W-39为嗜碱假单胞菌.
 |
| 图 2 菌株W-22和W-39基于16S rDNA的系统发育树 Fig. 2 Phylogenetic tree of strain W-22, W-39 and other related strains based on the 16S rDNA gene sequences |
菌株W-22和菌株W-39在不同碳源条件下反硝化脱氮效果和生长曲线分别如图 3和图 4所示.
 |
| 图 3 菌株W-22利用不同碳源的反硝化效果 (a.甲醇, b.乙醇, c.葡萄糖, d.己酸钠, e.辛酸钠, f.壬二酸) Fig. 3 Denitrification performance of W-22 using different carbon resources (a. methanol, b. ethanol, c. glucose, d. sodium caproate, e. sodium caprylate, f. anchoic acid) |
 |
| 图 4 菌株W-39利用不同碳源的反硝化效果 (a.甲醇、b.乙醇、c.葡萄糖、d.己酸钠、e.辛酸钠、f.壬二酸) Fig. 4 Denitrification performance of W-39 using different carbon resources (a. methanol, b. ethanol, c. glucose, d. sodium caproate, e. sodium caprylate, f. anchoic acid) |
不同常规碳源条件下, 两株细菌表现出3种硝酸盐反硝化方式.
① 不利用.在以甲醇为碳源的培养基中(图 3a, 4a), 72 h内菌株W-22和W-39的OD600和硝酸盐浓度基本不发生变化, 可以认为这两株菌不能利用甲醇进行生长和反硝化, 这可能与碳源的性质和微生物体内的代谢过程有关(邵留等, 2007; 王淑莹等, 2009), 理论上说, 碳源分子越小, 反硝化细菌利用越好, 但甲醇需经过降解转化为甲酸, 然后才能被反硝化细菌利用(徐亚同, 1994).
② 硝酸盐完全反硝化.在以乙醇为碳源的培养基中(图 3b), 初始36 h, W-22的细菌生长和硝酸盐浓度变化并不显著, 随着反应的进行, OD600从0.14增加到1.32, 菌体的生长与氮的去除趋势基本保持一致, 硝酸盐和总氮浓度分别降至0.26 mg · L-1和24.34 mg · L-1, 去除率分别为99.73%和75.68%, 在第60 h细菌生长速率最快时, 发生短暂但浓度不高的亚硝酸盐累积, 此时亚硝酸盐浓度为4.55 mg · L-1, 可以认为W-22利用乙醇进行了完全反硝化.
③ 硝酸盐部分反硝化, 出现亚硝酸盐积累.W-39利用乙醇进行反硝化(图 4b), W-39菌密度OD600从0.06均匀平缓增长至0.31, 在初始24 h, 硝酸盐浓度从99.52 mg · L-1迅速降至3.64 mg · L-1, 亚硝酸盐浓度迅速上升至峰值81.77 mg · L-1, 随着反应的进行, 总氮和亚硝酸盐浓度呈同步下降趋势, 最终分别降至62.54 mg · L-1和58.39 mg · L-1.W-22和W-39利用葡萄糖进行反硝化(图 3c, 4c), 都在较短时间内完成硝酸盐到亚硝酸盐的转化, 并维持较高的亚硝酸盐累积浓度, (1)W-22:在初始12 h, 菌密度OD600从0.02迅速增加到0.71, 此后OD600基本维持不变, 在初始36 h, 硝酸盐浓度从94.44 mg · L-1下降至2.83 mg · L-1, 亚硝酸盐浓度迅速上升至56.57 mg · L-1, 在此之后硝酸盐和亚硝酸盐浓度基本不变; (2)W-39:菌密度OD600从0.06均匀平缓增长至0.34, 在初始20 h, 硝酸盐浓度从100.61 mg · L-1迅速降至4.46 mg · L-1, 亚硝酸盐浓度迅速上升至峰值80.16 mg · L-1, 此后总氮和亚硝酸盐浓度变化不大.这与Gómez等(2000)和阎宁等(2002)的研究结果相一致, 葡萄糖是活细胞的能量来源和新陈代谢中间产物, 可以直接进入三羧酸循环, 因此, 细菌能够很好地利用葡萄糖作为碳源进行各种生理活动, 但糖类物质作为碳源时更容易出现亚硝酸盐累积的情况.
3.2.2 中长链脂肪酸不同中长链脂肪酸碳源条件下, 两株细菌表现出两种硝酸盐反硝化方式.
① 不利用.W-22在以己酸钠为碳源的培养基中(图 3d), W-22和W-39在以壬二酸为碳源的培养基中(图 3f, 4f), 在72 h内OD600和硝酸盐浓度基本不发生变化, 可以认为菌株W-22不能利用己酸钠生长和进行反硝化, 菌株W-22和W-39不能利用壬二酸生长和进行反硝化, 这与两株菌的标准菌株文献中的生理生化描述相一致(Palleroni et al., 1970; Elomari et al., 1996).
② 硝酸盐部分反硝化, 出现亚硝酸盐积累.W-39在以己酸钠为碳源的培养基中, 菌密度OD600始终在0.04~0.06之间(图 4d), 随着硝酸盐浓度从100.04 mg · L-1降至18.478 mg · L-1, 亚硝酸盐浓度逐渐升高至72.34 mg · L-1.W-22和W-39利用辛酸钠进行反硝化的特性比较相近(图 3e, 4e), 都出现较长的反应迟滞期, 期间硝酸盐浓度变化不大, 从第36 h才出现硝酸盐降解和亚硝酸盐累积, ①W-22:在36~72 h, 菌密度OD600从0.06增长至0.42, 硝酸盐和总氮浓度分别从94.98 mg · L-1和95.53 mg · L-1降至50.79 mg · L-1和61.34 mg · L-1, 亚硝酸盐浓度上升至6.60 mg · L-1; ②W-39:菌密度OD600始终维持在0.04~0.06之间, 在36~72 h, 硝酸盐浓度迅速从99.51 mg · L-1降至3.87 mg · L-1, 亚硝酸盐浓度迅速上升至86.83 mg · L-1.
3.2.3 碳源类型对亚硝酸盐累积动力学参数的影响研究表明, 碳源类型对菌株反硝化性能的影响存在明显差异.本研究采用Gompertz修正模型对菌株利用不同碳源进行反硝化的亚硝酸盐累积情况进行拟合分析(表 3), ①W-22和W-39利用葡萄糖进行反硝化, 亚硝酸盐累积的迟滞期t0为W-22>W-39, 亚硝酸盐最大累积速率Rm为W-39>W-22, 亚硝酸盐累积浓度最大值Sm为W-39>W-22, W-39优于W-22;②W-22和W-39利用辛酸钠进行反硝化, 亚硝酸盐累积的迟滞期t0明显较长, W-39的亚硝酸盐最大累积速率Rm为7.17 mg · L-1 · h-1, 亚硝酸盐累积浓度最大值Sm为86.83 mg · L-1, 显著优于W-22.W-22利用葡萄糖产生亚硝酸盐累积的效果显著优于对辛酸钠的利用; W-39对不同碳源的利用结果如下:迟滞期t0为辛酸钠>乙醇>葡萄糖>己酸钠, 最大累积速率Rm为葡萄糖>辛酸钠>乙醇>己酸钠, 亚硝酸盐累积浓度最大值Sm为辛酸钠>乙醇>葡萄糖>己酸钠.
| 表 3 菌株W-22和W-39累积亚硝酸盐动力学参数 Table 3 Kinetic parameters of nitrite accumulation by the strain W-22 and W-39 |
两株菌利用不同碳源表现出3种生长情况.
① 菌密度很低且变化不大:W-39利用己酸钠和辛酸钠进行反应过程中, 菌密度始终维持在0.04~0.06之间, 菌体生长不明显.
② 菌密度增长均匀平缓:W-39利用乙醇和葡萄糖进行反应过程中, 菌密度增长均匀平缓, 没有明显的时期划分.
③ 菌密度增长有明显的时期变化:菌株生长过程符合典型的微生物生长曲线迟滞期-对数期-稳定期的部分使用Gompertz修正模型进行模拟分析(表 4).W-22利用乙醇和辛酸钠进行反硝化时, 菌体生长经过较长的迟滞期后进入对数期; W-22利用葡萄糖进行反硝化时, 菌体很快进入对数期, 随后进入稳定期.菌体生长与氮转化趋势基本保持一致.
| 表 4 菌株W-22和W-39菌体生长动力学参数 Table 4 Kinetic parameters of cell growth of the strain W-22 and W-39 |
反硝化功能基因narG、nirS和nosZ均从W-22和W-39的基因组中得到扩增(图 5), 这表明两株菌都具有反硝化全过程的功能基因, 排除了菌株本身不具有反硝化功能的情况, 在本试验条件下, 碳源类型可能是影响反硝化进程的重要因素.碳源可能通过影响菌的生长和酶的活性, 实现对反硝化进程的控制, 因此, 要通过进一步的研究确定碳源种类及浓度对反硝化过程的影响.
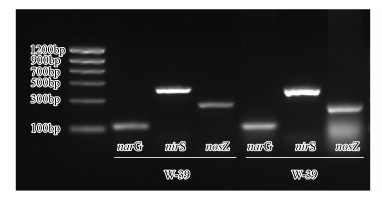 |
| 图 5 反硝化功能基因narG、nirS和nosZ的扩增 Fig. 5 Amplification of denitrification functional genes narG, nirS and nosZ |
1) 分离筛选得到两株反硝化菌W-22和W-39, 经形态学观察和16S rDNA序列分析鉴定为维罗尼假单胞菌(Pseudomonas veronii)和嗜碱假单胞菌(Pseudomonas alcaliphila).W-22和W-39都可以扩增出反硝化功能基因narG、nirS和nosZ.
2) 对于常规碳源甲醇、乙醇和葡萄糖:W-22利用乙醇可以实现完全反硝化; W-22利用葡萄糖、W-39利用乙醇和葡萄糖进行反硝化可以实现较高浓度的亚硝酸盐累积.
3) 对于中长链脂肪酸碳源己酸钠、辛酸钠和壬二酸:W-22不能利用己酸钠和壬二酸、W-39不能利用壬二酸进行反硝化; W-22和W-39利用辛酸钠进行反硝化出现较长的反应迟滞期, 后期伴随硝酸盐浓度降低和亚硝酸盐浓度升高; W-39利用己酸钠进行反硝化, 菌密度较低且变化不大, 硝酸盐浓度逐渐降低, 亚硝酸盐浓度逐渐升高.
4) 碳源类型可能是影响纯菌反硝化进程的重要因素, 该两株菌将为部分反硝化-厌氧氨氧化组合工艺脱氮中的应用提供科学依据和菌源保障.
Cao S, Wang S, Peng Y, et al. 2013. Achieving partial denitrification with sludge fermentation liquid as carbon source:the effect of seeding sludge[J]. Bioresource Technology, 149: 570–574.
DOI:10.1016/j.biortech.2013.09.072
|
丁伟军. 2018. 纤维素酶解反应动力学的研究[J]. 化工与医药工程, 2018, 39(4): 8–14.
|
Elomari M, Coroler L, Hoste B, et al. 1996. DNA relatedness among pseudomonas strains isolated from natural mineral waters and proposal of pseudomonas veronii sp.nov[J]. International Journal of Systematic and Evolutionary Microbiology, 46(4): 1138–1144.
|
Gómez M A, González-López J, Hontoria-Garci A E. 2000. Influence of carbon source on nitrate removal of contaminated groundwater in a denitrifying submerged filter[J]. Journal of Hazardous Materials, 80(1): 69–80.
|
国家环境保护总局. 2002. 水和废水监测分析方法[M]. 北京: 中国环境科学出版社.
|
Ge S, Peng Y, Wang S, et al. 2012. Nitrite accumulation under constant temperature in anoxic denitrification process:The effects of carbon sources and COD/NO3-N[J]. Bioresource Technology, 114: 137–143.
DOI:10.1016/j.biortech.2012.03.016
|
Graaf A A V D, Mulder A, Bruijn P D, et al. 1995. Anaerobic oxidation of ammonium is a biologically mediated process[J]. Applied & Environmental Microbiolog, 61(4): 1246.
|
Heylen K, Gevers D, Vanparys B, et al. 2006. The incidence of nirS and nirK and their genetic heterogeneity in cultivated denitrifiers[J]. Environmental Microbiology, 8(11): 2012–2021.
DOI:10.1111/emi.2006.8.issue-11
|
Kartal B, Kuenen J G, van Loosdrecht M C M. 2010. Sewage Treatment with Anammox[J]. Science, 328(5979): 702–703.
DOI:10.1126/science.1185941
|
康鹏亮, 陈胜男, 黄廷林, 等. 2018. 好/厌氧条件下反硝化细菌脱氮特性与功能基因[J]. 环境科学, 2018, 39(8): 3789–3796.
|
Lackner S, Gilbert E M, Vlaeminck S E, et al. 2014. Full-scale partial nitritation/anammox experiences——an application survey[J]. Water Research, 55: 292–303.
DOI:10.1016/j.watres.2014.02.032
|
Ma B, Wang S, Cao S, et al. 2016. Biological nitrogen removal from sewage via anammox:Recent advances[J]. Bioresource Technology, 200: 981–990.
DOI:10.1016/j.biortech.2015.10.074
|
Miao H, Wang S, Zhao M, et al. 2014. Codigestion of Taihu blue algae with swine manure for biogas production[J]. Energy Conversion & Management, 77(1): 643–649.
|
Palleroni N J, Doudoroff M, Stanier R Y, et al. 1970. Taxonomy of the aerobic Pseudomonads:the properties of the pseudomonas stutzeri group[J]. Microbiology, 60(2): 215–231.
|
Philippot L. 2002. Denitrifying genes in bacterial and Archaeal genomes[J]. BBA-Gene Structure and Expression, 1577(3): 355–376.
DOI:10.1016/S0167-4781(02)00420-7
|
Si Z, Peng Y, Yang A, et al. 2018. Rapid nitrite production via partial denitrification:pilot-scale operation and microbial community analysis[J]. Environmental Science:Water Research & Technology, 4(1): 80–86.
|
Strous M, Heijnen J J, Kuenen J G, et al. 1998. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms[J]. Applied Microbiology and Biotechnology, 50(5): 589–596.
DOI:10.1007/s002530051340
|
邵留, 徐祖信, 尹海龙. 2007. 污染水体脱氮工艺中外加碳源的研究进展[J]. 工业水处理, 2007, 27(12): 10–14.
|
沈萍, 陈向东. 2007. 微生物学实验[M]. 北京: 高等教育出版社.
|
Torà J A, Baeza J A, Carrera J, et al. 2011. Denitritation of a high-strength nitrite wastewater in a sequencing batch reactor using different organic carbon sources[J]. Chemical Engineering Journal, 172(2/3): 994–998.
|
王淑莹, 殷芳芳, 侯红勋, 等. 2009. 以甲醇作为外碳源的生物反硝化[J]. 北京工业大学学报, 2009, 35(11): 1521–1526.
DOI:10.11936/bjutxb2009111521 |
徐亚同. 1994. 不同碳源对生物反硝化的影响[J]. 环境科学, 1994(2): 29–32+44+93.
DOI:10.3321/j.issn:1001-6929.1994.02.010 |
徐亚同. 1995. 挥发性脂肪酸碳源生物反硝化研究[J]. 华东师范大学学报(自然科学版), 1995(2): 70–76.
|
阎宁, 金雪标, 张俊清. 2002. 甲醇与葡萄糖为碳源在反硝化过程中的比较[J]. 上海师范大学学报(自然科学版), 2002(3): 41–44.
DOI:10.3969/j.issn.1000-5137.2002.03.009 |
燕艳, 邹德勋, 王小伟, 等. 2013.餐厨垃圾厌氧消化残余物污染特征分析[C]. 2013中国环境科学学会学术年会, 昆明
http://cpfd.cnki.com.cn/Article/CPFDTOTAL-HJKP201308006405.htm |
张永梅, 王晓昌, 程喆, 等. 2017. 厨余垃圾短程发酵产物的性质及其反硝化性能[J]. 环境工程学报, 2017, 11(5): 3017–3023.
|
曾庆武, 梁运祥, 葛向阳. 2008. 反硝化细菌的分离筛选及其反硝化特性的初步研究[J]. 华中农业大学学报, 2008, 27(5): 616–620.
DOI:10.3321/j.issn:1000-2421.2008.05.009 |
 2019, Vol. 39
2019, Vol. 39


