随着工业的快速发展, 重金属污染成为环境保护领域的热点与难点问题.重金属铜污染广泛产生于电镀、印刷电路板和印染等多种行业(Fu et al., 2012;汤雨林等, 2018), 具有毒性大、难降解、易生物富集等特点, 并对人体及其他生物有强烈的“三致”效应, 因而对人体健康和生态环境造成了严重的威胁.鉴于其危害性, 我国将铜列为工业点源排放的优先控制污染物, 企业总铜排放浓度限值为1.0 mg · L-1(GB25467—2010).因在电镀、印刷电路板和印染等工艺中大量使用乙二胺四乙酸(EDTA)、氨三乙酸(NTA)、柠檬酸、酒石酸等化学络合剂, 导致废水中的铜通常与共存的有机配体形成络合物(谢丽萍等, 2012;Xu et al., 2015).铜络合物结构稳定, 难以被化学沉淀、化学混凝、铁屑还原法等常规处理方法去除(Wu et al., 2013; Xu et al., 2015).
先采用高级氧化法破坏络合结构(破络), 而后利用沉淀或吸附等常规方法去除或回收解离出来的重金属是目前重金属络合废水处理的主要策略.Fenton氧化(Lin et al., 2015)、臭氧氧化(Huang et al., 2016)、UV/H2O2(Lan et al., 2016)、UV/过硫酸盐(PS)(Xu et al., 2016)、光催化氧化(Madden et al., 2016)和光电催化氧化(Zhao et al., 2014)等高级氧化法是当前研究较多的破络方法. Fenton氧化存在H2O2利用率低、产铁泥量大等不足; 臭氧氧化、UV/H2O2和UV/PS处理络合重金属废水时氧化剂投量大, 且处理效率易受水体背景组分的影响; 光催化氧化、光电催化氧化等方法受催化材料性能、能耗、反应器构造等因素的限制, 目前还停留在实验室阶段.因此, 发展高效、经济的络合重金属废水处理新技术显得尤为迫切.
UV/氯是近年来兴起的一种新型高级氧化技术, 可同时产生羟基自由基(HO ·)和活性氯(如Cl ·、Cl2· -)等多种活性氧化物质(Fang et al., 2014; Wu et al., 2016).研究表明(Li et al., 2016; Huang et al., 2019), UV/氯在酸性、中性pH下以Cl ·和HO ·两者占主导, 而在碱性pH下以Cl ·占主导. Cl ·是一种选择性强氧化剂, 其氧化还原电位E=2.47 V, 可通过单电子转移、夺氢和加成等方式快速氧化富含羧基或氨基的有机物(如苯甲酸、腐殖酸和卡马西平)(Fang et al., 2014; Li et al., 2016; Wang et al., 2016), 因而对氨羧或羟羧-重金属络合物具有破络潜力.本课题组近期利用自由基捕获剂、自由基指示物、电子顺磁共振等方法证实, UV/氯在碱性pH下主要依靠Cl ·以扩散控制速率(~1010 L · mol-1 · s-1)快速降解Cu-EDTA, 同时利用碱性NaClO溶液自身富含的OH-实现破络后Cu的同步沉淀去除(Huang et al., 2019).基于非选择性的强氧化剂HO ·也可有效破坏Cu-EDTA、Cu-柠檬酸等络合物的络合结构, 反应速率常数达108~109 L · mol-1 · s-1 (Buxton et al., 1988;Cyris et al., 2013; Huang et al., 2016), 显然, 在酸、中性pH下UV/氯产生的HO ·也会参与破络, 但其贡献及与共存的Cl ·共同破络的特性并不清楚.因此, 有必要进一步研究UV/氯在酸、中性pH下的破络性能与机理.
基于此, 本文首先对比研究酸性pH下UV/氯降解Cu-EDTA、Cu-柠檬酸、Cu-酒石酸和Cu-NTA等多种铜络合物的效果; 其次, 以Cu-EDTA为代表物, 考察初始NaClO与初始Cu物质的量比([NaClO]0/[Cu]0)、溶液初始pH、共存物等因素对UV/氯破络性能的影响, 并通过自由基捕获实验、竞争动力学和降解产物分析破络的活性氧化物种和Cu-EDTA降解路径; 最后, 探讨UV/氯处理实际络合铜废水的可行性.
2 材料与方法(Materials and methods) 2.1 实验试剂Cu-EDTA(C10H12N2O8Na2Cu)、苯甲酸(C6H5COOH, BA)、硝基苯(C6H5NO2, NB)和腐殖酸(C9H9NO6)均为ACS纯度, 购于Sigma-Aldrich公司; NTA(C6H9NO6)、柠檬酸钠(C6H5O7Na3 · 2H2O)、酒石酸钠(C4H4O6Na2 · 2H2O)、氯化铜(CuSO4 · 5H2O)、盐酸(HCl)和氢氧化钠(NaOH)均为分析纯, 购于国药集团化学试剂有限公司; 叔丁醇(C4H10O2, TBA)和次氯酸钠溶液(NaClO, 6%~14%活性氯)均为分析纯, 购于阿拉丁试剂有限公司.实验用水为超纯水(Millipore, 18.2 MΩ · cm).
2.2 实验步骤本研究的光照实验和无光照实验均在自制的内照式石英玻璃反应器中进行, 以低压汞灯(28 W, 主波长253.7 nm)为光源.反应器由硼硅酸玻璃圆筒(有效容积500 mL)和内置的石英冷阱构成, 汞灯置于石英冷阱内, 其中, 石英冷阱内外壁之间为冷却循环水, 石英冷阱与圆筒之间为反应溶液.辐照实验开始前, 紫外灯管先预热30 min, 开启循环冷却水, 反应温度控制在(25.0±0.2) ℃.然后, 将模拟铜络合物溶液或实际络合铜废水加入光照反应器中, 开启磁力搅拌, 按预先设定的[NaClO]0/[Cu]0条件投加NaClO溶液, 溶液初始pH用0.1 mol · L-1 HCl或NaOH溶液调节.在预先设定的时间间隔内取样, 以1 mol · L-1的Na2SO3溶液作为终止剂, 加入适量NaOH溶液调节pH值至11.0使Cu2+沉淀, 之后样品用0.45 μm滤膜过滤后分析Cu、TOC或Cu-EDTA的剩余浓度.所有实验至少重复两次, 计算实验数据的平均值和标准误差.
2.3 实验仪器及分析方法pH测定使用精密pH计(PB-10, 赛多利斯).有效氯浓度采用N, N二乙基对苯二胺(DPD)分光光度法测定(国家环境保护总局《水和废水监测分析方法》委会编, 2002). Cu-EDTA浓度及其降解产物采用高效液相色谱(E2695, Waters)进行分析, 分析条件:色谱柱为Sunfire C18柱, 流动相为甲醇/甲酸-甲酸钠-四正丁基溴化铵缓冲溶液(15 mmol · L-1甲酸、5 mmol · L-1甲酸钠和1 mmol · L-1四正丁基溴化铵)(体积比为45 : 55), 流速为1 mL · min-1, 检测波长为258 nm. Cu含量使用原子吸收分光光谱仪(AA800, PE)测定. TOC浓度采用总有机碳分析仪(TOC-V CPN, 岛津)检测.
3 结果与讨论(Results and discussion) 3.1 UV/氯降解铜络合物的效果在铜络合物浓度为0.30 mmol · L-1, [NaClO]0/[Cu]0为60或150, 溶液初始pH为5.0的条件下, 比较研究了UV单独照射、氯单独氧化及UV/氯体系对Cu-EDTA、Cu-柠檬酸、Cu-酒石酸和Cu-NTA的破络效果, 结果如图 1所示.由图 1a可以看出, UV辐照2 h对Cu的去除不起作用, 主要是因为羟羧或氨羧-铜络合物的光活性低, UV照射不足以使Cu-络合物发生破络而释放出Cu2+.氯单独氧化对Cu-EDTA和Cu-NTA的破络效果很差, 反应2 h时Cu的去除率不足2%;对Cu-柠檬酸和Cu-酒石酸具有一定的破络效果, Cu的去除效率分别为7%和19%, 主要是因为NaClO对柠檬酸和酒石酸中的β-羟基具有一定的氧化能力(Deborde et al., 2008).酒石酸中的β-羟基数量多于柠檬酸, 使得Cu-酒石酸的破络效果高于Cu-柠檬酸.而UV/氯对Cu-EDTA、Cu-柠檬酸、Cu-酒石酸和Cu-NTA 4种铜络合物的破络效果显著提升.除Cu-NTA之外, 在[NaClO]0/[Cu]0为60时, UV/氯可将溶液中的Cu浓度从19.2 mg · L-1降至1.0 mg · L-1以下. [NaClO]0/[Cu]0的增加有效地促进了Cu-NTA的破络, 在[NaClO]0/[Cu]0为150时, 剩余Cu浓度低于0.8 mg · L-1.相对于碱性pH下(8.0~11.0)破络后Cu2+的自发沉淀(Huang et al., 2019), 在pH=5.0时, 破络后的Cu2+沉淀则需借助额外加碱, 其原因与反应后溶液pH有关, 本文接下来将进行探讨.
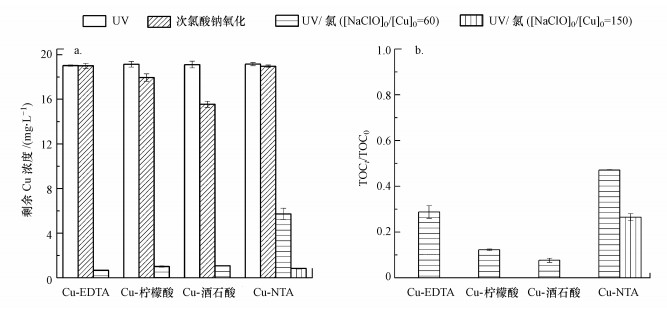 |
| 图 1 UV/氯处理不同Cu络合物过程中Cu (a)和TOC (b)的去除效果 Fig. 1 The efficiency of Cu(a) and TOC(b) removal during the decomplexation of Cu-complexes by UV/chlorine |
UV/氯对不同铜络合物的矿化效果如图 1b所示.UV/氯对TOC具有良好的去除效果, 在[NaClO]0/[Cu]0为60时, 对Cu-EDTA、Cu-柠檬酸和Cu-酒石酸3种络合物的TOC去除率介于70%~90%.[NaClO]0/[Cu]0的增加对Cu-NTA的TOC去除具有明显的促进作用, 在[NaClO]0/[Cu]0为150时, TOC的去除率高于70%.相比Cu-EDTA、Cu-柠檬酸、Cu-酒石酸, Cu-NTA的去除需要更大的[NaClO]0/[Cu]0, 这可能与HO ·或Cl ·与不同络合形态Cu的反应活性相关, 接下来将进行具体讨论.
3.2 [NaClO]0/[Cu]0的影响EDTA是电镀、印刷电路板等行业中最常使用的配体之一, Cu-EDTA络合态是这类排放废水中铜最为常见的形态之一(Zhao et al., 2013; Huang et al., 2016), 因此, 本文以Cu-EDTA为代表探究UV/氯降解铜络合物的影响因素与机理.在Cu-EDTA初始浓度为0.30 mmol · L-1和溶液初始pH为5.0的条件下, 考察了不同[NaClO]0/[Cu]0对Cu和TOC去除效果的影响, 结果如图 2所示.由图 2可知, [NaClO]0/[Cu]0的增加显著促进了Cu和TOC的去除, [NaClO]0/[Cu]0为5~10时, 剩余Cu的浓度为3~5 mg · L-1, TOC去除率约为40%;[NaClO]0/[Cu]0增加至20~30时, 剩余Cu的浓度为1~2 mg · L-1, TOC去除率约为60%;[NaClO]0/[Cu]0继续增加, 溶液中残留Cu浓度则降至1.0 mg · L-1以下, TOC去除率增加至70%左右; [NaClO]0/[Cu]0为60时, Cu去除率最高, 为96.5%, 剩余Cu浓度为0.67 mg · L-1; 但[NaClO]0/[Cu]0增加至90时对Cu和TOC去除的促进效果不明显.考虑到Cu、TOC的去除效率及药剂成本, 本文将最合适的[NaClO]0/[Cu]0设定为60.
 |
| 图 2 不同[NaClO]0/[Cu]0条件对Cu和TOC去除的影响 Fig. 2 Effect of [NaClO]0/[Cu]0 on Cu and TOC removal |
在Cu-EDTA初始浓度为0.30 mmol · L-1和[NaClO]0/[Cu]0为60的条件下, 在溶液初始pH值为2.0~7.0的范围内考察UV/氯对Cu和TOC去除效果的影响, 实验结果如图 3所示.酸性pH下Cu和TOC的去除效果略高于中性pH.在溶液初始pH为3.0~5.0的范围内, Cu和TOC的去除效果最好, 剩余Cu浓度低于1.0 mg · L-1, TOC去除率达70%.随溶液初始pH继续增加至6.0或以上, Cu和TOC的去除效率略有所降低.这一现象与UV/H2O2、O3和光电催化氧化等高级氧化过程降解EDTA-金属络合物一致(Jiraroj et al., 2006;Zhao et al., 2013;Huang et al., 2016).溶液pH变化通常影响着Cu-EDTA和HClO的存在形态.在pH<4.0时, Cu-EDTA主要以质子化的CuH2EDTA和CuHEDTA-形态存在; 在pH>4.0时, 则主要以脱质子化的CuEDTA2-形态存在; 当pH>5.0时, 部分HClO以ClO-形态存在, 且随pH的升高而增多.Cu-EDTA质子化形态CuHEDTA-和CuH2EDTA与HO ·或Cl ·的反应速率快于其脱质子化形态CuEDTA2-(Zhao et al., 2013; Huang et al., 2016), 以及ClO-较HClO具有较低的光量子效率与更高的自由基竞争消耗活性可能是造成溶液pH升高进而抑制Cu-EDTA破络的主要原因(Fang et al., 2014; Wang et al., 2016).
 |
| 图 3 溶液初始pH对Cu和TOC去除的影响 Fig. 3 Effect of initial solution pH on Cu and TOC removal |
由表 1可知, UV/氯在初始溶液pH为2.0~7.0的条件下反应后的pH均下降, 且初始pH越大, 下降越大.而在碱性pH(8.0~11.0)下, UV/氯反应后的pH依然保持在碱性(Huang et al., 2019).通常, 破络后释放出的Cu2+在溶液pH近中性或碱性条件下(pH>6.0)易发生沉淀(Huang et al., 2016), 因而UV/氯在酸、中性下破络释放的Cu2+则需依靠加碱沉淀去除, 在碱性pH下则可自发沉淀.
| 表 1 不同溶液初始pH下UV/氯降解Cu-EDTA前后溶液pH变化 Table 1 pH variation during Cu-EDTA degradation by UV/chlorine at different initial pH |
NO3-、SO42-、Ca2+和天然有机物(NOM)是水体中常见的共存组分, 在光化学氧化过程中通常扮演着竞争自由基或屏蔽紫外光的作用, 使目标污染物的去除效果降低.实验在Cu-EDTA初始浓度为0.30 mmol · L-1、[NaClO]0/[Cu]0为60和溶液初始pH=5.0的条件下, 考察了100 mmol · L-1 NO3-、100 mmol · L-1 SO42-、3 mmol · L-1 Ca2+和10 mg · L-1 NOM(腐殖酸)对Cu和TOC去除的影响, 结果如图 4所示.
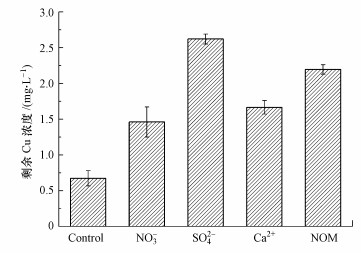 |
| 图 4 共存物对Cu去除的影响 Fig. 4 Effect of co-existing matters on Cu removal |
NO3-、SO42-、Ca2+和NOM的存在对Cu的去除均表现出一定的抑制作用, 其中, SO42-的影响最明显, 其次为NOM, 再次是Ca2+和NO3-. SO42-是较强的自由基抑制剂(Siedlecka et al., 2007), 其参与竞争HO ·和Cl ·导致破络效率降低. NOM的存在会与部分HO ·和Cl ·产生竞争效应及对UV具有一定屏蔽效应, 进而影响Cu-EDTA的氧化破络效果.虽然Ca2+不是自由基的抑制剂, 但其存在对Cu去除降低了约5%, 可能的原因是溶液中离子强度的增加导致盐效应增强进而影响破络过程中Cu2+的中和沉淀反应.共存的NO3-对光的屏蔽效应或其光解产物NO2-对HO ·和Cl ·的竞争导致其对Cu的去除表现出一定的抑制作用(Xu et al., 2015).
3.5 活性物种分析众多研究表明, UV/氯产生的HO ·、Cl ·、Cl2· -和ClO ·等多种自由基对水中药物、农药、EDCs等污染物具有联合降解效应(Sichel et al., 2011; Wu et al., 2016; Kong et al., 2016).叔丁醇(TBA)对HO ·和Cl ·均有强抑制作用, 与两者的二级反应速率常数分别为6.0×108和3.0×108 L · mol-1 · s-1(Fang et al., 2014).为了验证UV/氯破络过程中的主要氧化物种, 在体系中引入HO ·和Cl ·抑制剂TBA考察Cu-EDTA的降解动力学, 结果如图 5所示.由图 5a可知, TBA的加入显著抑制了Cu-EDTA的降解.外加20和40 mmol · L-1 TBA后, 反应15 min内Cu-EDTA的降解率分别降低了80%和95%. Cu-EDTA的降解符合假一级反应动力学, 20和40 mmol · L-1 TBA存在时, Cu-EDTA的降解速率常数由0.348 min-1分别下降至6.96×10-3和3.75×10-3 min-1(图 5b).以上结果表明, UV/氯中主要活性氧化物种为HO ·和Cl ·, 而Cl2· -和ClO ·等自由基的贡献不足2%.
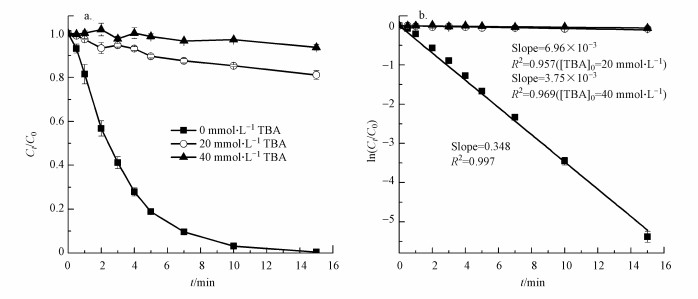 |
| 图 5 叔丁醇(TBA)对Cu-EDTA降解效率(a)和降解动力学(b)的影响 (pH=5.0, 25 ℃, [Cu-EDTA]0=0.30 mmol · L-1, [NaClO]0/[Cu]0=10) Fig. 5 Effect of TBA on the efficiency (a) and kinetics (b) of Cu-EDTA degradation in the UV/chlorine system |
为分析HO ·和Cl ·对Cu-EDTA降解的各自贡献, 实验以硝基苯(NB)为HO ·的特征指示物和以苯甲酸(BA)为HO ·和Cl ·的特征指示物研究了Cu-EDTA、NB和BA三者混合体系的竞争动力学, 结果如图 6所示. NB与Cl ·几乎不发生反应, 但可被HO ·快速氧化降解, 两者的二级反应速率常数为3.9×109 L · mol-1 · s-1(Wang et al., 2016). HO ·和Cl ·均能快速氧化降解BA, 二级反应速率常数分别为5.9×109和1.8×1010 L · mol-1 · s-1(Fang et al., 2014).假定UV/氯体系中HO ·和Cl ·处于稳态, NB、BA和Cu-EDTA的降解动力学方程可表示为:
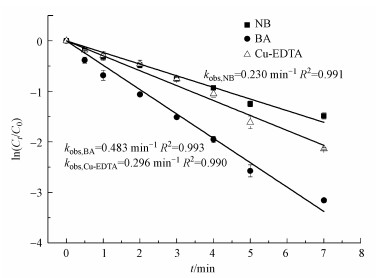 |
| 图 6 UV/氯体系中BA、NB和Cu-EDTA三者混合竞争动力学 (pH=5.0, 25 ℃, [Cu-EDTA]0=0.30 mmol · L-1, [NB]0=[BA]0=0.050 mmol · L-1, [NaClO]0/[Cu]0=10) Fig. 6 The degradation kinetics of the co-existing NB, BA and Cu-EDTA in the UV/chlorine system |
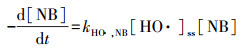
|
(1) |
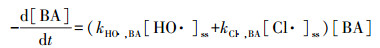
|
(2) |
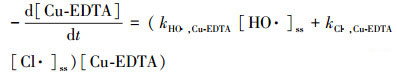
|
(3) |
式中, kHO ·, NB、kHO ·, BA和kHO ·, Cu-EDTA分别代表HO ·与NB、BA和Cu-EDTA的二级反应速率常数, kCl ·, BA和kCl ·, Cu-EDTA分别代表Cl ·与BA和Cu-EDTA的二级反应速率常数, [HO ·]ss和[Cl ·]ss分别代表HO ·和Cl ·的稳态浓度.
根据式(1)~(3), 表观动力学常数(kobs)可表示为式(4)~(6):
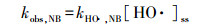
|
(4) |
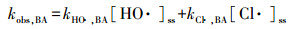
|
(5) |
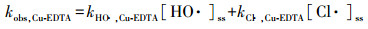
|
(6) |
由图 6可知, NB降解表观动力学常数(kobs, NB)和BA降解表观动力学常数(kobs, BA)分别为0.230和0.483 min-1, 带入式(4)和(5)可得到[HO ·]ss和[Cl ·]ss分别为9.83×10-13和1.25×10-13 mol · L-1, 则[HO ·]ss约为[Cl ·]ss的8倍.将Cu-EDTA降解表观动力学常数kobs, Cu-EDTA = 0.296 min-1和kHO ·, Cu-EDTA= 3.0×109 L · mol-1 · s-1(Lati et al., 1978)带入式(6)可得到kHO ·, Cu-EDTA[HO ·]ss=0.177 min-1和kCl ·, Cu-EDTA[Cl ·]ss=0.119 min-1.由此可得, 在pH=5.0的条件下, HO ·和Cl ·对Cu-EDTA降解的贡献分别为59.8%和40.2%.因此, UV/氯对Cu-EDTA等络合物的破络归因于HO ·和Cl ·两者的联合作用.
NTA-金属络合物与HO ·的反应速率常数(如NTA-Fe和NTA-Co, ~108 L · mol-1 · s-1)比EDTA-金属络合物(EDTA-Fe和EDTA-Co, ~109 L · mol-1 · s-1)低1个数量级(Buxton et al., 1988)可能是Cu-NTA比Cu-EDTA破络更难的原因之一. Cl ·与苯甲酸、乙酸、甲酸等羧酸化合物的反应速率常数达到109~1010 L · mol-1 · s-1(Fang et al, 2014; Huang et al., 2019), 可推测Cl ·对柠檬酸-Cu和酒石酸-Cu也具有较高的反应速率.课题组之前的研究已证实, Cl ·与Cu-EDTA的反应速率达~1010 L · mol-1 · s-1(Huang et al., 2019), 但其与Cu-NTA的反应速率未见相关报道. Cl ·与Cu-NTA的反应速率低于其与Cu-EDTA、Cu-柠檬和Cu-酒石酸的反应速率可能是Cu-NTA破络更难的另一原因.
3.6 降解产物与路径[NaClO]0/[Cu]0=10时UV/氯降解Cu-EDTA过程中HPLC谱图变化如图 7所示, 其中, Cu-乙二胺三乙酸(Cu-ED3A)产物先经制备HPLC分离后用高分辨质谱进行鉴定(Huang et al., 2016), 其他产物通过与标准样品的保留时间比对进行鉴定.随着反应时间的增加, Cu-EDTA逐步降解, Cu-ED3A峰强度逐渐升高, 在5 min时达到最大, 随后逐渐降低; 同时, 在反应3 min时可明显观察到Cu-NTA的产生.反应1 min时出现少量的Cu-ED2A, 而后随反应时间的增加而增大, 10 min时达到最大.接着在反应3 min时出现保留时间为1.3 min的宽峰.根据Cu-EDMA、Cu-EDA和Cu-IMDA三者在HPLC上的保留时间与该峰的位置一致, 其中, Cu-EDMA和Cu-EDA为Cu-ED2A脱一个乙酸基和两个乙酸基的产物, Cu-IMDA为Cu-NTA的脱羧产物, 而且三者在降解过程中均可能产生, 可推测该宽峰可能是由三者同时产生造成的.Cu-ED3A、Cu-ED2A、Cu-EDMA和Cu-NTA等脱羧产物的形成, 以及约70%的TOC(3~4个乙酸基)被矿化(图 1b), 表明UV/氯体系中Cu-EDTA的降解为逐步脱羧的过程.
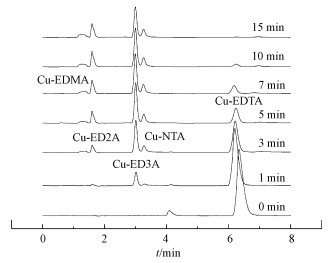 |
| 图 7 UV/氯降解Cu-EDTA过程中HPLC谱图变化 (pH=5.0, 25 ℃, [Cu-EDTA]0=0.30 mmol · L-1, [NaClO]0/[Cu]0=10) Fig. 7 The evolution of HPLC spectra during Cu-EDTA degradation by UV/chlorine |
Cu-EDTA降解的路径如图 8所示.由HPLC谱图可知, Cu-ED3A最大峰值约为Cu-NTA的4.3倍.经实验测得Cu-EDTA和Cu-NTA在λ=258 nm处的摩尔吸光系数(ε)接近, 分别为2640和2075 L · mol-1 · cm-1.根据两者的峰值和ε估算可得Cu-EDTA的生成浓度约为Cu-NTA的3.4倍.因此, Cu-EDTA中—N—(CH2—COOH)2基团上的N—C键断开生成Cu-ED3A为主要路径(路径1), 约占80%;—N—CH2—CH2—N—基团上N—C键的断裂形成Cu-NTA为次要途径, 约占20%.接着, Cu-ED3A与Cu-NTA逐步脱羧, 依次生成Cu-ED2A、Cu-EDMA、Cu-EDA和Cu-IMDA等脱羧产物, 进而被氧化分解成草酸、乙酸和甲酸等小分子有机酸及NO3-、CO2和H2O等无机物.同时, 伴随脱羧过程, Cu(Ⅱ)逐步释放, 在反应后溶液pH调至11.0左右以氢氧化物形式沉淀.
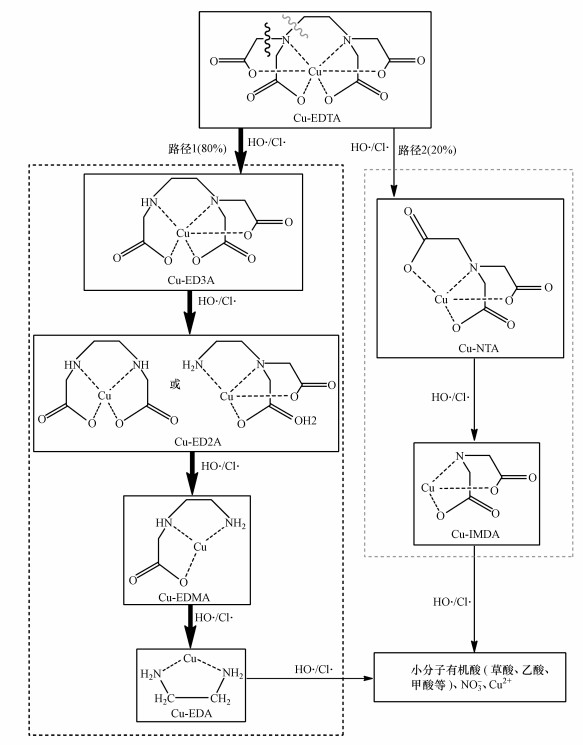 |
| 图 8 UV/氯体系中Cu-EDTA降解路径示意图 Fig. 8 Proposed reaction pathways of Cu-EDTA degradation by UV/chlorine |
实际废水取自温州市某电镀园区, 废水pH=3.5, Cu初始浓度为20.4 mg · L-1, 向废水中投加一定量的EDTA确保Cu2+处于络合形态, 按[NaClO]0/[Cu]0=60加入NaClO溶液, 调节废水pH至5.0, 考察了UV/氯体系对Cu的去除效果, 结果如表 2所示. UV单独辐照对实际络合态Cu废水无去除效果, NaClO单独氧化的效果也很差, 反应2 h时Cu的去除率为5.3%.而UV/氯对实际Cu络合废水仍具有良好的处理效果, 反应2 h后剩余Cu浓度降至约1.0 mg · L-1, 表明UV/氯在处理实际络合Cu废水方面具有很大的应用潜力.同时, 氯分解率高于90%, 剩余氯可经硫代硫酸钠、亚硫酸钠等还原剂降低至~10 mg · L-1, 而后随废水一并排放起到消毒作用.
| 表 2 UV/氯处理实际络合铜电镀废水的效果 Table 2 Treatment of copper electroplating effluent by UV/chlorine process |
1) 相比单独UV辐照和次氯酸钠氧化, UV/氯能实现对Cu-EDTA、Cu-柠檬酸、Cu-酒石酸和Cu-NTA等铜络合物的高效破络及Cu和TOC的有效去除.
2) 增加NaClO投量有利于Cu-EDTA破络; 溶液pH在3.0~5.0范围内破络效果较优, 剩余Cu浓度可降至1.0 mg · L-1以下; 共存的NO3-、SO42-、Ca2+和NOM对Cu-EDTA破络则有一定的抑制作用.
3) 自由基淬灭实验和竞争动力学研究结果证明HO ·和Cl ·是Cu-EDTA降解的主要氧化物种, 在pH=5.0时二者的贡献率分别约为60%和40%.
4) Cu-EDTA在UV/氯体系中降解路径为N—C逐步断键并脱羧的过程.
5) UV/氯处理实际废水中的铜络合物仍具有较高的效率, 可将Cu浓度降至约1.0 mg · L-1.
Buxton G V, Greenstock G L, Heman W P, et al. 1988. Critical review of rate constants for reactions of hydrated electron, hydrogen atoms and hydroxyl radicals (·OH/·O-) in aqueous solution[J]. Journal of Physical and Chemical Reference Data, 17: 513–886.
DOI:10.1063/1.555805
|
Cyris M, Knolle W, Richard J, et al. 2013. Reaction of gadolinium chelates with ozone and hydroxyl radicals[J]. Environmental Science & Technology, 47: 9942–9949.
|
Deborde M, von Gunten U. 2008. Reactions of chlorine with inorganic and organic compounds during water treatment-Kinetics and mechanisms:A critical review[J]. Water Research, 42: 13–51.
DOI:10.1016/j.watres.2007.07.025
|
Fang J, Fu Y, Shang C, et al. 2014. The roles of reactive species in micropollutant degradation in the UV/free chlorine system[J]. Environmental Science & Technology, 48: 1859–1868.
|
Fu F L, Wang Q. 2011. Removal of heavy metal ions from wastewaters:A review[J]. Journal Environmental Management, 92: 407–418.
|
国家环境保护总局《水和废水监测分析方法》委会编. 2002. 水与废水监测分析方法(第四版)[M]. 北京: 中国环境科学出版社.
|
Huang X, Wang Y, Li X, et al. 2019. Autocatalytic decomplexation of Cu(Ⅱ)-EDTA and simultaneous removal of aqueous Cu(Ⅱ) by UV/chlorine[J]. Environmental Science & Technology.
DOI:10.1021/acs.est.8b05346
|
Huang X, Xu Y, Shan C, et al. 2016. Coupled Cu(Ⅱ)-EDTA degradation and Cu(Ⅱ) removal from acidic wastewater by ozonation:Performance, products and pathways[J]. Chemical Engineering Journal, 299: 23–29.
DOI:10.1016/j.cej.2016.04.044
|
Jiraroj D, Unob F, Hagège A. 2006. Degradation of Pb-EDTA complex by a H2O2/UV process[J]. Water Research, 40: 107–112.
DOI:10.1016/j.watres.2005.10.041
|
Kong X, Jiang J, Ma J, et al. 2016. Degradation of atrazine by UV/chlorine:Efficiency, influencing factors, and products[J]. Water Research, 90: 15–23.
DOI:10.1016/j.watres.2015.11.068
|
Lan S, Xiong Y, Tian S, et al. 2016. Enhanced self-catalytic degradation of CuEDTA in the presence of H2O2/UV:Evidence and importance of Cu-peroxide as a photo-active intermediate[J]. Applied Catalysis B:Environmental, 183: 371–376.
DOI:10.1016/j.apcatb.2015.10.030
|
Lati J, Meyerstein D. 1978. Oxidation of first-row bivalent transition-metal complexes containing ethylenediaminetetra-acetate and nitrilotriacetate ligands by free radicals:a pulse-radiolysis study[J]. Journal of the Chemical Society, Dalton Transactions, 9: 1105–1118.
|
Li T, Jiang Y, An X, et al. 2016. Transformation of humic acid and halogenated byproduct formation in UV-chlorine processes[J]. Water Research, 102: 421–427.
DOI:10.1016/j.watres.2016.06.051
|
Lin Q, Pan H, Yao K, et al. 2015. Competitive removal of Cu-EDTA and Ni-EDTA via microwave-enhanced Fenton oxidation with hydroxide precipition[J]. Water Science & Technology, 72: 1184–1190.
|
Madden T H, Datye A K, Fulton M. 1997. Oxidation of metal-EDTA complexes by TiO2 photocatalysis[J]. Environmental Science & Technology, 31: 3475–3481.
|
Sichel C, Garcia C, Andre K. 2011. Feasibility studies:UV/chlorine advanced oxidation treatment for the removal of emerging contaminants[J]. Water Research, 45: 6371–638.
DOI:10.1016/j.watres.2011.09.025
|
Siedlecka E M, Wieckowaska A, Stepnowski P. 2007. Influence of inorganic ions on MTBE degradation by Fenton's reagent[J]. Journal of Hazardous Materials, 147: 497–502.
DOI:10.1016/j.jhazmat.2007.01.044
|
汤雨林, 游少鸿, 兰华春, 等. 2018. 氧掺杂g-C3N4光催化降解Cu-EDTA络合物的反应机理研究[J]. 环境科学学报, 2018, 38(10): 3973–3978.
|
Wang W, Wu Q, Huang N, et al. 2016. Synergistic effect between UV and chlorine (UV/chlorine) on the degradation of carbamazepine:influence factors and radical species[J]. Water Research, 98: 190–198.
DOI:10.1016/j.watres.2016.04.015
|
Wu L, Wang H, Lan H, et al. 2013. Adsorption of Cu (Ⅱ)-EDTA chelates on tri-ammonium-functionalized mesoporous silica from aqueous solution[J]. Separation and Purification Technology, 117: 118–123.
DOI:10.1016/j.seppur.2013.06.016
|
Wu Z, Fang J, Xiang Y, et al. 2016. Roles of reactive chlorine species in trimethoprim degradation in the UV/chlorine process:Kinetics and transformation pathways[J]. Water Research, 104: 272–282.
DOI:10.1016/j.watres.2016.08.011
|
谢丽萍, 付丰连, 汤兵. 2012. 络合重金属废水处理的研究进展[J]. 工业水处理, 2012, 32(8): 1–4.
DOI:10.3969/j.issn.1005-829X.2012.08.001 |
Xu Z, Gao G, Pan B, et al. 2015. A new combined process for efficient removal of Cu(Ⅱ) organic complexes from wastewater:Fe(Ⅲ) displacement/UVdegradation/alkaline precipitation[J]. Water Research, 87: 376–384.
|
Xu Z, Shan C, Xie B, et al. 2017. Decomplexation of Cu(Ⅱ)-EDTA by UV/persulfate and UV/H2O2:Efficiency and mechanism[J]. Applied Catalysis B:Environmental, 200: 439–447.
DOI:10.1016/j.apcatb.2016.07.023
|
Zhao X, Guo L, Qu J. 2014. Photoelectrocatalytic oxidation of Cu-EDTA complex and electrodeposition recovery of Cu in a continuous tubular photoelectrochemical reactor[J]. Chemical Engineering Journal, 239: 53–59.
DOI:10.1016/j.cej.2013.10.088
|
Zhao X, Guo L, Zhang B, et al. 2013. Photoeletrocatalytic oxidation of CuⅡ-EDTA at the TiO2 electrode and simultaneous recovery of CuⅡ by electrodeposition[J]. Environmental Science & Technology, 47: 4480–4488.
|
 2019, Vol. 39
2019, Vol. 39


