2. 福建师范大学地理研究所, 福州 350007;
3. 福建师范大学湿润亚热带生态地理过程教育部重点实验室, 福州 350007
2. Institute of Geography, Fujian Normal University, Fuzhou 350007;
3. Key Laboratory of Humid Sub-tropical Eco-geographical Process of Ministry of Education, Fujian Normal University, Fuzhou 350007
酸雨是指pH值小于5.6的大气降水(王文娟等, 2015), 其不仅危害陆地和水域生态系统及人体的健康, 而且还会造成巨大的经济损失(易晓芹等, 2018), 目前已成为全球农业、环境和生态领域关注的主要问题之一(Liu et al., 2011;Wang et al., 2014b;Liu et al., 2015).近年来, 我国土壤酸化面积逐年上升且酸化程度较高, 对水稻等农作物造成了十分严重的影响.长时间酸雨的淋洗会使土壤酸化加剧, 导致土壤矿物质风化, 释放盐基离子, 并使土壤养分含量发生改变, 造成土壤贫瘠(Liu et al., 2006;Liu et al., 2011).
稻田土壤中微生物种类较多且数量巨大, 包括细菌、真菌、放线菌及原生动物等, 是土壤微生物生物量的主要组成部分, 对水稻的生长、生理及土壤肥力等起着至关重要的作用;不仅如此, 土壤微生物在土壤有机质和无机质的转化过程中也起着至关重要的作用.酸雨会导致稻田土壤酸化, 这必然影响到土壤中微生物的生长繁殖.近年来, 有关酸雨对微生物影响的报道较多, 张琼等(2018)研究表明, 酸雨对土壤微生物的影响较为复杂, 不同酸度的酸雨对土壤微生物的影响效应不同.同时, 王丹等(2015)的研究也表明, 酸雨对琯溪蜜柚土壤不同微生物的影响效应也不相同, 具体表现为模拟酸雨处理降低了土壤中细菌和放线菌的数量, 却增加了土壤中真菌的数量.有研究表明, 模拟酸雨处理能够改变土壤理化性质, 如酸雨使土壤pH值下降, 因而导致大量阳离子, 特别是钙(Ca2+)、镁(Mg2+)、铁(Fe2+)等重要的营养元素从土壤中溶出和流失, 造成土壤的营养元素含量降低(李明桃等, 2014).可见, 酸雨对土壤微生物数量有显著影响, 并且能够改变土壤理化性质.那么酸雨究竟从哪方面影响微生物的数量, 其数量改变是否会导致群落结构的改变, 不同菌属对酸雨处理效应如何, 不同酸度酸雨的影响是否存在差异, 土壤理化性质的改变是否与微生物群落结构的改变具有相关性, 这些问题都有待研究.
农田生态系统中的微生物种类丰富且丰度极高, 是微生物群落的一个重要聚集场所.微生物对稻田土壤有机碳的固定、温室气体的排放及污染物的降解等有着极为重要的作用.真菌属于真核微生物, 多成丝状体, 且真菌是稻田土壤中一类重要的微生物群体, 其对pH要求范围较宽, 在不适合细菌和放线菌生长的酸性环境中真菌数量在一定程度上占优势.我国是酸雨污染较为严重的区域, 且近年来土壤酸化面积逐年上升.因此, 研究稻田土壤中真菌数量及群落结构的变化有助于了解酸雨对土壤生物学性状的影响.基于此, 本文以福州平原稻田为研究对象, 利用高通量测序技术探究模拟酸雨处理对稻田土壤真菌群落结构及稻田土壤性质和功能的影响, 这对我国酸雨背景下农田生态系统微生物群落及功能的研究具有重要的现实意义及生态意义, 可为进一步利用微生物改良土壤酸化问题奠定理论基础.
2 研究区与研究方法(Study area and methods) 2.1 研究区概况研究区位于福建省福州市城郊南部、乌龙江北岸, 属亚热带海洋季风气候, 年均气温19.6 ℃, 无霜期长达325~330 d, 年均降水量为1392.5 mm, 蒸发量为1413.7 mm, 相对湿度为77.6%, 区内地貌主要为冲海积平原, 地表平坦, 海拔3~5 m, 零星分布剥蚀丘陵地貌.本试验区位于福建省仓山区盖山镇福建省水稻研究所吴凤综合试验基地(26.1°N, 119.3°E)内, 该试验基地共有红壤稻田7 hm2(朱秋丽等, 2016).试验区内实行早稻-晚稻-蔬菜的轮作制度(马永跃等, 2012).
2.2 试验时间与水稻品种试验前对翻耕后的田地进行人工整平, 以保持土壤的均一性.本试验的早、晚稻栽培品种分别为江西省农科院研发的和盛10号和福建省农科院研发的沁香优212.采用机插方式, 株行距为14 cm×28 cm.早稻于2015年4月16日移栽秧苗, 2015年7月17日收割;晚稻于2015年7月25日移栽秧苗, 2015年11月7日收割.水稻种植中所用的肥料为复合肥(N-P2O5-K2O=16-16-16)和尿素(46% N).移栽前一天施加底肥(42 kg·hm-2 N、40 kg·m-2 P2O5和40 kg·hm-2 K2O), 移栽约1周后施加分蘖肥(35 kg·hm-2 N、20 kg·hm-2 P2O5和20 kg·hm-2 K2O), 移栽约8周后施加穗肥(18 kg·hm-2 N、10 kg·hm-2 P2O5和10 kg·hm-2 K2O)(Wang et al., 2016).
2.3 试验设计与土壤样品采集本试验于2015年在水稻田内分别设置空白对照(不喷淋模拟酸雨)及pH=2.5、pH=3.5和pH=4.5的模拟酸雨处理组, 每个处理设置3个重复, 共12个小区, 每个小区面积10 m2, 随机区组排列.各小区之间用0.5 cm厚、30 cm高的PVC板隔开, 防止各个小区之间进行水和营养物质的交换.根据福州市酸雨成分配置酸雨母液, 主要成分(含量)分别为:Na+(147.96 μmol·L-1)、K+(13.40 μmol·L-1)、Mg2+(24.086 μmol·L-1)、Ca2+(72.97 μmol·L-1)、NH4+(47.35 μmol·L-1)、Cl-(159.44 μmol·L-1)、NO3-(119.19 μmol·L-1)、SO42-(76.35 μmol·L-1).使用前用体积比为1:1的HNO3和H2SO4混合液调节pH值(pH=2.5、3.5、4.5), 配制成所要喷淋的酸雨工作液(Wang et al., 2014a;安婉丽等, 2017).根据福州市历年年均酸沉降量, 计算出每次每个样方每7 d喷淋酸雨450 mL.于水稻移栽后每隔7 d取配制好的不同酸度的模拟酸雨450 mL喷淋一次, 直至水稻收割.
土样采集:用采土器分别采集早、晚稻收获期对照、pH=2.5、pH=3.5和pH=4.5等4种处理的犁耕层(0~15 cm)土壤, 装入自封袋, 并用便携式保温箱密封保存, 带回实验室, 挑去植物残体根系后, 置于-20 ℃的冰箱中冷藏待用.
2.4 基于高通量测序技术的土壤真菌群落结构分析 2.4.1 真菌基因组DNA的提取和PCR扩增采用CTAB方法对土壤样品的基因组DNA进行提取, 之后利用琼脂糖凝胶电泳检测DNA的纯度和浓度, 取适量的DNA提取液于离心管中, 用无菌水稀释至1 ng·μL-1.以稀释后的基因组DNA为模板, 根据测序区域的选择, 使用带Barcode的特异引物、New England Biolabs公司的Phusion® High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶进行PCR, 确保扩增效率和准确性.其中, PCR扩增引物及序列分别为ITS5- 1737F:GGAAGTAAAAGTCG TAACAAGG和ITS2- 2043R:GCTGCGTTCTTCATCG ATCG.
2.4.2 PCR产物的混样和纯化PCR产物使用2%琼脂糖凝胶进行电泳检测, 根据PCR产物浓度进行等量混样, 充分混匀后使用1×TAE浓度的2%琼脂糖凝胶电泳纯化PCR产物, 剪切回收目标条带.使用产物纯化试剂盒(Thermo Scientific公司GeneJET胶回收试剂盒)回收产物.
2.4.3 文库构建和上机测序使用Thermofisher公司的Ion Plus Fragment Library Kit 48 rxns建库试剂盒进行文库的构建, 构建好的文库经过Qubit定量和文库检测合格后, 使用Thermofisher的Life Ion S5TM进行上机测序.
2.5 土壤理化性质的测定土壤电导率采用便携式电导计(2265FS, USA)测定.土壤pH值测定时水土质量比为5:1, 摇床振荡30 min, 静置后用便携式pH计(PHS-3C, 中国)测定.土壤含水量(WC)用土壤水分测定仪(TDR300, Soil Moisture Meter)测定.土壤容重(UW)的测定采用环刀法(中科院南京土壤研究所土壤物理室, 1978).
2.6 土壤活性碳组分的测定土壤有机碳(SOC)测定采用高温外热重铬酸钾氧化-容重法(鲁如坤, 2000), 土壤易氧化有机碳(EOC)测定采用高锰酸钾氧化法, 微生物量碳(MBC)测定采用氯仿熏蒸浸提法, 可溶性有机碳(DOC)测定采用去离子水浸提法(王宝霞等, 2011).
2.7 数据处理应用Excel2007和SPSS23.0统计分析软件对测定数据进行整理.为了研究不同处理的物种组成多样性, 对所有处理的Clean reads进行聚类, 以97%的一致性(Identity)将序列聚类成为一个OTU(Operational Taxonomic Units)操作单元, 然后对OTUs的代表序列进行物种注释.对真菌丰度与环境因子、碳组分的关系进行Spearman相关性分析.
3 结果与分析(Result and analysis) 3.1 模拟酸雨处理对稻田土壤理化因子的影响由表 1可知, 模拟酸雨处理改变了稻田土壤的理化性质.在早稻生长期, pH=4.5处理组土壤pH显著降低(p < 0.05), pH=3.5处理组土壤含水率显著下降(p < 0.05), pH=3.5处理组土温低于对照组(p < 0.05), 3组模拟酸雨处理组土壤容重均显著升高(p < 0.05).在晚稻生长期, 3组模拟酸雨处理组土壤pH均显著降低(p < 0.05), pH=2.5处理组土壤电导率(EC)及含水量均升高(p < 0.05), 3组模拟酸雨处理组土壤温度及容重均显著降低(p < 0.05).以上结果表明, 模拟酸雨处理能够改变稻田土壤理化性质, 其中以pH的改变最为显著.不同酸度模拟酸雨作用下稻田土壤pH值均有所降低, 但各处理组之间无显著差异.因此认为, 模拟酸雨处理降低了土壤pH, 但降低幅度与模拟酸雨的酸度关系不大, 这可能与土壤本身所具备的缓冲能力有关.此外, 土温和含水量等土壤理化因子的改变与小区背景及外界气候等的改变有着密切关系, 但也不排除是因为酸雨处理改变了土壤微生物的生命活动, 而微生物代谢会对土壤温度及含水量产生影响.
| 表 1 稻田土壤理化性质 Table 1 Physicochemical properties of paddy soil |
表 2显示, 各样品文库的覆盖率(Coverage)范围为99.7%~99.8%, 说明土样中基因序列被检出的概率较高, 本次测序结果能够反映稻田土壤真菌群落的真实情况.早稻对照组及pH=2.5、pH=3.5、pH=4.5处理组得到的有效OTUs数目分别为842、579、669、547个;晚稻对照组及pH=2.5、pH=3.5、pH=4.5处理组得到的有效OTUs分别为846、732、722、1298个.早稻4个土壤样品共得到2637个OTUs, 晚稻4个土壤样品共得到3598个OTUs.Shannon指数是用来估算样品中微生物多样性的指数之一, Shannon值越大, 说明群落的多样性越高.由表 2可知, 与对照相比, 早稻pH=2.5处理提高了土壤中真菌多样性, 而pH=3.5和pH=4.5处理则降低了真菌多样性.晚稻pH=4.5处理提高了土壤中真菌多样性, 而pH=2.5和pH=3.5处理则使得土壤中真菌多样性降低.Chao1指数是估算群落中OTU数目的指数, 可用来评估样品中微生物群落的丰富度.从Chao1指数来看, 不同酸度模拟酸雨处理, 除晚稻pH=4.5处理组外, 其余各处理组均降低了土壤真菌群落的丰富度.
| 表 2 模拟酸雨作用下稻田土壤真菌的多样性指数 Table 2 Analysis of fungus diversity in paddy soils under simulated acid rain |
分别对早、晚稻土壤中真菌OTUs绘制韦恩图(图 1).韦恩图可用于分析多个样品中所共有的和独有的OTU数目, 能够比较直观地表现不同样品的OTU组成相似性及重叠情况.图 1a显示, 早稻对照组、pH=2.5、pH=3.5、pH=4.5处理组特有的OTUs分别为252、80、92、38个;图 1b显示, 晚稻对照组、pH=2.5、pH=3.5、pH=4.5处理组特有的OTUs分别为158、81、69、506个.由此可见, 不同酸度模拟酸雨处理使得每个处理均出现了新的菌种, 进而改变了稻田土壤真菌的群落组成.
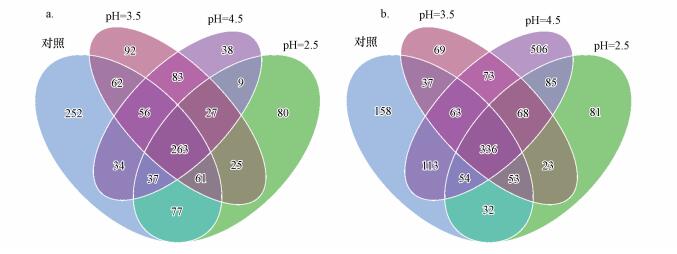 |
| 图 1 模拟酸雨作用下稻田土壤真菌OTUs分布韦恩图(a.早稻, b.晚稻) Fig. 1 Venn of fungus OTUs distribution in paddy field under acid rain |
不同处理稻田土壤真菌门水平的群落组成如图 2a所示, 早、晚稻对照组及模拟酸雨处理组土壤样品中相对丰度较高的门分别为:子囊菌门(Ascomycota)占比22.73%~76.59%, 接合菌门(Zygomycota)占比4.67%~74.10%, 壶菌门(Chytridiomycota)占比0.48%~52.97%, 担子菌门(Basidiomycota)占比2.33%~19.80%, 球囊菌门(Glomeromycota)占比0.12%~4.85%, 新丽鞭毛菌门(Neocallimastigomycota)占比0.03%~0.12%.
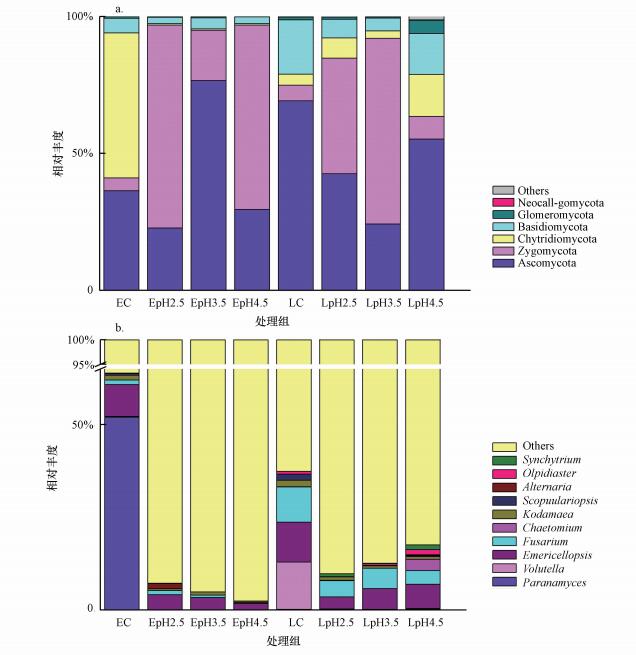 |
| 图 2 模拟酸雨作用下稻田土壤真菌门(a)和属(b)水平群落组成 (EC:早稻对照, LC:晚稻对照, EpH2.5(LpH2.5):早稻(晚稻)pH=2.5处理, 其余类同) Fig. 2 Community composition of Fungus at phylum (a) and genus(b) level in paddy soils under acid rain |
模拟酸雨处理下稻田土壤真菌属水平群落组成如图 2b所示, 本研究检测到相对丰度较高的真菌属有:Paranamyces、刺座霉属(Volutella)、翅孢壳属(Emericellopsis)、镰刀菌属(Fusarium)、毛壳菌属(Chaetomium)、Kodamaea、帚霉属(Scopulariopsis)、链格孢属(Alternaria)、Olpidiaster、集壶菌属(Synchytrium)等.模拟酸雨处理对早、晚稻真菌属水平的群落组成影响较大, 与对照相比, 模拟酸雨处理组某些菌属相对丰度明显降低, 同时又出现了些许不同菌属.其中, Paranamyces、刺座霉属(Volutella)、翅孢壳属(Emericellopsis)、镰刀菌属(Fusarium)的相对丰度变化最为显著.在不同酸度模拟酸雨处理下, 这几个菌属的相对丰度均有所降低, 降低幅度为4%~52%.同时, 在早、晚稻处理组出现了Monographella、Hygrocybe、Acremonium等在对照组中未检出的菌属.此结果说明, 模拟酸雨处理改变了稻田土壤真菌的相对丰度和真菌的群落组成, 同时, 模拟酸雨处理也改变了土壤中真菌的多样性.此外, 早、晚稻对照组真菌的群落组成差异亦十分明显, 说明水稻的不同种植期, 其土壤中所存在的真菌菌群也有所不同.
3.5 模拟酸雨作用下稻田土壤真菌属水平分布热图为进一步探究早、晚稻不同处理样品中真菌优势菌属的差异, 根据所有样品在属水平的物种注释及相对丰度信息, 选取相对丰度排列前35位的真菌属, 根据其在每个样品中的丰度信息, 从物种和样品两个层面进行聚类, 绘制成热图(图 3).如图 3所示, 在早稻土壤中, 对照组的优势真菌属为Pyrenula和Paranamyces, pH=2.5处理组为Alternaria, pH=3.5处理组为Westerdykella, pH=4.5处理组为Cosmospora;在晚稻土壤中, 对照组的优势真菌属为Volutella、Psilocybe、Scopulariopsis等, pH=2.5处理组为Auricularia、Mortierella、Acremonium等, pH=3.5处理组为Simplicillium, pH=4.5处理组为Microidium、Cladosporium、Gibberella等.可以看出, 不同真菌属在不同样品中的相对丰度具有一定的差异, 各个样品的优势菌属并不相同.说明模拟酸雨处理改变了微生物的生存环境, 从而使得土壤中优势菌属也有所改变.
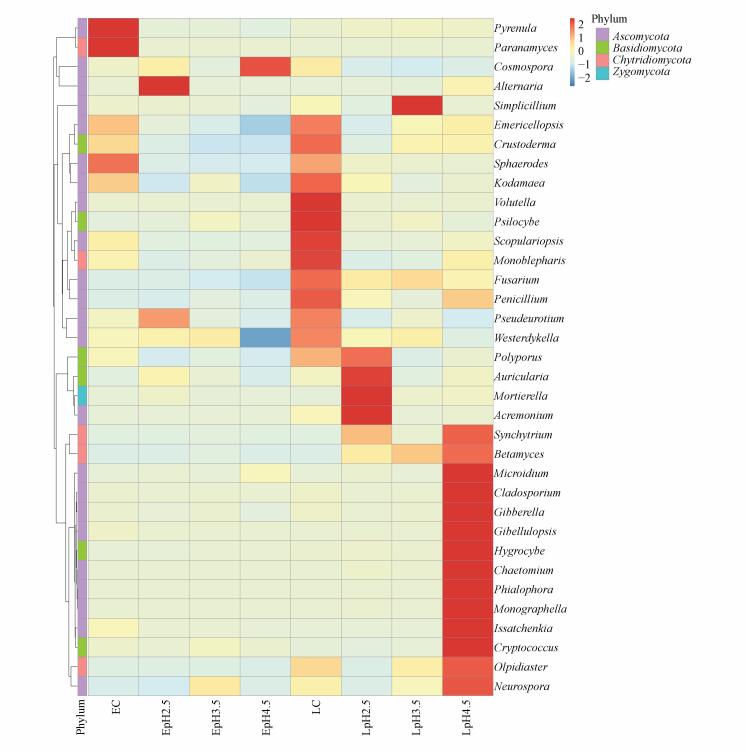 |
| 图 3 模拟酸雨作用下稻田土壤真菌相对丰度聚类热图 Fig. 3 Species relative abundance cluster diagram of fungus in paddy soils under acid rain |
为了能够直观地看出早、晚稻不同处理间稻田土壤真菌群落组成结构的差异, 特绘制PCA分析图(图 4).如图 4所示, 提取的前两个主成分的方差累计贡献率为56.63%, 说明这两个主成分(PC1和PC2)是酸雨作用下稻田土壤真菌群落组成结构差异的主要贡献者.图中各点代表不同的处理, 点距离越近, 真菌群落结构越相似, 点距离越远, 真菌群落结构差异越明显.如图 4所示, 早、晚稻不同处理所代表的点之间有一定的距离, 在早稻生长期, 3个模拟酸雨处理所代表的点与早稻对照组在主成分2轴上具有一定的距离.在晚稻生长期, 晚稻对照组与3个模拟酸雨处理组之间在主成分1轴上距离较远, 其中, 晚稻pH=4.5处理组与晚稻对照组在主成分1和2轴上距离均较远.PCA分析结果说明, 模拟酸雨处理能够改变稻田土壤真菌群落组成结构, 而晚稻的这一效应则更为显著.
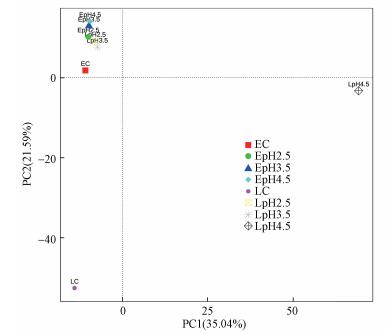 |
| 图 4 模拟酸雨作用下稻田土壤真菌群落结构PCA主成分分析 Fig. 4 Analysis of PCA principal component of fungus community structure in paddy soils under acid rain |
对稻田土壤真菌与环境因子进行Spearman相关性分析, 结果如图 5所示.从图中可以看出, 稻田土壤真菌丰富度与电导率(EC)、含水量(WC)、土壤温度(ST)及土壤pH之间均存在显著相关性, 而土壤容重(UW)则对稻田土壤真菌丰度无显著影响.
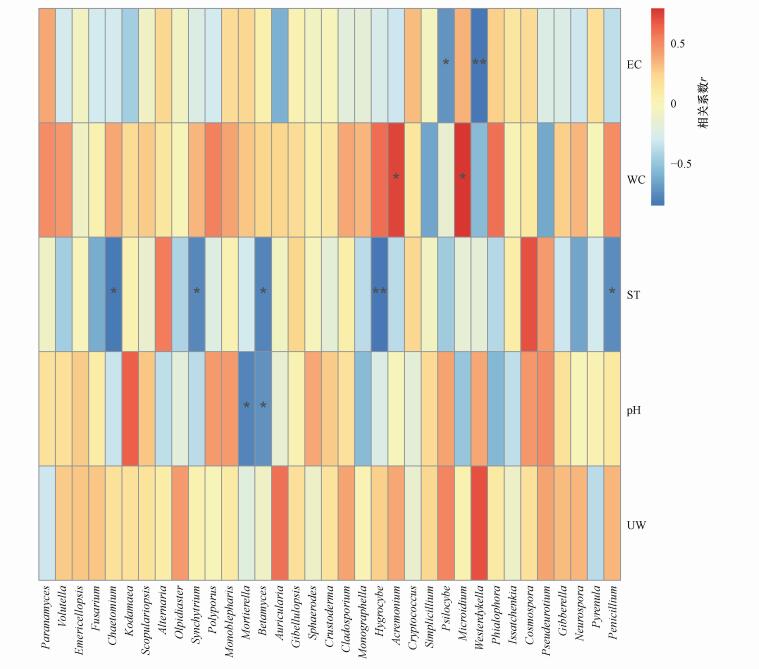 |
| 图 5 稻田土壤真菌物种多样性与环境因子相关性 (注:纵向为环境因子信息, 横向为物种信息, 中间热图对应的Spearman相关系数r介于-1~1之间, r < 0为负相关, r>0为正相关, 标*表示显著性检验为正相关, p < 0.05.) Fig. 5 Correlation between soil fungusl species diversity and environmental factors in paddy soils |
真菌Psilocybe的相对丰度与稻田土壤电导率(EC)呈显著负相关(p < 0.05), Westerdykella的相对丰度与稻田土壤电导率呈显著负相关(p < 0.01);Acremonium和Microidium的相对丰度与稻田土壤含水量(WC)呈显著正相关(p < 0.05);Chaetomium、Synchytrium、Betamyces和Penicillium的相对丰度与稻田土壤温度(ST)呈显著负相关(p < 0.05), Hygrocybe的相对丰度与土温呈显著负相关(p < 0.01);Betamyces与Mortierella的相对丰度与土壤pH呈显著负相关(p < 0.05).
3.7.2 稻田土壤细菌物种多样性与活性碳组分相关性分析稻田土壤真菌相对丰度同样受到活性碳组分的影响, 如图 6所示, 稻田土壤真菌丰富度与土壤总有机碳(SOC)、可溶性有机碳(DOC)及土壤微生物量碳(MBC)之间均存在相关性.
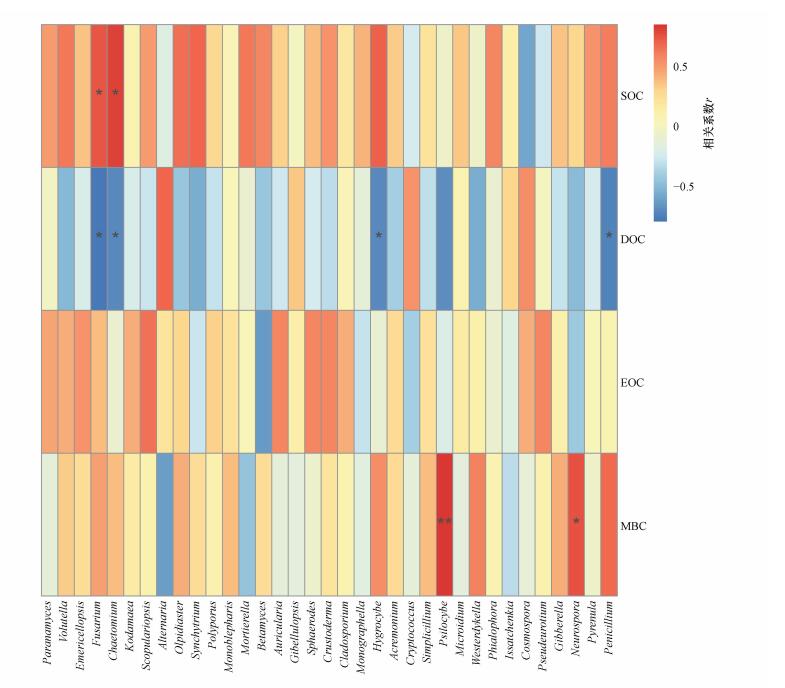 |
| 图 6 稻田土壤真菌物种多样性与活性碳组分相关性 Fig. 6 Correlation between soil fungus species diversity and activated carbon component in paddy soils |
Fusarium与Chaetomium的相对丰度与稻田土壤总有机碳(SOC)呈显著正相关(p < 0.05);Fusarium、Chaetomium、Hygrocybe及Penicillium的相对丰度与稻田土壤可溶性有机碳(DOC)呈显著负相关(p < 0.05);Psilocybe的相对丰度与稻田土壤微生物量碳(MBC)呈显著正相关(p < 0.01), Neurospora的相对丰度与微生物量碳(MBC)呈显著正相关(p < 0.05).
4 讨论(Discussion) 4.1 模拟酸雨处理对真菌多样性及群落结构的影响模拟酸雨处理改变了稻田土壤微生物生态的相对平衡性, 使得真菌的相对丰度和组成发生了变化.不同酸度模拟酸雨的处理, 对稻田土壤真菌多样性的影响效应不同.土壤化学因子、土壤温度、植被多样性是影响土壤微生物群落结构的主要因素(Rustad et al., 1998).早、晚稻两个不同种植期的不同温度、降水等也是影响稻田土壤真菌群落结构和多样性的重要因素.稻田土壤中主要含有三大类微生物, 分别为细菌、真菌和放线菌, 不同种类微生物对酸雨的敏感程度不同, 因此, 模拟酸雨处理会改变其生存环境进而使得其生长状态有所改变.孙岩等(2009)的研究表明, 随着酸雨pH值的下降, 玉米幼苗根际土壤中真菌数量呈先升高后降低的趋势, 而细菌和放线菌的生长则受到了不同程度上的抑制, 从而改变了稻田土壤微生物的群落结构和多样性.张萍华等(2014)研究表明, 模拟酸雨处理下中药植株(白术、元胡、贝母)能够抑制其土壤中细菌和放线菌的生长, 而真菌的数量随酸雨pH的降低呈先升高后下降的趋势, 当pH=2.5时真菌的数量最低.王丹等(2015)研究表明, 酸雨处理降低了土壤养分含量和细菌、放线菌数量, 增加了真菌数量.张琼等(2018)研究表明, pH=4.5(轻度酸雨)的酸雨胁迫可促进琯溪蜜柚土壤真菌生长, pH=3.5(中度酸雨)和pH=2.5(重度酸雨)的酸雨胁迫对琯溪蜜柚土壤真菌的抑制效果显著, 从而使得土壤中真菌多样性降低.本研究发现, 模拟酸雨处理改变了稻田土壤真菌的多样性, 在测序达到10542条后, 从检测到的OTUs数目来看, 早稻3个模拟酸雨处理组均降低了稻田土壤真菌多样性, 而在晚稻生长期, pH=2.5和pH=3.5处理使得稻田土壤真菌多样性降低, 而pH=4.5处理则使得真菌多样性显著升高, 此研究结果与前人的研究结果一致, 而早稻则略有不同.
4.2 模拟酸雨对稻田土壤优势真菌属的影响酸雨改变了土壤的pH, 从而改变了土壤原有的微环境.土壤微生物生长于较窄的pH范围内, 因此, 模拟酸雨处理必然会改变微生物的生存环境, 从而影响微生物的生长(陈平平等, 2017).本研究结果显示, 模拟酸雨处理使Paranamyces的相对丰度显著降低, 晚稻土壤中刺座霉属(Volutella)的相对丰度显著降低, 但毛壳菌属(Chaetomium)等的相对丰度则有所升高, 可见模拟酸雨处理对不同菌属的影响不同.这可能是因为模拟酸雨处理使稻田土壤pH降低, 部分微生物由于不能适应而停止生长, 有些耐酸或者嗜酸微生物能够抵抗这一酸性环境从而正常生长或者促进其生长和繁殖(张德明等, 1998).正是因为不同菌属对稻田土壤pH下降的效应不同, 所以不同酸度模拟酸雨处理下的稻田土壤中所含的优势菌属也大不相同.根据图 6真菌属水平分布热图可以解释这种差异.此外, 早、晚稻两个不同稻季降水强度及降雨持续时间的不同, 也导致了早、晚稻各个处理土壤中优势菌属的差异(王珍, 2017).
4.3 稻田土壤微生物与环境因子的关系及其对活性碳组分的影响土壤微生物群落结构组成的影响因子并不是单一的, 微生物群落结构组成及多样性变化是多种因素共同作用的结果, 诸如地理位置、耕作制度、土壤层次、植被覆盖、土壤肥力、气候条件等都是影响土壤中微生物数量与种类的主要因子(程教擘等, 2017).
在本研究中, 通过Spearman相关性分析发现, 稻田土壤真菌丰富度与环境因子(EC、WC、ST、pH)及碳组分(SOC、DOC、MBC)之间存在相关性.具体表现为某些真菌属与某种环境因子或者碳组分之间存在某种正相关或者负相关, 如Westerdykella的相对丰度与稻田土壤电导率呈显著负相关(p < 0.01).可以发现, 不同环境因子主要作用于特定的菌属, 通过改变其生境或者其它因素影响稻田土壤中真菌菌属的相对丰度, 从而影响土壤中真菌的群落结构.
土壤有机碳是土壤中极为重要的生态因子, 而土壤微生物则是土壤中最活跃的组分, 其有利于土壤有机质的分解和养分的循环, 并与土壤碳循环密切相关(肖烨, 2015).不仅如此, 土壤微生物和有机碳结构等更是影响土壤呼吸的关键因素(任立宁, 2018).因此, 了解土壤微生物群落结构和功能是研究土壤有机碳分解的重要基础.本研究结果显示, 有大量真菌属与稻田土壤有机碳组分存在相关性, 土壤中真菌的丰度能够影响有机碳组分的含量.有研究表明, 微生物的群落结构与多样性变化是影响有机碳固定的重要因素(De et al., 2008), 而土壤碳、氮含量被认为是土壤微生物生长的主要限制因素(Wardle et al., 2008).因此, 有机碳组分与土壤微生物相互作用, 有机碳组分促进相关微生物的生长, 某些微生物同样促进有机碳的固定.然而, 稻田土壤中微生物种类多、数量大, 微生物活动、丰度、群落结构等又会受到多种因素的影响.同时, 土壤有机碳的储量及碳库的稳定性同样受到碳组分结构特征、碳组分来源、土壤特性、环境因子等多种因素的交互影响(张仲胜等, 2018).那么稻田土壤中微生物究竟如何影响碳组分, 二者的作用对水稻及土壤又有何积极效应, 将有待进一步研究与探讨.
5 结论(Conclusions)1) 模拟酸雨处理改变了稻田土壤真菌的相对丰度、多样性及群落组成, 且不同酸度模拟酸雨处理, 真菌的优势菌属及相对丰度不同.
2) 早稻3个模拟酸雨处理组均使稻田土壤真菌多样性降低, 在晚稻生长期, pH=2.5和pH=3.5处理使稻田土壤真菌多样性降低, 而pH=4.5处理则使真菌多样性显著升高.
3) 模拟酸雨处理使Paranamyces、刺座霉属(Volutella)、镰刀菌属(Fusarium)的相对丰度显著降低, 同时也出现了少量Monographella、Hygrocybe、Acremonium等对照组中不存在的菌属.
4) 早、晚稻pH=4.5处理组与对照组之间真菌的物种多样性及群落结构差异均最大.
5) 环境因子能够影响土壤中真菌的相对丰度并改变土壤碳组分, 真菌Westerdykella(韦斯特壳属)的相对丰度与稻田土壤电导率(EC)呈显著负相关(p < 0.01), Psilocybe的相对丰度与稻田土壤微生物量碳(MBC)呈显著正相关(p < 0.01).
安婉丽, 曾从盛, 王维奇. 2017. 模拟酸雨对福州平原水稻田温室气体排放的影响[J]. 环境科学学报, 2017, 37(10): 3984–3994.
|
陈彬彬, 王宏, 郑秋萍, 等. 2016. 福建省区域酸雨特征及成因分析[J]. 气象与环境学报, 2016, 32(4): 70–76.
DOI:10.3969/j.issn.1673-503X.2016.04.009 |
陈家松.2016.模拟酸雨胁迫对夏腊梅幼苗生理、生长特性及土壤微生物多样性影响[D].上海: 上海师范大学
http://cdmd.cnki.com.cn/Article/CDMD-10270-1016125585.htm |
陈平平, 郭莉莉, 唐利忠, 等. 2017. 土壤pH对不同酸性敏感型水稻品种氮利用效率与根际土壤生物学特性的影响[J]. 核农学报, 2017, 31(4): 757–767.
|
程教擘, 陈力力, 李梦丹, 等. 2017. 不同耕作方式对稻田土壤微生物的影响[J]. 湖南农业科学, 2017, 3(8): 8–10.
|
De Deyn G B, Cornelissen J H C. 2008. Plant functional traits and soil carbon sequestration in contrasting biomes[J]. Ecology Letters, 11(5): 16–53.
|
国惠, 于鲁冀. 1999. 细菌生理群的研究及其生态学意义[J]. 生态学报, 1999, 39(1): 128–133.
DOI:10.3321/j.issn:1000-0933.1999.01.021 |
黄聚聪, 白亮, 苏锦, 等. 2017. 2005—2016年福建省酸雨时空变化特征及趋势分析[J]. 化学工程与装备, 2017(12): 328–330.
|
鲁如坤. 2000. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社.
|
李明桃. 2000. 酸雨对环境的危害分析[J]. 现代农业科技, 2000(19): 253–254.
|
Liu N, Wang Y J, Zhao Z J, et al. 2011. Responses of typical forest litters to acid deposition in southwestern subtropical region[J]. Journal of Soil Water Conservation, 25(2): 108–113.
|
Liu S G, Zhang T L, Wang X X, et al. 2006. Driving factors and countermeasure for the temporal-spatial variability of soil fertility in Yujiang Country of Jiangxi Province[J]. Chin J Soil Sci, 37(5): 869–874.
|
Liu M H, Yi L T, Yu S Q, et al. 2015. Chlorophyll fluorescence characteristics and the growth response of Elaeocarpus glabripetalusto simulated acid rain[J]. Photosynthetica, 53(1): 23–28.
|
Liu T W, Wu F H, Wang W H, et al. 2011. Effects of calcium on seed germination seedling growth and photosynthesis of six forest tree species under simulated acid rain[J]. Tree Physiology, 31(4): 402–413.
DOI:10.1093/treephys/tpr019
|
马永跃, 仝川, 王维奇, 等. 2012. 浮萍对福州平原稻田CH4和N2O排放的影响分析[J]. 中国生态农业学报, 2012, 20(6): 723–727.
|
任立宁.2018.川南毛竹林土壤有机碳和土壤微生物研究[D].北京: 中国林业科学研究院
http://cdmd.cnki.com.cn/Article/CDMD-82201-1018253254.htm |
Rustad L E, Cronan C S. 1998. Element loss and retention during litter decay in a red spruce stand in Maine[J]. Canadian Journal of Forst Research, 18(6): 947–953.
|
孙岩, 全炳武. 2009. 模拟酸雨对玉米幼苗生理与根际微生物的影响[J]. 延边大学农学学报, 2009, 31(3): 165–171.
DOI:10.3969/j.issn.1004-7999.2009.03.003 |
滕应, 黄昌勇, 龙健, 等. 2003. 铅锌银尾矿污染区土壤微生物区系及主要生理类群研究[J]. 农业环境科学学报, 2003, 22(4): 408–411.
DOI:10.3321/j.issn:1672-2043.2003.04.006 |
王宝霞.2011.闽江口鳝鱼滩入侵种互花米草与土著芦苇湿地壤碳库特征比较[D].福州: 福建师范大学
http://cdmd.cnki.com.cn/Article/CDMD-10394-1012267288.htm |
王丹, 马元丹, 郭慧媛, 等. 2015. 模拟酸雨胁迫与柳杉凋落物对土壤养分及微生物的影响[J]. 浙江农林大学学报, 2015, 32(2): 195–203.
|
王文娟, 杨知建, 徐华勤. 2015. 我国土壤酸化研究概述[J]. 安徽农业科学, 2015, 43(8): 54–56.
DOI:10.3969/j.issn.0517-6611.2015.08.022 |
王珍.2017.酸雨区不同配比凋落物分解过程中微生物多样性分析[D].福州: 福建农林大学
http://cdmd.cnki.com.cn/Article/CDMD-10389-1017178123.htm |
Wardle D A. 2008. A comparative assessment of factors which influence microbial biomass carbon and nitrogen levels in soil[J]. Biological Reviews, 67(3): 321–358.
|
Wang W, Zeng C, Sardans J, et al. 2016. Amendment with industrial and agricultural wastes reduces surface-water nutrient loss and storage of dissolved greenhouse gases in a subtropical paddy field[J]. Agriculture Ecosystems & Environment, 231: 296–303.
|
Wang L, Wang W, Zhou Q, et al. 2014a. Combined effects of lanthanum(Ⅲ) chloride and acid rain on photosynthetic parameters in rice[J]. Chemosphere, 112: 355–361.
DOI:10.1016/j.chemosphere.2014.04.069
|
Wang L, Chen Z, Shang H, et al. 2014b. Impact of simulated acid rain on soil microbial community function in Masson pine seedlings[J]. Electronic Journal of Biotechnology, 17(5): 199–203.
DOI:10.1016/j.ejbt.2014.07.008
|
肖烨, 黄志刚, 武海涛, 等. 2015. 三江平原不同湿地类型土壤活性有机碳组分及含量差异[J]. 生态学报, 2015, 35(23): 7625–7633.
|
易晓芹, 田双红, 贺群, 等. 2018. 模拟酸雨胁迫对茶树幼苗生长和光合生理的影响[J]. 基因组学与应用生物学, 2018, 38(5): 1–6.
|
张德明, 陈章和, 林丽明, 等. 1998. 白云山土壤微生物的季节变化及其对环境污染的反应[J]. 生态科学, 1998, 17(1): 40–45.
|
张萍华, 申秀英, 许晓路, 等. 2004. 模拟酸雨对中药基质土壤微生物的影响[J]. 农业环境科学学报, 2004, 23(2): 281–283.
DOI:10.3321/j.issn:1672-2043.2004.02.019 |
张琼, 陆銮眉, 戴清霞, 等. 2018. 模拟酸雨对琯溪蜜柚土壤微生物和酶活性的影响[J]. 泉州师范学院学报, 2018, 36(2): 6–12.
|
张仲胜, 李敏, 宋晓林, 等. 2018. 气候变化对土壤有机碳库分子结构特征与稳定性影响研究进展[J]. 土壤学报, 2018, 5(2): 273–282.
|
中科院南京土壤研究所土壤物理室. 1978. 土壤物理性质测定方法[M]. 北京: 科学出版社.
|
朱秋丽, 曾冬萍, 王纯, 等. 2016. 废弃物施加对福州平原稻田土壤团聚体分布及其稳定性的影响[J]. 环境科学学报, 2016, 36(8): 3000–3008.
|
 2019, Vol. 39
2019, Vol. 39


