2. 华中师范大学生命科学学院, 遗传调控与整合生物学湖北省重点实验室, 武汉 430079
2. Hubei Key Laboratory of Genetic Regulation and Integrative Biology, School of Life Sciences, Central China Normal University, Wuhan 430079
邻苯二甲酸酯(PAEs)是我国最主要的塑化剂之一, 被普遍应用于玩具、食品包装、医疗制品等多个领域, 其暴露可累及人体的多个靶器官(路雨等, 2018), 可能对儿童的学习、记忆产生重要的影响(Kim et al., 2009; Cho et al., 2010).近年来发现, PAEs可通过孕妇胎盘和婴幼儿血脑屏障导致海马神经元发生凋亡, 但其作用机制不详(Wojtowicz et al., 2017).细胞外调节蛋白激酶(ERK1/2)是关键MAPK家族成员(Jr, 2012), 广泛存在于哺乳动物的脑组织中, 在神经行为反应和学习记忆过程中发挥重要作用(Kamei et al., 2006).越来越多的研究证实(Whitlock et al., 2006), ERK1/2通路与中枢神经系统的海马组织有重要关联, ERK1/2通路可能参与海马突触可塑性的形成, 调节神经突触可塑性相关的转录因子、蛋白质翻译等过程(Medina et al., 2018).其他研究(Qin et al., 2018)也表明, PAEs作为胞外信号, 可通过氧化应激途径激活p38 MAPK, 介导激活下游转录因子, 进而调控细胞凋亡等多种生物学功能.本实验复制邻苯二甲酸二丁酯(DBP, PAEs最常见的一类)诱导的学习记忆小鼠模型, 以常见天然药物维生素E(VE)为抗氧化剂, 探究ERK1/2通路活化与DBP诱导的海马神经元凋亡的关联.
2 材料与方法(Materials and methods) 2.1 实验动物SPF级雄性KM小鼠, 体重(17 ± 1) g, 购自湖北省实验动物研究中心(使用证明:No.00262713).动物房温度(25±2) ℃, 湿度45%, 昼夜交替12 h, 动物自由饮食进水.
2.2 试剂与仪器试剂:DBP(≥99.6%, 84-74-2)、VE(59-02-9)、Hoechst 33258荧光染料(>99.9%)均购自美国Sigma公司, 脑源性神经营养因子(BDNF)、磷酸化cAMP反应元件结合蛋白(p-CREB)、caspase-3 ELISA试剂盒均购自美国ebioscience公司, 还原型谷胱甘肽(GSH)试剂盒(南京建成生物工程研究所), SDS-PAGE凝胶制备试剂盒(ASPEN, AS1012), RIPA总蛋白裂解液(ASPEN, AS1004), BCA蛋白质浓度测定试剂盒(ASPEN, AS1086), 抗体洗脱液(AS1026, ASPEN), ECL化学发光检测试剂盒(ASPEN, AS1059), 蛋白Marker (Thermo, 26616), 一抗:均为兔抗小鼠, β-Actin(Abcam, ab37168, 5%脱脂牛奶, 1 : 10000), p-ERK(CST, 4370, 5%BSA, 1 : 1000), ERK(CST, 4695, 5%BSA, 1 : 2000), 其他化学试剂均为国产分析纯.
仪器:实验动物神经行为记录仪(EthoVision XT Version 12.0, 荷兰Noldus), RM2245切片机(德国LEICA), 酶标仪(ELx800, 美国Bio-Tek), 显微镜(BX53, 日本Olympus).
2.3 实验方法与分组36只KM小鼠随机分成4组:生理盐水组(Saline)、50 mg · kg-1 · d-1 DBP组、50 mg · kg-1 · d-1 VE组, DBP+VE组.根据王彝白纳等(2016)利用2011—2013年收集的24类食品中DBP含量数据表明, 食品中DBP的含量范围为0.00~46.50 mg · kg-1, 选择DBP的暴露剂量为50 mg · kg-1 · d-1.DBP先用Tween 80助溶, 再用生理盐水稀释至终浓度(Wu et al., 2017).VE先用Tween 80助溶, 再用生理盐水配制, VE剂量(50 mg · kg-1 · d-1)及给药途径参考Ahadi等(2010)的研究.DBP+VE组中DBP先灌胃给药, 2 h后再灌胃给药VE, 其它组正常灌胃给药.DBP诱导的学习记忆小鼠模型参照Yan等(2016)的研究, 实验鼠灌胃体积为10 mL · kg-1, 连续给药28 d, 小鼠于第22~26 d进行水迷宫定向航行训练, 第27 d为遗忘期, 第28 d撤掉平台后, 进行空间探索实验, 检测不同组小鼠的潜伏期.
2.4 Morris水迷宫实验Morris水迷宫(morris water maze, MWM)实验选用通用小鼠型, 直径为100 cm圆桶形水箱, 水深20 cm, 水温控制范围(23±1) ℃, 逃逸平台位于NW象限的正中央, 距离水面0.5 cm.小鼠的游泳轨迹等数据由水池正上方的摄像机记录, 影像数据记录传入计算机, 通过EthoVision XT Version 12.0软件分析数据.
2.5 脑海马组织CA1切片病理学观察实验取材的脑海马组织用4%多聚甲醛固定, 常规脱水, 石腊包埋切片, 按照文献所述方法(Hochstim et al., 2010)进行苏木素-伊红(H&E)染色和Nissl染色, 显微镜下观察脑海马组织CA1的病理变化.
2.6 脑海马组织CA1区荧光染色脑海马组织CA1区切片经工作浓度为5 mg · kg-1 Hoechst 33258荧光染液, 染色5 min, 用PBS水洗两遍后, 置于荧光显微镜下观察结果.
2.7 Western blot实验检测ERK、p-ERK蛋白水平将冰冻的小鼠脑海马组织剪成小块, 加RIPA裂解液裂解后, 冰浴彻底匀浆, 提取总蛋白, BCA法测定样品中蛋白浓度.上样量10 μg, 10% SDS-PAGE电泳胶分离蛋白, 然后转膜至0.45 μm聚偏二氟乙烯(PVDF)膜上, 加封闭液室温封闭1 h, 除去封闭液, 加入用一抗稀释液稀释好的一抗4 ℃过夜, 回收已稀释的一抗, 用TBST缓冲液洗3次, 每次5 min;加入二抗稀释液稀释好的二抗, 室温孵育30 min, 用TBST缓冲液在室温下摇床上洗4次, 每次5 min.滴加新鲜配制的ECL混合溶液(A : B=1 : 1)到膜的蛋白面侧, 暗室中曝光, ECL显影.采集β-Actin、ERK及p-ERK条带灰度值, β-Actin作内参, 分别得到各样本ERK、p-ERK与β-Actin的灰度比值.
2.8 脑海马组织匀浆制备脑海马组织置于预冷PBS (pH=7.4)中漂洗, 滤纸拭干, 置于匀浆器中加预冷的PBS制成10% (mg · mL-1)匀浆液, 4 ℃, 10000× g离心10 min后取上清, 用于实验指标的检测.
2.9 脑海马组织氧化应激水平的检测脑海马组织匀浆中活性氧(ROS)含量用二氯二氢荧光素-乙酰乙酸酯(DCFH-DA)荧光法进行测定(LeBel et al., 1992);GSH含量按试剂盒测定, GSH含量(μmol · g-1)=[(测定OD值-空白OD值)/(标准OD值-空白OD值)]×标准管浓度×样本稀释倍数÷待测匀浆蛋白浓度(g · L-1).丙二醛(MDA)含量用硫代巴比妥酸(TBA)法(Ohkawa et al., 1979)进行测定, MDA含量(μmol · mg-1)=[6.45(OD532-OD600)-0.56OD600](μmol · L-1)×样本稀释倍数÷待测匀浆蛋白浓度(mg · mL-1), Folin-酚试剂盒(北京鼎国昌盛生物技术有限责任公司)测定蛋白质含量.
2.10 脑海马组织BDNF、p-CREB及caspase-3水平的检测取脑海马组织匀浆上清液测定BDNF、p-CREB、caspase-3水平, 按照成品ELISA试剂盒步骤完成测定指标, 灵敏度分别为0.1 ng · mL-1、1.0 pg · mL-1、1.0 pmol · L-1.
2.11 统计学分析实验数据均用平均数±标准差(x±s)表示, 采用GraphPad Prism 5.0软件进行统计分析, 组间差异采用单因素方差(ANOVA)结合最小显著性差异法LSD-t检验比较, p < 0.05表示差异具有统计学意义.
3 结果(Results) 3.1 各组小鼠的MWM实验结果如图 1A所示, 与对照组相比, 50 mg · kg-1 · d-1 DBP组小鼠在寻找目标象限(即NW象限)中逃逸平台的潜伏期出现了显著上升趋势(p<0.01);加入VE处理后, 与50 mg · kg-1 · d-1DBP组比较, DBP+VE组小鼠的潜伏期下降, 差异有统计学意义(p<0.05).
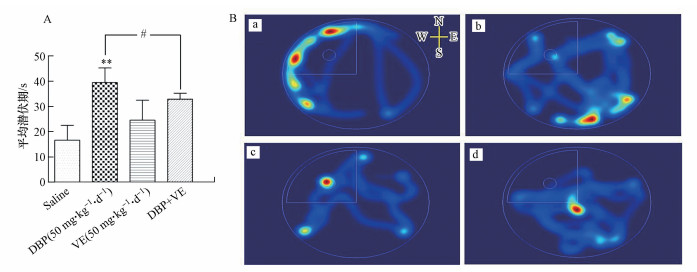 |
| 图 1 各组小鼠的MWM实验结果 (A.各组小鼠的逃避潜伏期(n=9), * * p<0.01, 50 mg · kg-1 · d-1 DBP组与对照组比较;#p<0.05, 50 mg · kg-1 · d-1 DBP组与DBP+VE组比较;B.各组小鼠的游泳轨迹热点, 红色、黄色、蓝色轨迹对应小鼠的运动时间, 其中红色表示小鼠在该区域运动占整个运动时间的比例最长, 依次为黄色、蓝色, 无轨迹表示小鼠未运动到该区域.a.Saline组, b.50 mg · kg-1 · d-1 DBP组, c.50 mg · kg-1 · d-1 VE组, d.DBP+VE组.) Fig. 1 MWM experimental results of mice in different treatment groups (A. The escape latency (s) of mice in each group (n=9), * * p < 0.01, 50 mg · kg-1 · d-1 DBP group compared to control group; #p < 0.05, 50 mg · kg-1 · d-1 DBP group compared to DDP + VE group; B. Hot spots of mice in each group. The track of red, yellow and blue corresponds to the movement time of mice, in which red indicates that the proportion of the whole movement time of mice in this area is the longest, followed by yellow and blue, and no track indicates that the mice do not move to this area. a: saline group, b: 50 mg · kg-1 · d-1 DBP group, c: 50 mg · kg-1 · d-1 VE group, d: DBP+VE group.) |
小鼠运动60 s内寻找平台的轨迹热点见图 1B, 结果显示, 50 mg · kg-1 · d-1 DBP组小鼠的轨迹热点较少出现在目标象限, 运动目的性不强, 反映该组小鼠将会花费更多的时间才能找到平台(图 1B(b));DBP+VE组小鼠在目标象限的轨迹热点有一定程度的增加(图 1B(d)).
3.2 各组小鼠脑海马组织的氧化应激水平与对照组比较, 50 mg · kg-1 · d-1DBP组小鼠脑海马组织中ROS相对荧光强度、MDA含量上升(图 2a、2c), GSH含量下降(图 2b), 差异均有统计学意义(p<0.01;p<0.05).加入VE处理后, 与50 mg · kg-1 · d-1DBP组比较, DBP+VE组小鼠脑海马组织中ROS相对荧光强度、MDA含量显著下降(p<0.05)(图 2a、2c), GSH含量显著上升(p<0.05) (图 2b).
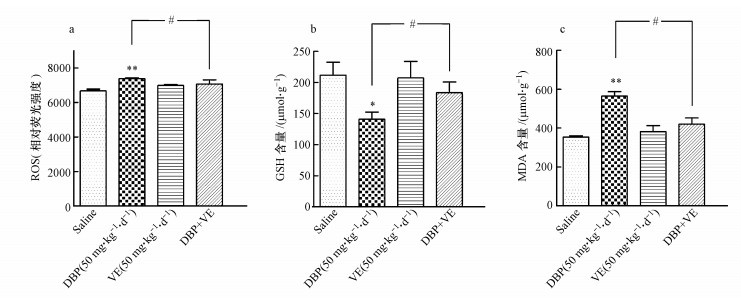 |
| 图 2 各组小鼠的脑海马组织的氧化应激水平(n=9) (a. ROS的相对荧光强度;b. GSH含量;c. MDA含量.* p<0.05, * * p<0.01, 50 mg · kg-1 · d-1 DBP组与对照组比较;#p<0.05, 50 mg · kg-1 · d-1 DBP组与DBP+VE组比较, 下同) Fig. 2 Oxidative stress levels in brain hippocampal tissue of mice in different treatment groups (a. The relative fluorescence intensity of ROS; b. The content of GSH. c. The content of MDA. * p < 0.05, * * p < 0.01, 50 mg · kg-1 · d-1 DBP group compared to control group; #p < 0.05, 50 mg · kg-1 · d-1 DBP group compared to DDP + VE group, the same below) |
小鼠脑海马组织ERK1/2、p-ERK1/2的表达见图 3.各组小鼠脑海马组织中ERK1/2含量未见明显变化;与对照组比较, 50 mg · kg-1 · d-1 DBP组小鼠脑海马p-ERK磷酸化水平显著上调(p<0.01);加入VE处理后, DBP+VE组小鼠脑海马p-ERK磷酸化水平下调, 差异有统计学意义(p<0.05).
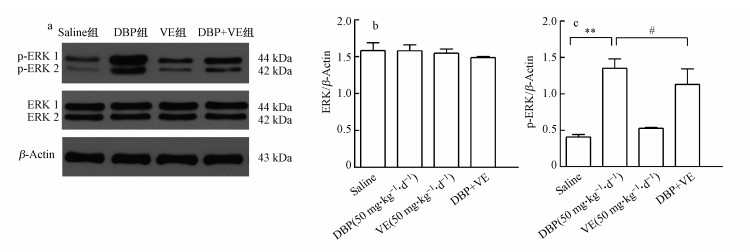 |
| 图 3 各组小鼠脑海马组织的ERK1/2、p-ERK1/2水平(n=3) (a. Western blot蛋白条带;b.各组ERK灰度值与β-Actin灰度值的比值柱形图;c.各组p-ERK灰度值与β-Actin灰度值的比值柱形图) Fig. 3 Expression levels of ERK and p-ERK1/2 in brain hippocampal tissue of mice in different treatment groups (n=3) (a. Western blot protein band; b.The ratio of the gray value of ERK to the gray value of β-Actin in different treatment groups; c.The ratio of gray value of p-ERK to gray value of β-Actin in different treatment groups) |
从图 4可知, 与对照组比较, 50 mg · kg-1 · d-1 DBP组小鼠脑海马组织中BDNF和p-CREB的表达量下降, 差异均有统计学意义(p<0.01;p<0.05);加入VE处理后, 与50 mg · kg-1 · d-1 DBP组比较, DBP+VE组小鼠脑海马组织中BDNF表达量显著上升(p<0.05), p-CREB的表达量有一定程度的上升(图 4a, 4b).
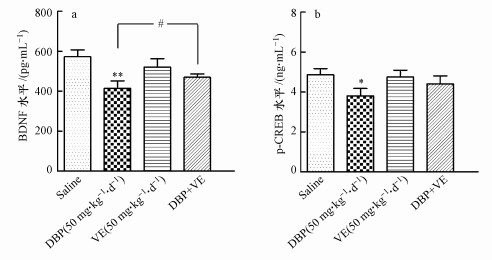 |
| 图 4 各组小鼠脑海马组织的BDNF、p-CREB水平(n=7) (a. BDNF水平;b. p-CREB水平) Fig. 4 Levels of BDNF and p-CREB in brain hippocampal tissue of mice in different treatment groups (a. The level of BDNF; b. The level of p-CREB) |
由图 5A可知, 与对照组比较, 50 mg · kg-1 · d-1 DBP组小鼠脑海马组织中caspase-3含量显著上升(p<0.01);加入VE处理后, 与50 mg · kg-1 · d-1 DBP组比较, DBP+VE组小鼠脑海马组织中caspase-3含量显著下降(p<0.05) (图 5A).荧光显微镜下, 选用340 nm的激发光观察Hoechst 33258荧光非特异性染色结果见图 5B, 凋亡细胞的核或细胞质内可见浓染致密的颗粒块状荧光, 50 mg · kg-1 · d-1 DBP组小鼠脑海马组织凋亡细胞数量明显多于对照组, 且荧光强度也有显著差异;加入VE处理后, DBP+VE组小鼠脑海马组织凋亡细胞数量有所减少, 且荧光强度有所减弱.
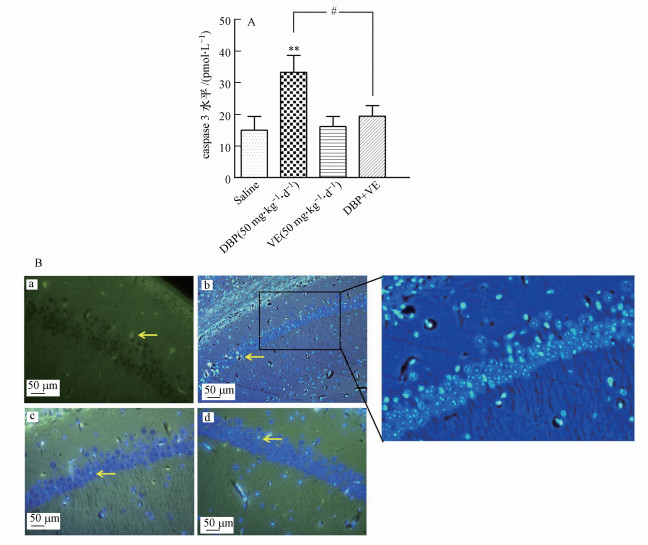 |
| 图 5 各组小鼠脑海马组织的细胞凋亡检测结果 (A. Caspase-3水平(n=7), B.脑海马组织CA1区的荧光染色结果, 凋亡细胞(黄色箭头);a.Saline组, b.50 mg · kg-1 · d-1DBP组, c.50 mg · kg-1 · d-1 VE组, d.DBP+VE组) Fig. 5 Detection of apoptosis in brain hippocampal tissue of mice in different treatment groups (A. The level of caspase-3 (n=7), B. The results of fluorescence staining in CA1 region of hippocampus, apoptotic cells (yellow arrow). a. saline group, b. 50 mg · kg-1 · d-1 DBP group, c. 50 mg · kg-1 · d-1VE group, d. DBP+VE group) |
H&E染色结果显示(图 6A), 对照组小鼠脑海马CA1区的锥体细胞正常, 排列规律, 细胞边缘清晰, 细胞呈多角形(图 6A(a1));50 mg · kg-1 · d-1 DBP组小鼠脑海马出现了损伤特征, 锥体细胞肿胀变形, 顶状树突变短或消失, 排列疏松(图 6A(b1));加入VE处理后, DBP+VE组小鼠脑海马锥体细胞虽仍表现出一定程度的损伤, 但组织病理学的改变如肿胀变形、顶状树突变短或消失等损伤细胞的数量明显减少(图 6A(d1)).Nissl染色结果显示(图 6B), 50 mg · kg-1 · d-1 DBP组与对照组比较, 细胞内Nissl小体数目下降, 出现了大量Nissl小体的缺失, 细胞结构受到一定程度的破坏(图 6B(b2));加入VE处理后, DBP+VE组Nissl小体缺失的现象在给予VE保护后有所缓解(图 6B(d2)).
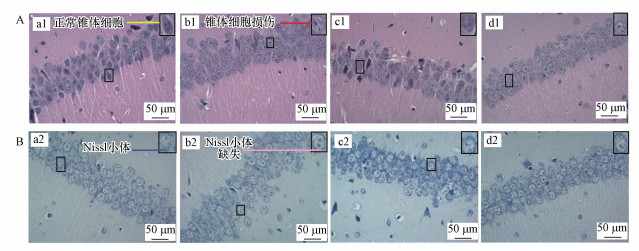 |
| 图 6 不同处理组小鼠的脑海马CA1区的切片染色图 (A. H&E染色, 正常的锥体神经元(黄线), 损伤的锥体神经元(红线), a1.Saline组, b1.50 mg · kg-1 · d-1DBP组, c1.50 mg · kg-1 · d-1 VE组, d1.DBP+VE组.B. Nissl染色, Nissl小体(蓝线), Nissl小体缺失(浅红线);a2.Saline组, b2.50 mg · kg-1 · d-1 DBP组, c2.50 mg · kg-1 · d-1VE组, d2.DBP+VE组) Fig. 6 Histopathological changes of brain hippocampal CA1 region of mice in different treatment groups (A. H&E staining, normal pyramidal neurons (yellow line) and injured pyramidal neurons (red line), a1. saline group, b1. 50 mg · kg-1 · d-1 DBP group, c1. 50 mg · kg-1 · d-1 VE group, d1. DBP+VE group. B. Nissl dyeing, Nissl body (blue line) and Missing Nissl body (light red line), a2. saline group, b2. 50 mg · kg-1 · d-1 DBP group, c2. 50 mg · kg-1 · d-1 VE group, d2. DBP+VE group) |
海马位于大脑皮层下, 是脑边缘系统中的重要结构, 与学习、记忆、认知功能密切相关.海马神经元的损伤及凋亡, 可能是导致学习记忆障碍发生的关键事件(Whitlock et al., 2006);而ERK1/2信号通路参与细胞的生长、凋亡, 影响相关调控蛋白水平, 是海马神经元损伤及凋亡的重要机制之一(Chang et al., 2001).本研究发现, 长期DBP(50 mg · kg-1 · d-1)暴露可引起小鼠脑组织氧化损伤, 并上调海马组织p-ERK1/2蛋白磷酸化水平, 并导致小鼠脑海马组织CA1区神经元细胞凋亡, 继而引起小鼠的神经行为学改变.VE作为抗氧化剂可减少或阻断ROS的过量生成从而下调p-ERK1/2蛋白磷酸化水平, 降低DBP对小鼠脑组织CA1区神经元的损伤及凋亡, 改善小鼠的学习记忆.上述结果提示, ERK1/2通路活化可能参与介导了DBP诱导海马神经元凋亡的毒理学过程.
本研究发现, DBP可引起小鼠神经行为学的改变.本实验复制DBP学习记忆障碍模型(Yan et al., 2016), MWM实验被用来检测DBP所致小鼠的神经行为学变化.结果表明, 50 mg · kg-1 · d-1 DBP处理组小鼠的逃逸潜伏期明显高于对照组, 明显低于DBP+VE组, 提示VE能改善DBP暴露后小鼠的学习记忆行为.其他文献报道证实(Nakamura et al., 2009), VE作为非酶抗氧化剂, 可直接清除O2-等ROS, 具有强大的抗氧化能力, 能降低细胞内MDA的生成, 有效地阻断环境化学物引起的氧化应激, 减轻细胞或细胞结构的损伤, 从而发挥神经保护作用.
研究表明(Schmidt-Kastner et al., 2015), 海马头部主要是由CA1区折叠形成, 而CA1区对损伤较为敏感, 是较易发生病变的关键靶位.本研究进一步发现, DBP可导致小鼠脑海马CA1病理学损伤、神经元凋亡程度增加.H&E染色结果显示, DBP暴露可导致脑海马组织CA1区神经细胞突触消失, 排列松散且无序, 这与Yan等(2016)的研究结果相一致.Nissl染色结果进一步显示, 50 mg · kg-1 · d-1 DBP组小鼠脑海马组织CA1区锥体神经元细胞出现了损伤, 伴有Nissl小体缺失.本实验结果证实, 50 mg · kg-1 · d-1 DBP组小鼠脑海马组织caspase-3含量明显高于对照组, Hoechst 33258荧光结果也显示DBP暴露后小鼠脑海马组织CA1区的凋亡细胞显著增多, 提示DBP暴露可能激活了caspase-3细胞凋亡途径, 导致小鼠脑组织神经细胞的损伤及凋亡.
ERK1/2信号通路活化与内源性细胞凋亡的发生有重要关联.Ying等(2012)的研究表明, ERK1/2通路活化涉及凋亡因子caspase-3的激活.其他报道(Robinson et al., 2002)指出, p-ERK1/2是ERK1/2通路活化的主要标志, 其功能可介导转录因子如CREB的磷酸化, 进而调节下游一系列基因启动子区域含有核转录因子结合位点靶基因的转录表达, 调控细胞凋亡等多种生物学功能.Suematsu等(2003)报道, ROS及氧化应激可参与ERK1/2信号通路, 可以诱导细胞凋亡或坏死, 最终导致组织或器官功能障碍.本实验结果表明, 50 mg · kg-1 · d-1 DBP组小鼠脑海马组织的氧化应激水平明显高于对照组, 提示细胞内ROS积聚会进一步导致组织出现氧化损伤.本实验结果还表明, 50 mg · kg-1 · d-1 DBP组小鼠脑海马组织BDNF、p-CREB水平明显低于对照组, 这与Min等(2014)的结果一致;而p-ERK1/2蛋白磷酸化水平明显高于对照组.以上结果提示DBP可通过ERK1/2通路的激活, 促进神经细胞内BDNF的释放, 影响细胞核内CREB的磷酸化, 从而使神经元细胞趋于凋亡.
此外, 值得注意的是, 本研究中, ERK与CREB磷酸化水平并没有出现同步上升或同步下降, 一方面, 这与ERK的激活在神经系统具有双重功能有关:ERK的激活既可能抑制凋亡, 又可以促进凋亡的发生(李强等, 2014);另一方面, 或可能与暴露物的毒理作用不同有关:暴露物往往对受试动物有不同的刺激效应, 刚开始暴露时, 可能某种蛋白水平趋于降低, 但长久暴露又可能使该蛋白水平上调.例如, 常见环境污染物铅对神经系统的损害, 就存在一个明显的“窗口效应”.此外, 暴露物的“剂量-时间效应”也可能对结果产生影响.这也从侧面反映了ERK通路的重要性和功能复杂性, 有待进一步研究.
5 结论(Conclusions)邻苯二甲酸二丁酯(DBP)暴露导致小鼠海马组织CA1病理学损伤、神经元凋亡程度增加、学习功能下降, 其神经行为学改变可以通过添加VE得到缓解, 相关生理生化指标测试表明ERK系统应激氧化性损伤机制参与介导了毒理学过程.
Ahadi F, Chekaniazar S, Shahryar H A, et al. 2010. Effect of dietary supplementation with fish oil with selenium or vitamin E on oxidative stability and consumer acceptability of broilers meat[J]. Experiments in Fluids, 55(7): 1–16.
|
Chang L, Karin M. 2001. Mammalian MAP kinase signalling cascades[J]. Nature, 410: 37–40.
DOI:10.1038/35065000
|
Cho S C, Bhang S Y, Hong Y C, et al. 2010. Relationship between environmental phthalate exposure and the intelligence of school-age children[J]. Environmental Health Perspectives, 118(7): 1027–1032.
DOI:10.1289/ehp.0901376
|
Finkel T, Holbrook N J. 2000. Oxidants, oxidative stress and the biology of ageing[J]. Nature, 408(6809): 239–247.
DOI:10.1038/35041687
|
Hochstim C J, Choi J Y, Lowe D, et al. 2010. Biofilm detection with hematoxylin-eosin staining[J]. Arch Otolaryngol Head Neck Surg, 136(5): 453–456.
DOI:10.1001/archoto.2010.62
|
Jr R R. 2012. ERK1/2 MAP kinases:structure, function, and regulation[J]. Pharmacological Research, 66(2): 105–143.
DOI:10.1016/j.phrs.2012.04.005
|
Kamei H, Nagai T, Nakano H, et al. 2006. Repeated methamphetamine treatment impairs recognition memory through a failure of novelty-induced ERK1/2 activation in the prefrontal cortex of mice[J]. Biological Psychiatry, 59(1): 75–84.
DOI:10.1016/j.biopsych.2005.06.006
|
Kim B N, Cho S C, Kim Y, et al. 2009. Phthalates exposure and attention-deficit/hyper-activity disorder in school-age children[J]. Biological Psychiatry, 66(10): 958–963.
DOI:10.1016/j.biopsych.2009.07.034
|
LeBel C P, Ischiropoulos H, Bondy S C. 1992. Evaluation of the probe 2', 7'-dichlorofluorescin as an indicator of reactive oxygen species formation and oxidative stress[J]. Chemical Research in Toxicology, 5: 227–231.
DOI:10.1021/tx00026a012
|
李强, 杨桂英, 李峰, 等. 2014. ERK信号通路在神经细胞凋亡中的双重作用[J]. 齐齐哈尔医学院学报, 2014, 22: 3357–3359.
|
路雨, 李瑶, 胡赢丹, 等. 2018. 邻苯二甲酸二异癸酯对小鼠学习记忆的影响[J]. 中国环境科学, 2018, 38(1): 361–368.
DOI:10.3969/j.issn.1000-6923.2018.01.040 |
Medina J H, Viola H. 2018. ERK1/2:A key cellular component for the formation, retrieval, reconsolidation and persistence of memory[J]. Frontiers in Molecular Neuroscience, 11: 361–368.
DOI:10.3389/fnmol.2018.00361
|
Min A, Liu F, Yang X, et al. 2014. Benzyl butyl phthalate exposure impairs learning and memory and attenuates neurotransmission and CREB phosphorylation in mice[J]. Food and Chemical Toxicology, 71: 81–89.
DOI:10.1016/j.fct.2014.05.021
|
Nakamura Y K, Omaye S T. 2009. Vitamin E-modulated gene expression associated with ROS generation[J]. Journal of Functional Foods, 1(3): 241–252.
DOI:10.1016/j.jff.2009.02.002
|
Ohkawa H, Ohishi N, Yagi K. 1979. Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction[J]. Analytical Biochemistry, 95: 351–358.
DOI:10.1016/0003-2697(79)90738-3
|
Qin W, Deng T, Cui H, et al. 2018. Exposure to diisodecyl phthalate exacerbated Th2 and Th17-mediated asthma through aggravating oxidative stress and the activation of p38 MAPK[J]. Food and Chemical Toxicology, 114: 78–87.
DOI:10.1016/j.fct.2018.02.028
|
Robinson M J, Cobb M H. 2002. Mitogen-activated protein kinase pathways mediated by ERK, JNK, and p38 protein kinases[J]. Science, 298(5600): 1911–1912.
DOI:10.1126/science.1072682
|
Schmidt-Kastner R, Freund T F. 2015. Selective vulnerability of the hippocampus in brain ischemia[J]. Neuroscience, 309(3): 259–279.
|
Suematsu N, Tsutsui H, Wen J, et al. 2003. Oxidative stress mediates tumor necrosis factor-α-induced mitochondrial DNA damage and dysfunction in Cardiac Myocytes[J]. Circulation, 107(10): 1418–1423.
DOI:10.1161/01.CIR.0000055318.09997.1F
|
王彝白纳, 蒋定国, 杨大进, 等. 2016. 中国居民邻苯二甲酸二丁酯膳食摄入水平及其风险评估[J]. 中国食品卫生杂志, 2016, 28(6): 800–804.
|
Whitlock J R, Heynen A J, Shuler M G, et al. 2006. Learning induces long-term potentiation in the hippocampus[J]. Science, 313(5790): 1093–1097.
DOI:10.1126/science.1128134
|
Wojtowicz A K, Szychowski K A, Wnuk A, et al. 2017. Dibutyl Phthalate (DBP)-induced apoptosis and neurotoxicity are mediated via the Aryl Hydrocarbon Receptor (AhR) but not by Estrogen Receptor Alpha (ERα), Estrogen Receptor Beta (ERβ), or Peroxisome Proliferator-Activated Receptor Gamma (PPARγ) in mouse cortical neurons[J]. Neurotoxicity Research, 31(1): 77–89.
DOI:10.1007/s12640-016-9665-x
|
Wu Y, Li J, Yan B, et al. 2017. Oral exposure to dibutyl phthalate exacerbates chronic lymphocytic thyroiditis through oxidative stress in female wistar rats[J]. Scientific Reports, 7(1): 15469.
DOI:10.1038/s41598-017-15533-z
|
Yan B, Guo J, Liu X, et al. 2016. Oxidative stress mediates dibutyl phthalate induced anxiety-like behavior in Kunming mice[J]. Environmental Toxicology & Pharmacology, 45: 45–51.
|
Ying T H, Yang S F, Tsai S J, et al. 2012. Fisetin induces apoptosis in human cervical cancer HeLa cells through ERK1/2-mediated activation of caspase-8-/caspase-3-dependent pathway[J]. Archives of Toxicology, 86(2): 263–273.
DOI:10.1007/s00204-011-0754-6
|
 2019, Vol. 39
2019, Vol. 39


