磺胺类抗生素(Sulfonamides, SAs)是一类以对氨基苯磺酰胺为母体结构的抗菌药物, 抗菌谱广且便于长期保存使用(张敏等, 2011), 目前广泛应用于人类医疗、动物疾病防治以及畜禽养殖等领域(Boxall et al., 2004;何金华等, 2012).研究表明, 85%以上的药用磺胺类抗生素无法被动物和人体肠胃吸收, 并被排出体外, 从而造成水体和土壤环境污染(Sarmah et al., 2006).其中, 磺胺甲噁唑(Sulfamethoxazole, SMX)在环境中以多种形态存在, 导致其较难在土壤/沉积物中进行吸附去除, 且降解转化机理复杂(金彩霞等, 2015).土壤中SAs的检出浓度水平为μg·kg-1~mg·kg-1级(秦国建等, 2011), 施用过动物粪便及进行过粪便堆肥处理的土壤中, SAs的检出浓度会明显提高.自然水体中SAs检出水平为ng·L-1~μg·L-1级, 地表水中SMX的检出浓度及频率较高(Tamtam et al., 2008;Tong et al., 2014), 如珠江三角洲对于SMX的检出浓度达到了776.0 ng·L-1(叶计朋等, 2007).医院废水和污水处理厂中所测出的SAs浓度相差无几, 在广州污水处理厂和海南的医院废水中SAs的检出浓度分别高达3497.8和2248.0 ng·L-1(陈涛等, 2010;肖湘波等, 2015).
自然界中铁还原微生物种类多、分布广、功能具有多样性, Shewanella oneidensis被发现在异化铁还原过程中可以获取能量并支持生长.铁还原微生物在矿物的溶解过程中有重要的作用, 同时影响着环境中有机和无机污染物的转化和归趋, 具有重要的环境意义.已有研究表明铁还原微生物对磺胺类抗生素具有一定的耐药性(Groh et al., 2007;Kang et al., 2016), 且异化铁还原作用可加强环境中磺胺类抗生素的降解(Mohatt et al., 2011).异化还原过程是涉及碳源、微生物及铁氧化物的一个复杂体系, 任何一种因素的改变都足以改变整个反应进程, 加之诸多环境因素的影响, 使异化还原反应的影响因素更加的复杂(马小兰等, 2012).在地表和土壤环境中普遍存在的含有羧基基团的苹果酸、柠檬酸和草酸等低分子有机酸, 它们能够通过氧化还原及络合作用等方式影响土壤中界面化学反应.在反应中, 低分子有机酸作为电子供体, 提供微生物生长的能量, 铁氧化物中的Fe(Ⅲ)作为电子受体接受电子后被还原为Fe(Ⅱ), 低分子有机酸与铁还原生成的Fe(Ⅱ)形成配合物后会使Fe(Ⅲ)/Fe(Ⅱ)氧化还原电位受到影响, 并促进氧化还原反应的发生, 之后, Fe(Ⅱ)本身失电子被氧化成Fe(Ⅲ), 重新参与到异化还原反应中(许超等, 2011).并且, S. oneidensis可以利用部分低分子有机酸作为电子供体促进微生物生长.因此, 低分子有机酸对Fe(Ⅲ)的强化作用可能对环境中有机物的降解转化起重要作用.
因此, 本文对低分子有机酸强化Fe(Ⅲ)还原介导的S. oneidensis MR-1降解SMX进行研究, 探讨S. oneidensis MR-1、Fe(Ⅲ)、低分子有机酸之间的相互影响关系, 以及三者对SMX的降解效率, 以期为地下水污染场地修复提供理论依据.本试验选用铁还原菌S. oneidensis MR-1作为模式菌株, 在实验室条件下, 分别考察了S. oneidensis MR-1对SMX的降解特性;3种低分子有机酸(柠檬酸、苹果酸、草酸)和Fe(Ⅲ)对S. oneidensis MR-1降解SMX的影响;低分子有机酸强化Fe(Ⅲ)还原介导的S. oneidensis MR-1降解SMX的影响, 同时考察了对铁还原过程的影响.实验结果表明, 低分子有机酸强化Fe(Ⅲ)还原介导的S. oneidensis MR-1对SMX的降解有着明显的促进作用.
2 材料与方法(Materials and methods) 2.1 实验材料与仪器磺胺甲噁唑, 纯度大于99%, 购自美国阿拉丁试剂公司.铁还原菌S. oneidensis MR-1, 购自西北农林科技大学土壤微生物实验室.试验所需试剂:甲醇、乙酸和乙腈均为色谱纯试剂, 其它试剂为分析纯.Agilent 1220高效液相色谱(美国安捷伦公司);MA-6000荧光定量PCR仪(苏州雅睿生物技术有限公司, 加拿大Funglyn Biotech);超净工作台(SW-CJ-FI, 上海华光仪器仪表厂);722S紫外分光光度计(上海精密科学仪器有限公司分析仪器总厂);DNP-9028AE型电热恒温培养箱(上海三发科学仪器有限公司);CHA-S型台式恒温振荡箱(江苏金坛亿通公司).
2.2 实验方法 2.2.1 S. oneidensis MR-1菌种特性及菌悬液制备菌种来源:铁还原菌S. oneidensis MR-1来自西北农林科技大学土壤微生物实验室;菌种性质:兼性厌氧菌S. oneidensis MR-1是一种假单胞菌, 菌体表面无明显荚膜存在, 较为光滑, 长度在2~3 μm, 宽度为500 nm左右;S. oneidensis MR-1专性培养基(g·L-1):KH2PO4·7H2O 3.0, Na2HPO4·7H2O 12.8, NH4Cl 1.0, NaAc 2.0, 酵母提取物2.0;LB培养基(g·L-1):牛肉浸膏5.0, 蛋白胨10.0, NaCl 5.0, pH=7.0;固体培养基中琼脂粉的加入比例为1.8%, 121 ℃高压灭菌30 min(汪明霞, 2014).
2.2.2 S. oneidensis MR-1对磺胺甲噁唑的降解动力学试验分为两组进行, 第一组配制LB培养基于50 mL棕色血清瓶中, 121 ℃灭菌30 min后, 初始pH为7.0, SMX初始浓度分别设置为10、20、30、50、70 mg·L-1, 30 ℃恒温培养5 d, 添加S. oneidensis MR-1菌悬液使其浓度为107 cells·mL-1, 充N2后拧紧瓶盖密封放置于30 ℃恒温振荡摇床中, 150 r·min-1连续培养5 d;第二组为高温灭活组, 在棕色血清瓶中加入等量的菌悬液后121 ℃灭菌30 min, 其余培养条件与第一组相同.每天连续取样, 样品经0.22 μm水相滤膜过滤后使用高效液相色谱测定培养基中残留的SMX浓度, 同时测定菌体生长曲线.试验设置3组平行对照.试验操作需严格遵守无菌操作要求.
2.2.3 低分子有机酸对S. oneidensis MR-1降解磺胺甲噁唑的影响分别配制初始苹果酸、草酸、柠檬酸浓度为0、0.5、1.0、2.5 mmol·L-1的LB培养基于50 mL棕色血清瓶中, 121 ℃灭菌30 min后, 初始pH设置为7.0, 添加SMX标准溶液使其浓度分别为10 mg·L-1, 添加S. oneidensis MR-1菌悬液使其浓度为107 cells·mL-1, 充N2后拧紧瓶盖密封放置于30 ℃恒温振荡摇床中, 150 r·min-1连续培养5 d.每天连续取样, 样品经0.22 μm水相滤膜过滤后使用高效液相色谱测定培养基中残留SMX浓度.试验设置3组平行对照及空白对照.试验操作严格遵守无菌操作要求.
2.2.4 Fe(Ⅲ)还原对S. oneidensis MR-1降解磺胺甲噁唑的影响试验分为3组, 第1组为异化铁还原组, 配制LB培养基于50 mL棕色血清瓶中, 121 ℃灭菌30 min后, 添加SMX标准溶液使其浓度分别为10 mg·L-1, 分别加入人工配制的Fe(OH)3/Fe3O4悬浮液使得培养基中Fe(Ⅲ)浓度为5.0 mmol·L-1, 实验初始pH设置为7.0.添加S. oneidensis MR-1菌悬液使其浓度为107 cells·mL-1, 充N2后拧紧瓶盖密封放置于30 ℃恒温振荡摇床中, 150 r·min-1连续培养5 d;第2组为无添加铁对照组, 试验不添加Fe(OH)3/Fe3O4悬浮液, 其余培养条件和第一组一样;第3组为无菌对照组, 试验不添加S. oneidensis MR-1菌液.每组试验3个平行, 每天取样测定培养基中SMX残留浓度以及Fe(Ⅱ)生成量.
2.2.5 低分子有机酸强化Fe(Ⅲ)还原对S. oneidensis MR-1降解磺胺甲噁唑的影响分别配制LB培养基于50 mL棕色血清瓶中, 121 ℃灭菌30 min后, 添加SMX标准溶液使其浓度分别为10 mg·L-1, 分别添加苹果酸、草酸、柠檬酸标准溶液使其初始浓度分别为0、0.5、1.0、2.5 mmol·L-1, 分别加入人工配制的Fe(OH)3/Fe3O4悬浮液使得培养基中Fe(Ⅲ)浓度为5.0 mmol·L-1, 添加S. oneidensis MR-1菌悬液使其浓度为107 cells·mL-1, 培养基初始pH为7.0, 充N2后拧紧瓶盖密封放置于30 ℃恒温振荡摇床中, 150 r·min-1连续培养5 d.每天连续取样, 样品经0.22 μm水相滤膜过滤后使用高效液相色谱测定培养基中残留SMX浓度.试验设置3组平行对照.试验操作需严格遵守无菌操作要求.
2.3 样品测定与数据处理 2.3.1 磺胺类抗生素的测定采用高效液相色谱法测定培养基中SMX浓度, 取1 mL样品用适量甲醇洗涤, 超声振荡, 离心过后取上清液过0.22 μm水相滤膜, 取滤液进行液相测定.仪器型号为Agilent 1220型高效液相色谱分析仪(HPLC), 色谱柱: Agilent HC-C18, Analytical 4.6 mm×250 mm;流动相为0.4%乙酸:乙腈=60:40(V/V);检测波长:270 nm;流速:1.0 mL·min-1;进样量:20 μL;柱温:40 ℃.
2.3.2 Fe(Ⅱ)测定培养基中的Fe(Ⅱ)含量采用邻菲啰啉紫外分光光度法进行测定.充分摇匀血清瓶, 取1 mL样品加入4 mL 0.5 mol·L-1的HCl浸提24 h, 取浸提液用0.22 μm滤膜过滤后转移到50 mL容量瓶中, 分别加入2.5 mL现配的0.1%盐酸羟胺溶液、5 mL pH 4.6的醋酸钠缓冲溶液、5 mL 0.1%邻菲啰啉溶液, 定容, 摇匀, 静置15 min, 520 nm处测定吸光度(Zhou et al., 2018).
2.3.3 数据分析与处理使用一级动力学模型拟合生物降解曲线并预估S. oneidensis MR-1的SMX降解能力:
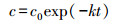
|
(1) |
式中, c0为SMX的初始浓度, c为SMX的实测值, k是SMX降解速率常数(d-1), t是培养时间(d).
3 结果与讨论(Results and discussions) 3.1 S. oneidensis MR-1对磺胺甲噁唑的降解动力学考察不同SMX浓度下, S. oneidensis MR-1对SMX的降解能力及生长情况, 如图 1a所示, 在pH 7.0时, 几组试验中SMX的降解率分别为42.4%、24.6%、14.5%、13.4%、3.4%, 当SMX初始浓度为70 mg·L-1时, SMX几乎无降解.实验中S. oneidensis MR-1初始接种量为107 cells·mL-1, 从图 1b可以看出S. oneidensis MR-1在培养1 d后直接进入对数生长期, 后3 d进入生长平缓期.随着SMX初始浓度的增加, 菌体数量逐渐减少, 当SMX初始浓度为70 mg·L-1时, S. oneidensis MR-1的生长几乎停滞.结果表明, S. oneidensis MR-1对低浓度SMX有一定降解能力, 但降解率较小, 且随着SMX的浓度逐渐加大菌体生长逐渐受抑制, S. oneidensis MR-1对SMX的降解率也逐渐减小.说明SMX浓度能够影响菌体生长, 从而影响菌体对SMX的降解效率, 因此SMX初始浓度是实验中非常重要的影响因素.
 |
| 图 1 不同初始浓度对S. oneidensis MR-1降解磺胺甲噁唑的影响(a. SMX (C/C0); b. S. oneidensis MR-1生长曲线) Fig. 1 Effect of different initial concentration on degradation of SMX by S. oneidensis MR-1 (a. SMX (C/C0); b. growth curves of S. oneidensis MR-1) |
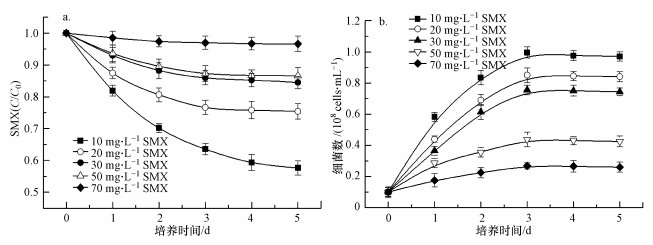
考察低分子有机酸对S. oneidensis MR-1降解SMX的影响, 3种不同的低分子有机酸对SMX残留变化如图 2所示.空白对照组中SMX降解率为38.5%.添加不同浓度有机酸均对SMX降解率有一定促进作用.如图 2a所示, 加入不同浓度苹果酸时SMX降解率分别为41.8%、57.3%、48.9%.当苹果酸初始浓度为1.0 mmol·L-1时SMX降解率最大, 高浓度苹果酸促进效果不如中等浓度.如图 2b所示, 加入不同浓度草酸时SMX降解率分别为42.6%、55.4%、40.8%, 草酸浓度为1.0 mmol·L-1时SMX降解率最大.相比对照组添加不同浓度草酸对SMX降解有一定强化作用, 促进作用不如苹果酸强.如图 2c所示, 添加不同浓度柠檬酸时SMX降解率分别为42.2%、58.5%、56.7%, 相比较苹果酸和草酸, 柠檬酸对S. oneidensis MR-1降解SMX的促进效果最好.低分子有机酸对SMX与铁还原的促进作用与其本身的性质相关, 主要与其一级电离常数(pKa1)和二级电离常数(pKa2)有关.柠檬酸为三元羧酸, 其在溶液中的存在形式除柠檬酸分子外, 另有3种解离形态(Ka)分别为带1个、2个、3个负电荷的柠檬酸根离子, 这使得柠檬酸作为电子供体可以提供更多的电子.当pH在2.0~8.0的范围内时, 带有1个和2个负电荷的柠檬酸根离子提供电子的能力大于另外2种形态的柠檬酸根离子(Gao et al., 2003;Qin et al., 2004).其它两种低分子有机酸均为二元羧酸, 其中草酸分子质量最小, 使得这两种低分子有机酸作为电子供体无法提供更多的电子(罗涛等, 2018).另外, 铁还原微生物S. oneidensis MR-1可以将部分低分子有机酸作为电子供体并获得能量, 加快环境中污染物质的降解转化.通过比较不同浓度的3种低分子有机酸对S. oneidensis MR-1降解SMX的促进作用, 有机酸浓度为1.0 mmol·L-1时, 与其余浓度有着显著性差异, 后续实验将低分子有机酸浓度设置为1.0 mmol·L-1.
 |
| 图 2 低分子有机酸对S. oneidensis MR-1降解磺胺甲噁唑的影响(a.苹果酸;b.草酸;c.柠檬酸) Fig. 2 Effects of low molecular organic acids on SMX degradation by S. oneidensis MR-1:(a. malic acid; b. oxalic acid; c. citric acid) |
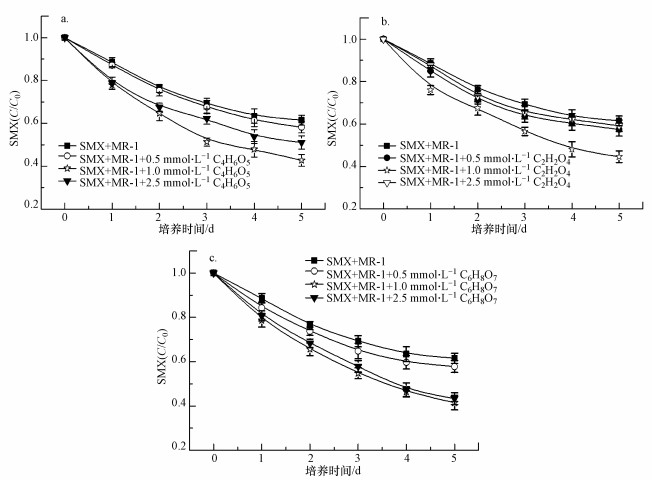
异化铁还原作用在SMX的微生物降解过程中有显著的影响.如图 3a所示, 外加一定量Fe(OH)3和Fe3O4悬浮液后, S. oneidensis MR-1对SMX的降解率分别为67.6%和46.1%, 远高于对照组.其中Fe(Ⅲ)本身对SMX的吸附作用非常微弱, 因此培养基中SMX的去除主要来源于异化铁还原作用.近年来, Latta等采用稳定铁同位素57Fe-穆斯堡尔谱手段, 系统研究了Fe(Ⅱ)催化作用下不同氧化铁晶相重组过程, 其结果显示, 氧化铁中某些Fe(Ⅲ)接受电子后, 被还原成Fe(Ⅱ)释放到溶液中去, 这一过程影响着Fe(Ⅲ)对环境污染物的吸附/固定/降解等环境行为(Latta et al., 2012).因此, 本实验对Fe2+浓度进行测定, 结果如图 3b所示.培养基中Fe(Ⅱ)最终浓度分别为1.8 mmol·L-1和1.4 mmol·L-1, 铁还原率分别为36.8%和28.4%.当Fe(Ⅲ)浓度为5.0 mmol·L-1时, SMX的降解率是对照组中SMX降解率的2倍, 并且在这一过程中Fe(Ⅱ)的生成量逐渐增加.通过对照组可以发现, 不加入S. oneidensis MR-1时, 体系中产生的Fe(Ⅱ)浓度较低, 结果表明, 还原菌S. oneidensis MR-1可以将环境中游离的Fe(Ⅲ)还原成Fe(Ⅱ), 并且从这一过程中获得自身生长所需的能量, 从而增强了对SMX的降解效率.相比较上述结果, Fe3O4对S. oneidensis MR-1降解SMX的促进效果不如人工配制的Fe(OH)3悬浮液, 说明Fe(OH)3相较Fe3O4更易被S. oneidensis MR-1还原.
 |
| 图 3 Fe(Ⅲ)对S. oneidensis MR-1降解磺胺甲噁唑的影响(a. SMX (c/c0); b. Fe(Ⅱ)浓度) Fig. 3 Effects of Fe(Ⅲ) on the degradation of SMX by S. oneidensis MR-1 (a. SMX (c/c0); b. the concentration of Fe(Ⅱ)) |
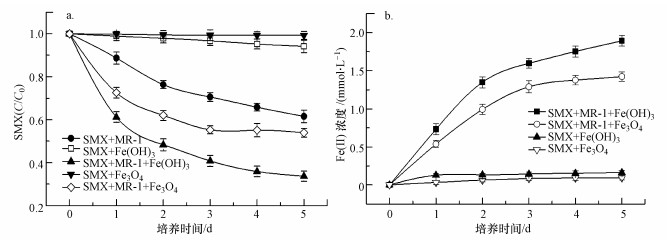
低分子有机酸强化Fe(Ⅲ)还原介导S. oneidensis MR-1能更有效的降解磺胺甲噁唑.如图 4a所示, 3种有机酸协同Fe(OH)3对S. oneidensis MR-1降解SMX有较大促进作用, 分别加入苹果酸、草酸和柠檬酸后SMX的最终降解率分别为71.1%、66.4%、83.6%, 柠檬酸与Fe(OH)3的协同效果最好.3种有机酸与Fe3O4协同作用同样可以促进SMX的生物降解过程, 分别加入苹果酸、草酸和柠檬酸后SMX的最终降解率分别为62.1%、59.4%、74.6%.上述结果说明有机酸与Fe(OH)3协同促进S. oneidensis MR-1降解SMX效果更好, 且3种有机酸中柠檬酸效果最好.
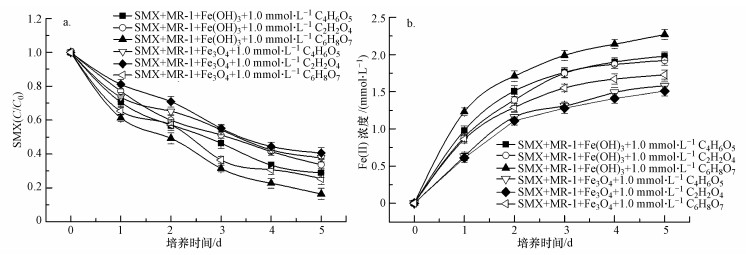 |
| 图 4 有机酸强化Fe(Ⅲ)对S. oneidensis MR-1降解磺胺甲噁唑的影响(a. SMX (c/c0); b. Fe(Ⅱ)浓度) Fig. 4 Organic acids enhance Fe(Ⅲ) reduction mediated the degradation of SMX by S. oneidensis MR-1: (a. SMX (c/c0); b. the concentration of Fe(Ⅱ)) |
基于实验的设计原理, 添加Fe(Ⅲ)作为电子受体, 接受低分子有机酸及其他底物氧化产生的电子, 并同时富集异化铁还原菌提高电子传递效率(Lovley, 2006; Wang et al., 2010);在厌氧体系下, Fe(Ⅱ)可氧化为Fe(Ⅲ), Fe(Ⅲ)又可在异化铁还原菌作用下还原为Fe(Ⅱ), 因此存在Fe(Ⅱ)/Fe(Ⅲ)的循环(Druschel et al., 2008), 可起到电子介体的作用(Richter et al., 2012).因此, 本实验对Fe2+浓度进行测定, 结果如图 4b所示.当加入Fe(OH)3悬浮液时, 对照组中Fe(Ⅱ)最终含量为1.8 mmol·L-1, 分别加入1.0 mmol·L-1苹果酸、草酸、柠檬酸后Fe(Ⅱ)最终生成量为2.0、1.9、2.3 mmol·L-1.当加入Fe3O4悬浮液时, 对照组中Fe(Ⅱ)最终含量为1.4 mmol·L-1, 分别加入1.0 mmol·L-1苹果酸、草酸、柠檬酸后Fe(Ⅱ)最终生成量为1.6、1.5、1.7 mmol·L-1.上述结果说明Fe(OH)3较Fe3O4更容易被还原为Fe(Ⅱ), 且添加有机酸后Fe(Ⅱ)生成量均有一定增加, 3种有机酸中效果最好的是柠檬酸.
3.5 S. oneidensis MR-1降解磺胺甲噁唑的产物分析近期报道可知, 多项研究已经证实3-氨基-5-甲基异恶唑为SMX的生物降解产物(Eibes et al., 2011;García-Galán et al., 2011;Jiang et al., 2014;Reis et al., 2014).如图 5所示, 3种中间产物被检出, 分别为3-氨基-5-甲基异恶唑(m/z=99.1)、4-氨基苯硫酚(m/z=126.1)和4-氨基苯磺酸(m/z=173.2), 本研究结果与之报道的一致.如图 6所示, 3-氨基-5-甲基异恶唑作为胺化侧链片段, 由与杂环上连接氨基化合物的化学键断裂失掉电子而形成.因此, 它可作为一个基团脱离.在降解产物中它们的存在表明SMX可从它的直链末端被水解.此外, 3-氨基-5-甲基异恶唑与4-氨基苯磺酸在降解产物中同时出现揭示了SMX的起始降解是由S—N键断裂引起的, 其中4-氨基苯磺酸进一步降解生成4-氨基苯硫酚(毛飞, 2017).Wang等的研究结果表明:以S. oneidensis MR-1构建生物燃料电池降解SMX, 首先S—N键断裂生成4-氨基苯亚磺酸和3-氨基-5-甲基异恶唑, 4-氨基苯亚磺酸进一步降解生成4-氨基苯硫酚, 这和本论文研究得到的结果一致, 但3-氨基-5-甲基异恶唑进一步被利用降解生成5-甲基-异恶唑, 最终生成异丙醇(Wang et al., 2016).利用大肠杆菌和S. oneidensis MR-1检测SMX降解产物的抑菌毒性, 结果表明利用这种方法降解SMX, 其抑菌性被大大的降低.菌株BR1降解SMX, 首先形成羟化物, 由于该物质的不稳定性瞬间分裂生成对亚氨基醌、二氧化硫、胺化取代基, 最终形成对氨基苯酚、亚硫酸氢根离子、3-氨基-5-甲基异恶唑(Ricken et al., 2013);Jiang等的研究结果表明SMX的降解首先在水解作用下, N—C键和S—N键断裂各自形成相应产物, 产物3-氨基-5-甲基异恶唑的生成是由于S—N键断裂所致(Jiang et al., 2014).结果表明:实验中有机酸协同Fe(Ⅲ)对S. oneidensis MR-1降解SMX的中间产物为3-氨基-5-甲基异恶唑和4-氨基苯硫酚.
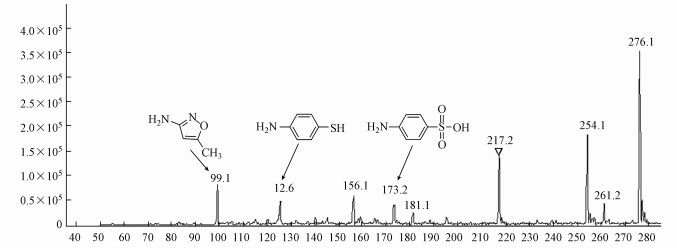 |
| 图 5 磺胺甲噁唑经有机酸协同Fe(Ⅲ)降解的总离子流图(TIC) Fig. 5 Total ion current of SMX degradation by organic acids and Fe(Ⅲ) |
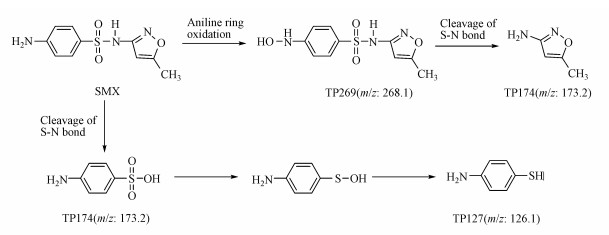 |
| 图 6 S. oneidensis MR-1降解磺胺甲噁唑的可能途径分析 Fig. 6 Proposed mechanism of sulfamethoxazole degradation by S. oneidensis MR-1 |
在实验室条件下, 低分子有机酸强化Fe(Ⅲ)还原介导S. oneidensis MR-1对SMX有着较好的降解效果.比较3种低分子有机酸(苹果酸、草酸、柠檬酸)强化两种Fe(Ⅲ)(Fe(OH)3、Fe3O4)还原介导S. oneidensis MR-1对SMX的降解效果, 实验发现当体系中加入1.0 mmol·L-1柠檬酸和5.0 mmol·L-1 Fe(OH)3悬浮液时, 培养5 d后SMX降解率为90.3%, 柠檬酸和Fe(OH)3协同作用对SMX生物降解和铁还原作用促进效果最佳.最后, 采用LC-MS对SMX的降解产物进行了分析, 检测到SMX生成的3种中间产物分别为3-氨基-5-甲基异恶唑(m/z=99.1)、4-氨基苯磺酸(m/z=173.2)、4-氨基苯硫酚(m/z=126.1).本研究表明自然环境中的低分子有机酸和Fe(Ⅲ)之间的协同作用, 可以有效促进S. oneidensis MR-1对SMX的降解效果.
Boxall A B A, Fogg L A, Blackwell P A, et al. 2004.Veterinary medicines in the environment[M]//Reviews of environmental contamination and toxicology. Springer, New York, NY. 1-91
|
陈涛, 李彦文, 莫测辉, 等. 2010. 广州污水厂磺胺和喹诺酮抗生素污染特征研究[J]. 环境科学与技术, 2010, 33(6): 144–147, 180.
|
Colon D, Weber E J, Anderson J L. 2008. Effect of natural organic matter on the reduction of nitroaromatics by Fe(Ⅱ) Species[J]. Environmental Science and Technology, 42(17): 6538–6543.
DOI:10.1021/es8004249
|
Druschel G K, Emerson D, Sutka R, et al. 2008. Low-oxygen and chemical kinetic constraints on the geochemical niche of neutrophilic iron(Ⅱ) oxidizing microorganisms[J]. Geochimica Et Cosmochimica Acta, 72(14): 3358–3370.
DOI:10.1016/j.gca.2008.04.035
|
Eibes G, Debernardi G, Feijoo G, et al. 2011. Oxidation of pharmaceutically active compounds by a ligninolytic fungal peroxidase[J]. Biodegradation, 22(3): 539–550.
DOI:10.1007/s10532-010-9426-0
|
Gao Y Z, He J Z, Ling W T, et al. 2003. Effects of organic acids on copper and cadmium desorption from contaminated soils[J]. Environment International, 29(5): 613–618.
DOI:10.1016/S0160-4120(03)00048-5
|
García-Galán M, Rodríguez-Rodríguez C E, Vicent T, et al. 2011. Biodegradation of sulfamethazine by Trametes versicolor: Removal from sewage sludge and identification of intermediate products by UPLC-QqTOF-MS[J]. Science of the Total Environment, 409(24): 5505–5512.
DOI:10.1016/j.scitotenv.2011.08.022
|
Groh J L, Luo Q W, Ballard J D, et al. 2007. Genes that enhance the ecological fitness of Shewanella oneidensis MR-1 in sediments reveal the value of antibiotic resistance[J]. Applied and Environmental Microbiology, 73(2): 492–498.
DOI:10.1128/AEM.01086-06
|
何金华, 丘锦荣, 贺德春, 等. 2012. 磺胺类抗生素的环境行为及其控制技术研究进展[J]. 广东农业科学, 2012, 12(7): 225–229.
DOI:10.3969/j.issn.1004-874X.2012.07.073 |
Jiang B C, Li A, Cui D, et al. 2014. Biodegradation and metabolic pathway of sulfamethoxazole by Pseudomonas psychrophila HA-4, a newly isolated cold-adapted sulfamethoxazole-degrading bacterium[J]. Applied Microbiology and Biotechnology, 98(10): 4671–4681.
DOI:10.1007/s00253-013-5488-3
|
金彩霞, 司晓薇, 毛蕾, 等. 2015. 磺胺类药物在土壤中的形态转化及降解研究[J]. 环境科学学报, 2015, 35(12): 3985–3990.
|
Kang C H, So J S. 2016. Antibiotic heavy metal resistance in Shewanella putrefaciens strains isolated from shellfishes collected from the West Sea, Korea[J]. Marine Pollution Bulletin, 112(1/2): 111–116.
|
Latta D E, Bachman J E, Scherer M M. 2012. fe electron transfer and atom exchange in goethite: Influence of al-substitution and anion sorption[J]. Environmental Science and Technology, 46(19): 10614–10623.
DOI:10.1021/es302094a
|
Lovley D R. 2006. Bug juice: harvesting electricity with microorganisms[J]. Nature Reviews Microbiology, 4(7): 497–508.
DOI:10.1038/nrmicro1442
|
罗涛, 李取生, 陈惠君, 等. 2018. 6种低分子有机酸对针铁矿、蒙脱石和生物炭中结合态Cd活化效果的对比[J]. 环境工程学报, 2018, 12(7): 2047–2055.
|
毛飞. 2017. Shewanella oneidensis MR-1和Shewanella sp.strain MR-4对磺胺类抗生素的降解特性研究[D].安徽: 安徽农业大学. 1-49
http://cdmd.cnki.com.cn/Article/CDMD-10364-1017256011.htm |
马小兰, 丁琳洁, 董军, 等. 2012. 地下环境中铁氧化物生物异化还原耦合降解硝基苯的影响因素研究[J]. 生态环境学报, 2012, 21(6): 1109–1114.
|
Mohatt J L, Hu L H, Finneran K T, et al. 2011. Microbially mediated abiotic transformation of the antimicrobial agent sulfamethoxazole under iron-reducing soil conditions[J]. Environmental Science and Technology, 45(11): 4793–4801.
DOI:10.1021/es200413g
|
Qin F, Shan X Q, Wei B. 2004. Effects of low-molecular-weight organic acids and residence time on desorption of Cu, Cd, and Pb from soils[J]. Chemosphere, 57(4): 253–263.
DOI:10.1016/j.chemosphere.2004.06.010
|
秦国建, 许振成, 吴根义, 等. 2011. 残留磺胺类抗生素的来源及环境行为研究进展[J]. 农业灾害研究, 2011, 1(1): 58–60.
|
Reis P J M, Reis A C, Ricken B, et al. 2014. Biodegradation of sulfamethoxazole and other sulfonamides by Achromobacter denitrificans PR1[J]. Journal of Hazardous Materials, 280: 741–749.
DOI:10.1016/j.jhazmat.2014.08.039
|
Richter K, Schicklberger M, Gescher J. 2012. Dissimilatory reduction of extracellular electron acceptors in anaerobic respiration[J]. Applied and Environmental Microbiology, 78(4): 913–921.
DOI:10.1128/AEM.06803-11
|
Ricken B, Corvini P F X, Cichocka D, et al. 2013. ipso-Hydroxylation and subsequent fragmentation: a novel microbial strategy to eliminate sulfonamide antibiotics[J]. Applied and Environmental Microbiology, 79(18): 5550–5558.
DOI:10.1128/AEM.00911-13
|
Sarmah A K, Meyer M T, Boxall A B A. 2006. A global perspective on the use, sales, exposure pathways, occurrence, fate and effects of veterinary antibiotics (VAs) in the environment[J]. Chemosphere, 65(5): 725–759.
DOI:10.1016/j.chemosphere.2006.03.026
|
Tamtam F, Mercier F, Le Bot B, et al. 2008. Occurrence and fate of antibiotics in the Seine River in various hydrological conditions[J]. Science of the Total Environment, 393(1): 84–95.
DOI:10.1016/j.scitotenv.2007.12.009
|
Tong L, Huang S B, Wang Y X, et al. 2014. Occurrence of antibiotics in the aquatic environment of Jianghan Plain, central China[J]. Science of the Total Environment, 497: 180–187.
|
Wang A J, Sun D, Ren N Q, et al. 2010. A rapid selection strategy for an anodophilic consortium for microbial fuel cells[J]. Bioresource Technology, 101(14): 5733–5735.
DOI:10.1016/j.biortech.2010.02.056
|
Wang L, Liu Y L, Ma J, et al. 2016. Rapid degradation of sulphamethoxazole and the further transformation of 3-amino-5-methylisoxazole in a microbial fuel cell[J]. Water Research, 88: 322–328.
DOI:10.1016/j.watres.2015.10.030
|
汪明霞, 王娟, 司友斌, 等. 2014. Shewanella oneidensis MR-1异化还原Fe(Ⅲ)介导的As(Ⅲ)氧化转化[J]. 中国环境科学, 2014, 34(9): 2368–2373.
|
肖湘波, 唐天乐, 徐浩, 等. 2015. 医院典型废水处理工艺单元的抗生素去除效果与评价[J]. 环境科学与技术, 2015, 38(4): 121–127.
|
许超, 董军, 马小兰, 等. 2011. 微生物异化还原铁氧化物体系对硝基苯的降解作用[J]. 中国环境科学, 2011, 31(9): 1472–1476.
|
叶计朋, 邹世春, 张干, 等. 2007. 典型抗生素类药物在珠江三角洲水体中的污染特征[J]. 生态环境, 2007, 16(2): 384–388.
DOI:10.3969/j.issn.1674-5906.2007.02.023 |
张敏, 李轶, 敖永华, 等. 2011. 土壤中磺胺类兽药残留的生态效应及转归[J]. 中国农学通报, 2011, 27(3): 369–373.
|
Zhou C, Wang H Q, Si Y B, et al. 2018. Electron shuttles enhance the degradation of sulfamethoxazole coupled with Fe(Ⅲ) reduction by Shewanella oneidensis MR-1[J]. Environmental Toxicology and Pharmacology, 62: 156–163.
DOI:10.1016/j.etap.2018.07.006
|
 2019, Vol. 39
2019, Vol. 39


